2.1.共价键课件(共21张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.共价键课件(共21张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 494.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 10:34:51 | ||
图片预览






文档简介
(共21张PPT)
第一节 共价键
化学键:
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
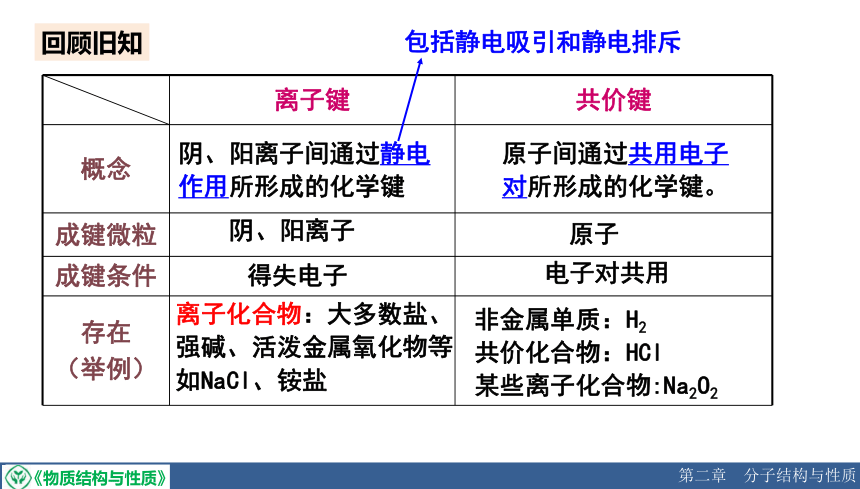
回顾旧知
离子键 共价键
概念
成键微粒
成键条件
存在 (举例)
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物:大多数盐、强碱、活泼金属氧化物等如NaCl、铵盐
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物:Na2O2
包括静电吸引和静电排斥
回顾旧知
【课堂练习】
1.下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A.②④⑤⑦ B.②③④ C.①②③④⑥ D.①③⑤⑥
B
2.下列各组化合物中,化学键类型完全相同的是( )
A.C2H6、H2O2、C2H5OH B.HCl、NaCl、MgCl2
C.H2O、CO2、Na2O2 D.NaOH、NaClO、Na2O
A
3.下列关于化学键的说法正确的是 ( )
①含有金属元素的化合物一定是离子化合物
②ⅠA族和ⅦA族元素原子化合时,一定形成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与活泼非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
A.①②⑤ B.④⑤⑥ C.①③④ D.②③⑤
B
1.定义:
原子间通过共用电子对所形成的强烈相互作用
2.成键元素:
一般由非金属元素的原子结合
3.本质:
原子之间形成共用电子对(或原子轨道的重叠)。自旋方向相反的未成对电子形成共用电子对。
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
----共价键具有方向性。
立体构型
一、共价键
4.特征:
【思考与讨论1】 H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子?
H︰H
电子式
H︰Cl︰
‥
‥
︰Cl︰Cl︰
‥
‥
‥
‥
由于电子对的共用,H2、HCl、Cl2分子中,各原子核外电子达到饱和。不能再形成H3、H2Cl、Cl3等分子。
—共价键具有饱和性。
分子组成(各原子数量关系)
一、共价键
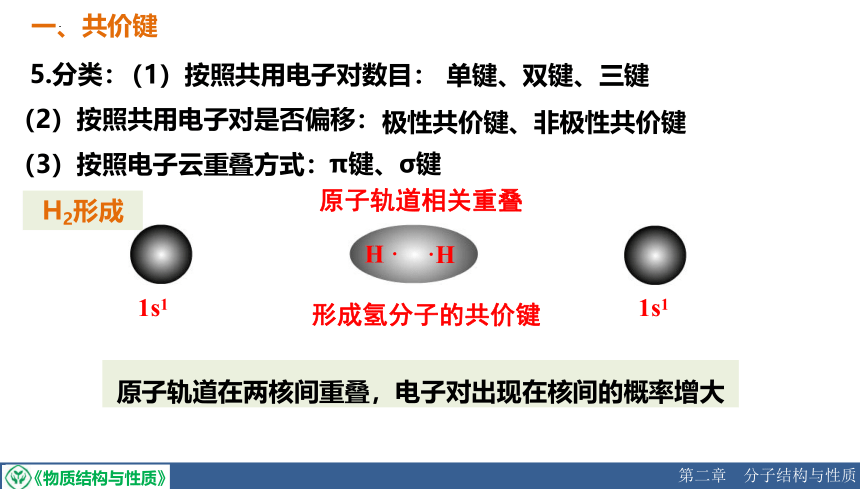
5.分类:
(1)按照共用电子对数目:
单键、双键、三键
(2)按照共用电子对是否偏移:
极性共价键、非极性共价键
(3)按照电子云重叠方式:
π键、σ键
一、共价键
1s1
1s1
原子轨道相关重叠
形成氢分子的共价键
H ·
·H
H2形成
原子轨道在两核间重叠,电子对出现在核间的概率增大
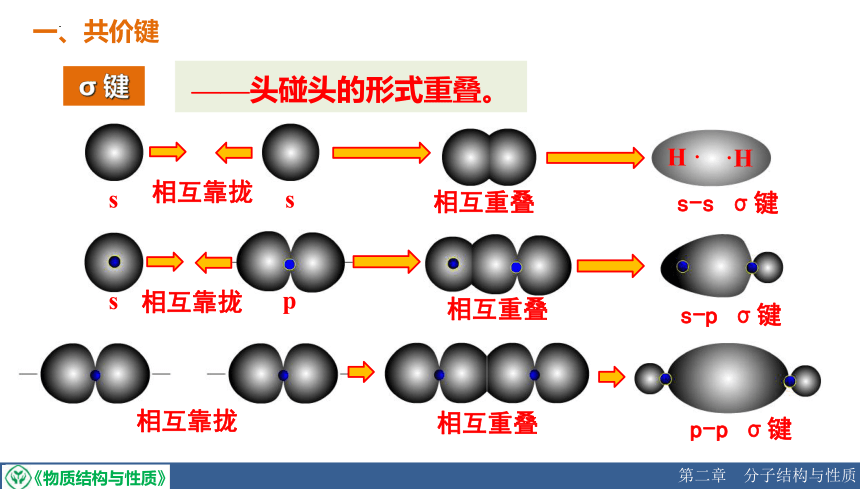
σ 键
s
H ·
·H
相互靠拢
s
相互重叠
s-s σ键
p
s
相互靠拢
相互重叠
s-p σ键
相互靠拢
相互重叠
p-p σ键
——头碰头的形式重叠。
一、共价键
(1)以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。
(2)形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
(3)以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
σ 键特征
一、共价键
π 键
相互重叠
p-p π键
p
相互靠拢
——肩并肩的形式重叠
p
——σ键、π键是共价键的两种基本形式。
一、共价键
一、共价键
↑↓
↑↓
↑ ↑ ↑
1s 2s 2p
N
↑↓
↑↓
↑ ↑ ↑
1s 2s 2p
N
z
z
y
y
x
x
z
z
x
π 键特征
(1)每个π键的电子云由两块组成,分别位于由两原子核 构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜面对称。不可旋转。
(2)形成π键时电子云重叠程度比σ键小,π键不如σ键 牢固。特例:N2分子中的π键比σ键稳定。
(3)一般来说,共价单键是σ键;共价双键中有一个σ键,另一个是π键;共价三键由一个σ键、两个π键构成。
一、共价键
(1)观察下图中乙烷、乙烯和乙炔分子的球棍模型,它们的分子中的共价键分别由几个σ键和几个π键构成?
C2H6 C2H4 C2H2
σ键
π键
7
0
5
1
3
2
【思考与讨论2】
σ键可单独存在,而π键不可单独存在。
(2)乙烯和乙炔的化学性质为什么比乙烷活泼
乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
形成π键时电子云重叠程度比σ键小,σ键比π键牢固。
【课堂练习】
4.正误判断
(1)形成共价键后体系的能量降低,趋于稳定( )
(2)共价键的饱和性是由成键原子的未成对电子数决定的( )
(3)共价键的饱和性决定了分子内部原子的数量关系( )
(4)π键不可以单独存在( )
(5)原子轨道在空间都具有方向性( )
(6)π键一定没有σ键稳定( )
(7)单键一定比双键稳定( )
(8)形成共价键的原子一定达到饱和状态( )
√
√
√
√
×
×
×
×
例:BF3
5.下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
C
6.σ键的常见类型有(1)s-s, (2)s-p, (3)p-p, 请指出下列分子σ键所属类型: A、HBr B、NH3 C、F2 D、H2
s-p
s-p
p-p
s-s
7.关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.分子中含有1个π键
C
8.相距很远的两个H原子相互逐渐接近,在这一过程中体系能量将 ( )
A.先变大后变小 B.先变小后变大
C.逐渐变小 D.逐渐增大
B
9. 下列说法正确的是( )
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C.一般 σ 键比 π 键重叠程度大,形成的共价键强
D.气体单质中,一定有 σ 键,可能有 π 键
C
10.下列微粒中的各原子均满足8电子稳定结构的是( )
A. PCl5 B. NH3 C.CO2 D. BF3
C
11.已知碳的氧化物可以制备尿素、乙烯脲等,其中乙烯脲可用于制备树脂、增塑剂、喷漆、胶黏剂等。
(1)乙烯脲分子中含σ键与π键的数目之比为__________。
(2)尿素分子中含σ键与π键的数目之比为_________。
12∶1
7∶1
12.P元素的价电子排布为3s23p3,P与Cl形成的化合物有PCl3、PCl5,对此判断正确的是( )
A.磷原子最外层有三个未成对电子,故只能结合三个氯原子形成PCl3
B.PCl3分子中的P—Cl键含有π键
C.PCl5分子中的P—Cl键都是π键
D.磷原子最外层有三个未成对电子,但是能形成PCl5,说明传统的价键理论存在缺陷
D
第一节 共价键
化学键:
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
回顾旧知
离子键 共价键
概念
成键微粒
成键条件
存在 (举例)
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物:大多数盐、强碱、活泼金属氧化物等如NaCl、铵盐
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物:Na2O2
包括静电吸引和静电排斥
回顾旧知
【课堂练习】
1.下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A.②④⑤⑦ B.②③④ C.①②③④⑥ D.①③⑤⑥
B
2.下列各组化合物中,化学键类型完全相同的是( )
A.C2H6、H2O2、C2H5OH B.HCl、NaCl、MgCl2
C.H2O、CO2、Na2O2 D.NaOH、NaClO、Na2O
A
3.下列关于化学键的说法正确的是 ( )
①含有金属元素的化合物一定是离子化合物
②ⅠA族和ⅦA族元素原子化合时,一定形成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与活泼非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
A.①②⑤ B.④⑤⑥ C.①③④ D.②③⑤
B
1.定义:
原子间通过共用电子对所形成的强烈相互作用
2.成键元素:
一般由非金属元素的原子结合
3.本质:
原子之间形成共用电子对(或原子轨道的重叠)。自旋方向相反的未成对电子形成共用电子对。
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
----共价键具有方向性。
立体构型
一、共价键
4.特征:
【思考与讨论1】 H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子?
H︰H
电子式
H︰Cl︰
‥
‥
︰Cl︰Cl︰
‥
‥
‥
‥
由于电子对的共用,H2、HCl、Cl2分子中,各原子核外电子达到饱和。不能再形成H3、H2Cl、Cl3等分子。
—共价键具有饱和性。
分子组成(各原子数量关系)
一、共价键
5.分类:
(1)按照共用电子对数目:
单键、双键、三键
(2)按照共用电子对是否偏移:
极性共价键、非极性共价键
(3)按照电子云重叠方式:
π键、σ键
一、共价键
1s1
1s1
原子轨道相关重叠
形成氢分子的共价键
H ·
·H
H2形成
原子轨道在两核间重叠,电子对出现在核间的概率增大
σ 键
s
H ·
·H
相互靠拢
s
相互重叠
s-s σ键
p
s
相互靠拢
相互重叠
s-p σ键
相互靠拢
相互重叠
p-p σ键
——头碰头的形式重叠。
一、共价键
(1)以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。
(2)形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
(3)以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
σ 键特征
一、共价键
π 键
相互重叠
p-p π键
p
相互靠拢
——肩并肩的形式重叠
p
——σ键、π键是共价键的两种基本形式。
一、共价键
一、共价键
↑↓
↑↓
↑ ↑ ↑
1s 2s 2p
N
↑↓
↑↓
↑ ↑ ↑
1s 2s 2p
N
z
z
y
y
x
x
z
z
x
π 键特征
(1)每个π键的电子云由两块组成,分别位于由两原子核 构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜面对称。不可旋转。
(2)形成π键时电子云重叠程度比σ键小,π键不如σ键 牢固。特例:N2分子中的π键比σ键稳定。
(3)一般来说,共价单键是σ键;共价双键中有一个σ键,另一个是π键;共价三键由一个σ键、两个π键构成。
一、共价键
(1)观察下图中乙烷、乙烯和乙炔分子的球棍模型,它们的分子中的共价键分别由几个σ键和几个π键构成?
C2H6 C2H4 C2H2
σ键
π键
7
0
5
1
3
2
【思考与讨论2】
σ键可单独存在,而π键不可单独存在。
(2)乙烯和乙炔的化学性质为什么比乙烷活泼
乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
形成π键时电子云重叠程度比σ键小,σ键比π键牢固。
【课堂练习】
4.正误判断
(1)形成共价键后体系的能量降低,趋于稳定( )
(2)共价键的饱和性是由成键原子的未成对电子数决定的( )
(3)共价键的饱和性决定了分子内部原子的数量关系( )
(4)π键不可以单独存在( )
(5)原子轨道在空间都具有方向性( )
(6)π键一定没有σ键稳定( )
(7)单键一定比双键稳定( )
(8)形成共价键的原子一定达到饱和状态( )
√
√
√
√
×
×
×
×
例:BF3
5.下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
C
6.σ键的常见类型有(1)s-s, (2)s-p, (3)p-p, 请指出下列分子σ键所属类型: A、HBr B、NH3 C、F2 D、H2
s-p
s-p
p-p
s-s
7.关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.分子中含有1个π键
C
8.相距很远的两个H原子相互逐渐接近,在这一过程中体系能量将 ( )
A.先变大后变小 B.先变小后变大
C.逐渐变小 D.逐渐增大
B
9. 下列说法正确的是( )
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C.一般 σ 键比 π 键重叠程度大,形成的共价键强
D.气体单质中,一定有 σ 键,可能有 π 键
C
10.下列微粒中的各原子均满足8电子稳定结构的是( )
A. PCl5 B. NH3 C.CO2 D. BF3
C
11.已知碳的氧化物可以制备尿素、乙烯脲等,其中乙烯脲可用于制备树脂、增塑剂、喷漆、胶黏剂等。
(1)乙烯脲分子中含σ键与π键的数目之比为__________。
(2)尿素分子中含σ键与π键的数目之比为_________。
12∶1
7∶1
12.P元素的价电子排布为3s23p3,P与Cl形成的化合物有PCl3、PCl5,对此判断正确的是( )
A.磷原子最外层有三个未成对电子,故只能结合三个氯原子形成PCl3
B.PCl3分子中的P—Cl键含有π键
C.PCl5分子中的P—Cl键都是π键
D.磷原子最外层有三个未成对电子,但是能形成PCl5,说明传统的价键理论存在缺陷
D
