2.3.1物质的量的单位课件(共32张PPT)2022_2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.1物质的量的单位课件(共32张PPT)2022_2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 869.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 10:35:37 | ||
图片预览










文档简介
(共32张PPT)
物质的量的单位---摩尔
一滴水(约0.05mL)里的水分子,10亿人数,每人每分钟数100个,日夜不停,大约需要3万多年才能数清。
有多少个水分子呢?
50mL水里
小资料
宏观的物理量(体积、质量)用微观的物理量(粒子数)表示时,数目非常的巨大,使用很不方便!
提出问题
能否在宏观量与微观量之间建立一个物理量和单位,用合适的数值来表示很大数目的微观粒子呢?
日常生活中,我们一般说一辆汽车的质量为3吨,不会说是 3×106克。再比如做某事花去10分钟时间,我们不会说成是用了1.9 ×10-5年。人们喜欢选用一个合适的计量单位,把很大或很小的数值变为适中的数值,便于使用。
提出设想
联系生活
宏 观
(质量/体积等)
微 观
(粒子数)
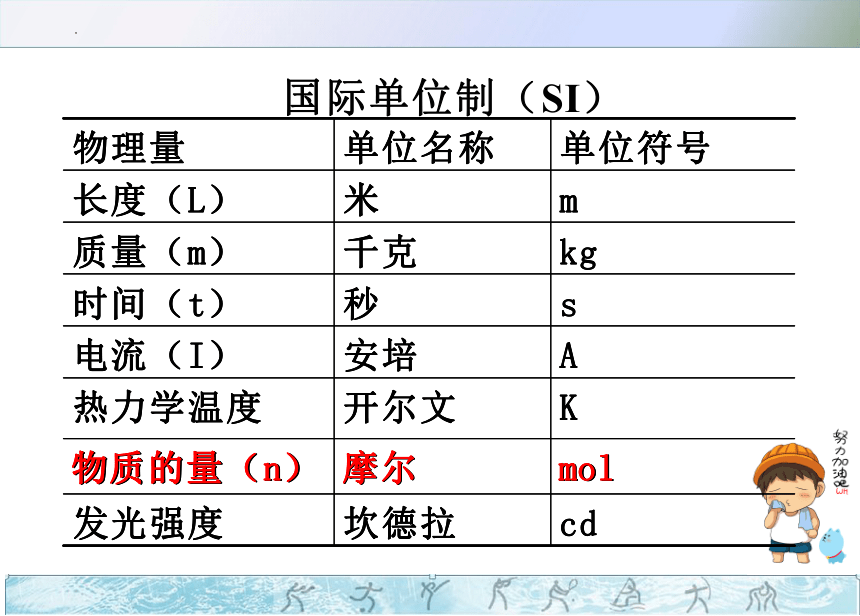
物质的量
一、物质的量的单位---摩尔
(一)物质的量(n)
意义:表示一定数目粒子的集合体。
1
2
单位:
摩尔(mol)
【注意】 “物质的量”为专业术语,字数不可增减,不能说成“物质的质量”或“物质的数量”。
(1)不适用宏观物质,仅适用微观粒子:分子、原子、离子、原子团、质子、中子、电子(e-)
或粒子的特定组合。
(2)使用“mol”作单位时,要用化学式指明微观粒子的种类。
3
注意事项:
1mol苹果
1mol H
1mol H2
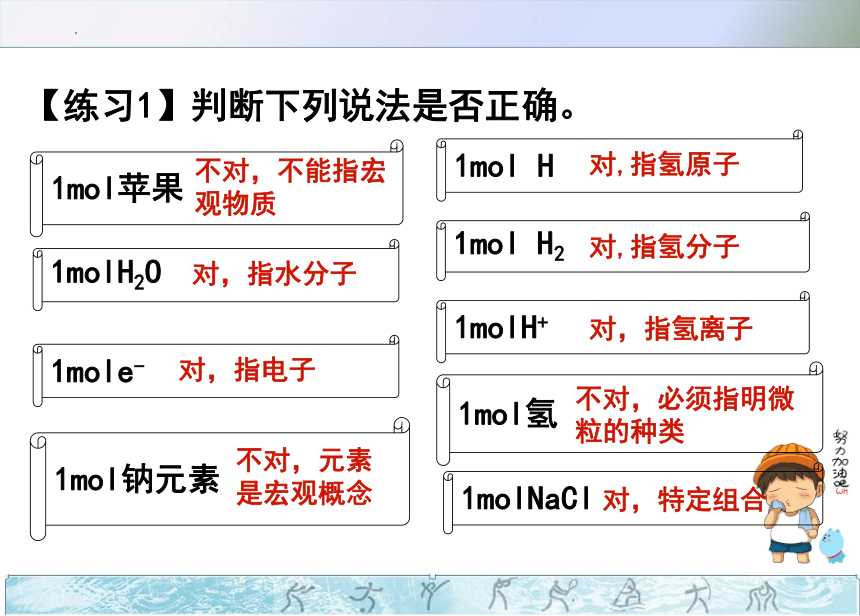
【练习1】判断下列说法是否正确。
1molH2O
1mole-
1molH+
1mol钠元素
1molNaCl
不对,不能指宏观物质
对,指氢原子
对,指水分子
对,指电子
对,指氢离子
不对,元素是宏观概念
对,特定组合
1mol氢
不对,必须指明微粒的种类
对,指氢分子
一打铅笔有12支
生活小常识
那么1mol粒子到底有多少个粒子呢
已知一个12C原子的质量为1.993×10-26 kg,那么0.012 kg12C中有多少个碳原子?
——
0.012kg
1.993×10-26kg
≈
6.02 ×1023
解析:
1mol的标准:
1
2
(二)阿伏加德罗常数
国际计量大会规定:将1mol任何粒子所含的粒子数叫做阿伏加德罗常数(符号NA)
NA≈ 6.02×1023mol-1
例:1molO2中含有的氧原子数为 ,
约为 个。
2NA
1.204 ×1024
如果把6.02×1023个硬币排成一行,可以来回于地球与太阳之间多少次?
如果把 6.02×1023 粒米给全球74亿人吃,5万粒大米约为1千克,每人每年吃200千克大米,要吃多少年?
感受一下
如此巨大的数据!
240亿次!
814万年!
可见,物质的量所描述的对象只适用于微观粒子,不适用于宏观物体。
2mol CO2 中含有的CO2的分子数约为多少?
含3.01×1023 个分子的H2,其物质的量是多少?
2mol × 6.02 ×1023mol -1 = 1.204 ×1024
3.01 ×1023 ÷6.02 ×1023mol -1 = 0.5mol
【思考】粒子个数(N)、阿伏加德罗常数(NA)、物质的量(n)三者的关系
粒子个数(N)、阿伏加德罗常数(NA)、物质的量(n)三者的关系
n
=
N
NA
N =
n
NA
·
n (H) = =
=1.5mol
9.03×1023
6.02×1023mol-1
解析:
N(H)
NA
N(O2)=n(O2) ×NA=5mol×6.02×1023mol-1=3.01×1024
解析:
(2)9.03×1023个H原子,其物质的量是多少?
(1)5molO2中有多少个氧分子?
3
(1)3 mol H2SO4中约含有 个H2SO4,
含有 mol H
含有 mol 0
(2)2mol Ba(OH)2中含有 molBa2+
含有 molOH-
(3)5 mol Na2CO3中约含有 个Na+
1.806×1024
6
6.02×1024
12
2
4
【练习2】
若amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.a/(4b) mol-1 B.b/a mol-1
C.a/b mol-1 D.b/(4a) mol-1
D
【练习3】
百度一下
1811年,他发现了阿伏加德罗定律
此后,又发现了阿伏加德罗常数
阿伏加德罗是第一个认识到物质由分子组成、分子由原子组成的人。他的分子假说奠定了原子一分子论的基础,推动了物理学、化学的发展,对近代科学产生了深远的影响。
物质的量的单位---摩尔
1mol物质 所含粒子数 一个粒子的质量(g) 1mol 粒子的质量(g) 粒子的相对原子(分子)质量
1mol 12C 1.993×10-23
1mol Al 4.485×10-23
1mol H2O 2.990×10-23
1mol Fe3+ 9.278×10-23
6.02×1023
6.02×1023
6.02×1023
6.02×1023
12
27
18
56
【问题探究】完成填空,从中你能得出什么结论?
12
27
18
56
结论: 1mol任何粒子的质量以g为单位时,其数值与该粒子的相对原子(分子)质量相等。
m
——
n
M =
表达式:
18g/mol
56g/mol
定义:单位物质的量的物质所具有的质量。
M(H2O) = ________ M(Fe3+) = _________
单位: g/mol
(三)摩尔质量(M)
1
2
3
1mol H2O 2.990×10-23
1mol Fe3+ 9.278×10-23
18g
18
56
56g
6.02×1023
6.02×1023
(1)摩尔质量在以g/mol为单位时,在数值等于1mol该物质的质量(以g为单位) ,也等于该物质的相对原子(分子)质量。
4
注意事项:
(2)对于确定的物质来说,其摩尔质量的值是一个定值,与物质的量的多少无关。
(3)电子的质量很小,同种元素的原子和离子的摩尔质量相等。
【练习】下列说法正确的是 ( )
A.O的摩尔质量是32 g mol-1
B.H2SO4的摩尔质量是98g
C.CO2的相对分子质量是44g
D.CO32-摩尔质量是60g/mol
D
n =
m
M
——
m
——
n
M =
例 : 24.5克H2SO4的物质的量是多少
解:
n(H2SO4) =
=0.25 mol
【思考】36g H2O 中约含有多少个水分子?
物质的质量与微观粒子数目的关系
m
N
NA
—
=
—
M
n
=
归纳小结:
2H2 + O2 ═ 2H2O
微观角度
宏观角度
2个H原子
1个O2分子
2个H2O分子
NA
NA
NA
4g : 32g : 36g
2mol : 1mol : 2mol
同时扩大NA倍
物质的量
2g/mol
32g/mol
18g/mol
结论:化学反应方程式中参加反应的各物质的物质的量之比等于其化学计量数之比。
练习1:
(1) 3.01×1022个H2O的物质的量为 ___ mol,
质量为 ________,
含有H的物质的量为 ________mol ,
含有O的物质的量为_________mol。
0.05
0.9 g
0.1
0.05
(2)已知氢氧化钡的摩尔质量为171g/mol,
2.0molBa(OH)2中约含有__________个Ba2+ ,
约含有 ___________个OH- ,
2.0molBa(OH)2的质量为 ________g,
含有1.204×1023个 OH-的Ba(OH)2物质的量为_________mol.
1.204×1024
2.408×1024
342
0.1
【复习】原子结构知识:
【思考】一个Al、Al3+的质子数和电子数是多少?一个S、S2-的质子数和电子数是多少?
(1)1个H2S中含有___个质子,含有____ 个电子 。
(2)1个NH4+中含有____个质子,含有_____ 个电子 。
【思考1】34gH2S中含有___个质子,含有____ 个电子。
【思考2】3.6g NH4+中含有____ 个质子,含有 ____ 个电子 。
练习2:
18NA
18NA
2.2NA
2NA
18
10
11
18
练习3: NA为阿伏加德罗常数的值,下列说法正确的是( ) (已知:N-14 O-16 Al-27 Ca-40)
A.28 g氮气含有的原子数为NA
B.4 g金属钙变成钙离子时失去的电子数0.1NA
C.1 mol Al3+含有的核外电子数为3NA
D.32 g O2分子和32 g O3分子所含的氧原子数目相等
D
练习4 :已知H-1 C-12 N-14 O-16 有以下四种
物质: ①22 g二氧化碳;②8 g氢气;③1.204×1024个氮气分子;④4℃时18 mL水它们所含分子数最多的是________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(均填序号)。
②
②
③
③
练习5 已知H-1 C-12 O-16 S-32 Cl-35.5
有五种物质是:①0.5molCO2 ② 6gH2
③92g乙醇(C2H5OH) ④ 1.204×1024个HCl
⑤147gH2SO4,它们中物质的量最大的是_____(填序号,下同),所含分子数最多的是______,含有原子个数最多的是_____ ,质量最大的是_____。
②
②
③
⑤
3mol
2mol
2mol
1.5mol
22g
71g
物质的量的单位---摩尔
一滴水(约0.05mL)里的水分子,10亿人数,每人每分钟数100个,日夜不停,大约需要3万多年才能数清。
有多少个水分子呢?
50mL水里
小资料
宏观的物理量(体积、质量)用微观的物理量(粒子数)表示时,数目非常的巨大,使用很不方便!
提出问题
能否在宏观量与微观量之间建立一个物理量和单位,用合适的数值来表示很大数目的微观粒子呢?
日常生活中,我们一般说一辆汽车的质量为3吨,不会说是 3×106克。再比如做某事花去10分钟时间,我们不会说成是用了1.9 ×10-5年。人们喜欢选用一个合适的计量单位,把很大或很小的数值变为适中的数值,便于使用。
提出设想
联系生活
宏 观
(质量/体积等)
微 观
(粒子数)
物质的量
一、物质的量的单位---摩尔
(一)物质的量(n)
意义:表示一定数目粒子的集合体。
1
2
单位:
摩尔(mol)
【注意】 “物质的量”为专业术语,字数不可增减,不能说成“物质的质量”或“物质的数量”。
(1)不适用宏观物质,仅适用微观粒子:分子、原子、离子、原子团、质子、中子、电子(e-)
或粒子的特定组合。
(2)使用“mol”作单位时,要用化学式指明微观粒子的种类。
3
注意事项:
1mol苹果
1mol H
1mol H2
【练习1】判断下列说法是否正确。
1molH2O
1mole-
1molH+
1mol钠元素
1molNaCl
不对,不能指宏观物质
对,指氢原子
对,指水分子
对,指电子
对,指氢离子
不对,元素是宏观概念
对,特定组合
1mol氢
不对,必须指明微粒的种类
对,指氢分子
一打铅笔有12支
生活小常识
那么1mol粒子到底有多少个粒子呢
已知一个12C原子的质量为1.993×10-26 kg,那么0.012 kg12C中有多少个碳原子?
——
0.012kg
1.993×10-26kg
≈
6.02 ×1023
解析:
1mol的标准:
1
2
(二)阿伏加德罗常数
国际计量大会规定:将1mol任何粒子所含的粒子数叫做阿伏加德罗常数(符号NA)
NA≈ 6.02×1023mol-1
例:1molO2中含有的氧原子数为 ,
约为 个。
2NA
1.204 ×1024
如果把6.02×1023个硬币排成一行,可以来回于地球与太阳之间多少次?
如果把 6.02×1023 粒米给全球74亿人吃,5万粒大米约为1千克,每人每年吃200千克大米,要吃多少年?
感受一下
如此巨大的数据!
240亿次!
814万年!
可见,物质的量所描述的对象只适用于微观粒子,不适用于宏观物体。
2mol CO2 中含有的CO2的分子数约为多少?
含3.01×1023 个分子的H2,其物质的量是多少?
2mol × 6.02 ×1023mol -1 = 1.204 ×1024
3.01 ×1023 ÷6.02 ×1023mol -1 = 0.5mol
【思考】粒子个数(N)、阿伏加德罗常数(NA)、物质的量(n)三者的关系
粒子个数(N)、阿伏加德罗常数(NA)、物质的量(n)三者的关系
n
=
N
NA
N =
n
NA
·
n (H) = =
=1.5mol
9.03×1023
6.02×1023mol-1
解析:
N(H)
NA
N(O2)=n(O2) ×NA=5mol×6.02×1023mol-1=3.01×1024
解析:
(2)9.03×1023个H原子,其物质的量是多少?
(1)5molO2中有多少个氧分子?
3
(1)3 mol H2SO4中约含有 个H2SO4,
含有 mol H
含有 mol 0
(2)2mol Ba(OH)2中含有 molBa2+
含有 molOH-
(3)5 mol Na2CO3中约含有 个Na+
1.806×1024
6
6.02×1024
12
2
4
【练习2】
若amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.a/(4b) mol-1 B.b/a mol-1
C.a/b mol-1 D.b/(4a) mol-1
D
【练习3】
百度一下
1811年,他发现了阿伏加德罗定律
此后,又发现了阿伏加德罗常数
阿伏加德罗是第一个认识到物质由分子组成、分子由原子组成的人。他的分子假说奠定了原子一分子论的基础,推动了物理学、化学的发展,对近代科学产生了深远的影响。
物质的量的单位---摩尔
1mol物质 所含粒子数 一个粒子的质量(g) 1mol 粒子的质量(g) 粒子的相对原子(分子)质量
1mol 12C 1.993×10-23
1mol Al 4.485×10-23
1mol H2O 2.990×10-23
1mol Fe3+ 9.278×10-23
6.02×1023
6.02×1023
6.02×1023
6.02×1023
12
27
18
56
【问题探究】完成填空,从中你能得出什么结论?
12
27
18
56
结论: 1mol任何粒子的质量以g为单位时,其数值与该粒子的相对原子(分子)质量相等。
m
——
n
M =
表达式:
18g/mol
56g/mol
定义:单位物质的量的物质所具有的质量。
M(H2O) = ________ M(Fe3+) = _________
单位: g/mol
(三)摩尔质量(M)
1
2
3
1mol H2O 2.990×10-23
1mol Fe3+ 9.278×10-23
18g
18
56
56g
6.02×1023
6.02×1023
(1)摩尔质量在以g/mol为单位时,在数值等于1mol该物质的质量(以g为单位) ,也等于该物质的相对原子(分子)质量。
4
注意事项:
(2)对于确定的物质来说,其摩尔质量的值是一个定值,与物质的量的多少无关。
(3)电子的质量很小,同种元素的原子和离子的摩尔质量相等。
【练习】下列说法正确的是 ( )
A.O的摩尔质量是32 g mol-1
B.H2SO4的摩尔质量是98g
C.CO2的相对分子质量是44g
D.CO32-摩尔质量是60g/mol
D
n =
m
M
——
m
——
n
M =
例 : 24.5克H2SO4的物质的量是多少
解:
n(H2SO4) =
=0.25 mol
【思考】36g H2O 中约含有多少个水分子?
物质的质量与微观粒子数目的关系
m
N
NA
—
=
—
M
n
=
归纳小结:
2H2 + O2 ═ 2H2O
微观角度
宏观角度
2个H原子
1个O2分子
2个H2O分子
NA
NA
NA
4g : 32g : 36g
2mol : 1mol : 2mol
同时扩大NA倍
物质的量
2g/mol
32g/mol
18g/mol
结论:化学反应方程式中参加反应的各物质的物质的量之比等于其化学计量数之比。
练习1:
(1) 3.01×1022个H2O的物质的量为 ___ mol,
质量为 ________,
含有H的物质的量为 ________mol ,
含有O的物质的量为_________mol。
0.05
0.9 g
0.1
0.05
(2)已知氢氧化钡的摩尔质量为171g/mol,
2.0molBa(OH)2中约含有__________个Ba2+ ,
约含有 ___________个OH- ,
2.0molBa(OH)2的质量为 ________g,
含有1.204×1023个 OH-的Ba(OH)2物质的量为_________mol.
1.204×1024
2.408×1024
342
0.1
【复习】原子结构知识:
【思考】一个Al、Al3+的质子数和电子数是多少?一个S、S2-的质子数和电子数是多少?
(1)1个H2S中含有___个质子,含有____ 个电子 。
(2)1个NH4+中含有____个质子,含有_____ 个电子 。
【思考1】34gH2S中含有___个质子,含有____ 个电子。
【思考2】3.6g NH4+中含有____ 个质子,含有 ____ 个电子 。
练习2:
18NA
18NA
2.2NA
2NA
18
10
11
18
练习3: NA为阿伏加德罗常数的值,下列说法正确的是( ) (已知:N-14 O-16 Al-27 Ca-40)
A.28 g氮气含有的原子数为NA
B.4 g金属钙变成钙离子时失去的电子数0.1NA
C.1 mol Al3+含有的核外电子数为3NA
D.32 g O2分子和32 g O3分子所含的氧原子数目相等
D
练习4 :已知H-1 C-12 N-14 O-16 有以下四种
物质: ①22 g二氧化碳;②8 g氢气;③1.204×1024个氮气分子;④4℃时18 mL水它们所含分子数最多的是________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(均填序号)。
②
②
③
③
练习5 已知H-1 C-12 O-16 S-32 Cl-35.5
有五种物质是:①0.5molCO2 ② 6gH2
③92g乙醇(C2H5OH) ④ 1.204×1024个HCl
⑤147gH2SO4,它们中物质的量最大的是_____(填序号,下同),所含分子数最多的是______,含有原子个数最多的是_____ ,质量最大的是_____。
②
②
③
⑤
3mol
2mol
2mol
1.5mol
22g
71g
