【备考2023】浙教版科学中考第二轮复习讲义第20讲:盐和化肥【word,含答案】
文档属性
| 名称 | 【备考2023】浙教版科学中考第二轮复习讲义第20讲:盐和化肥【word,含答案】 |
|
|
| 格式 | doc | ||
| 文件大小 | 896.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-06 00:00:00 | ||
图片预览



文档简介
一、常见盐的特性及用途
1. 概念:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
2. 常见的盐
二、盐的化学性质
1. 与某些金属反应
规律:金属(K、Ca、Na除外)+盐→ 新金属+新盐(活动性:金属>新金属)
举例:(1)铁和硫酸铜溶液:
(2)铜和硝酸银溶液:
2. 与酸反应
规律:盐+酸→ 新盐+新酸
举例:(1)稀盐酸和碳酸钙:
(2)稀硫酸和氯化钡:
3. 与碱反应
规律:碱+盐→ 新碱+新盐
举例:(1)碳酸钠和氢氧化钡:Na2CO3+Ba(OH)2=== BaCO3↓+2NaOH
(2)硫酸铜和氢氧化钠:CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4
4. 与某些盐反应
规律:盐+盐→ 新盐+新盐
举例:(1)硝酸银和氯化钠:
(2)硫酸铜和氯化钡:
三、复分解反应及其应用
1. 概念:由两种化合物相互交换成分,生成另外两种化合物的反应。
2. 特点:双交换,价不变。
3. 表达式:AB+CD→ AD+CB
4. 常见的类型
【记忆口诀】常见盐的溶解性:钾钠铵硝皆可溶 盐酸盐中银不溶 硫酸盐中钡不溶 其他碳酸盐都不溶
5. 应用:判断物质间能否共存、进行物质的鉴别和除杂等。
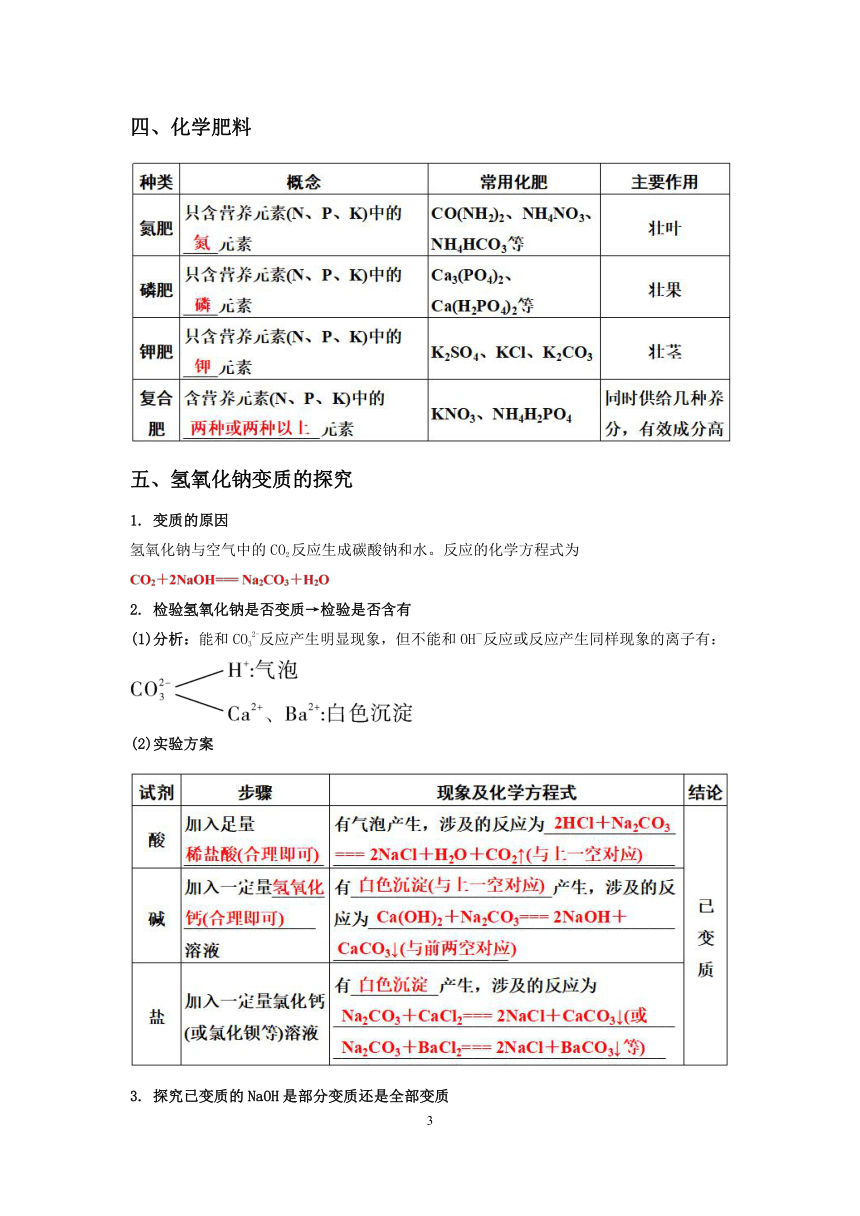
四、化学肥料
五、氢氧化钠变质的探究
1. 变质的原因
氢氧化钠与空气中的CO2反应生成碳酸钠和水。反应的化学方程式为
2. 检验氢氧化钠是否变质→检验是否含有
(1)分析:能和CO32-反应产生明显现象,但不能和OH-反应或反应产生同样现象的离子有:
(2)实验方案
3. 探究已变质的NaOH是部分变质还是全部变质
(1)变质后的成分
(2)分析:在有CO32-存在的情况下检验是否有OH-,应先除去CO32-,再检验OH-:
除去CO32- ——含Ca2+、Ba2+的物质(如CaCl2、BaCl2等)(不能引入OH-)。
(3)实验方案
4. 实验反思
氢氧化钠应密封保存。
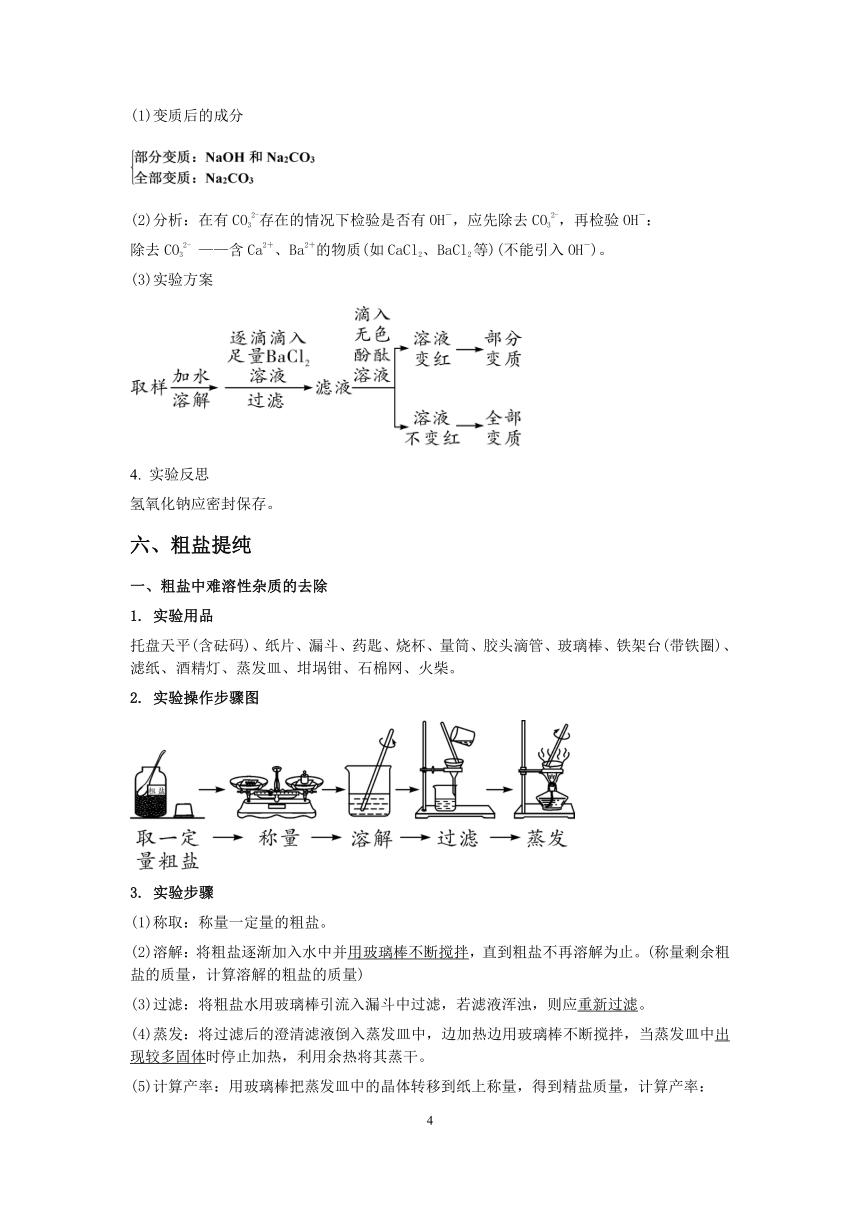
六、粗盐提纯
一、粗盐中难溶性杂质的去除
1. 实验用品
托盘天平(含砝码)、纸片、漏斗、药匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)、滤纸、酒精灯、蒸发皿、坩埚钳、石棉网、火柴。
2. 实验操作步骤图
3. 实验步骤
(1)称取:称量一定量的粗盐。
(2)溶解:将粗盐逐渐加入水中并用玻璃棒不断搅拌,直到粗盐不再溶解为止。(称量剩余粗盐的质量,计算溶解的粗盐的质量)
(3)过滤:将粗盐水用玻璃棒引流入漏斗中过滤,若滤液浑浊,则应重新过滤。
(4)蒸发:将过滤后的澄清滤液倒入蒸发皿中,边加热边用玻璃棒不断搅拌,当蒸发皿中出现较多固体时停止加热,利用余热将其蒸干。
(5)计算产率:用玻璃棒把蒸发皿中的晶体转移到纸上称量,得到精盐质量,计算产率:
二、粗盐中可溶性杂质的去除
1. 粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故除杂实质为除去Ca2+、Mg2+、SO42-(填离子符号)。
2. 方法
(1)选除杂试剂
(2) 除杂流程
①加入过量的BaCl2溶液———除去Na2SO4;
②加入过量的NaOH溶液———除去MgCl2;
③加入过量的Na2CO3溶液———除去CaCl2、BaCl2;
④加入稀盐酸———除去NaOH、Na2CO3。
例1、Na2CO3 的水溶液呈碱性,下列说法错误的是( )
A.碳酸钠在水中会电离出 OH-
B.往碳酸钠溶液中加稀硫酸后溶液的 pH降低
C.碳酸钠溶液中存在 OH-
D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
例2、在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图像能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系是( )
例3、硫酸铜、硝酸铜具有一相似的化学质。请回答:
(1)硫酸铜、硝酸铜两种物质的溶液均显________色,因为它们部具有________离子。
(2)向硫酸铜,硝酸铜两种物质的液中分别加入BaCl2溶液,能发生反应的物质是________(填化学式),化学方程式是________。
(3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根根离子转变成沉淀,该净物的化学式为________。
例4、某校科学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于25g水后,再加入11.2g氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠反应的化学方程式为:NH4NO3+NaOH △ NaNO3+H2O+NH3↑)。把产生的所有NH3用足量的硫酸溶液吸收,同时测量2min内硫酸溶液增加的质量,结果如表所示:
时间(s) 0 20 30 40 60 80 100 120
增加的质量(g) 0 0.7 m 1.2 1.5 1.6 1.7 1.7
试回答下列问题:
(1)请以反应时间为横坐标,以产生的NH3质量为纵坐标,画出能够表明产生气体的质量随时间变化的关系曲线。
(2)表中m约为___________________。
(3)求硝酸铵样品的纯度。
(4)求反应后所得硝酸钠溶液的溶质质量分数(不考虑反应过程中水损失的 质量)。
1.侯氏制碱法的生产过程涉及如下反应:NH3+CO2+NaCl+X===NaHCO3↓+NH4Cl,2NaHCO3 △ Na2CO3+CO2↑+H2O。下列说法错误的是( )
A.X的化学式为H2O
B.NaHCO3受热易分解
C.CO2和Na2CO3中碳元素的化合价不同
D.NaHCO3分解产生的CO2可以回收再利用
2.过氧化氢(H2O2)俗称双氧水,是一种液体,易分解,常作氧化剂、漂白剂和消毒剂.为了便于贮存、运输和使用,工业上常将它转化为固态的过碳酸钠晶体(2Na2CO3 3H2O2),该晶体具有Na2CO3和H2O2的双重性质.下列物质不会使过碳酸钠晶体失效的是( )
A.MnO2 B.H2S C.稀盐酸 D.NaHCO3
3.下列说法正确的是( )
A.向某溶液中滴加AgNO3溶液和稀HNO3,产生白色沉淀。该溶液一定为稀盐酸
B.可用适量的硝酸钙溶液,除去氯化钠溶液中混有的碳酸钠,得到纯净的氯化钠
C.要除去铜粉中混有的少量炭粉,可采用在空气中充分灼烧混合物的方法
D.有盐和水生成的反应不一定是中和反应
4.有一包白色固体样品,可能含碳酸钠、硫酸钠、氯化钠、氢氧化钠中的一种或几种。小科同学为探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaCl2溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图所示。
请回答下列问题:
(1)AB段观察到的现象是____________________________________。
(2)C点时,溶液中一定含有的溶质是__________________________。
5.通过海水晒制可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。以下是一种由粗盐制备精盐的实验方案流程图:
分析该流程图,回答下列问题:
(1)试剂X为________(填写化学式)。
(2)加适量HCl溶液的目的是________。
(3)操作Y________。
(4)选择除杂的试剂不能用KOH代替NaOH溶液,理由是________。
1.下列化肥中,利用其物理性质即可与其他化肥区别开来的一种是( )
A.硫酸铵 B.磷矿粉
C.尿素 D.硝酸钾
2.下列有关联合制碱法的原料(氯化钠、二氧化碳、氨气、水)与产品(碳酸钠、氯化铵)说法不正确的是( )
A.碳酸钠广泛应用于玻璃、造纸、纺织和洗涤剂的生产
B.氯化钠在自然界中分布很广,海洋、盐湖、盐井、盐矿等都是氯化钠的来源
C.侯氏制碱法消耗了二氧化碳,极大地缓解了酸雨的形成
D.氯化铵与熟石灰粉末混合研磨,放出具有刺激性气味的氨气
3.如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KCl,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A.上述过程中涉及的化学反应属于复分解反应
B.80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C.上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D.在0~100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
4.从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如图:
(1)反应池Ⅰ中用硝酸不用稀硫酸的主要原因是_________________________。
(2)反应池Ⅱ中加入氨水的目的是_____________________________________。
(3)反应池Ⅲ中生成碳酸钙的化学方程式是_______________________________。
(4)过滤Ⅱ中所得滤液在农业生产中的一种用途是_________________________。
5.草木灰是农村常用的一种肥料(其有效成分是K2CO3)。某兴趣小组为了测定草木灰中K2CO3的含量,取现有的草木灰40g放入锥形瓶中,将40g盐酸分4次(每次10g)加入瓶中,所得溶液总质量与加入盐酸的关系如下表;已知K2CO3+2HC=2KCl+H2O+CO2↑(假设草木灰中除K2CO3外,其它物质均不溶于水,也不与盐酸反应)
所加次数 第一次 第二次 第三次 第四次
锥形瓶中物质总质量/g 49.68 59.36 69.12 79.12
(1)以上四次实验,其中盐酸有剩余的是________。
(2)第一次加入盐酸后产生气体的质量为________克。
(3)草木灰中K2CO3的质量分数为多少?_______
参考答案
例1、A
例2、B
例3、(1)蓝;铜(2)CuSO4;CuSO4+BaCl2=CuCl2+BaSO4↓(3)Ba(OH)2
例4、(1) (2)1.0
(3)根据图中曲线可知样品反应完释放的氨气是1.7g,根据质量守恒定律,设硝酸铵的质量为x,生成的硝酸钠的质量为y,
NH4NO3+NaOH △ NaNO3+H2O+NH3↑
80 85 17
x y 1.7g
==,x=8g,y=8.5g,
NH4NO3%=×100%=80%。
(4)NaNO3%=×100%=20%。
1.C 2.D 3.D
4.固体部分溶解并有气泡产生 NaCl、BaCl2、HCl
5.(1)Na2CO3(2)除去多余的CO32-和OH-(3)蒸发结晶(4)会引进新的杂质KCl或K+
1.B 2.C 3.B
4.反应生成的CaSO4微溶于水,包裹在CaCO3表面,阻止反应继续进行
与过量的硝酸反应,与硝酸铁反应生成氢氧化铁沉淀
(NH4)2CO3+Ca(NO3)2=== CaCO3↓+2NH4NO3 氮肥
5.三、四 0.32 6.9%
【解析】(1)第一次生成二氧化碳的质量为40g+10g-49.68g=0.32g,第二次生成二氧化碳的质量为49.68g+10g-59.36g=0.32g,第三次生成二氧化碳的质量为59.36g+10g-69.12g=0.24g,说明第三次开始稀盐酸过量,故填:三、四。
(2) 第一次生成二氧化碳的质量为40g+10g-49.68g=0.32g,故填:0.32g。
(3)解:设草木灰中碳酸钾质量为x克 ,CO2的质量为:80-79.12=0.88克
x=2.76
样品中K2CO3的质量分数为:2.76g/40g=6.9%
答:草木灰中的K2CO3质量分数为6.9%。
【备考2023】浙教版科学中考第二轮复习--第20讲
盐和化肥
1. 概念:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
2. 常见的盐
二、盐的化学性质
1. 与某些金属反应
规律:金属(K、Ca、Na除外)+盐→ 新金属+新盐(活动性:金属>新金属)
举例:(1)铁和硫酸铜溶液:
(2)铜和硝酸银溶液:
2. 与酸反应
规律:盐+酸→ 新盐+新酸
举例:(1)稀盐酸和碳酸钙:
(2)稀硫酸和氯化钡:
3. 与碱反应
规律:碱+盐→ 新碱+新盐
举例:(1)碳酸钠和氢氧化钡:Na2CO3+Ba(OH)2=== BaCO3↓+2NaOH
(2)硫酸铜和氢氧化钠:CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4
4. 与某些盐反应
规律:盐+盐→ 新盐+新盐
举例:(1)硝酸银和氯化钠:
(2)硫酸铜和氯化钡:
三、复分解反应及其应用
1. 概念:由两种化合物相互交换成分,生成另外两种化合物的反应。
2. 特点:双交换,价不变。
3. 表达式:AB+CD→ AD+CB
4. 常见的类型
【记忆口诀】常见盐的溶解性:钾钠铵硝皆可溶 盐酸盐中银不溶 硫酸盐中钡不溶 其他碳酸盐都不溶
5. 应用:判断物质间能否共存、进行物质的鉴别和除杂等。
四、化学肥料
五、氢氧化钠变质的探究
1. 变质的原因
氢氧化钠与空气中的CO2反应生成碳酸钠和水。反应的化学方程式为
2. 检验氢氧化钠是否变质→检验是否含有
(1)分析:能和CO32-反应产生明显现象,但不能和OH-反应或反应产生同样现象的离子有:
(2)实验方案
3. 探究已变质的NaOH是部分变质还是全部变质
(1)变质后的成分
(2)分析:在有CO32-存在的情况下检验是否有OH-,应先除去CO32-,再检验OH-:
除去CO32- ——含Ca2+、Ba2+的物质(如CaCl2、BaCl2等)(不能引入OH-)。
(3)实验方案
4. 实验反思
氢氧化钠应密封保存。
六、粗盐提纯
一、粗盐中难溶性杂质的去除
1. 实验用品
托盘天平(含砝码)、纸片、漏斗、药匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)、滤纸、酒精灯、蒸发皿、坩埚钳、石棉网、火柴。
2. 实验操作步骤图
3. 实验步骤
(1)称取:称量一定量的粗盐。
(2)溶解:将粗盐逐渐加入水中并用玻璃棒不断搅拌,直到粗盐不再溶解为止。(称量剩余粗盐的质量,计算溶解的粗盐的质量)
(3)过滤:将粗盐水用玻璃棒引流入漏斗中过滤,若滤液浑浊,则应重新过滤。
(4)蒸发:将过滤后的澄清滤液倒入蒸发皿中,边加热边用玻璃棒不断搅拌,当蒸发皿中出现较多固体时停止加热,利用余热将其蒸干。
(5)计算产率:用玻璃棒把蒸发皿中的晶体转移到纸上称量,得到精盐质量,计算产率:
二、粗盐中可溶性杂质的去除
1. 粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故除杂实质为除去Ca2+、Mg2+、SO42-(填离子符号)。
2. 方法
(1)选除杂试剂
(2) 除杂流程
①加入过量的BaCl2溶液———除去Na2SO4;
②加入过量的NaOH溶液———除去MgCl2;
③加入过量的Na2CO3溶液———除去CaCl2、BaCl2;
④加入稀盐酸———除去NaOH、Na2CO3。
例1、Na2CO3 的水溶液呈碱性,下列说法错误的是( )
A.碳酸钠在水中会电离出 OH-
B.往碳酸钠溶液中加稀硫酸后溶液的 pH降低
C.碳酸钠溶液中存在 OH-
D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
例2、在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图像能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系是( )
例3、硫酸铜、硝酸铜具有一相似的化学质。请回答:
(1)硫酸铜、硝酸铜两种物质的溶液均显________色,因为它们部具有________离子。
(2)向硫酸铜,硝酸铜两种物质的液中分别加入BaCl2溶液,能发生反应的物质是________(填化学式),化学方程式是________。
(3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根根离子转变成沉淀,该净物的化学式为________。
例4、某校科学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于25g水后,再加入11.2g氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠反应的化学方程式为:NH4NO3+NaOH △ NaNO3+H2O+NH3↑)。把产生的所有NH3用足量的硫酸溶液吸收,同时测量2min内硫酸溶液增加的质量,结果如表所示:
时间(s) 0 20 30 40 60 80 100 120
增加的质量(g) 0 0.7 m 1.2 1.5 1.6 1.7 1.7
试回答下列问题:
(1)请以反应时间为横坐标,以产生的NH3质量为纵坐标,画出能够表明产生气体的质量随时间变化的关系曲线。
(2)表中m约为___________________。
(3)求硝酸铵样品的纯度。
(4)求反应后所得硝酸钠溶液的溶质质量分数(不考虑反应过程中水损失的 质量)。
1.侯氏制碱法的生产过程涉及如下反应:NH3+CO2+NaCl+X===NaHCO3↓+NH4Cl,2NaHCO3 △ Na2CO3+CO2↑+H2O。下列说法错误的是( )
A.X的化学式为H2O
B.NaHCO3受热易分解
C.CO2和Na2CO3中碳元素的化合价不同
D.NaHCO3分解产生的CO2可以回收再利用
2.过氧化氢(H2O2)俗称双氧水,是一种液体,易分解,常作氧化剂、漂白剂和消毒剂.为了便于贮存、运输和使用,工业上常将它转化为固态的过碳酸钠晶体(2Na2CO3 3H2O2),该晶体具有Na2CO3和H2O2的双重性质.下列物质不会使过碳酸钠晶体失效的是( )
A.MnO2 B.H2S C.稀盐酸 D.NaHCO3
3.下列说法正确的是( )
A.向某溶液中滴加AgNO3溶液和稀HNO3,产生白色沉淀。该溶液一定为稀盐酸
B.可用适量的硝酸钙溶液,除去氯化钠溶液中混有的碳酸钠,得到纯净的氯化钠
C.要除去铜粉中混有的少量炭粉,可采用在空气中充分灼烧混合物的方法
D.有盐和水生成的反应不一定是中和反应
4.有一包白色固体样品,可能含碳酸钠、硫酸钠、氯化钠、氢氧化钠中的一种或几种。小科同学为探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaCl2溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图所示。
请回答下列问题:
(1)AB段观察到的现象是____________________________________。
(2)C点时,溶液中一定含有的溶质是__________________________。
5.通过海水晒制可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。以下是一种由粗盐制备精盐的实验方案流程图:
分析该流程图,回答下列问题:
(1)试剂X为________(填写化学式)。
(2)加适量HCl溶液的目的是________。
(3)操作Y________。
(4)选择除杂的试剂不能用KOH代替NaOH溶液,理由是________。
1.下列化肥中,利用其物理性质即可与其他化肥区别开来的一种是( )
A.硫酸铵 B.磷矿粉
C.尿素 D.硝酸钾
2.下列有关联合制碱法的原料(氯化钠、二氧化碳、氨气、水)与产品(碳酸钠、氯化铵)说法不正确的是( )
A.碳酸钠广泛应用于玻璃、造纸、纺织和洗涤剂的生产
B.氯化钠在自然界中分布很广,海洋、盐湖、盐井、盐矿等都是氯化钠的来源
C.侯氏制碱法消耗了二氧化碳,极大地缓解了酸雨的形成
D.氯化铵与熟石灰粉末混合研磨,放出具有刺激性气味的氨气
3.如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KCl,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A.上述过程中涉及的化学反应属于复分解反应
B.80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C.上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D.在0~100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
4.从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如图:
(1)反应池Ⅰ中用硝酸不用稀硫酸的主要原因是_________________________。
(2)反应池Ⅱ中加入氨水的目的是_____________________________________。
(3)反应池Ⅲ中生成碳酸钙的化学方程式是_______________________________。
(4)过滤Ⅱ中所得滤液在农业生产中的一种用途是_________________________。
5.草木灰是农村常用的一种肥料(其有效成分是K2CO3)。某兴趣小组为了测定草木灰中K2CO3的含量,取现有的草木灰40g放入锥形瓶中,将40g盐酸分4次(每次10g)加入瓶中,所得溶液总质量与加入盐酸的关系如下表;已知K2CO3+2HC=2KCl+H2O+CO2↑(假设草木灰中除K2CO3外,其它物质均不溶于水,也不与盐酸反应)
所加次数 第一次 第二次 第三次 第四次
锥形瓶中物质总质量/g 49.68 59.36 69.12 79.12
(1)以上四次实验,其中盐酸有剩余的是________。
(2)第一次加入盐酸后产生气体的质量为________克。
(3)草木灰中K2CO3的质量分数为多少?_______
参考答案
例1、A
例2、B
例3、(1)蓝;铜(2)CuSO4;CuSO4+BaCl2=CuCl2+BaSO4↓(3)Ba(OH)2
例4、(1) (2)1.0
(3)根据图中曲线可知样品反应完释放的氨气是1.7g,根据质量守恒定律,设硝酸铵的质量为x,生成的硝酸钠的质量为y,
NH4NO3+NaOH △ NaNO3+H2O+NH3↑
80 85 17
x y 1.7g
==,x=8g,y=8.5g,
NH4NO3%=×100%=80%。
(4)NaNO3%=×100%=20%。
1.C 2.D 3.D
4.固体部分溶解并有气泡产生 NaCl、BaCl2、HCl
5.(1)Na2CO3(2)除去多余的CO32-和OH-(3)蒸发结晶(4)会引进新的杂质KCl或K+
1.B 2.C 3.B
4.反应生成的CaSO4微溶于水,包裹在CaCO3表面,阻止反应继续进行
与过量的硝酸反应,与硝酸铁反应生成氢氧化铁沉淀
(NH4)2CO3+Ca(NO3)2=== CaCO3↓+2NH4NO3 氮肥
5.三、四 0.32 6.9%
【解析】(1)第一次生成二氧化碳的质量为40g+10g-49.68g=0.32g,第二次生成二氧化碳的质量为49.68g+10g-59.36g=0.32g,第三次生成二氧化碳的质量为59.36g+10g-69.12g=0.24g,说明第三次开始稀盐酸过量,故填:三、四。
(2) 第一次生成二氧化碳的质量为40g+10g-49.68g=0.32g,故填:0.32g。
(3)解:设草木灰中碳酸钾质量为x克 ,CO2的质量为:80-79.12=0.88克
x=2.76
样品中K2CO3的质量分数为:2.76g/40g=6.9%
答:草木灰中的K2CO3质量分数为6.9%。
【备考2023】浙教版科学中考第二轮复习--第20讲
盐和化肥
