1.2 溶液组成的定量表示 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学
文档属性
| 名称 | 1.2 溶液组成的定量表示 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 47.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-06 21:12:31 | ||
图片预览


文档简介
1.2 溶液组成的定量表示 同步练习
一、单选题
1.某同学配制100g 9.5%的食盐溶液,下列操作会使溶液质量分数偏大的是( )
A.用天平称取食盐时砝码和物质位置放反
B.天平调零时游码未放在零刻度
C.用量筒取水时仰视液面
D.将水倒入烧杯中时有水溅出
2.如图,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水.对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
3.将50g20%的硝酸钾溶液稀释到200g,稀释后所得溶液中溶质的质量分数是( )
A.20% B.10% C.5% D.1%
4.如果要将100g溶质质量分数为20%的硝酸钾溶液,稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为 ( )
A.50 g B.90 g C.100 g D.200 g
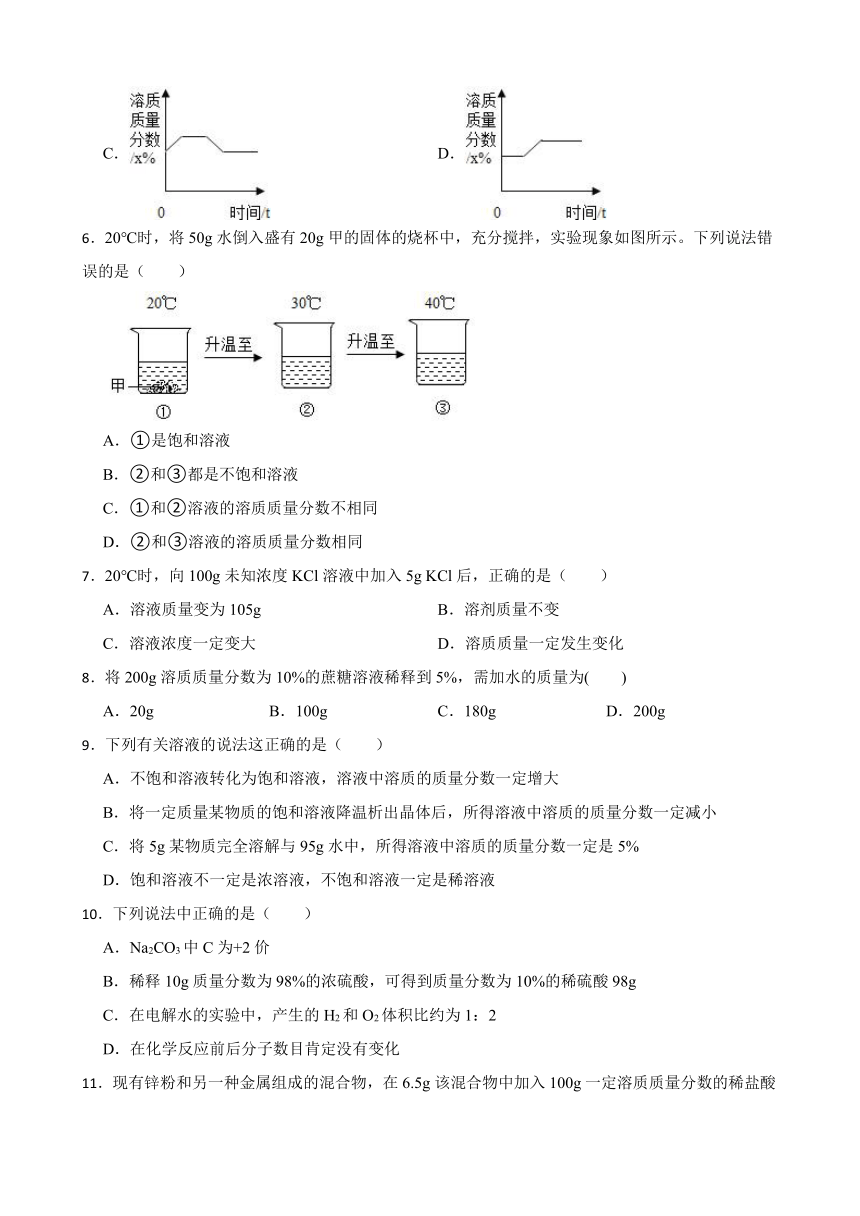
5.70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是 ( )
A. B.
C. D.
6.20℃时,将50g水倒入盛有20g甲的固体的烧杯中,充分搅拌,实验现象如图所示。下列说法错误的是( )
A.①是饱和溶液
B.②和③都是不饱和溶液
C.①和②溶液的溶质质量分数不相同
D.②和③溶液的溶质质量分数相同
7.20℃时,向100g未知浓度KCl溶液中加入5g KCl后,正确的是( )
A.溶液质量变为105g B.溶剂质量不变
C.溶液浓度一定变大 D.溶质质量一定发生变化
8.将200g溶质质量分数为10%的蔗糖溶液稀释到5%,需加水的质量为( )
A.20g B.100g C.180g D.200g
9.下列有关溶液的说法这正确的是( )
A.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
B.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量分数一定减小
C.将5g某物质完全溶解与95g水中,所得溶液中溶质的质量分数一定是5%
D.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
10.下列说法中正确的是( )
A.Na2CO3中C为+2价
B.稀释10g质量分数为98%的浓硫酸,可得到质量分数为10%的稀硫酸98g
C.在电解水的实验中,产生的H2和O2体积比约为1:2
D.在化学反应前后分子数目肯定没有变化
11.现有锌粉和另一种金属组成的混合物,在6.5g该混合物中加入100g一定溶质质量分数的稀盐酸后,混合物与稀盐酸恰好完全反应,产生氢气的质量为m,下列说法正确的是( )
A.若混合物为Zn,Mg,m可能是0.2g
B.若混合物为Zn,Fe,m等于0.2g
C.若混合物为Zn,Fe,m等于0.1g,混合物中铁的质量分数为50%
D.若混合物为Zn,Mg,则稀盐酸中溶质质量分数一定大于7.3%
12.一定温度下,向图I烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )
A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
二、填空题
13.请你填全下面两种氯化钠溶液中的各个量
NaCl溶液(g) 水(g) 溶解的NaCl固体(g) 溶质的质量分数
200 10
150 16%
14.将一定量的溶质质量分数为20.0%的某溶液,在一定温度下蒸发掉10.0克水时,有2.0克不含结晶水的溶质晶体析出,此时溶液中溶质的质量分数变为24.0%.则该溶液在此温度下的溶解度为 ;此实验中所取的20.0%的溶液质量为 .
15.10度时在100水中放入30硝酸钾固体,充分搅拌后尚有9.1硝酸钾没有溶解,其形成的溶液中含硝酸钾的质量 ,形成硝酸钾溶液的质量为 ,其溶质的质量分数是 ?
16.某固体物质的溶解度曲线如图所示,试回答有关问题.
(1)估计90℃下该固体的溶解度为 克.
(2)②点可表示将①点溶液降温到约 ℃,溶液刚好达到饱和状态.
(3)③点可表示将②点溶液降温到40℃左右,有 析出.
(4)③点溶液中溶质的质量分数 (填“大于”或“小于”或“等于”④点溶液中溶质的质量分数.
17.化学实验室有质量分数为98%的浓硫酸,将50g上述浓硫酸稀释成质量分数为20%的稀硫酸,需要水的质量为 .
18.把100g质量分数为98%的浓H2SO4稀释成10%的稀H2SO4,需要水的质量是 g。
三、综合题
19.某兴趣小组的同学欲测定石灰石中碳酸钙的质量分数,取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表(已知该石灰石中的杂质不溶于水,也不与稀盐酸反应).计算:
实验次数 加入稀盐酸的质量/g 剩余固体的质量/g
1 20 15
2 20 10
3 20 7
4 20 m
(1)表中m的数值为 .
(2)样品中碳酸钙的质量分数 .
(3)稀盐酸中溶质的质量分数(结果精确到0.1%)
20.某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如下图所示:
请回答下列问题:
(1)反应生成的气体质量为 g;
(2)该废水中Na2CO3的质量分数和所用稀盐酸溶质的质量分数.
21.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 ;
(2)通过计算说明实际钙含量是否与标注相符;
(3)试计算所用稀盐酸的溶质质量分数.
22.某硫酸溶液100克恰好和6.5克锌完全反应,计算:
(1)生成氢气多少克?
(2)硫酸溶液溶质质量分数是多少?
(3)生成物溶液溶质质量分数是多少?
答案解析部分
1.【答案】D
2.【答案】B
3.【答案】C
4.【答案】C
5.【答案】C
6.【答案】B
7.【答案】B
8.【答案】D
9.【答案】B
10.【答案】B
11.【答案】D
12.【答案】C
13.【答案】190;5%;126;24
14.【答案】31.6g;22g
15.【答案】20.9g;120.9g;17.3%
16.【答案】190;60;固体;大于
17.【答案】195g
18.【答案】880
19.【答案】(1)7
(2)65%
(3)设20g稀盐酸中氯化氢质量为x,CaCO3+2HCl═CaCl2+H2O+CO2↑, 100 73
5g x
,x=3.65g,稀盐酸中溶质的质量分数为:×100%=18.25%,答:稀盐酸中溶质质量分数是18.25%.
20.【答案】(1)4.4
(2)解:设生成4.4g二氧化碳需要碳酸钠的质量为X,消耗氯化氢的质量为Y则:
Na2CO3+ 2HCl═2NaCl+H2O+ CO2↑
106 73 44
x y 4.4g
根据: 解得X=10.6g,根据: 解得Y=7.3g
废水中Na2CO3的质量分数: ×100%=10.6%;
所用稀盐酸溶质的质量分数: ×100%=10%.
答:废水中Na2CO3的质量分数是10.6%,所用稀盐酸溶质的质量分数为10%
21.【答案】(1)5.5;复分解反应
(2)解:设10片片剂中碳酸钙的质量为x,消耗盐酸中的氯化氢质量为y,
CaCO3+ 2HCl═CaCl2+H2O+ CO2↑
100 73 44
x y 5.5g
,
x=12.5g,y=9.125g
每片中钙含量是12.5g× ÷10片=0.5g<0.6g,实际钙含量与标注不相符
(3)解:所用稀盐酸的溶质质量分数: =18.25%
22.【答案】(1)解:设硫酸溶液中溶质的质量为x,生成硫酸锌的质量为y,生成氢气的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
6.5g x y z
x=9.8g y=16.1g z=0.2g
生成氢气的质量为0.2g
(2)解:硫酸溶液中溶质的质量分数= ×100%=9.8%
(3)解:硫酸锌溶液的溶质质量分数= ×100%=15.1%
一、单选题
1.某同学配制100g 9.5%的食盐溶液,下列操作会使溶液质量分数偏大的是( )
A.用天平称取食盐时砝码和物质位置放反
B.天平调零时游码未放在零刻度
C.用量筒取水时仰视液面
D.将水倒入烧杯中时有水溅出
2.如图,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水.对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
3.将50g20%的硝酸钾溶液稀释到200g,稀释后所得溶液中溶质的质量分数是( )
A.20% B.10% C.5% D.1%
4.如果要将100g溶质质量分数为20%的硝酸钾溶液,稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为 ( )
A.50 g B.90 g C.100 g D.200 g
5.70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是 ( )
A. B.
C. D.
6.20℃时,将50g水倒入盛有20g甲的固体的烧杯中,充分搅拌,实验现象如图所示。下列说法错误的是( )
A.①是饱和溶液
B.②和③都是不饱和溶液
C.①和②溶液的溶质质量分数不相同
D.②和③溶液的溶质质量分数相同
7.20℃时,向100g未知浓度KCl溶液中加入5g KCl后,正确的是( )
A.溶液质量变为105g B.溶剂质量不变
C.溶液浓度一定变大 D.溶质质量一定发生变化
8.将200g溶质质量分数为10%的蔗糖溶液稀释到5%,需加水的质量为( )
A.20g B.100g C.180g D.200g
9.下列有关溶液的说法这正确的是( )
A.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
B.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量分数一定减小
C.将5g某物质完全溶解与95g水中,所得溶液中溶质的质量分数一定是5%
D.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
10.下列说法中正确的是( )
A.Na2CO3中C为+2价
B.稀释10g质量分数为98%的浓硫酸,可得到质量分数为10%的稀硫酸98g
C.在电解水的实验中,产生的H2和O2体积比约为1:2
D.在化学反应前后分子数目肯定没有变化
11.现有锌粉和另一种金属组成的混合物,在6.5g该混合物中加入100g一定溶质质量分数的稀盐酸后,混合物与稀盐酸恰好完全反应,产生氢气的质量为m,下列说法正确的是( )
A.若混合物为Zn,Mg,m可能是0.2g
B.若混合物为Zn,Fe,m等于0.2g
C.若混合物为Zn,Fe,m等于0.1g,混合物中铁的质量分数为50%
D.若混合物为Zn,Mg,则稀盐酸中溶质质量分数一定大于7.3%
12.一定温度下,向图I烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )
A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
二、填空题
13.请你填全下面两种氯化钠溶液中的各个量
NaCl溶液(g) 水(g) 溶解的NaCl固体(g) 溶质的质量分数
200 10
150 16%
14.将一定量的溶质质量分数为20.0%的某溶液,在一定温度下蒸发掉10.0克水时,有2.0克不含结晶水的溶质晶体析出,此时溶液中溶质的质量分数变为24.0%.则该溶液在此温度下的溶解度为 ;此实验中所取的20.0%的溶液质量为 .
15.10度时在100水中放入30硝酸钾固体,充分搅拌后尚有9.1硝酸钾没有溶解,其形成的溶液中含硝酸钾的质量 ,形成硝酸钾溶液的质量为 ,其溶质的质量分数是 ?
16.某固体物质的溶解度曲线如图所示,试回答有关问题.
(1)估计90℃下该固体的溶解度为 克.
(2)②点可表示将①点溶液降温到约 ℃,溶液刚好达到饱和状态.
(3)③点可表示将②点溶液降温到40℃左右,有 析出.
(4)③点溶液中溶质的质量分数 (填“大于”或“小于”或“等于”④点溶液中溶质的质量分数.
17.化学实验室有质量分数为98%的浓硫酸,将50g上述浓硫酸稀释成质量分数为20%的稀硫酸,需要水的质量为 .
18.把100g质量分数为98%的浓H2SO4稀释成10%的稀H2SO4,需要水的质量是 g。
三、综合题
19.某兴趣小组的同学欲测定石灰石中碳酸钙的质量分数,取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表(已知该石灰石中的杂质不溶于水,也不与稀盐酸反应).计算:
实验次数 加入稀盐酸的质量/g 剩余固体的质量/g
1 20 15
2 20 10
3 20 7
4 20 m
(1)表中m的数值为 .
(2)样品中碳酸钙的质量分数 .
(3)稀盐酸中溶质的质量分数(结果精确到0.1%)
20.某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如下图所示:
请回答下列问题:
(1)反应生成的气体质量为 g;
(2)该废水中Na2CO3的质量分数和所用稀盐酸溶质的质量分数.
21.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 ;
(2)通过计算说明实际钙含量是否与标注相符;
(3)试计算所用稀盐酸的溶质质量分数.
22.某硫酸溶液100克恰好和6.5克锌完全反应,计算:
(1)生成氢气多少克?
(2)硫酸溶液溶质质量分数是多少?
(3)生成物溶液溶质质量分数是多少?
答案解析部分
1.【答案】D
2.【答案】B
3.【答案】C
4.【答案】C
5.【答案】C
6.【答案】B
7.【答案】B
8.【答案】D
9.【答案】B
10.【答案】B
11.【答案】D
12.【答案】C
13.【答案】190;5%;126;24
14.【答案】31.6g;22g
15.【答案】20.9g;120.9g;17.3%
16.【答案】190;60;固体;大于
17.【答案】195g
18.【答案】880
19.【答案】(1)7
(2)65%
(3)设20g稀盐酸中氯化氢质量为x,CaCO3+2HCl═CaCl2+H2O+CO2↑, 100 73
5g x
,x=3.65g,稀盐酸中溶质的质量分数为:×100%=18.25%,答:稀盐酸中溶质质量分数是18.25%.
20.【答案】(1)4.4
(2)解:设生成4.4g二氧化碳需要碳酸钠的质量为X,消耗氯化氢的质量为Y则:
Na2CO3+ 2HCl═2NaCl+H2O+ CO2↑
106 73 44
x y 4.4g
根据: 解得X=10.6g,根据: 解得Y=7.3g
废水中Na2CO3的质量分数: ×100%=10.6%;
所用稀盐酸溶质的质量分数: ×100%=10%.
答:废水中Na2CO3的质量分数是10.6%,所用稀盐酸溶质的质量分数为10%
21.【答案】(1)5.5;复分解反应
(2)解:设10片片剂中碳酸钙的质量为x,消耗盐酸中的氯化氢质量为y,
CaCO3+ 2HCl═CaCl2+H2O+ CO2↑
100 73 44
x y 5.5g
,
x=12.5g,y=9.125g
每片中钙含量是12.5g× ÷10片=0.5g<0.6g,实际钙含量与标注不相符
(3)解:所用稀盐酸的溶质质量分数: =18.25%
22.【答案】(1)解:设硫酸溶液中溶质的质量为x,生成硫酸锌的质量为y,生成氢气的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
6.5g x y z
x=9.8g y=16.1g z=0.2g
生成氢气的质量为0.2g
(2)解:硫酸溶液中溶质的质量分数= ×100%=9.8%
(3)解:硫酸锌溶液的溶质质量分数= ×100%=15.1%
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
