第三章 第2节 第一课时 醇 课件(共40张PPT) 2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第三章 第2节 第一课时 醇 课件(共40张PPT) 2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 15:45:58 | ||
图片预览



文档简介
(共40张PPT)
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第二节 醇 酚
学习
目标
第1课时
醇的结构与性质
PART
01
PART
02
结合醇的代表物了解醇的分类、组成和结构,理解醇的性质,培养“宏观辨别与微观探析”的核心素养
以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。培养“变化观念与证据推理”的核心素养
CH3OH
CH3CH2OH
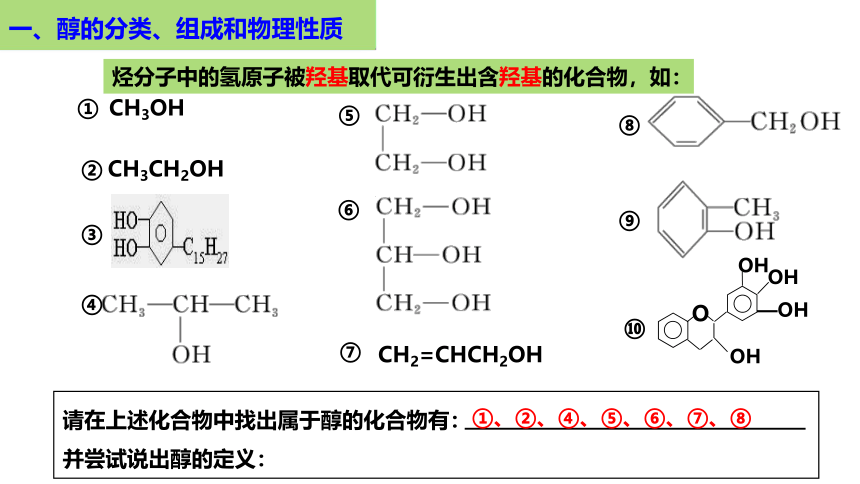
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
请在上述化合物中找出属于醇的化合物有:
并尝试说出醇的定义:
①
②
③
④
⑤
⑥
⑧
⑨
⑩
①、②、④、⑤、⑥、⑦、⑧
CH2=CHCH2OH
⑦
O
—OH
OH
OH
OH
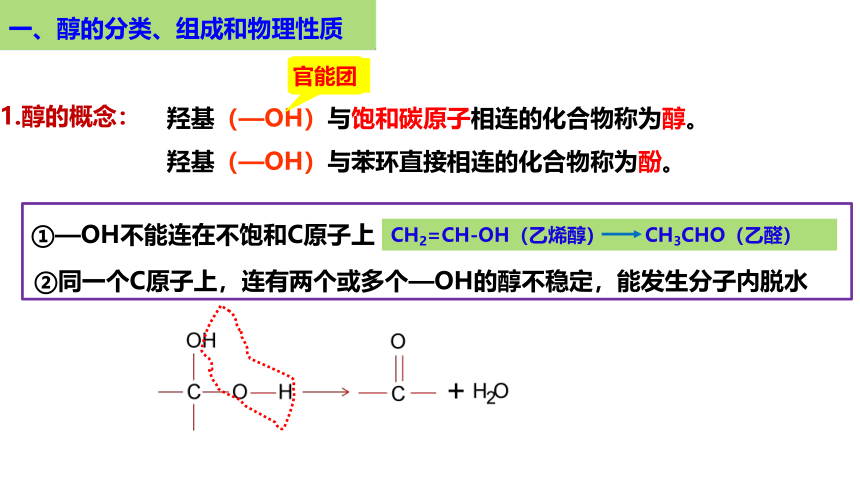
一、醇的分类、组成和物理性质
羟基(—OH)与饱和碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
1.醇的概念:
①—OH不能连在不饱和C原子上
CH2=CH-OH(乙烯醇) CH3CHO(乙醛)
②同一个C原子上,连有两个或多个—OH的醇不稳定,能发生分子内脱水
官能团
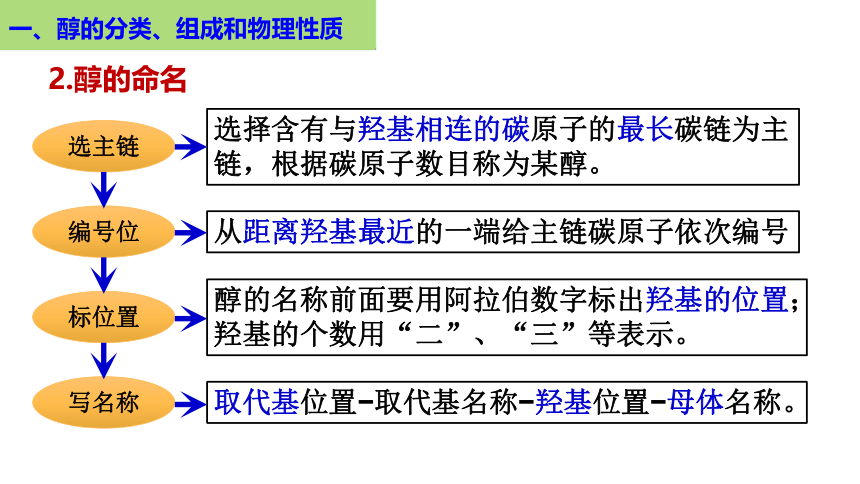
一、醇的分类、组成和物理性质
选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇。
从距离羟基最近的一端给主链碳原子依次编号
醇的名称前面要用阿拉伯数字标出羟基的位置;
羟基的个数用“二”、“三”等表示。
取代基位置 取代基名称 羟基位置 母体名称。
选主链
编号位
标位置
写名称
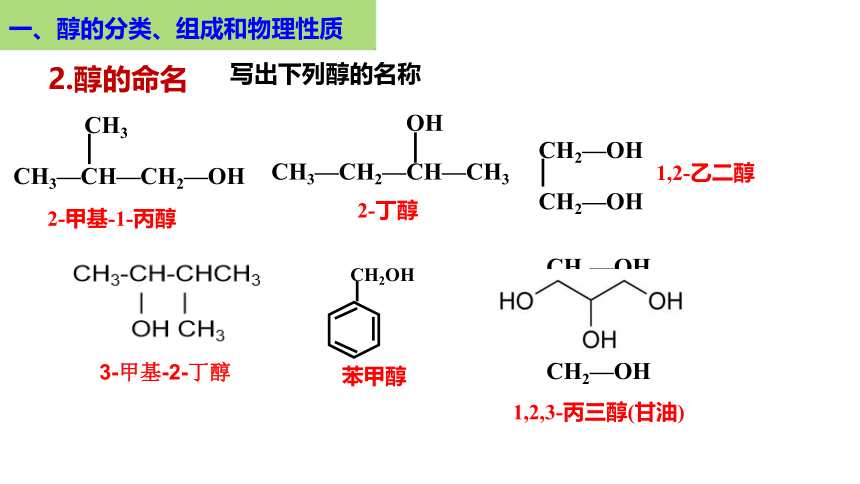
2.醇的命名
一、醇的分类、组成和物理性质
选主链
编号位
标位置
写名称
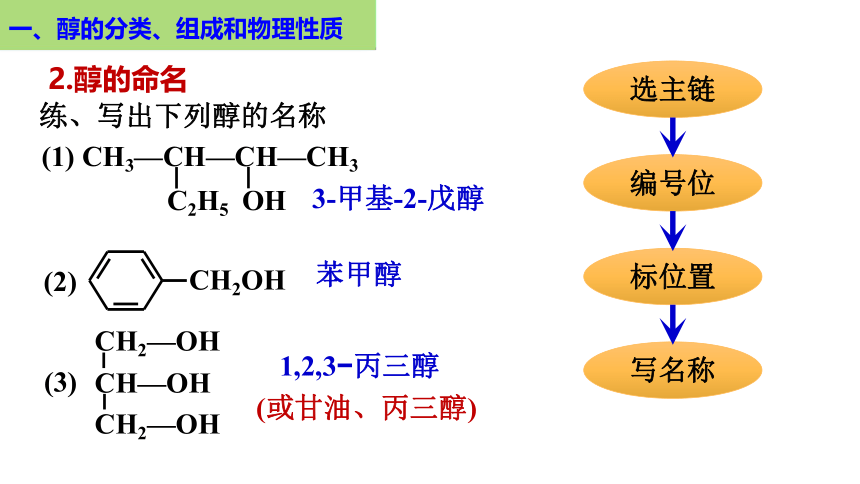
(1) CH3—CH—CH—CH3
C2H5
OH
练、写出下列醇的名称
CH2OH
(2)
CH2—OH
CH—OH
CH2—OH
(3)
3-甲基-2-戊醇
苯甲醇
1,2,3 丙三醇
(或甘油、丙三醇)
2.醇的命名
一、醇的分类、组成和物理性质
写出下列醇的名称
2-甲基-1-丙醇
2-丁醇
1,2-乙二醇
1,2,3-丙三醇(甘油)
苯甲醇
CH3—CH—CH2—OH
CH3
CH3—CH2—CH—CH3
OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH2OH
3-甲基-2-丁醇
2.醇的命名
一、醇的分类、组成和物理性质
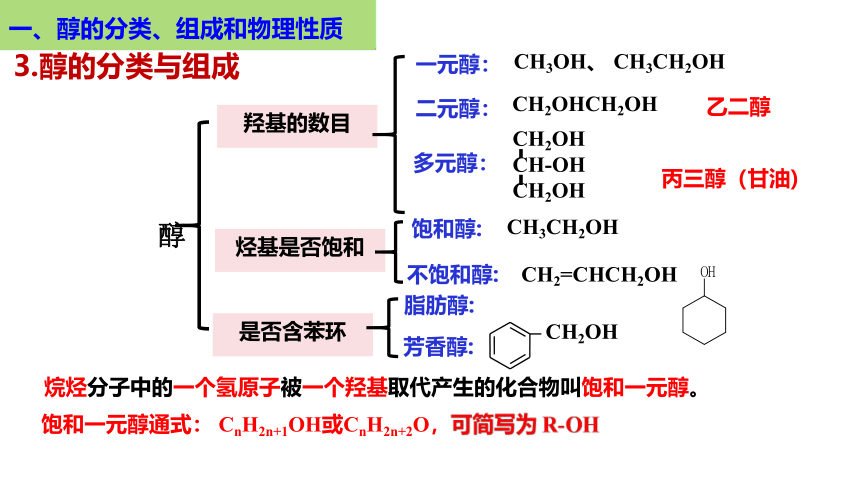
羟基的数目
烃基是否饱和
是否含苯环
一元醇:
CH3OH、 CH3CH2OH
二元醇:
多元醇:
CH2OHCH2OH
CH2OH
CH-OH
CH2OH
丙三醇(甘油)
乙二醇
饱和醇:
不饱和醇:
CH3CH2OH
CH2=CHCH2OH
脂肪醇:
CH2OH
芳香醇:
醇
3.醇的分类与组成
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH或CnH2n+2O,可简写为 R-OH
一、醇的分类、组成和物理性质
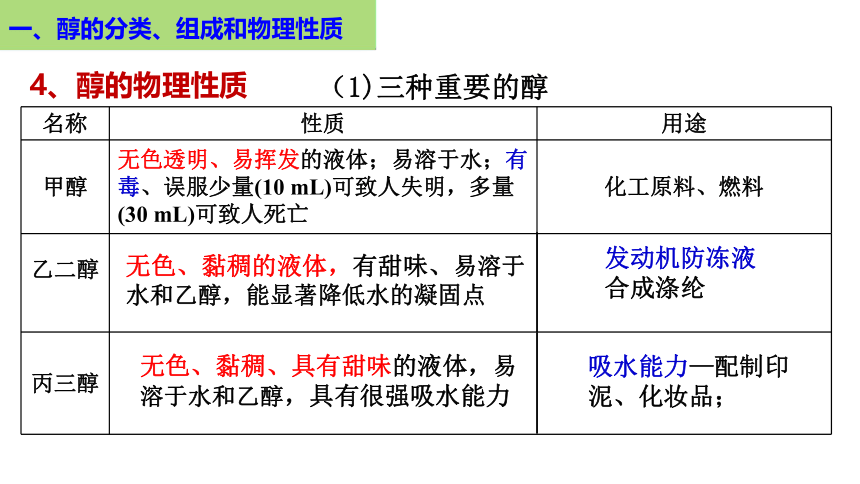
(1)三种重要的醇
名称 性质 用途
甲醇 无色透明、易挥发的液体;易溶于水;有毒、误服少量(10 mL)可致人失明,多量(30 mL)可致人死亡 化工原料、燃料
乙二醇 丙三醇 无色、黏稠的液体,有甜味、易溶于水和乙醇,能显著降低水的凝固点
发动机防冻液
合成涤纶
无色、黏稠、具有甜味的液体,易溶于水和乙醇,具有很强吸水能力
吸水能力—配制印泥、化妆品;
4、醇的物理性质
一、醇的分类、组成和物理性质
CH2CH2
OH OH
乙二醇
(甘醇)
二元醇
CH2CH CH2
OH OH OH
丙三醇(甘油)
吸湿性,护肤
三元醇
一元醇
CH3OH
甲醇
剧毒
工业酒精有毒!
汽车防冻剂
配制化妆品
车用燃料
(1)三种重要的醇
4、醇的物理性质
一、醇的分类、组成和物理性质
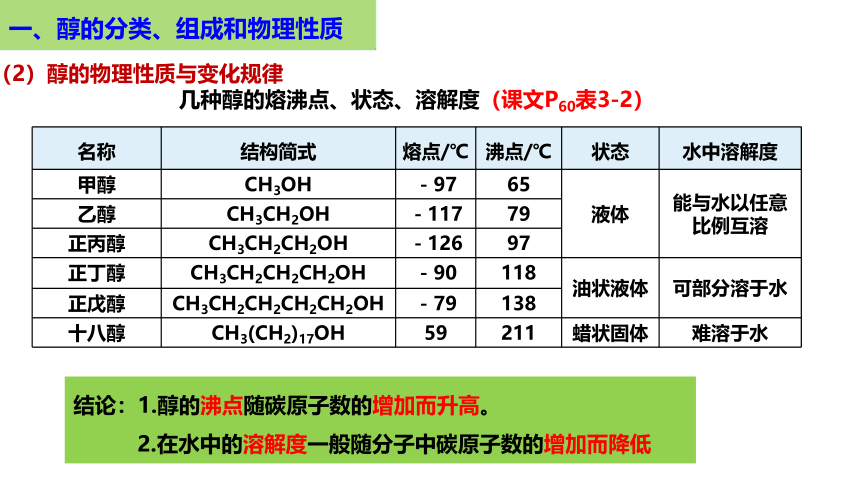
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
结论:1.醇的沸点随碳原子数的增加而升高。
2.在水中的溶解度一般随分子中碳原子数的增加而降低
几种醇的熔沸点、状态、溶解度(课文P60表3-2)
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
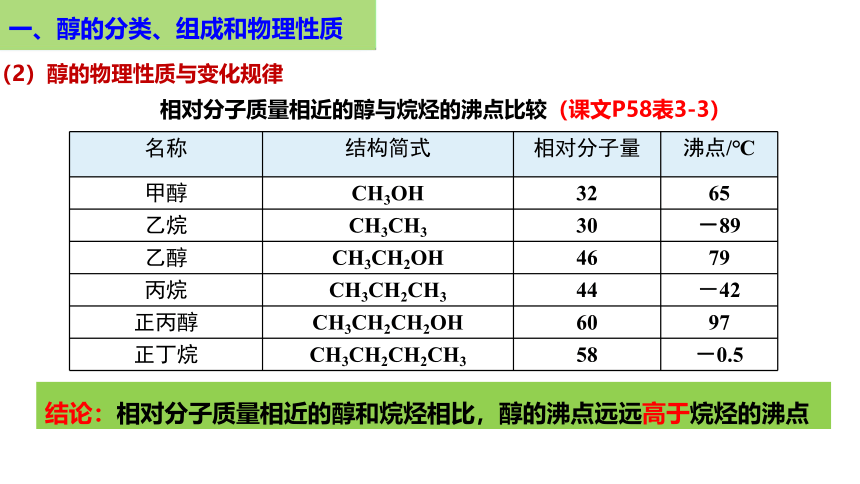
相对分子质量相近的醇与烷烃的沸点比较(课文P58表3-3)
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
结论:相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
原因:
一个醇分子的羟基氢原子可与另一个醇分子羟基氧原子相互吸引,形成氢键,形成氢键可以增大分子间作用力,从而影响物质的溶解度、熔沸点。
相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。
氢键
为什么相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点?
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
结论:
结论:含相同碳原子数的醇,羟基数越多,沸点越高。
变式:下表列举了一些醇的沸点。沸点变化有什么规律,并作出解释
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-二丙醇 2 188
1,2,3-丙三醇 3 259
解释:醇分子中羟基数越多,分子间形成的氢键数目越多,分子间作用力越大,沸点就越高,同理可推测醇分子中羟基数越多,在水中的溶解度增大
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
①沸点
①相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。
②饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
③碳原子数相同时,羟基个数越多,醇的沸点越高。
②溶解性
①甲醇、乙醇和丙醇均可与水互溶,因为醇分子与水分子间形成了氢键。
②醇在水中的溶解度一般随碳原子数的增加而减小。
③碳原子数相同时,羟基个数越多,醇的水溶性越好。
醇中羟基形成氢键使沸点升高!
羟基越多,氢键越多,沸点越高!
小 结
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
③状态:
④密度:
一元醇的密度一般比水小,且随碳原子数的增多,密度一般增大。
常温下,碳原子数为1-3的饱和一元醇为液体;
碳原子数为4-11的饱和一元醇为油状液体;
碳原子数更多的高级饱和一元醇为固体
小 结
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
(1)乙醇与甲醚(CH3—O—CH3)互为碳架异构( )
(2)分子中含有—OH的有机物是醇( )
(3)质量分数为95%的乙醇溶液常作消毒剂( )
(4)向工业酒精中加入生石灰,然后加热蒸馏,可制得无水乙醇( )
(5)相对分子质量相近的醇和烷烃,醇的沸点远远高于烷烃,低级醇可与水以任意比例混溶,醇的这些物理性质都与羟基间或羟基与水分子间形成氢键有关( )
×
×
正误判断
√
×
√
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
1.下列关于醇类的说法错误的是
A.羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇
B.醇的同分异构体中一定有酚类物质
C.乙二醇和丙三醇都是无色液体,易溶于水和乙醇,其中丙三醇可用于
配制化妆品
D.甲醇是一种无色、易挥发、易溶于水的液体,常用作车用燃料
应用体验
B
(1)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
2.下列各组物质中互为同系物的是
A.乙二醇与丙三醇
B. 与
C.乙醇与2-丙醇
D. 与
C
(1)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代;同样C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
二、乙醇的结构与化学性质
(以乙醇为例)
反应名称 反应类型 断键位置
与金属钠反应
燃烧反应
Cu或Ag催化氧化
浓硫酸条件下与乙酸加热
① ③
①②③④⑤
①
①
取代反应
氧化反应
氧化反应
取代反应
二、乙醇的结构与化学性质
交流与讨论: 我们已经学习过乙醇的一些性质。请与同学交流你所知道的乙醇的化学性质,试列举乙醇发生的化学反应,并指出在反应过程中乙醇分子中的哪些化学键发生了断裂
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
(以乙醇为例)
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
反应机理:
卤原子取代了羟基,羟基和氢结合生成水
1.取代反应
应用:
可用于制备卤代烃
卤代烷
醇
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
二、乙醇的结构与化学性质
①与氢卤酸反应
(以乙醇为例)
1.取代反应
二、乙醇的结构与化学性质
②分子间脱水
C2H5—OH+H—OC2H5
浓硫酸
140℃
乙醚
C2H5 O C2H5+H2O
酸脱羟基、醇脱氢
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
③酯化反应——
①与浓卤化氢
CH3CH2—OH + H—X
Δ
CH3CH2X + H2O
(以乙醇为例)
【实验3-2】在圆底烧瓶中加入乙醇与浓硫酸按体积比1∶3的混合液20 mL,并加入碎瓷片防止暴沸。加热混合溶液,迅速升温到170 ℃,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
KMnO4酸性溶液、溴的四氯化碳溶液褪色。
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
实验现象:
实验结论:
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚易溶于有机溶剂,它本身就是一种优良溶剂,能溶解多种有机化合物。
2.醇的消去反应:
二、乙醇的结构与化学性质
注:如果把乙醇和浓硫酸的混合液的温度控制在140 ℃左右,乙醇将以另外一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚:(副反应)
C2H5—OH+H—OC2H5
浓硫酸
140℃
乙醚
C2H5 O C2H5+H2O
【醚类物质】
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
(以乙醇为例)
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
制乙烯实验装置
酒精与浓硫酸体积比为1∶3怎么混合?
浓硫酸的作用是什么?
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
用排水集气法收集
防止暴沸
催化剂和脱水剂
液面以下
防止在140℃时生成乙醚。
逐渐变黑。浓硫酸能将无水酒精氧化生成碳单质等多种物质。
有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
醇发生的消去反应的规律:
2.若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3或CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
1.连有羟基的碳原子的相邻碳原子上必须有氢才能发生消去反应形成不饱和键:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
二、乙醇的结构与化学性质
(以乙醇为例)
例:写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ 2H2O
等不能发生消除反应。
[思考:]下列醇在浓硫酸作催化剂的条件下能发生消去反应吗?
二、乙醇的结构与化学性质
醇发生消去反应的规律
(以乙醇为例)
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
①处O—H键断开
3.置换反应——与活泼金属钠反应
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
二、乙醇的结构与化学性质
2mol—OH ~ 2mol Na ~ 1molH2
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
A
练习:
(以乙醇为例)
分别写出下列乙醇氧化反应的化学方程式、现象、反应类型及断键位置。
(1)燃烧反应(完全燃烧)
2CO2 +3H2O
C2H5OH + 3O2
点燃
淡蓝色火焰
CuO中间产物,Cu催化剂
(2)催化氧化
2C2H5OH + O2
Cu
2CH3CHO + 2 H2O
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
①处O—H和③处α-C—H键断开
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(2)催化氧化
(以乙醇为例)
醇催化氧化反应的规律
醇发生催化氧化的断键位置:
—C—C—H
O—H
+ Cu+H2O
α
+ Cu O
—C—C
O
1.醇发生催化氧化的必备条件:α–C原子上必须连有氢原子。
2.醇发生催化氧化的产物的类别,取决于α–C原子上的氢原子的个数 。
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
醇发生催化氧化的产物类别——取决于与羟基相连的碳原子上氢的个数:
与—OH相连的碳原子上没有H时——则不能被氧化
C OH
R2
R1
R3
(3)
(2) 2 CH—OH + O2
R2
R1
Cu
△
(1) 2R—CH2—OH + O2
Cu
△
(与—OH相连的碳上有2-3个H时——产物为醛
O
=
2R—C—H + 2H2O
(与—OH相连的碳上有1个H时——产物为酮
O
=
2R1—C—R2 + 2H2O
二、乙醇的结构与化学性质
(以乙醇为例)
2.下列醇分子中可以被氧化生成醛的是( )。
A.CH3OH B.(CH3)3C—OH
C. D.(CH3)2CH—OH
A
A
练习
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
酸性KMnO4溶液:MnO4- (紫红色 ) Mn2+ (无色)
(3)被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化成乙酸
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
CH3CH2OH
乙醇
氧化
CH3CHO
乙醛
氧化
CH3COOH
乙酸
强氧化剂KMnO4/K2Cr2O7
应用:交警判断驾驶员是否酒后驾车的方法
酸性K2Cr2O7溶液: Cr2O72- (橙色) Cr3+(绿色)
K2Cr2O7(橙色)
Cr2(SO4)3(绿色)
C2H5OH
常见的强氧化剂:(课文P62实验3-3)
(以乙醇为例)
(3)被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化成乙酸
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
醇被酸性高锰酸钾等强氧化剂氧化的规律
C OH + KMnO4(H+) 不褪色
R2
R1
R3
(3)
(2) CH—OH + KMnO4(H+) 褪色
R2
R1
(1) 2R—CH2—OH + KMnO4(H+) 褪色
伯醇
仲醇
叔醇
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
小结:
烃
取
代
卤代烃
R-X
水
解
醇
R-OH
氧
化
醇
R'-CHO
氧
化
酸
R'-COOH
不 饱 和 烃
消
去
消
去
酯
加
成
加
成
取代
HX
强氧化剂
二、乙醇的结构与化学性质
(以乙醇为例)
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第二节 醇 酚
学习
目标
第1课时
醇的结构与性质
PART
01
PART
02
结合醇的代表物了解醇的分类、组成和结构,理解醇的性质,培养“宏观辨别与微观探析”的核心素养
以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。培养“变化观念与证据推理”的核心素养
CH3OH
CH3CH2OH
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
请在上述化合物中找出属于醇的化合物有:
并尝试说出醇的定义:
①
②
③
④
⑤
⑥
⑧
⑨
⑩
①、②、④、⑤、⑥、⑦、⑧
CH2=CHCH2OH
⑦
O
—OH
OH
OH
OH
一、醇的分类、组成和物理性质
羟基(—OH)与饱和碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
1.醇的概念:
①—OH不能连在不饱和C原子上
CH2=CH-OH(乙烯醇) CH3CHO(乙醛)
②同一个C原子上,连有两个或多个—OH的醇不稳定,能发生分子内脱水
官能团
一、醇的分类、组成和物理性质
选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇。
从距离羟基最近的一端给主链碳原子依次编号
醇的名称前面要用阿拉伯数字标出羟基的位置;
羟基的个数用“二”、“三”等表示。
取代基位置 取代基名称 羟基位置 母体名称。
选主链
编号位
标位置
写名称
2.醇的命名
一、醇的分类、组成和物理性质
选主链
编号位
标位置
写名称
(1) CH3—CH—CH—CH3
C2H5
OH
练、写出下列醇的名称
CH2OH
(2)
CH2—OH
CH—OH
CH2—OH
(3)
3-甲基-2-戊醇
苯甲醇
1,2,3 丙三醇
(或甘油、丙三醇)
2.醇的命名
一、醇的分类、组成和物理性质
写出下列醇的名称
2-甲基-1-丙醇
2-丁醇
1,2-乙二醇
1,2,3-丙三醇(甘油)
苯甲醇
CH3—CH—CH2—OH
CH3
CH3—CH2—CH—CH3
OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH2OH
3-甲基-2-丁醇
2.醇的命名
一、醇的分类、组成和物理性质
羟基的数目
烃基是否饱和
是否含苯环
一元醇:
CH3OH、 CH3CH2OH
二元醇:
多元醇:
CH2OHCH2OH
CH2OH
CH-OH
CH2OH
丙三醇(甘油)
乙二醇
饱和醇:
不饱和醇:
CH3CH2OH
CH2=CHCH2OH
脂肪醇:
CH2OH
芳香醇:
醇
3.醇的分类与组成
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH或CnH2n+2O,可简写为 R-OH
一、醇的分类、组成和物理性质
(1)三种重要的醇
名称 性质 用途
甲醇 无色透明、易挥发的液体;易溶于水;有毒、误服少量(10 mL)可致人失明,多量(30 mL)可致人死亡 化工原料、燃料
乙二醇 丙三醇 无色、黏稠的液体,有甜味、易溶于水和乙醇,能显著降低水的凝固点
发动机防冻液
合成涤纶
无色、黏稠、具有甜味的液体,易溶于水和乙醇,具有很强吸水能力
吸水能力—配制印泥、化妆品;
4、醇的物理性质
一、醇的分类、组成和物理性质
CH2CH2
OH OH
乙二醇
(甘醇)
二元醇
CH2CH CH2
OH OH OH
丙三醇(甘油)
吸湿性,护肤
三元醇
一元醇
CH3OH
甲醇
剧毒
工业酒精有毒!
汽车防冻剂
配制化妆品
车用燃料
(1)三种重要的醇
4、醇的物理性质
一、醇的分类、组成和物理性质
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
结论:1.醇的沸点随碳原子数的增加而升高。
2.在水中的溶解度一般随分子中碳原子数的增加而降低
几种醇的熔沸点、状态、溶解度(课文P60表3-2)
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
相对分子质量相近的醇与烷烃的沸点比较(课文P58表3-3)
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
结论:相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
原因:
一个醇分子的羟基氢原子可与另一个醇分子羟基氧原子相互吸引,形成氢键,形成氢键可以增大分子间作用力,从而影响物质的溶解度、熔沸点。
相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。
氢键
为什么相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点?
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
结论:
结论:含相同碳原子数的醇,羟基数越多,沸点越高。
变式:下表列举了一些醇的沸点。沸点变化有什么规律,并作出解释
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-二丙醇 2 188
1,2,3-丙三醇 3 259
解释:醇分子中羟基数越多,分子间形成的氢键数目越多,分子间作用力越大,沸点就越高,同理可推测醇分子中羟基数越多,在水中的溶解度增大
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
①沸点
①相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。
②饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
③碳原子数相同时,羟基个数越多,醇的沸点越高。
②溶解性
①甲醇、乙醇和丙醇均可与水互溶,因为醇分子与水分子间形成了氢键。
②醇在水中的溶解度一般随碳原子数的增加而减小。
③碳原子数相同时,羟基个数越多,醇的水溶性越好。
醇中羟基形成氢键使沸点升高!
羟基越多,氢键越多,沸点越高!
小 结
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
③状态:
④密度:
一元醇的密度一般比水小,且随碳原子数的增多,密度一般增大。
常温下,碳原子数为1-3的饱和一元醇为液体;
碳原子数为4-11的饱和一元醇为油状液体;
碳原子数更多的高级饱和一元醇为固体
小 结
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
(1)乙醇与甲醚(CH3—O—CH3)互为碳架异构( )
(2)分子中含有—OH的有机物是醇( )
(3)质量分数为95%的乙醇溶液常作消毒剂( )
(4)向工业酒精中加入生石灰,然后加热蒸馏,可制得无水乙醇( )
(5)相对分子质量相近的醇和烷烃,醇的沸点远远高于烷烃,低级醇可与水以任意比例混溶,醇的这些物理性质都与羟基间或羟基与水分子间形成氢键有关( )
×
×
正误判断
√
×
√
(2)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
1.下列关于醇类的说法错误的是
A.羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇
B.醇的同分异构体中一定有酚类物质
C.乙二醇和丙三醇都是无色液体,易溶于水和乙醇,其中丙三醇可用于
配制化妆品
D.甲醇是一种无色、易挥发、易溶于水的液体,常用作车用燃料
应用体验
B
(1)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
2.下列各组物质中互为同系物的是
A.乙二醇与丙三醇
B. 与
C.乙醇与2-丙醇
D. 与
C
(1)醇的物理性质与变化规律
一、醇的分类、组成和物理性质
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代;同样C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
二、乙醇的结构与化学性质
(以乙醇为例)
反应名称 反应类型 断键位置
与金属钠反应
燃烧反应
Cu或Ag催化氧化
浓硫酸条件下与乙酸加热
① ③
①②③④⑤
①
①
取代反应
氧化反应
氧化反应
取代反应
二、乙醇的结构与化学性质
交流与讨论: 我们已经学习过乙醇的一些性质。请与同学交流你所知道的乙醇的化学性质,试列举乙醇发生的化学反应,并指出在反应过程中乙醇分子中的哪些化学键发生了断裂
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
(以乙醇为例)
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
反应机理:
卤原子取代了羟基,羟基和氢结合生成水
1.取代反应
应用:
可用于制备卤代烃
卤代烷
醇
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
二、乙醇的结构与化学性质
①与氢卤酸反应
(以乙醇为例)
1.取代反应
二、乙醇的结构与化学性质
②分子间脱水
C2H5—OH+H—OC2H5
浓硫酸
140℃
乙醚
C2H5 O C2H5+H2O
酸脱羟基、醇脱氢
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
③酯化反应——
①与浓卤化氢
CH3CH2—OH + H—X
Δ
CH3CH2X + H2O
(以乙醇为例)
【实验3-2】在圆底烧瓶中加入乙醇与浓硫酸按体积比1∶3的混合液20 mL,并加入碎瓷片防止暴沸。加热混合溶液,迅速升温到170 ℃,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
KMnO4酸性溶液、溴的四氯化碳溶液褪色。
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
实验现象:
实验结论:
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚易溶于有机溶剂,它本身就是一种优良溶剂,能溶解多种有机化合物。
2.醇的消去反应:
二、乙醇的结构与化学性质
注:如果把乙醇和浓硫酸的混合液的温度控制在140 ℃左右,乙醇将以另外一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚:(副反应)
C2H5—OH+H—OC2H5
浓硫酸
140℃
乙醚
C2H5 O C2H5+H2O
【醚类物质】
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
(以乙醇为例)
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
制乙烯实验装置
酒精与浓硫酸体积比为1∶3怎么混合?
浓硫酸的作用是什么?
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
用排水集气法收集
防止暴沸
催化剂和脱水剂
液面以下
防止在140℃时生成乙醚。
逐渐变黑。浓硫酸能将无水酒精氧化生成碳单质等多种物质。
有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
2.醇的消去反应:
二、乙醇的结构与化学性质
(以乙醇为例)
醇发生的消去反应的规律:
2.若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3或CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
1.连有羟基的碳原子的相邻碳原子上必须有氢才能发生消去反应形成不饱和键:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
二、乙醇的结构与化学性质
(以乙醇为例)
例:写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ 2H2O
等不能发生消除反应。
[思考:]下列醇在浓硫酸作催化剂的条件下能发生消去反应吗?
二、乙醇的结构与化学性质
醇发生消去反应的规律
(以乙醇为例)
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
①处O—H键断开
3.置换反应——与活泼金属钠反应
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
二、乙醇的结构与化学性质
2mol—OH ~ 2mol Na ~ 1molH2
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
A
练习:
(以乙醇为例)
分别写出下列乙醇氧化反应的化学方程式、现象、反应类型及断键位置。
(1)燃烧反应(完全燃烧)
2CO2 +3H2O
C2H5OH + 3O2
点燃
淡蓝色火焰
CuO中间产物,Cu催化剂
(2)催化氧化
2C2H5OH + O2
Cu
2CH3CHO + 2 H2O
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
①处O—H和③处α-C—H键断开
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(2)催化氧化
(以乙醇为例)
醇催化氧化反应的规律
醇发生催化氧化的断键位置:
—C—C—H
O—H
+ Cu+H2O
α
+ Cu O
—C—C
O
1.醇发生催化氧化的必备条件:α–C原子上必须连有氢原子。
2.醇发生催化氧化的产物的类别,取决于α–C原子上的氢原子的个数 。
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
醇发生催化氧化的产物类别——取决于与羟基相连的碳原子上氢的个数:
与—OH相连的碳原子上没有H时——则不能被氧化
C OH
R2
R1
R3
(3)
(2) 2 CH—OH + O2
R2
R1
Cu
△
(1) 2R—CH2—OH + O2
Cu
△
(与—OH相连的碳上有2-3个H时——产物为醛
O
=
2R—C—H + 2H2O
(与—OH相连的碳上有1个H时——产物为酮
O
=
2R1—C—R2 + 2H2O
二、乙醇的结构与化学性质
(以乙醇为例)
2.下列醇分子中可以被氧化生成醛的是( )。
A.CH3OH B.(CH3)3C—OH
C. D.(CH3)2CH—OH
A
A
练习
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
酸性KMnO4溶液:MnO4- (紫红色 ) Mn2+ (无色)
(3)被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化成乙酸
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
CH3CH2OH
乙醇
氧化
CH3CHO
乙醛
氧化
CH3COOH
乙酸
强氧化剂KMnO4/K2Cr2O7
应用:交警判断驾驶员是否酒后驾车的方法
酸性K2Cr2O7溶液: Cr2O72- (橙色) Cr3+(绿色)
K2Cr2O7(橙色)
Cr2(SO4)3(绿色)
C2H5OH
常见的强氧化剂:(课文P62实验3-3)
(以乙醇为例)
(3)被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化成乙酸
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
醇被酸性高锰酸钾等强氧化剂氧化的规律
C OH + KMnO4(H+) 不褪色
R2
R1
R3
(3)
(2) CH—OH + KMnO4(H+) 褪色
R2
R1
(1) 2R—CH2—OH + KMnO4(H+) 褪色
伯醇
仲醇
叔醇
二、乙醇的结构与化学性质
4.乙醇的氧化反应:
(以乙醇为例)
小结:
烃
取
代
卤代烃
R-X
水
解
醇
R-OH
氧
化
醇
R'-CHO
氧
化
酸
R'-COOH
不 饱 和 烃
消
去
消
去
酯
加
成
加
成
取代
HX
强氧化剂
二、乙醇的结构与化学性质
(以乙醇为例)
