广东省汕头市实验学校 2022-2023 学年度第一学期期末质量检测高—化学试题(含答案)
文档属性
| 名称 | 广东省汕头市实验学校 2022-2023 学年度第一学期期末质量检测高—化学试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 455.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-07 16:43:04 | ||
图片预览



文档简介
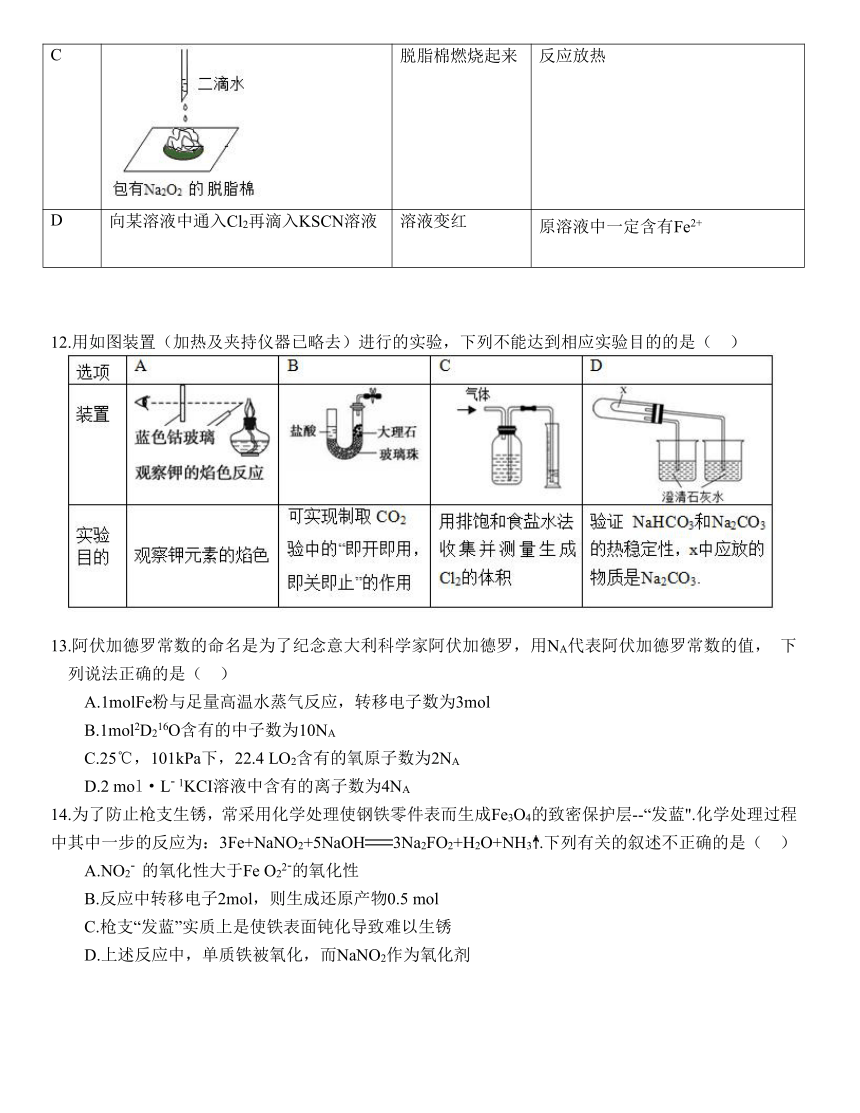
广东省汕头市实验学校 2022-2023 学年度第一学期期末质量检测高—化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24
Al-27 S-32 Cl-35.5 Ca-40 Fe-56
一、选择题:本题共 16 小题,共 44 分,其中 1-10 题每小题 2 分,共 20 分,11-16 题每小题 4 分,共 24分,每个小题只有一个选项符合题目要求。
1.合金材料的制造与使用在我国已有数千年历史,下列文物不是由合金制作的是( )
A.秦兵马俑 B.越王勾践剑 C.曾候乙编钟 D.马踏飞燕青铜器
2.下列各组排序,不正确的是( )
A.金属性:AlC.氧化性:I23.下列反应的离子方程式书写正确的是( )
A.钠投入水中:Na+2H2ONa++2OH- +H2
B.氯气通入水中:Cl2 + H2O2H++CI- + CIO-
C.Fe(OH) 3固体与盐酸反应:OH- + H+ H2O
D.铝片与NaOH溶液反应:2Al+2OH- +2H2O 2AIO2- +3 H2
4.下列化学用语表示正确的是( )
A.HCI 的电子式: B. S2- 的结构示意图:
C.N2的结构式:N=N D.质量数为37的氯原子
5.“稀土是我国宝贵的战略资源,国家已经控制其出口。与 是稀土元素,下列有关说法正确的是( )
A. 与互为同位素 B. 与的质量数相同
C. 与是同一种核素 D. 与的核外电子数和中子数均为62
6.如图表示Na2CO3与NaHCO3性质的对比实验过程,不能从该实验中得出的结论是( )
A. Na2CO3与 NaHCO3溶液均呈碱性 B.溶解度大小:Na2CO3> NaHCO3
C.热稳定性:Na2CO3> NaHCO3 D.溶液碱性强弱:Na2CO3> NaHCO3
7.分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )
A.根据是否含氧元素,将物质分为氧化剂和还原剂
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C.根据水溶液是否能够导电:浴将物质分为电解质和非电解质
D根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
8.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中,正确的是( )
A.原子半径:W> Z > Y > X
B.形成氢化物的稳定性:Z > W
C.常温下:X、Y、Z、W 形成的常见单质均为气态
D.W 的单质能与水反应,生成一种具有漂白性的物质
9.下列说法中正确的是( )
A.过量的铁在Cl2中充分燃烧,可得下FeCl2
B.除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2
C.Fe(OH)3胶体和FeCl3溶液共同具备的性质是两者均能透过半透膜
D.等物质的量的 Na2CO3和NaHCO3与足量盐酸反应,消耗HCI的物质的量之比为2:1
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.碱性溶液中:HCO3-、SO42-、K+、Cl-
B.无色透明溶液中:K'+、SO42-、Na+、MnO4-
C.酸性溶液中:NO3-、Na+、Al3+、K+
D.c(Fe3+)=1 mol·L-1的溶液中:H+、SCN-、Cl-、NH4+
11.下列实验操作和现象所得结论正确的是( )
选项 实验操作 现象 结论
A 向某无色溶液中滴加氯化钡溶液 溶液变浑浊 原溶液中一定存在SO42-
B 向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌 有白色沉淀产生 亚铁盐可与碱反应制备氢氧化亚铁
C 脱脂棉燃烧起来 反应放热
D 向某溶液中通入Cl2再滴入KSCN溶液 溶液变红 原溶液中一定含有Fe2+
12.用如图装置(加热及夹持仪器已略去)进行的实验,下列不能达到相应实验目的的是( )
13.阿伏加德罗常数的命名是为了纪念意大利科学家阿伏加德罗,用NA代表阿伏加德罗常数的值, 下列说法正确的是( )
A.1molFe粉与足量高温水蒸气反应,转移电子数为3mol
B.1mol2D216O含有的中子数为10NA
C.25℃,101kPa下,22.4 LO2含有的氧原子数为2NA
D.2 mol·L- 1KCI溶液中含有的离子数为4NA
14.为了防止枪支生锈,常采用化学处理使钢铁零件表而生成Fe3O4的致密保护层--“发蓝".化学处理过程中其中一步的反应为:3Fe+NaNO2+5NaOH3Na2FO2+H2O+NH3.下列有关的叙述不正确的是( )
A.NO2- 的氧化性大于Fe O22-的氧化性
B.反应中转移电子2mol,则生成还原产物0.5 mol
C.枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D.上述反应中,单质铁被氧化,而NaNO2作为氧化剂
15.印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得,…种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如图: 下列说法不正确的是( )
A.腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
B.腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
C.置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2++和Fe+2Fe3+=3Fe2+
D.再生池中可加入过量的铁粉
16.实验室欲配制230mL1.00mol/LNa2CO3溶液。下列有关叙述中,正确的是( )
A.称取26.5g Na2CO3固体
B.将Na2CO3固体放入容量瓶中,加水至刻度线
C.没有将洗涤液转移到容量瓶中,所配溶液浓度偏高
D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体
二、非选择题:4道大题,共56分。
17.(17分)几种主族元素在周期表中的位置如下
根据上表回答下列问题:
(1)⑥元素的氢化物的电子式是____________
(2)①③⑦三种元素原子半径由大到小的顺序是__________________(用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是______,其最高价氧化物对应的水化物所含的化学键有____________
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是________(填化学式)
①与③最高价氧化物对应水化物反应的离子方程式为______________________________。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是__________(填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
18.(13分)黑木耳是常见食品,可以补充人体所必需的微量元素铁,某兴趣小组设计实验,检验黑木耳中的铁元素,实验流程如图;
(1)灼烧黑木耳必须用到下列仪器中的______(填字母)。
A B C D
(2)灰烬中含有铁的氧化物以及鋰、钙、硅等元素的化合物,酸浸的目的是__________________
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有_________;另取滤液检验,滤液能使KmnO4溶液紫色褪去,说明滤液中存在具有_____(填“氧化性”或“还原性”)的粒子。
(4)为进一步探究 Fe3+和 Fe2+的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
实验操作 实验现象 离子方程式 实验结论
向FeCl2溶液中添加新制氯水 溶液由浅绿色变为棕黄色 ①__________________ Fe2+具有还原性
向 FeCl3 溶液加入足量的铁粉 铁粉逐渐溶解,溶液由棕黄色变为浅绿色 Fe+2Fe3+=3Fe 2+ ②___________
19.(11 分)某化学课外活动小组为了验证主族元素化学性质的递变规律,进行如下实验探究。
探究1:
(1) 验证同周期主族元素 X、Y、Z 的金属性递变规律。
实验内容 实验现象
a.各取1.0金属X和金属Y,分别加入5mL水中 金属X与水反应比金属Y与水反应剧烈
b.各取1.0金属Y和金属 Z,分别加入5mL1.0mol/L盐酸中 金属Y与盐酸反应比金属Z与盐酸反应剧烈
通过实验验证三种元素金属性也强到弱的顺序是____________,则下列判断正确的是______(填字母)
A.原子序数:X>Y> Z B.原子的最外层电子数:Z>Y>X
C.原子半径:X>Y> Z D. Y的最高价氧化物对应水化物的碱性最强
(2)为了比较镁和铝的金属性强弱,某同学取适量溶性镁盐和铝盐与氨水反应制备氢氧化镁和氢氧化铝,请写出制备氢氧化铝的离子方程式________________________
探究2:某小组同学设计实验比较VIIA族元素的非金属性:Cl>Br>I
甲同学设计实验如下:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝,
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
乙同学设计实验如下:向A中通入少量Cl2充分反应后,将A中液体滴入试管内,取下试管,充分振荡,静置A中液体为橙黄色,试管中的CCl4层变为紫红色。
(3)以上两位同学的实验,______(填“甲”或“乙)同学的实验能证明非金属性:Cl>Br>I。
(4)除了利用卤素单质间的置换反应,以下陈述哪些可作为卤族元素非金属性递变规律的判断依据______.(填字母)
A.Cl2、Br2、I2的熔点逐渐升高 B. HCl 、HBr、HI 的稳定性逐渐减弱
C.HCl、HBr、HI水溶液的酸性逐渐增强 D. Cl-、Br-、I-的还原性逐渐增强
20.(15 分)某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A中反应为:KClO3+6HCI(浓)=KCl+3Cl2+3H2O;
②石灰乳的主要成分为:Ca( OH )2,其他杂质不参与反应。
(1)实验结束后,立即将B中溶液满几滴在紫色石蕊试纸上,可观察到的现象是_________________.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入的物质正确的是
________(填字母)
编号 I Ⅱ III
A 干燥的有色布条 碱石灰 湿润的有色布条
B 干燥的有色布条 浓硫酸 湿润的有色布条
C 湿润的有色布条 浓硫酸 干燥的有色布条
D 湿润的有色布条 碱石灰 干燥的有色布条
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成分为_____(填化学式)。
(4)F装置的作用是(用离子方程式表示)_________________________
(5)2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。
其中含氯消毒剂在生产生活中有着广泛的用途。
①己知KMnO4的摩尔质量为158g/mol,其与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:
2KMnO4+ 16HCl=2KCl + 2MnCl2+ 5Cl2+ 8H2O
15.8g KMnO4参与上述反应,产生的Cl2在标准状况下的体积为______L:
②常温下,氯气与烧碱溶液反应得"84"消毒液,NaClO是"84"消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用:
浸泡衣物时加入"84"消毒液在空气中放置一段时间漂自效果更好,原因用离子方程式表示为:
________________________________
(已知酸性:H2CO3>HClO>HCO3)
参考答案
一、选择题:本题共 16 小题,共 44 分,其中 1-10 题每小题 2 分,共 20 分,11-16 题每小题 4 分,共 24分,每个小题只有一个选项符合题目要求。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
A D D D A C D D D C C D B B D B
二、非选择题:4道大题,共56分
17. (1)
(2)Na>Al>Cl
(3)第三周期 I A族
(4)KOH
(5)abc
OH-+Al(OH)3=AIO2-+2H2O
18. (1)A
(2)将铁的氧化物溶解
(3)Fe3+ 还原性
(4)2Fe2++ Cl2=2Fe3++2Cl- Fe3+具有氧化性
19. (1)X>Y> Z BC
(2)NH3·H2O+Al3+ = Al(OH)3+3NH4+
(3)乙
(4)BD
20. (1)先变红后褪色
(2)C
(3)Ca(ClO)2
(4)Cl2+2OH-= ClO-+Cl-+ H2O
(5) ①5.6 ②ClO-+ H2O+CO2= HClO+HCO3-
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24
Al-27 S-32 Cl-35.5 Ca-40 Fe-56
一、选择题:本题共 16 小题,共 44 分,其中 1-10 题每小题 2 分,共 20 分,11-16 题每小题 4 分,共 24分,每个小题只有一个选项符合题目要求。
1.合金材料的制造与使用在我国已有数千年历史,下列文物不是由合金制作的是( )
A.秦兵马俑 B.越王勾践剑 C.曾候乙编钟 D.马踏飞燕青铜器
2.下列各组排序,不正确的是( )
A.金属性:Al
A.钠投入水中:Na+2H2ONa++2OH- +H2
B.氯气通入水中:Cl2 + H2O2H++CI- + CIO-
C.Fe(OH) 3固体与盐酸反应:OH- + H+ H2O
D.铝片与NaOH溶液反应:2Al+2OH- +2H2O 2AIO2- +3 H2
4.下列化学用语表示正确的是( )
A.HCI 的电子式: B. S2- 的结构示意图:
C.N2的结构式:N=N D.质量数为37的氯原子
5.“稀土是我国宝贵的战略资源,国家已经控制其出口。与 是稀土元素,下列有关说法正确的是( )
A. 与互为同位素 B. 与的质量数相同
C. 与是同一种核素 D. 与的核外电子数和中子数均为62
6.如图表示Na2CO3与NaHCO3性质的对比实验过程,不能从该实验中得出的结论是( )
A. Na2CO3与 NaHCO3溶液均呈碱性 B.溶解度大小:Na2CO3> NaHCO3
C.热稳定性:Na2CO3> NaHCO3 D.溶液碱性强弱:Na2CO3> NaHCO3
7.分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )
A.根据是否含氧元素,将物质分为氧化剂和还原剂
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C.根据水溶液是否能够导电:浴将物质分为电解质和非电解质
D根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
8.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中,正确的是( )
A.原子半径:W> Z > Y > X
B.形成氢化物的稳定性:Z > W
C.常温下:X、Y、Z、W 形成的常见单质均为气态
D.W 的单质能与水反应,生成一种具有漂白性的物质
9.下列说法中正确的是( )
A.过量的铁在Cl2中充分燃烧,可得下FeCl2
B.除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2
C.Fe(OH)3胶体和FeCl3溶液共同具备的性质是两者均能透过半透膜
D.等物质的量的 Na2CO3和NaHCO3与足量盐酸反应,消耗HCI的物质的量之比为2:1
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.碱性溶液中:HCO3-、SO42-、K+、Cl-
B.无色透明溶液中:K'+、SO42-、Na+、MnO4-
C.酸性溶液中:NO3-、Na+、Al3+、K+
D.c(Fe3+)=1 mol·L-1的溶液中:H+、SCN-、Cl-、NH4+
11.下列实验操作和现象所得结论正确的是( )
选项 实验操作 现象 结论
A 向某无色溶液中滴加氯化钡溶液 溶液变浑浊 原溶液中一定存在SO42-
B 向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌 有白色沉淀产生 亚铁盐可与碱反应制备氢氧化亚铁
C 脱脂棉燃烧起来 反应放热
D 向某溶液中通入Cl2再滴入KSCN溶液 溶液变红 原溶液中一定含有Fe2+
12.用如图装置(加热及夹持仪器已略去)进行的实验,下列不能达到相应实验目的的是( )
13.阿伏加德罗常数的命名是为了纪念意大利科学家阿伏加德罗,用NA代表阿伏加德罗常数的值, 下列说法正确的是( )
A.1molFe粉与足量高温水蒸气反应,转移电子数为3mol
B.1mol2D216O含有的中子数为10NA
C.25℃,101kPa下,22.4 LO2含有的氧原子数为2NA
D.2 mol·L- 1KCI溶液中含有的离子数为4NA
14.为了防止枪支生锈,常采用化学处理使钢铁零件表而生成Fe3O4的致密保护层--“发蓝".化学处理过程中其中一步的反应为:3Fe+NaNO2+5NaOH3Na2FO2+H2O+NH3.下列有关的叙述不正确的是( )
A.NO2- 的氧化性大于Fe O22-的氧化性
B.反应中转移电子2mol,则生成还原产物0.5 mol
C.枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D.上述反应中,单质铁被氧化,而NaNO2作为氧化剂
15.印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得,…种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如图: 下列说法不正确的是( )
A.腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
B.腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
C.置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2++和Fe+2Fe3+=3Fe2+
D.再生池中可加入过量的铁粉
16.实验室欲配制230mL1.00mol/LNa2CO3溶液。下列有关叙述中,正确的是( )
A.称取26.5g Na2CO3固体
B.将Na2CO3固体放入容量瓶中,加水至刻度线
C.没有将洗涤液转移到容量瓶中,所配溶液浓度偏高
D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体
二、非选择题:4道大题,共56分。
17.(17分)几种主族元素在周期表中的位置如下
根据上表回答下列问题:
(1)⑥元素的氢化物的电子式是____________
(2)①③⑦三种元素原子半径由大到小的顺序是__________________(用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是______,其最高价氧化物对应的水化物所含的化学键有____________
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是________(填化学式)
①与③最高价氧化物对应水化物反应的离子方程式为______________________________。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是__________(填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
18.(13分)黑木耳是常见食品,可以补充人体所必需的微量元素铁,某兴趣小组设计实验,检验黑木耳中的铁元素,实验流程如图;
(1)灼烧黑木耳必须用到下列仪器中的______(填字母)。
A B C D
(2)灰烬中含有铁的氧化物以及鋰、钙、硅等元素的化合物,酸浸的目的是__________________
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有_________;另取滤液检验,滤液能使KmnO4溶液紫色褪去,说明滤液中存在具有_____(填“氧化性”或“还原性”)的粒子。
(4)为进一步探究 Fe3+和 Fe2+的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
实验操作 实验现象 离子方程式 实验结论
向FeCl2溶液中添加新制氯水 溶液由浅绿色变为棕黄色 ①__________________ Fe2+具有还原性
向 FeCl3 溶液加入足量的铁粉 铁粉逐渐溶解,溶液由棕黄色变为浅绿色 Fe+2Fe3+=3Fe 2+ ②___________
19.(11 分)某化学课外活动小组为了验证主族元素化学性质的递变规律,进行如下实验探究。
探究1:
(1) 验证同周期主族元素 X、Y、Z 的金属性递变规律。
实验内容 实验现象
a.各取1.0金属X和金属Y,分别加入5mL水中 金属X与水反应比金属Y与水反应剧烈
b.各取1.0金属Y和金属 Z,分别加入5mL1.0mol/L盐酸中 金属Y与盐酸反应比金属Z与盐酸反应剧烈
通过实验验证三种元素金属性也强到弱的顺序是____________,则下列判断正确的是______(填字母)
A.原子序数:X>Y> Z B.原子的最外层电子数:Z>Y>X
C.原子半径:X>Y> Z D. Y的最高价氧化物对应水化物的碱性最强
(2)为了比较镁和铝的金属性强弱,某同学取适量溶性镁盐和铝盐与氨水反应制备氢氧化镁和氢氧化铝,请写出制备氢氧化铝的离子方程式________________________
探究2:某小组同学设计实验比较VIIA族元素的非金属性:Cl>Br>I
甲同学设计实验如下:打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉KI试纸变蓝,
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
乙同学设计实验如下:向A中通入少量Cl2充分反应后,将A中液体滴入试管内,取下试管,充分振荡,静置A中液体为橙黄色,试管中的CCl4层变为紫红色。
(3)以上两位同学的实验,______(填“甲”或“乙)同学的实验能证明非金属性:Cl>Br>I。
(4)除了利用卤素单质间的置换反应,以下陈述哪些可作为卤族元素非金属性递变规律的判断依据______.(填字母)
A.Cl2、Br2、I2的熔点逐渐升高 B. HCl 、HBr、HI 的稳定性逐渐减弱
C.HCl、HBr、HI水溶液的酸性逐渐增强 D. Cl-、Br-、I-的还原性逐渐增强
20.(15 分)某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A中反应为:KClO3+6HCI(浓)=KCl+3Cl2+3H2O;
②石灰乳的主要成分为:Ca( OH )2,其他杂质不参与反应。
(1)实验结束后,立即将B中溶液满几滴在紫色石蕊试纸上,可观察到的现象是_________________.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入的物质正确的是
________(填字母)
编号 I Ⅱ III
A 干燥的有色布条 碱石灰 湿润的有色布条
B 干燥的有色布条 浓硫酸 湿润的有色布条
C 湿润的有色布条 浓硫酸 干燥的有色布条
D 湿润的有色布条 碱石灰 干燥的有色布条
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成分为_____(填化学式)。
(4)F装置的作用是(用离子方程式表示)_________________________
(5)2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。
其中含氯消毒剂在生产生活中有着广泛的用途。
①己知KMnO4的摩尔质量为158g/mol,其与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:
2KMnO4+ 16HCl=2KCl + 2MnCl2+ 5Cl2+ 8H2O
15.8g KMnO4参与上述反应,产生的Cl2在标准状况下的体积为______L:
②常温下,氯气与烧碱溶液反应得"84"消毒液,NaClO是"84"消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用:
浸泡衣物时加入"84"消毒液在空气中放置一段时间漂自效果更好,原因用离子方程式表示为:
________________________________
(已知酸性:H2CO3>HClO>HCO3)
参考答案
一、选择题:本题共 16 小题,共 44 分,其中 1-10 题每小题 2 分,共 20 分,11-16 题每小题 4 分,共 24分,每个小题只有一个选项符合题目要求。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
A D D D A C D D D C C D B B D B
二、非选择题:4道大题,共56分
17. (1)
(2)Na>Al>Cl
(3)第三周期 I A族
(4)KOH
(5)abc
OH-+Al(OH)3=AIO2-+2H2O
18. (1)A
(2)将铁的氧化物溶解
(3)Fe3+ 还原性
(4)2Fe2++ Cl2=2Fe3++2Cl- Fe3+具有氧化性
19. (1)X>Y> Z BC
(2)NH3·H2O+Al3+ = Al(OH)3+3NH4+
(3)乙
(4)BD
20. (1)先变红后褪色
(2)C
(3)Ca(ClO)2
(4)Cl2+2OH-= ClO-+Cl-+ H2O
(5) ①5.6 ②ClO-+ H2O+CO2= HClO+HCO3-
同课章节目录
