实验活动 6 酸、碱的化学性质 同步练习(含答案) 2022-2023学年人教版九年级下册化学
文档属性
| 名称 | 实验活动 6 酸、碱的化学性质 同步练习(含答案) 2022-2023学年人教版九年级下册化学 | 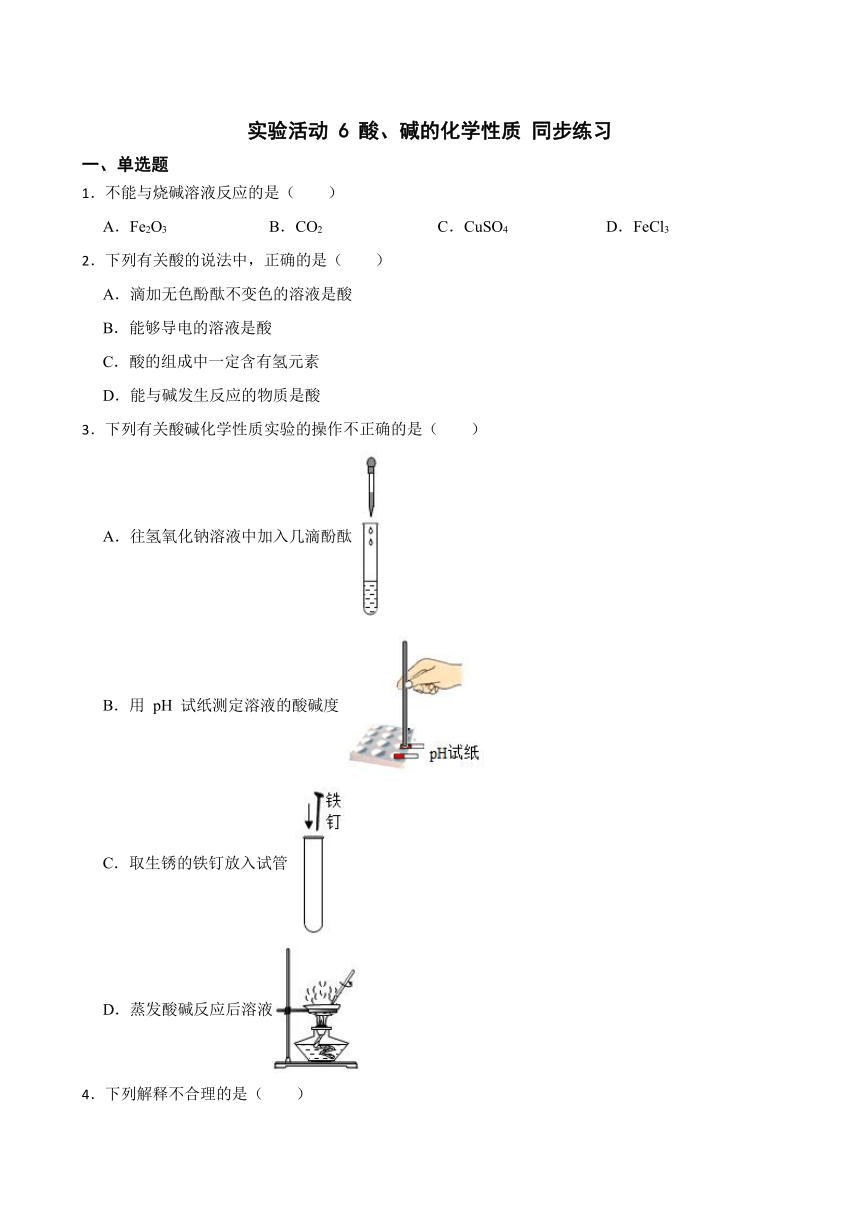 | |
| 格式 | zip | ||
| 文件大小 | 69.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 07:46:14 | ||
图片预览




文档简介
实验活动 6 酸、碱的化学性质 同步练习
一、单选题
1.不能与烧碱溶液反应的是( )
A.Fe2O3 B.CO2 C.CuSO4 D.FeCl3
2.下列有关酸的说法中,正确的是( )
A.滴加无色酚酞不变色的溶液是酸
B.能够导电的溶液是酸
C.酸的组成中一定含有氢元素
D.能与碱发生反应的物质是酸
3.下列有关酸碱化学性质实验的操作不正确的是( )
A.往氢氧化钠溶液中加入几滴酚酞
B.用 pH 试纸测定溶液的酸碱度
C.取生锈的铁钉放入试管
D.蒸发酸碱反应后溶液
4.下列解释不合理的是( )
A.生铁和钢的性能不同于它们的组成中含碳量不同有关
B.铁丝在空气中不能被点燃与空气中氧气的体积分数有关
C.氢氧化钠和氢氧化钙化学性质相似与它们的水溶液中都含有OH﹣有关
D.过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关
5.在一定条件下,与氢氧化钠溶液、硝酸银溶液、氧化铁、锌、碳酸钠溶液五种物质均能发生反应的是( )
A.硝酸铜溶液 B.稀盐酸 C.硫酸钠溶液 D.氮气
6.物质X可发生“X+碱→盐+H2O”的反应,则X可能是( )
A.Mg B.CO2 C.KOH D.CaO
7.推理是化学学习中常用的思维方法。下列推理正确的是()
A.酸能使石蕊试液变红,CO2也能使紫色石蕊试液变红,所以CO2是酸
B.锌和铜均是金属,锌与稀硫酸反应产生氢气,则铜也能与稀硫酸反应产生氢气
C.碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性
D.溶液中有晶体析出,其溶质质量减少,所以溶质的质量分数一定减小
8.下列物质能与NaOH反应的是( )
A.Fe B.CO2 C.Fe2O3 D.NaCl
9.如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状,则滴管甲、乙和烧杯①②中的物质可能是( )
A.甲:稀盐酸 ①铁; 乙:水 ②生石灰
B.甲:水 ①硝酸铵; 乙:稀盐酸 ②铁
C.甲:水 ①氢氧化钠; 乙:稀硫酸 ②锌
D.甲:水 ①生石灰 乙:稀盐酸 ②氢氧化钠
10.不能说明硫酸具有酸的通性的反应是( )
A.Fe+H2SO4=FeSO4+H2↑ B.BaCl2+H2SO4=BaSO4↓+2HCl
C.MgO+H2SO4=MgSO4+H2O D.2NaOH+H2SO4=Na2SO4+2H2O
11.向盛有酚酞试液和NaOH溶液的烧杯中滴加稀盐酸,直到液体呈无色.为了探究反应后溶液的酸碱性,所选试剂不正确 的是( )
A.碳酸钙 B.镁条 C.pH试纸 D.稀硫酸
12.有甲、乙、丙三种溶液,甲能使紫色石蕊试液变红,乙能使无色酚酞试液变红,丙与紫色石蕊试液和无色酚酞试液均无变化,则三种溶液 的pH值由大到小的顺序为( )
A.甲>丙>乙 B.丙>乙>甲
C.乙>甲>丙 D.乙>丙>甲
二、填空题
13.将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH值变化情况如图所示.
溶液 A B C D
X 盐酸 氢氧化钠 盐酸 氢氧化钠
Y 水 水 氢氧化钠 盐酸
(1)表格中符合这种变化情况的是 (填写编号),理由是: .
(2)写出该反应的化学方程式 .
(3)在Y溶液中滴入石蕊试液,若不断滴入X溶液,石蕊颜色的变化是 .
14.写出下列反应的化学方程式:
(a)铁丝在氧气中燃烧: ;
(B)碳酸钠溶液与氢氧化钙溶液反应,生成氢氧化钠和碳酸钙: ;
(c)煅烧石灰石: 。
15.鉴别稀盐酸和稀硫酸可选用的试剂是 ;除去盐酸中混有的少量硫酸,可先加入适量的 ,然后再 ,就可以得到较纯的盐酸;若要证明混合溶液中含有Cl﹣和SO42﹣应先加入适量的 ,再加稀硝酸,证明SO42﹣存在并除去SO42﹣,将沉淀滤去,在滤液中,再加入适量的 ,再加 证明Cl﹣存在.
16.金属锂(元素符号Li)在通信和航天领域中有重要用途.氢氧化锂(化学式LiOH)是一种易溶于水的白色固体,有辣味;化学性质与NaOH相似,有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的 性质(填“化学”或“物理”);
(2)LiOH属于 类(填“氧化物”“酸”“碱”或“盐”);
(3)LiOH利NaOH都呈碱性,是因为它们在水溶液中都能解离出 离子(填“金属”“氢”或“氢氧根”);
(4)载人航天飞船中常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式为 .
17.金属的用途很广,我们应该节约和保护金属资源,铁制品长期裸露在室外易生锈,铁生锈实际上是铁与空气中的氧气和水蒸气等发生化学反应的过程。为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前,先要除去铁制品表面的铁锈。用稀盐酸除去铁锈的化学反应方程式是 。
18.如图所示,在粗玻璃管内壁上粘附湿润的石蕊试纸,向细玻璃管里滴入数滴浓醋酸后,立即封闭管口.10s后即观察到:仅有中下部的石蕊试纸从上往下逐渐变色.
(1)本实验应选用 (填“红”或“蓝”)色石蕊试纸;
(2)本实验利用的醋酸性质包括:①酸性,② 性,③醋酸蒸气密度 (填“<”或“>”)空气密度;
(3)由实验现象可推知微粒具有的特征是 ;
(4)本实验用试剂Y代替浓醋酸也出现相似的现象,Y为 (填序号).
a.浓氨水 b.浓硫酸 c.浓盐酸.
三、综合题
19.向盐酸和氯化钙的混合液中逐滴滴入碳酸钠溶液,并用pH传感器连续监测,得到pH随时间的变化曲线如图所示。(注:碳酸钠溶液显碱性)
(1)所在原混合溶液中滴入少量紫色石蕊溶液,则AB段溶液颜色变化 。
(2)图中C点溶液所含的溶质为 。
(3)图中DE段pH上升的原因是 。
20.化学与生活息息相关.回答下列问题:
(1)SO2是引起 雨的主要物质;实验室可将SO2通入NaOH溶液中转化成Na2SO3而除去,用化学方程式表示相关反应是 .
(2)铁生锈实际是铁与空气中的 发生化学反应,故铁表面要做涂油、刷漆等防腐措施;而铝合金材料不涂油也具有较好的抗腐蚀性,用化学方程式表示其原因 .
21.元旦联欢会上,雯雯拿出一幅画(如图所示),表演了一个化学魔术。
(1)她向画中的衣服上喷了一种无色溶液,衣服由紫色变成红色,若衣服上预先涂过石蕊溶液,则喷的无色溶液可能是 。
(2)她向画中的灯笼上喷了另一种无色溶液,灯笼由白色变成红色,则该无色溶液及灯笼上预先涂过的试剂可能分别是 。
22.化学试剂常常要密封保存,但原因各不相同。
(1)浓盐酸密封保存的原因是什么 ?
(2)氢氧化钠溶液若敞口放置会发生变质,请用化学方程式表示其变质原因 。
(3)如何检验NaOH溶液是否完全变质,请简述实验方法 。
答案解析部分
1.【答案】A
2.【答案】C
3.【答案】C
4.【答案】D
5.【答案】B
6.【答案】B
7.【答案】C
8.【答案】B
9.【答案】C
10.【答案】B
11.【答案】D
12.【答案】D
13.【答案】D;开始时Y溶液的pH<7,一定是盐酸,滴加X溶液时,混合溶液pH由小变大,直到pH>7,只能是加pH>7的溶液,即加NaOH溶液;NaOH+HCl=NaCl+H2O;红色逐渐变为紫色,再变为蓝色
14.【答案】3Fe + 2O2 Fe3O4;Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓;CaCO3 CaO + CO2↑
15.【答案】氯化钡溶液;氯化钡溶液;过滤;硝酸钡溶液;硝酸钡溶液;硝酸银溶液
16.【答案】物理;碱;氢氧根;CO2+2LiOH═Li2CO3+H2O
17.【答案】Fe2O3+6HCl=2FeCl3+3H2O
18.【答案】蓝;挥发;>;微粒在不断运动;a、c
19.【答案】(1)溶液由红色逐渐变为紫色
(2)NaCl、CaCl2
(3)碳酸钠溶液过量且碳酸钠溶液呈碱性
20.【答案】(1)酸;SO2+2NaOH=Na2SO3+H2O
(2)水和氧气;4Al+3O2═2Al2O3
21.【答案】(1)盐酸溶液(或无色的酸性溶液)
(2)氢氧化钠溶液、无色酚酞溶液(答案合理即可)
22.【答案】(1)浓盐酸具有挥发性
(2)2NaOH+CO2=Na2CO3+H2O
(3)取少量样品于试管中,加入足量氯化钙溶液,有白色沉淀产生;取少量充分反应后的溶液于试管中,滴入酚酞试液,若酚酞试液变红色,说明氢氧化钠溶液部分变质,若不变红色,说明氢氧化钠溶液全部变质
一、单选题
1.不能与烧碱溶液反应的是( )
A.Fe2O3 B.CO2 C.CuSO4 D.FeCl3
2.下列有关酸的说法中,正确的是( )
A.滴加无色酚酞不变色的溶液是酸
B.能够导电的溶液是酸
C.酸的组成中一定含有氢元素
D.能与碱发生反应的物质是酸
3.下列有关酸碱化学性质实验的操作不正确的是( )
A.往氢氧化钠溶液中加入几滴酚酞
B.用 pH 试纸测定溶液的酸碱度
C.取生锈的铁钉放入试管
D.蒸发酸碱反应后溶液
4.下列解释不合理的是( )
A.生铁和钢的性能不同于它们的组成中含碳量不同有关
B.铁丝在空气中不能被点燃与空气中氧气的体积分数有关
C.氢氧化钠和氢氧化钙化学性质相似与它们的水溶液中都含有OH﹣有关
D.过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关
5.在一定条件下,与氢氧化钠溶液、硝酸银溶液、氧化铁、锌、碳酸钠溶液五种物质均能发生反应的是( )
A.硝酸铜溶液 B.稀盐酸 C.硫酸钠溶液 D.氮气
6.物质X可发生“X+碱→盐+H2O”的反应,则X可能是( )
A.Mg B.CO2 C.KOH D.CaO
7.推理是化学学习中常用的思维方法。下列推理正确的是()
A.酸能使石蕊试液变红,CO2也能使紫色石蕊试液变红,所以CO2是酸
B.锌和铜均是金属,锌与稀硫酸反应产生氢气,则铜也能与稀硫酸反应产生氢气
C.碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性
D.溶液中有晶体析出,其溶质质量减少,所以溶质的质量分数一定减小
8.下列物质能与NaOH反应的是( )
A.Fe B.CO2 C.Fe2O3 D.NaCl
9.如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状,则滴管甲、乙和烧杯①②中的物质可能是( )
A.甲:稀盐酸 ①铁; 乙:水 ②生石灰
B.甲:水 ①硝酸铵; 乙:稀盐酸 ②铁
C.甲:水 ①氢氧化钠; 乙:稀硫酸 ②锌
D.甲:水 ①生石灰 乙:稀盐酸 ②氢氧化钠
10.不能说明硫酸具有酸的通性的反应是( )
A.Fe+H2SO4=FeSO4+H2↑ B.BaCl2+H2SO4=BaSO4↓+2HCl
C.MgO+H2SO4=MgSO4+H2O D.2NaOH+H2SO4=Na2SO4+2H2O
11.向盛有酚酞试液和NaOH溶液的烧杯中滴加稀盐酸,直到液体呈无色.为了探究反应后溶液的酸碱性,所选试剂不正确 的是( )
A.碳酸钙 B.镁条 C.pH试纸 D.稀硫酸
12.有甲、乙、丙三种溶液,甲能使紫色石蕊试液变红,乙能使无色酚酞试液变红,丙与紫色石蕊试液和无色酚酞试液均无变化,则三种溶液 的pH值由大到小的顺序为( )
A.甲>丙>乙 B.丙>乙>甲
C.乙>甲>丙 D.乙>丙>甲
二、填空题
13.将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH值变化情况如图所示.
溶液 A B C D
X 盐酸 氢氧化钠 盐酸 氢氧化钠
Y 水 水 氢氧化钠 盐酸
(1)表格中符合这种变化情况的是 (填写编号),理由是: .
(2)写出该反应的化学方程式 .
(3)在Y溶液中滴入石蕊试液,若不断滴入X溶液,石蕊颜色的变化是 .
14.写出下列反应的化学方程式:
(a)铁丝在氧气中燃烧: ;
(B)碳酸钠溶液与氢氧化钙溶液反应,生成氢氧化钠和碳酸钙: ;
(c)煅烧石灰石: 。
15.鉴别稀盐酸和稀硫酸可选用的试剂是 ;除去盐酸中混有的少量硫酸,可先加入适量的 ,然后再 ,就可以得到较纯的盐酸;若要证明混合溶液中含有Cl﹣和SO42﹣应先加入适量的 ,再加稀硝酸,证明SO42﹣存在并除去SO42﹣,将沉淀滤去,在滤液中,再加入适量的 ,再加 证明Cl﹣存在.
16.金属锂(元素符号Li)在通信和航天领域中有重要用途.氢氧化锂(化学式LiOH)是一种易溶于水的白色固体,有辣味;化学性质与NaOH相似,有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的 性质(填“化学”或“物理”);
(2)LiOH属于 类(填“氧化物”“酸”“碱”或“盐”);
(3)LiOH利NaOH都呈碱性,是因为它们在水溶液中都能解离出 离子(填“金属”“氢”或“氢氧根”);
(4)载人航天飞船中常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式为 .
17.金属的用途很广,我们应该节约和保护金属资源,铁制品长期裸露在室外易生锈,铁生锈实际上是铁与空气中的氧气和水蒸气等发生化学反应的过程。为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前,先要除去铁制品表面的铁锈。用稀盐酸除去铁锈的化学反应方程式是 。
18.如图所示,在粗玻璃管内壁上粘附湿润的石蕊试纸,向细玻璃管里滴入数滴浓醋酸后,立即封闭管口.10s后即观察到:仅有中下部的石蕊试纸从上往下逐渐变色.
(1)本实验应选用 (填“红”或“蓝”)色石蕊试纸;
(2)本实验利用的醋酸性质包括:①酸性,② 性,③醋酸蒸气密度 (填“<”或“>”)空气密度;
(3)由实验现象可推知微粒具有的特征是 ;
(4)本实验用试剂Y代替浓醋酸也出现相似的现象,Y为 (填序号).
a.浓氨水 b.浓硫酸 c.浓盐酸.
三、综合题
19.向盐酸和氯化钙的混合液中逐滴滴入碳酸钠溶液,并用pH传感器连续监测,得到pH随时间的变化曲线如图所示。(注:碳酸钠溶液显碱性)
(1)所在原混合溶液中滴入少量紫色石蕊溶液,则AB段溶液颜色变化 。
(2)图中C点溶液所含的溶质为 。
(3)图中DE段pH上升的原因是 。
20.化学与生活息息相关.回答下列问题:
(1)SO2是引起 雨的主要物质;实验室可将SO2通入NaOH溶液中转化成Na2SO3而除去,用化学方程式表示相关反应是 .
(2)铁生锈实际是铁与空气中的 发生化学反应,故铁表面要做涂油、刷漆等防腐措施;而铝合金材料不涂油也具有较好的抗腐蚀性,用化学方程式表示其原因 .
21.元旦联欢会上,雯雯拿出一幅画(如图所示),表演了一个化学魔术。
(1)她向画中的衣服上喷了一种无色溶液,衣服由紫色变成红色,若衣服上预先涂过石蕊溶液,则喷的无色溶液可能是 。
(2)她向画中的灯笼上喷了另一种无色溶液,灯笼由白色变成红色,则该无色溶液及灯笼上预先涂过的试剂可能分别是 。
22.化学试剂常常要密封保存,但原因各不相同。
(1)浓盐酸密封保存的原因是什么 ?
(2)氢氧化钠溶液若敞口放置会发生变质,请用化学方程式表示其变质原因 。
(3)如何检验NaOH溶液是否完全变质,请简述实验方法 。
答案解析部分
1.【答案】A
2.【答案】C
3.【答案】C
4.【答案】D
5.【答案】B
6.【答案】B
7.【答案】C
8.【答案】B
9.【答案】C
10.【答案】B
11.【答案】D
12.【答案】D
13.【答案】D;开始时Y溶液的pH<7,一定是盐酸,滴加X溶液时,混合溶液pH由小变大,直到pH>7,只能是加pH>7的溶液,即加NaOH溶液;NaOH+HCl=NaCl+H2O;红色逐渐变为紫色,再变为蓝色
14.【答案】3Fe + 2O2 Fe3O4;Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓;CaCO3 CaO + CO2↑
15.【答案】氯化钡溶液;氯化钡溶液;过滤;硝酸钡溶液;硝酸钡溶液;硝酸银溶液
16.【答案】物理;碱;氢氧根;CO2+2LiOH═Li2CO3+H2O
17.【答案】Fe2O3+6HCl=2FeCl3+3H2O
18.【答案】蓝;挥发;>;微粒在不断运动;a、c
19.【答案】(1)溶液由红色逐渐变为紫色
(2)NaCl、CaCl2
(3)碳酸钠溶液过量且碳酸钠溶液呈碱性
20.【答案】(1)酸;SO2+2NaOH=Na2SO3+H2O
(2)水和氧气;4Al+3O2═2Al2O3
21.【答案】(1)盐酸溶液(或无色的酸性溶液)
(2)氢氧化钠溶液、无色酚酞溶液(答案合理即可)
22.【答案】(1)浓盐酸具有挥发性
(2)2NaOH+CO2=Na2CO3+H2O
(3)取少量样品于试管中,加入足量氯化钙溶液,有白色沉淀产生;取少量充分反应后的溶液于试管中,滴入酚酞试液,若酚酞试液变红色,说明氢氧化钠溶液部分变质,若不变红色,说明氢氧化钠溶液全部变质
同课章节目录
