6.1 奇光异彩的金属 同步练习(含答案) 2022-2023学年沪教版(上海)九年级下册化学
文档属性
| 名称 | 6.1 奇光异彩的金属 同步练习(含答案) 2022-2023学年沪教版(上海)九年级下册化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 66.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 10:48:45 | ||
图片预览


文档简介
6.1 奇光异彩的金属 同步练习
一、单选题
1.根据金属活动性顺序Al>Fe>Cu>Ag判断,下列说法不正确的是( )
A.反应Cu+FeSO4═Fe+CuSO4可以发生,属于置换反应
B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生,属于置换反应
C.反应Cu+2AgNO3═2Ag+Cu(NO3)2可以发生,溶液颜色由无色变成蓝色
D.反应2Al+3CuSO4═3Cu+Al2(SO4)3可以表面有红色物质析出,溶液由蓝色变无色
2.下列实验现象的描述错误的是( )
A.铁钉置于稀硫酸中表面产生气泡,溶液变为蓝色
B.生石灰与水反应放出大量热
C.镁带在空气中燃烧发出耀眼的白光
D.硫在空气中燃烧,发出淡蓝色火焰
3.向AgNO3、NaNO3、Cu(NO3)2混合液中加入一定量的锌粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子一定有( )
A.Ag+、Cu2+ B.Cu2+、Zn2+ C.Zn2+、Na+ D.Zn2+、Ag+
4.镉(Cd)及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是一种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为+2.根据金属化学性质的一般规律,下列预测合理的是:( )
①镉能与氢氧化钠溶液反应
②H2或CO能将镉的氧化物转化为金属镉
③镉能与盐酸或稀硫酸反应
④硫酸镉溶液中的硫酸锌可加入镉粉除去
A.①② B.②③ C.③④ D.②④
5.向氧化铜和锌粉的混合物中加入一定量的稀硫酸,反应停止后过滤,再向滤液中插入铁片,铁片无变化.以下判断正确的是
( )
A.滤液中一定含有铜和锌 B.滤液中一定含有Zn2+
C.滤液中一定含有铜 D.滤液中一定含有Cu2+
6.下列说法正确的是( )
A.铝比铁的抗腐蚀性能强,故铝比铁的化学性质稳定
B.中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应
C.燃烧一般都伴随发光和放热现象,所以有发光和放热现象的变化都是燃烧
D.原子不显电性,所以构成原子的粒子也不显电性
7.有关颜色的描述错误的是( )
A.金属都是银白色的
B.硫粉在氧气中燃烧出现蓝紫色火焰
C.将铜片放入硝酸银溶液,溶液由无色变为蓝色
D.对木炭和氧化铜的粉末加强热,固体由黑色变红色
8.金属材料在人类活动中已得到越来越广泛的应用,下列材料属于金属共性的是( )
A.有良好的导电性、导热性 B.密度较大,熔点较低
C.是银白色的固体 D.都是混合物
9.推理是化学学习中常用的思维方法.下列推断错误的是( )
A.碱溶液一定呈碱性,呈碱性的溶液不一定是碱溶液
B.置换反应一定有单质生成,有单质生成的不一定是置换反应
C.饱和溶液不一定是浓溶液,浓溶液一定是饱和溶液
D.单质只含一种元素,含有一种元素的物质不一定是单质
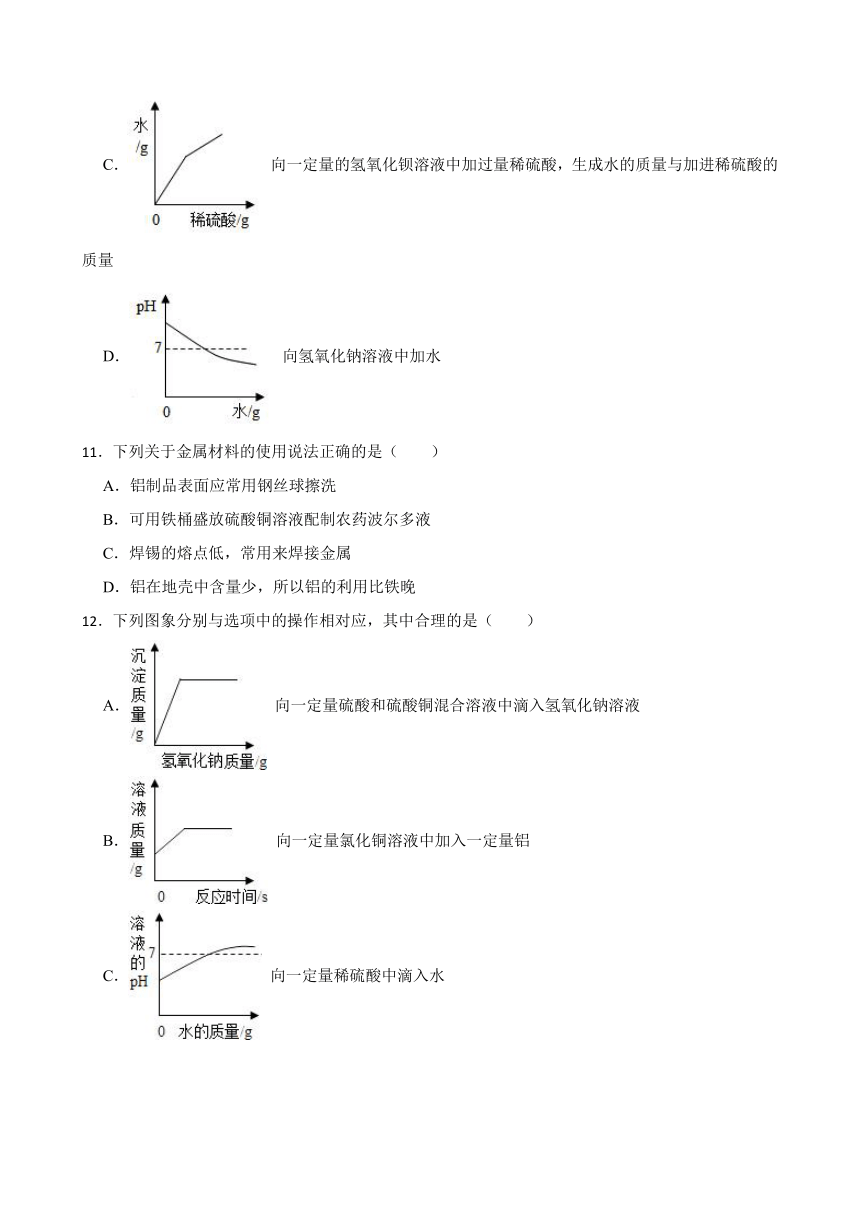
10.下列图象能正确反映对应变化关系的是( )
A. 向一定质量的氢氧化钠溶液中加入稀盐酸
B. 向等质量、等浓度的稀硫酸中分别逐渐加入铝粉和镁粉
C. 向一定量的氢氧化钡溶液中加过量稀硫酸,生成水的质量与加进稀硫酸的质量
D. 向氢氧化钠溶液中加水
11.下列关于金属材料的使用说法正确的是( )
A.铝制品表面应常用钢丝球擦洗
B.可用铁桶盛放硫酸铜溶液配制农药波尔多液
C.焊锡的熔点低,常用来焊接金属
D.铝在地壳中含量少,所以铝的利用比铁晚
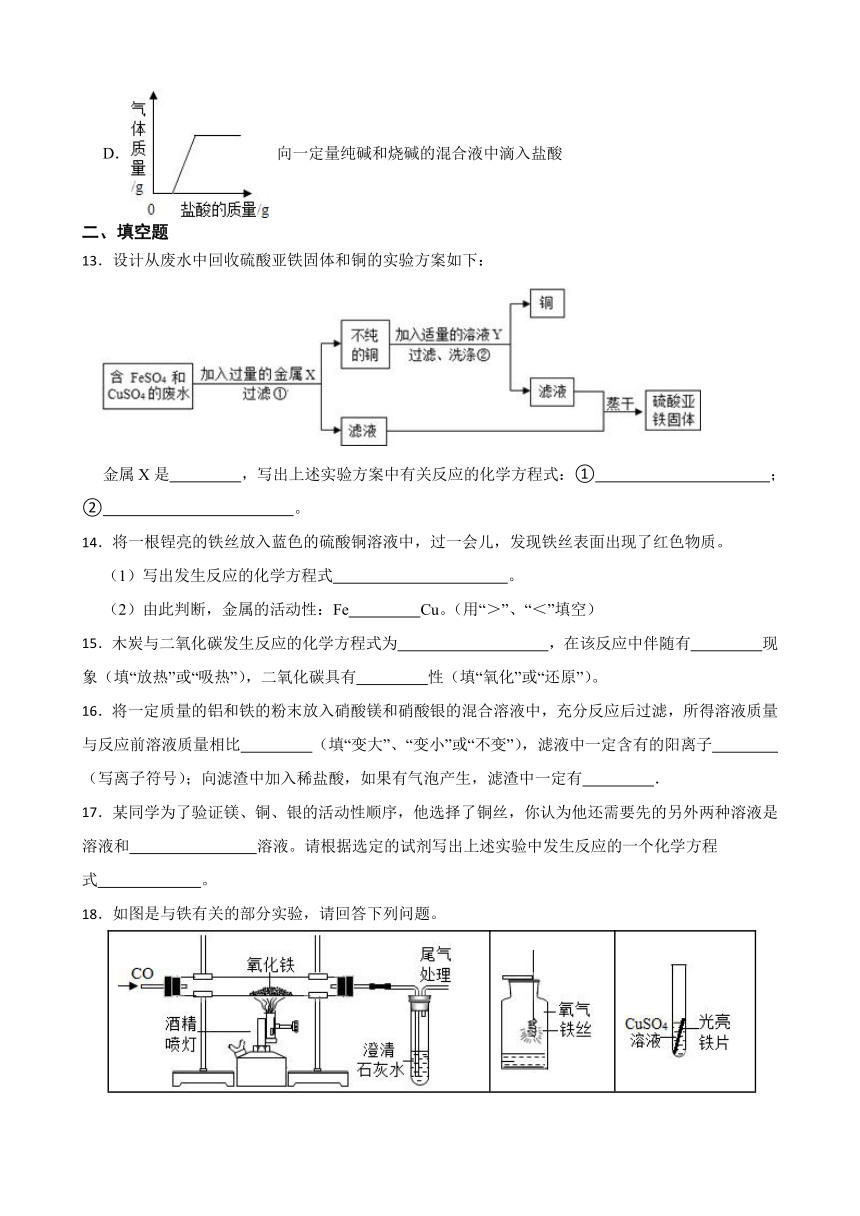
12.下列图象分别与选项中的操作相对应,其中合理的是( )
A. 向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液
B. 向一定量氯化铜溶液中加入一定量铝
C. 向一定量稀硫酸中滴入水
D. 向一定量纯碱和烧碱的混合液中滴入盐酸
二、填空题
13.设计从废水中回收硫酸亚铁固体和铜的实验方案如下:
金属X是 ,写出上述实验方案中有关反应的化学方程式:① ;② 。
14.将一根锃亮的铁丝放入蓝色的硫酸铜溶液中,过一会儿,发现铁丝表面出现了红色物质。
(1)写出发生反应的化学方程式 。
(2)由此判断,金属的活动性:Fe Cu。(用“>”、“<”填空)
15.木炭与二氧化碳发生反应的化学方程式为 ,在该反应中伴随有 现象(填“放热”或“吸热”),二氧化碳具有 性(填“氧化”或“还原”)。
16.将一定质量的铝和铁的粉末放入硝酸镁和硝酸银的混合溶液中,充分反应后过滤,所得溶液质量与反应前溶液质量相比 (填“变大”、“变小”或“不变”),滤液中一定含有的阳离子 (写离子符号);向滤渣中加入稀盐酸,如果有气泡产生,滤渣中一定有 .
17.某同学为了验证镁、铜、银的活动性顺序,他选择了铜丝,你认为他还需要先的另外两种溶液是 溶液和 溶液。请根据选定的试剂写出上述实验中发生反应的一个化学方程式 。
18.如图是与铁有关的部分实验,请回答下列问题。
甲 乙 丙
(1)甲中获得铁的化学方程式是 。
(2)乙中证明铁发生反应的依据是 。
(3)丙中能发生反应的原因是 。
三、综合题
19.某钣金厂废料中含有Cu、Fe、Au(金)等金属单质,欲回收Cu、Au并制取铁红(Fe2O3)的工艺流程如下:
查阅资料:
(1)写出下列物质的化学式:气体A ,固体B 。
(2)反应①中加入过量稀硫酸的目的是 ,反应前需将废料进行粉碎,其目的是 。
(3)在加热的条件下,向固体A中通入空气的目的是 。
(4)操作Ⅰ 的名称是 ,所用到的玻璃仪器有玻璃棒、烧杯和 。
(5)反应②的化学方程式是 ,反应基本类型是 。
20.合金在工农业生产中有广泛用途。XY合金、XZ合金由金属X、Y、Z制造而成。将XY合金粉末、XZ合金粉末分别加入到足量稀硫酸中,XY合金粉末完全溶解,XZ合金粉末部分溶解。
(1)XY合金具有熔点 (选填“高”或“低”)的性质,因而易于加工;
(2)金属活动性强弱:Y Z(选填“>”或“<”);
(3)下列两组试剂,一定能证明X和Y的活动性强弱的选项是 。
A X、Y、H2SO4溶液
B X、YSO4溶液
21.实验室将一定量的铁粉加入含硝酸银的废液中,用于回收其中的银。
(1)反应完全,为判断银是否全部被铁置换,同学设计了两种不同的实验方案:
方案I:将反应后的混合物进行过滤,取少量滤渣,滴入稀盐酸,产生气泡,由此判断银全部被置换。滴入盐酸发生反应的化学方程式是 。
方案II:将反应后的混合物进行过滤, (请将实验方案补充完整),由此判断银全部被置换。
(2)本实验 (选填“能”或“不能”)用锌代替铁,用于回收废液中的银。
22.钠的化学性质非常活泼,直到1807 年才由英国化学家戴维通过电解氢氧化钠得到单质金属钠。实验室通常金属钠保存在煤油或液体石蜡中,仍然会发生缓慢的氧化。请回答下列问题:
(1)写出金属钠发生缓慢氧化反应的化学方程式 ;
(2)探究金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声:向反应后的溶液中滴加酚酞试剂,溶液呈红色。由此推断:钠与水反应的化学方程式为 ;
(3)根据金属活动性顺序推测:金属钠放入硫酸铜溶液中,溶液底部应出现金属铜的红色沉积物:经实验证明,实际观察到的是蓝色沉淀[Cu(OH)2]和一种盐。产生蓝色沉淀的原因是 ;(用化学方程式解释)。 如果往蓝色沉淀里加入稀盐酸,沉淀又消失了,用化学方程式表示发生这个现象的原因 。
答案解析部分
1.【答案】A
2.【答案】A
3.【答案】C
4.【答案】B
5.【答案】B
6.【答案】B
7.【答案】A
8.【答案】A
9.【答案】C
10.【答案】B
11.【答案】C
12.【答案】D
13.【答案】Fe;;
14.【答案】(1)Fe+CuSO4=Cu+FeSO4
(2)>
15.【答案】;吸热;氧化
16.【答案】变小;Mg2+、Al3+;银、铁
17.【答案】硫酸镁MgSO4;硝酸银AgNO3;方程式略
18.【答案】(1)
(2)铁丝剧烈燃烧,火星四射,放出大量热量,并生成黑色固体
(3)铁的金属活动性强于铜
19.【答案】(1)H2;Au
(2)将铁全部转化为FeSO4;使反应更快更充分
(3)将铜转化为氧化铜
(4)过滤;漏斗
(5);置换反应
20.【答案】(1)低
(2)>
(3)B
21.【答案】(1);取少量滤液,滴加盐酸,无明显现象(合理即可)
(2)能
22.【答案】(1)
(2)
(3);
一、单选题
1.根据金属活动性顺序Al>Fe>Cu>Ag判断,下列说法不正确的是( )
A.反应Cu+FeSO4═Fe+CuSO4可以发生,属于置换反应
B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生,属于置换反应
C.反应Cu+2AgNO3═2Ag+Cu(NO3)2可以发生,溶液颜色由无色变成蓝色
D.反应2Al+3CuSO4═3Cu+Al2(SO4)3可以表面有红色物质析出,溶液由蓝色变无色
2.下列实验现象的描述错误的是( )
A.铁钉置于稀硫酸中表面产生气泡,溶液变为蓝色
B.生石灰与水反应放出大量热
C.镁带在空气中燃烧发出耀眼的白光
D.硫在空气中燃烧,发出淡蓝色火焰
3.向AgNO3、NaNO3、Cu(NO3)2混合液中加入一定量的锌粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子一定有( )
A.Ag+、Cu2+ B.Cu2+、Zn2+ C.Zn2+、Na+ D.Zn2+、Ag+
4.镉(Cd)及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是一种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为+2.根据金属化学性质的一般规律,下列预测合理的是:( )
①镉能与氢氧化钠溶液反应
②H2或CO能将镉的氧化物转化为金属镉
③镉能与盐酸或稀硫酸反应
④硫酸镉溶液中的硫酸锌可加入镉粉除去
A.①② B.②③ C.③④ D.②④
5.向氧化铜和锌粉的混合物中加入一定量的稀硫酸,反应停止后过滤,再向滤液中插入铁片,铁片无变化.以下判断正确的是
( )
A.滤液中一定含有铜和锌 B.滤液中一定含有Zn2+
C.滤液中一定含有铜 D.滤液中一定含有Cu2+
6.下列说法正确的是( )
A.铝比铁的抗腐蚀性能强,故铝比铁的化学性质稳定
B.中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应
C.燃烧一般都伴随发光和放热现象,所以有发光和放热现象的变化都是燃烧
D.原子不显电性,所以构成原子的粒子也不显电性
7.有关颜色的描述错误的是( )
A.金属都是银白色的
B.硫粉在氧气中燃烧出现蓝紫色火焰
C.将铜片放入硝酸银溶液,溶液由无色变为蓝色
D.对木炭和氧化铜的粉末加强热,固体由黑色变红色
8.金属材料在人类活动中已得到越来越广泛的应用,下列材料属于金属共性的是( )
A.有良好的导电性、导热性 B.密度较大,熔点较低
C.是银白色的固体 D.都是混合物
9.推理是化学学习中常用的思维方法.下列推断错误的是( )
A.碱溶液一定呈碱性,呈碱性的溶液不一定是碱溶液
B.置换反应一定有单质生成,有单质生成的不一定是置换反应
C.饱和溶液不一定是浓溶液,浓溶液一定是饱和溶液
D.单质只含一种元素,含有一种元素的物质不一定是单质
10.下列图象能正确反映对应变化关系的是( )
A. 向一定质量的氢氧化钠溶液中加入稀盐酸
B. 向等质量、等浓度的稀硫酸中分别逐渐加入铝粉和镁粉
C. 向一定量的氢氧化钡溶液中加过量稀硫酸,生成水的质量与加进稀硫酸的质量
D. 向氢氧化钠溶液中加水
11.下列关于金属材料的使用说法正确的是( )
A.铝制品表面应常用钢丝球擦洗
B.可用铁桶盛放硫酸铜溶液配制农药波尔多液
C.焊锡的熔点低,常用来焊接金属
D.铝在地壳中含量少,所以铝的利用比铁晚
12.下列图象分别与选项中的操作相对应,其中合理的是( )
A. 向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液
B. 向一定量氯化铜溶液中加入一定量铝
C. 向一定量稀硫酸中滴入水
D. 向一定量纯碱和烧碱的混合液中滴入盐酸
二、填空题
13.设计从废水中回收硫酸亚铁固体和铜的实验方案如下:
金属X是 ,写出上述实验方案中有关反应的化学方程式:① ;② 。
14.将一根锃亮的铁丝放入蓝色的硫酸铜溶液中,过一会儿,发现铁丝表面出现了红色物质。
(1)写出发生反应的化学方程式 。
(2)由此判断,金属的活动性:Fe Cu。(用“>”、“<”填空)
15.木炭与二氧化碳发生反应的化学方程式为 ,在该反应中伴随有 现象(填“放热”或“吸热”),二氧化碳具有 性(填“氧化”或“还原”)。
16.将一定质量的铝和铁的粉末放入硝酸镁和硝酸银的混合溶液中,充分反应后过滤,所得溶液质量与反应前溶液质量相比 (填“变大”、“变小”或“不变”),滤液中一定含有的阳离子 (写离子符号);向滤渣中加入稀盐酸,如果有气泡产生,滤渣中一定有 .
17.某同学为了验证镁、铜、银的活动性顺序,他选择了铜丝,你认为他还需要先的另外两种溶液是 溶液和 溶液。请根据选定的试剂写出上述实验中发生反应的一个化学方程式 。
18.如图是与铁有关的部分实验,请回答下列问题。
甲 乙 丙
(1)甲中获得铁的化学方程式是 。
(2)乙中证明铁发生反应的依据是 。
(3)丙中能发生反应的原因是 。
三、综合题
19.某钣金厂废料中含有Cu、Fe、Au(金)等金属单质,欲回收Cu、Au并制取铁红(Fe2O3)的工艺流程如下:
查阅资料:
(1)写出下列物质的化学式:气体A ,固体B 。
(2)反应①中加入过量稀硫酸的目的是 ,反应前需将废料进行粉碎,其目的是 。
(3)在加热的条件下,向固体A中通入空气的目的是 。
(4)操作Ⅰ 的名称是 ,所用到的玻璃仪器有玻璃棒、烧杯和 。
(5)反应②的化学方程式是 ,反应基本类型是 。
20.合金在工农业生产中有广泛用途。XY合金、XZ合金由金属X、Y、Z制造而成。将XY合金粉末、XZ合金粉末分别加入到足量稀硫酸中,XY合金粉末完全溶解,XZ合金粉末部分溶解。
(1)XY合金具有熔点 (选填“高”或“低”)的性质,因而易于加工;
(2)金属活动性强弱:Y Z(选填“>”或“<”);
(3)下列两组试剂,一定能证明X和Y的活动性强弱的选项是 。
A X、Y、H2SO4溶液
B X、YSO4溶液
21.实验室将一定量的铁粉加入含硝酸银的废液中,用于回收其中的银。
(1)反应完全,为判断银是否全部被铁置换,同学设计了两种不同的实验方案:
方案I:将反应后的混合物进行过滤,取少量滤渣,滴入稀盐酸,产生气泡,由此判断银全部被置换。滴入盐酸发生反应的化学方程式是 。
方案II:将反应后的混合物进行过滤, (请将实验方案补充完整),由此判断银全部被置换。
(2)本实验 (选填“能”或“不能”)用锌代替铁,用于回收废液中的银。
22.钠的化学性质非常活泼,直到1807 年才由英国化学家戴维通过电解氢氧化钠得到单质金属钠。实验室通常金属钠保存在煤油或液体石蜡中,仍然会发生缓慢的氧化。请回答下列问题:
(1)写出金属钠发生缓慢氧化反应的化学方程式 ;
(2)探究金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声:向反应后的溶液中滴加酚酞试剂,溶液呈红色。由此推断:钠与水反应的化学方程式为 ;
(3)根据金属活动性顺序推测:金属钠放入硫酸铜溶液中,溶液底部应出现金属铜的红色沉积物:经实验证明,实际观察到的是蓝色沉淀[Cu(OH)2]和一种盐。产生蓝色沉淀的原因是 ;(用化学方程式解释)。 如果往蓝色沉淀里加入稀盐酸,沉淀又消失了,用化学方程式表示发生这个现象的原因 。
答案解析部分
1.【答案】A
2.【答案】A
3.【答案】C
4.【答案】B
5.【答案】B
6.【答案】B
7.【答案】A
8.【答案】A
9.【答案】C
10.【答案】B
11.【答案】C
12.【答案】D
13.【答案】Fe;;
14.【答案】(1)Fe+CuSO4=Cu+FeSO4
(2)>
15.【答案】;吸热;氧化
16.【答案】变小;Mg2+、Al3+;银、铁
17.【答案】硫酸镁MgSO4;硝酸银AgNO3;方程式略
18.【答案】(1)
(2)铁丝剧烈燃烧,火星四射,放出大量热量,并生成黑色固体
(3)铁的金属活动性强于铜
19.【答案】(1)H2;Au
(2)将铁全部转化为FeSO4;使反应更快更充分
(3)将铜转化为氧化铜
(4)过滤;漏斗
(5);置换反应
20.【答案】(1)低
(2)>
(3)B
21.【答案】(1);取少量滤液,滴加盐酸,无明显现象(合理即可)
(2)能
22.【答案】(1)
(2)
(3);
