第五章第一节 硫及其化合物 第2课时三氧化硫 硫酸 课件(共16张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章第一节 硫及其化合物 第2课时三氧化硫 硫酸 课件(共16张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 09:11:22 | ||
图片预览






文档简介
(共16张PPT)
第一节 硫及其化合物
第二课时 三氧化硫 硫酸
第五章 化工生产中的重要非金属元素
2SO2+ O2 2SO3
一、 三氧化硫
(1)SO3的物理性质
常温下为无色液体,熔点:16.8℃ 沸点:44.8℃,标况下为固体,加热为气体。易溶于水,并与水反应生成硫酸,放出大量的热
(2)SO3的化学性质—酸性氧化物
①与H2O反应
②与碱反应
③与碱性氧化物反应
SO3+H2O=H2SO4
SO3+2NaOH=Na2SO4 +H2O
SO3+ CaO = CaSO4
二、 硫酸
硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等,工业上一般以硫磺或者其他含硫矿物(如黄铁矿)为原料制备硫酸。
硫酸的产量被视为一个国家无机化工工业发展水平的标志。
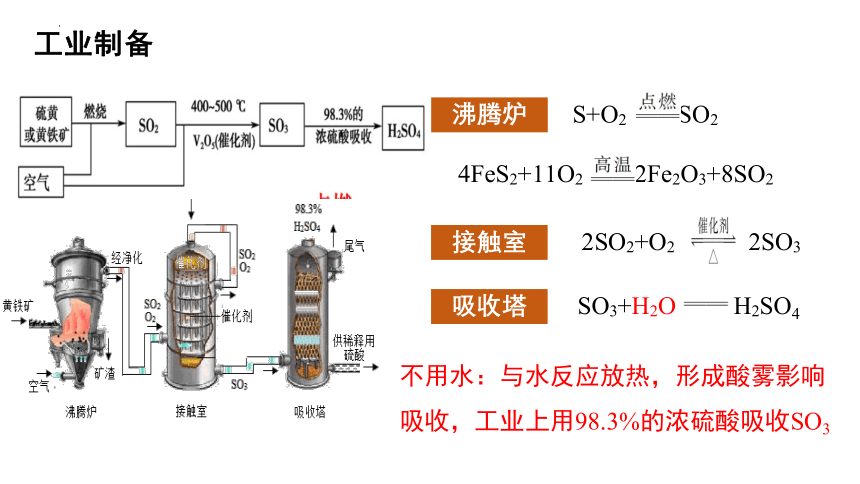
工业制备
S+O2 SO2
4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O H2SO4
沸腾炉
接触室
吸收塔
不用水:与水反应放热,形成酸雾影响吸收,工业上用98.3%的浓硫酸吸收SO3
二、 硫酸
1、硫酸的物理性质
无色油状液体,沸点约338℃,高沸点难挥发酸。密度1.84g/cm3,与水以任意比混合,并放出大量的热。
浓硫酸如何稀释?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌
2、稀硫酸的化学性质——酸的通性
H2SO4 = 2H+ + SO42-
①使酸碱指示剂变色
②与活泼金属反应
③与碱反应
④与碱性氧化物反应
⑤与盐反应
使紫色石蕊试液变红
Zn + 2H+ = Zn2+ + H2↑
OH- + H+ = H2O
CuO + 2H+ = Cu2+ + H2O
SO42- + Ba2+ = BaSO4↓
CO32- + 2H+ = CO2↑ + H2O
3.浓硫酸的性质:
(1).吸水性:
吸收物质中原本含有的水份
或结晶水
游离水
应用:
①、作干燥剂
②、除结晶水
物理变化
化学变化
干燥中性气体或酸性气体
H2、O2、Cl2、CO2、CO、CH4、SO2、N2等
不能干燥碱性或还原性气体:
NH3、H2S、HBr、HI
练习.在实验探究课上,同学们积极思考,共设计出下图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是___________。
3.浓硫酸的性质:
(2).脱水性:——化学变化
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
特点:有机物中原本无水,是将H、O原子按2∶1的比例脱去后生成H2O
①.与金属单质反应
2H2SO4(浓)+Cu==CuSO4+2H2O+SO2↑
a试管中铜丝表面有气泡产生
b试管中的品红溶液逐渐变为无色
c试管中的紫色石蕊溶液逐渐变为红色
将a试管里的溶液慢慢倒入水中,溶液变为蓝色
可抽动的铜丝有什么作用?
铜丝为何螺旋状?
浸有碱液的棉花团有什么作用?
浓硫酸表现了什么性质?
控制反应的发生与停止
增大接触面积
吸收SO2,防止污染
生成SO2,表现氧化性;
生成CuSO4,表现酸性
2H2SO4(浓)+Cu==CuSO4+2H2O+SO2↑
总结:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,生成SO2气体。
浓硫酸能和金属反应,为什么
可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸能让Fe、Al 钝化
常温下,Fe、Al 与浓 H2SO4 或浓 HNO3 反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。钝化是________变化。
故可用铁罐车或铝槽车运输冷的浓硫酸、浓硝酸。
化学
②.与非金属单质反应
0
+4
+6
+4
只有氧化性
如何检验该反应的产物?
KMnO4颜色变浅除去SO2气体
浑浊
检验CO2
白色变为蓝色检验H2O的存在
品红溶液褪色检验SO2的存在
不褪色
检验SO2是否除尽
物 理 性 质 纯净的硫酸是无色油状液体,沸点高,难挥发,密度比水的大(98%的浓H2SO4密度为1.84 g·cm-3),溶于水放出大量的热 吸水性 常用作 干燥剂 能干燥 H2、O2、N2、CO2、Cl2、HCl、SO2、CO、CH4等 不能干燥 碱性气体,如 NH3等 还原性气体,如 H2S、HBr、HI 等 化 学 性 质 脱水性 将有机物中的氢、氧元素按原子个数 2∶1的比例脱去,如蔗糖脱水炭化 强氧 化性 与活泼金属反应 2Fe+6H2SO4(浓) Fe2(SO4)3+ 3SO2↑+6H2O,
常温下浓硫酸使Fe、Al钝化
与不活泼金属反应 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
与非金属反应 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
课堂小结
下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
(7)强酸性
(1)脱水性
(2) 吸水性
(3) 酸性
(4)酸性和强氧化性
(5)难挥发性
(6)强氧化性
第一节 硫及其化合物
第二课时 三氧化硫 硫酸
第五章 化工生产中的重要非金属元素
2SO2+ O2 2SO3
一、 三氧化硫
(1)SO3的物理性质
常温下为无色液体,熔点:16.8℃ 沸点:44.8℃,标况下为固体,加热为气体。易溶于水,并与水反应生成硫酸,放出大量的热
(2)SO3的化学性质—酸性氧化物
①与H2O反应
②与碱反应
③与碱性氧化物反应
SO3+H2O=H2SO4
SO3+2NaOH=Na2SO4 +H2O
SO3+ CaO = CaSO4
二、 硫酸
硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等,工业上一般以硫磺或者其他含硫矿物(如黄铁矿)为原料制备硫酸。
硫酸的产量被视为一个国家无机化工工业发展水平的标志。
工业制备
S+O2 SO2
4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O H2SO4
沸腾炉
接触室
吸收塔
不用水:与水反应放热,形成酸雾影响吸收,工业上用98.3%的浓硫酸吸收SO3
二、 硫酸
1、硫酸的物理性质
无色油状液体,沸点约338℃,高沸点难挥发酸。密度1.84g/cm3,与水以任意比混合,并放出大量的热。
浓硫酸如何稀释?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌
2、稀硫酸的化学性质——酸的通性
H2SO4 = 2H+ + SO42-
①使酸碱指示剂变色
②与活泼金属反应
③与碱反应
④与碱性氧化物反应
⑤与盐反应
使紫色石蕊试液变红
Zn + 2H+ = Zn2+ + H2↑
OH- + H+ = H2O
CuO + 2H+ = Cu2+ + H2O
SO42- + Ba2+ = BaSO4↓
CO32- + 2H+ = CO2↑ + H2O
3.浓硫酸的性质:
(1).吸水性:
吸收物质中原本含有的水份
或结晶水
游离水
应用:
①、作干燥剂
②、除结晶水
物理变化
化学变化
干燥中性气体或酸性气体
H2、O2、Cl2、CO2、CO、CH4、SO2、N2等
不能干燥碱性或还原性气体:
NH3、H2S、HBr、HI
练习.在实验探究课上,同学们积极思考,共设计出下图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是___________。
3.浓硫酸的性质:
(2).脱水性:——化学变化
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
特点:有机物中原本无水,是将H、O原子按2∶1的比例脱去后生成H2O
①.与金属单质反应
2H2SO4(浓)+Cu==CuSO4+2H2O+SO2↑
a试管中铜丝表面有气泡产生
b试管中的品红溶液逐渐变为无色
c试管中的紫色石蕊溶液逐渐变为红色
将a试管里的溶液慢慢倒入水中,溶液变为蓝色
可抽动的铜丝有什么作用?
铜丝为何螺旋状?
浸有碱液的棉花团有什么作用?
浓硫酸表现了什么性质?
控制反应的发生与停止
增大接触面积
吸收SO2,防止污染
生成SO2,表现氧化性;
生成CuSO4,表现酸性
2H2SO4(浓)+Cu==CuSO4+2H2O+SO2↑
总结:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,生成SO2气体。
浓硫酸能和金属反应,为什么
可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸能让Fe、Al 钝化
常温下,Fe、Al 与浓 H2SO4 或浓 HNO3 反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。钝化是________变化。
故可用铁罐车或铝槽车运输冷的浓硫酸、浓硝酸。
化学
②.与非金属单质反应
0
+4
+6
+4
只有氧化性
如何检验该反应的产物?
KMnO4颜色变浅除去SO2气体
浑浊
检验CO2
白色变为蓝色检验H2O的存在
品红溶液褪色检验SO2的存在
不褪色
检验SO2是否除尽
物 理 性 质 纯净的硫酸是无色油状液体,沸点高,难挥发,密度比水的大(98%的浓H2SO4密度为1.84 g·cm-3),溶于水放出大量的热 吸水性 常用作 干燥剂 能干燥 H2、O2、N2、CO2、Cl2、HCl、SO2、CO、CH4等 不能干燥 碱性气体,如 NH3等 还原性气体,如 H2S、HBr、HI 等 化 学 性 质 脱水性 将有机物中的氢、氧元素按原子个数 2∶1的比例脱去,如蔗糖脱水炭化 强氧 化性 与活泼金属反应 2Fe+6H2SO4(浓) Fe2(SO4)3+ 3SO2↑+6H2O,
常温下浓硫酸使Fe、Al钝化
与不活泼金属反应 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
与非金属反应 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
课堂小结
下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
(7)强酸性
(1)脱水性
(2) 吸水性
(3) 酸性
(4)酸性和强氧化性
(5)难挥发性
(6)强氧化性
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
