5.3.无机非金属材料 课件(共37张PPT) 2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.3.无机非金属材料 课件(共37张PPT) 2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 09:45:18 | ||
图片预览









文档简介
(共37张PPT)
第五章 非金属及其化合物
第三节无机非金属材料
硅在自然界的存在形态:
——由于硅是一种亲氧元素,没有游离态,只有化合态,主要以二氧化硅和硅酸盐的形式存在。
硅元素在自然界中的存在
岩石 沙子 土壤
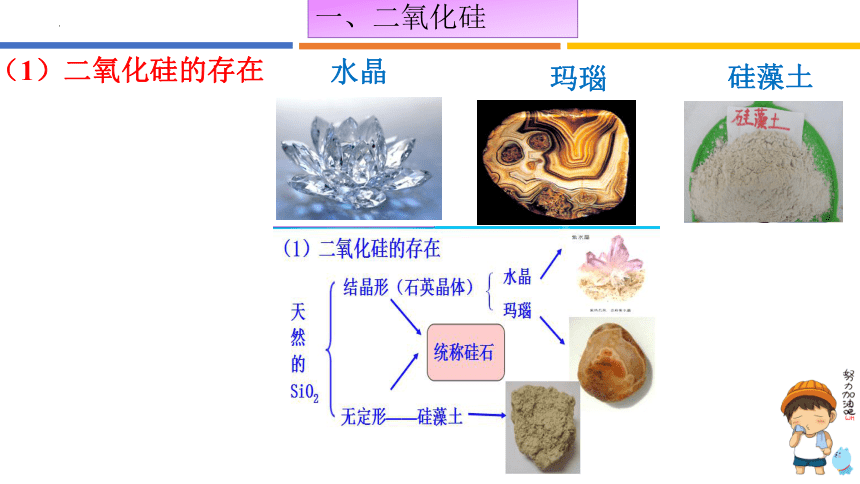
水晶
玛瑙
硅藻土
一、二氧化硅
(1)二氧化硅的存在
石英研钵
坩埚
轴承
(2)二氧化硅的用途
二氧化硅的用途和存在 二氧化硅的物理性质
石英坩埚
轴承
沙子
熔沸点高
硬度大
不溶于水
根据SiO2的存在和应用,请你分析以下问题SiO2具有哪些物理性质?
化学稳定性:____________________________
很稳定
二氧化硅的晶体结构示意图
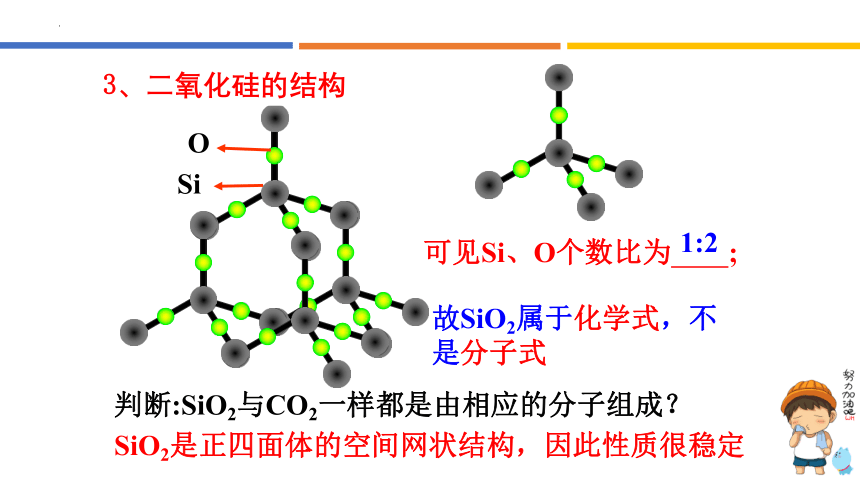
可见Si、O个数比为 ;
故SiO2属于化学式,不是分子式
1:2
Si
O
SiO2是正四面体的空间网状结构,因此性质很稳定
判断:SiO2与CO2一样都是由相应的分子组成?
3、二氧化硅的结构
熔点高,硬度大,不溶于水,
1.物理性质:
2.化学性质:
①与碱的反应:
(1)酸性氧化物
一、二氧化硅
SiO2 + 2NaOH=Na2SiO3+H2O
②与碱性氧化物反应:
高温
SiO2 + CaO CaSiO3
③与水反应:
不反应
Na2SiO3可溶于水,其水溶液俗名水玻璃,有粘性。
(2)在高温下与碳酸盐的反应
SiO2+Na2CO3=== CO2 +Na2SiO3
高温
SiO2+CaCO3===CO2 +CaSiO3
高温
玻璃的主要成分SiO2、Na2SiO3、CaSiO3
盛放碱性溶液时用橡胶塞。
氢
氟
酸
}制取玻璃原理
(3)特性:不与其他酸反应,只与氢氟酸反应
SiO2 + 4HF == SiF4 + 2H2O
(玻璃花雕刻)
不能玻璃瓶用保存氢氟酸
由于SiO2既可与碱反应,也可与氢氟酸反应,所以SiO2为两性氧化物,这种说法是否正确
×
SiO2能与HF反应为特例,其产物SiF4不是盐,所以SiO2只是酸性氧化物
(4)弱的氧化性
SiO2+2C == Si+2CO ↑
高温
(制硅单质的原理)
二氧化硅(SiO2) 二氧化碳(CO2)
物理性质
与水反应
与碱反应
与碱性氧化物反应
与酸反应
与碳反应
高温
熔沸点高、硬度大
熔沸点低、硬度小
不反应
CO2+H2O=H2CO3
SiO2+2NaOH=Na2SiO3+H2O
CO2+2NaOH=Na2CO3+H2O
SiO2+CaO== CaSiO3
CO2+CaO= CaCO3
高温
SiO2+4HF=SiF4↑+2H2O
不反应
SiO2+2C== Si+2CO
高温
CO2+C== 2CO
高温
SiO2+Na2CO3 = CO2 +Na2SiO3
高温
课堂·习题
1.地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是( )
A.熔点很高
B.与水反应生成对应的酸
C.坚硬
D.可与烧碱反应生成盐
B
【思考】二氧化硅不溶于水,不跟水反应,如何来制备H2SiO3
实验4-1
现 象
结 论
化学方程式
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3的水溶液呈碱性,
硅酸难溶于水
滴入酚酞溶液呈红色,
滴入盐酸有白色胶状沉淀产生
通入CO2呢?
强酸
弱酸
可溶性硅酸盐与其它酸反应制得的。
Na2SiO3+CO2+H2O = Na2CO3+H2SiO3↓
制取原理:较强酸制较弱酸。
1.物理性质
硅酸是一种 溶于水的 胶状物。
2.化学性质
白色
不
H2SiO3===H2O+SiO2
加热
3.用途
硅酸干凝胶 “硅胶”
干燥剂
催化剂的载体
硅酸凝胶
H2SiO3
二、硅酸(H2SiO3)
(1)弱酸性:
(2)不稳定性:
酸性太弱(不能使石蕊试液变红)
干燥剂的分类
干燥剂
酸性干燥剂:
浓硫酸、硅酸、P2O5
碱性干燥剂:
碱石灰、生石灰
中性干燥剂:
CaCl2
(不能干燥碱性气体)
(不能干燥酸性气体)
(不能干燥氨气、乙醇)
知识拓展
(一)二氧化硅
物理性质:
化学性质:
用途:
(二)硅酸
制备:
物理性质:
化学性质:
用途:
一、二氧化硅(SiO2)和硅酸(H2SiO3)
光导纤维,石英玻璃等
酸性氧化物 //
不溶于水的白色胶状沉淀
熔点、硬度、不溶于水
酸性、不稳定性
硅酸盐 + 酸
干燥剂和催化剂载体等
特性与HF
知识总结 能力提升
例1.下列说法正确的是( )
A.硅酸不溶于水,因此不与NaOH溶液反应
B.根据SiO2+CaCO3 CaSiO3+CO2↑的反应,可推知硅酸酸性比碳酸酸性强
C.CO2气体通入硅酸钠溶液中可以制得硅酸
D.SiO2溶于水显酸性
C
课堂·习题
例2. 下列关于硅酸的说法正确的是 ( )
A.硅酸可以通过SiO2和水的化合反应直接制得
B.用反应Na2SiO3+2HCl===2NaCl+H2SiO3↓制取硅酸是利用了可溶性酸制难溶性酸的性质
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.硅胶可用作袋装食品的干燥剂
D
课堂·习题
例3、为确认盐酸、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
(1)锥形瓶中装某可溶性正盐溶液,
分液漏斗所盛试剂应为______。
(2)装置B所盛的试剂是
___________________,
其作用是________________________。
(3)装置C所盛试剂是_____________,C中反应的离子方程式是______________________________。
盐酸
饱和NaHCO3溶液
除去CO2中的HCl气体
Na2SiO3溶液
课堂·习题
链接·高考
例4.将过量的CO2分别通入① CaCl2溶液;② Na2SiO3溶液;③ Ca(OH)2溶液;④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④ B.②④
C.①②③ D.①②④
B
1.硅酸盐是由硅、氧和金属组成的化合物的总称。
特点:结构复杂,除K2SiO3 、 Na2SiO3 、 ( NH4 )2SiO3铵以外均难溶于水,化学性质很稳定。
高岭石: Al2Si2O5(OH)4
石棉:CaMg3Si4O12
沸石:Na2Al2Si3O8(OH)4
云母:K2Al6Si6O20(OH)4
三、硅酸盐
高岭石{Al2Si2O5(OH)4}:
石棉{CaMg3Si4O12}:
云母{KAl3Si3O10(OH)2}:
改写成氧化物的形式
活泼金属氧化物 → 较活泼金属氧化物 → 二氧化硅 → 水
Al2O3 · 2SiO2 ·2H2O
CaO· 3MgO· 4SiO2
K2O· 3Al2O3 · 6SiO2· 2H2O
练习1:改写成氧化物形式
玻璃{Na2CaSi6O14}:
黏土{Al2Si2O5(OH)4}:
Na2O · CaO· 6SiO2
Al2O3 · 2SiO2· 2H2O
1.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x,y的数值分别是( )
A. 7,2 B. 5,4
C. 6,3 D. 3,6
B
硅酸钠水溶液俗称为水玻璃,是无色黏稠状液体。
硅酸钠可用作肥皂填料、用水玻璃浸泡过的木材或织物可防火、防腐蚀。
水玻璃可保存于玻璃瓶中,但不能使用玻璃塞,要用橡胶塞。
2.硅酸钠(Na2SiO3)
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓
硅酸钠溶液在空气中易变质,反应的化学方程式为:
硅酸盐工业
1 玻璃
原料:石灰石、纯碱、石英砂
Na2SiO3 、CaSiO3 、SiO2
原理:
CaCO3+SiO2 = CaSiO3 + CO2↑
高温
Na2CO3+SiO2 = Na2SiO3 + CO2 ↑
高温
主要成份
辨析:普通玻璃、石英玻璃
普通玻璃: Na2O·CaO·6SiO2
2 陶瓷
以黏土为主要原料,经高温烧结而成
3 水泥
原料:黏土、石灰石、适量石膏等
性能用途:水硬性、建筑材料、钢筋混凝土
万丈高楼平地起,穿针引线是水泥。
晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料。
四、硅单质
单质硅有晶体和无定形两种。晶体硅是带有金属光泽的灰黑色固体,熔点高,硬度大,有脆性,在常温下化学性质不活泼。
Si+2F2=SiF4
Si+4HF=SiF4 +2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2 ↑
1:常温下,只和氢氟酸、氟气、强碱反应。
2:加热情况下,硅也能跟一些非金属反应。高温下化学性质活泼
Si+2Cl2 = SiCl4
Si+O2 = SiO2
Si+ C = SiC
2Mg+ Si = Mg2Si
高温
高温
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
Ⅰ.高温下用碳还原二氧化硅制得粗硅;
Ⅱ.粗硅与干燥的HCl气体反应制得SiHCl3:
Si+3HCl==SiHCl3+H2;
Ⅲ.SiHCl3与过量H2在1000~1100 ℃反应制得纯硅。
300℃
3:硅的工业制法
C
高温
二
氧
化
硅
粗
硅
粗
三
氯
化
硅
纯
三
氯
化
硅
高
纯
硅
HCl
高温
H2
高温
精
馏
SiCl4 + 2H2 = Si + 4HCl
高温
SiO2 + 2C = Si + 2CO↑
高温
硅可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制成太阳能电池,可制成有良好导磁性、耐酸性的合金。在美国旧金山,有个最大的高科技工业园区,称之为“硅谷”。
4.硅的用途
硅太阳能电池
大规模集成电路
CPU、芯片
制备纯硅的主要步骤如下:
①高温下 用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体在300℃反应制得SiHCl3:
Si+3HCl = SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84. 7℃),提纯SiHCl3采用的方法为: 。
SiO2 + 2C = Si + 2CO
高温
分馏
能力提升
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是______ ,装置C中的烧瓶需要加热,其目的是: ___________________
②反应一段时间后,装置D中观察到的现象是______
装置D不能采用普通玻璃管的原因是 ______
装置D中发生反应的化学方程式为。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 ______
浓硫酸
使滴入烧瓶中的 SiHCI3 气化
有固体物质生成
在反应温度下,普通玻璃会软化
排尽装置中的空气
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水
c.NaOH溶液 d.KSCN溶液
e.Na2SO3溶液
bd
1不能通过化合反应来制取的物质是 ( )
A. SiCl4
B. H2SiO3
C. Na2O2
D. CaSiO3
B
2:下列物品或设备:
①水泥路面 ②门窗玻璃
③水晶镜片 ④石英钟表
⑤玛瑙手镯 ⑥硅太阳能电池
⑦光导纤维 ⑧计算机芯片
所用材料为SiO2或要用到SiO2的是( )
A.⑥⑧ B.①②⑦⑧
C.①②③④⑤⑦ D.全部
C
3.下列离子方程式书写正确的是( )
A.往澄清石灰水中通入过量的二氧化碳:
Ca2++2OH-+CO2=CaCO3↓+H2O
B.往硅酸钠溶液中通入足量二氧化碳:
C.小苏打溶液中加足量澄清石灰水:
2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.硅酸与烧碱溶液中和:
H2SiO3+2OH-=SiO32-+2H2O
D
SiO32- + H2O + CO2 = CO3 2-+ H2SiO3↓
4、有一粗铝内含Fe和Si,取等质量样品两份,分别投入足量的稀盐酸和稀强碱中,放出等物质的量的气体,则Fe和Si的关系为( )
A.物质的量比为1:1
B.物质的量比为2:1
C.物质的量比为1:2
D.物质的量比为2:3
B
第五章 非金属及其化合物
第三节无机非金属材料
硅在自然界的存在形态:
——由于硅是一种亲氧元素,没有游离态,只有化合态,主要以二氧化硅和硅酸盐的形式存在。
硅元素在自然界中的存在
岩石 沙子 土壤
水晶
玛瑙
硅藻土
一、二氧化硅
(1)二氧化硅的存在
石英研钵
坩埚
轴承
(2)二氧化硅的用途
二氧化硅的用途和存在 二氧化硅的物理性质
石英坩埚
轴承
沙子
熔沸点高
硬度大
不溶于水
根据SiO2的存在和应用,请你分析以下问题SiO2具有哪些物理性质?
化学稳定性:____________________________
很稳定
二氧化硅的晶体结构示意图
可见Si、O个数比为 ;
故SiO2属于化学式,不是分子式
1:2
Si
O
SiO2是正四面体的空间网状结构,因此性质很稳定
判断:SiO2与CO2一样都是由相应的分子组成?
3、二氧化硅的结构
熔点高,硬度大,不溶于水,
1.物理性质:
2.化学性质:
①与碱的反应:
(1)酸性氧化物
一、二氧化硅
SiO2 + 2NaOH=Na2SiO3+H2O
②与碱性氧化物反应:
高温
SiO2 + CaO CaSiO3
③与水反应:
不反应
Na2SiO3可溶于水,其水溶液俗名水玻璃,有粘性。
(2)在高温下与碳酸盐的反应
SiO2+Na2CO3=== CO2 +Na2SiO3
高温
SiO2+CaCO3===CO2 +CaSiO3
高温
玻璃的主要成分SiO2、Na2SiO3、CaSiO3
盛放碱性溶液时用橡胶塞。
氢
氟
酸
}制取玻璃原理
(3)特性:不与其他酸反应,只与氢氟酸反应
SiO2 + 4HF == SiF4 + 2H2O
(玻璃花雕刻)
不能玻璃瓶用保存氢氟酸
由于SiO2既可与碱反应,也可与氢氟酸反应,所以SiO2为两性氧化物,这种说法是否正确
×
SiO2能与HF反应为特例,其产物SiF4不是盐,所以SiO2只是酸性氧化物
(4)弱的氧化性
SiO2+2C == Si+2CO ↑
高温
(制硅单质的原理)
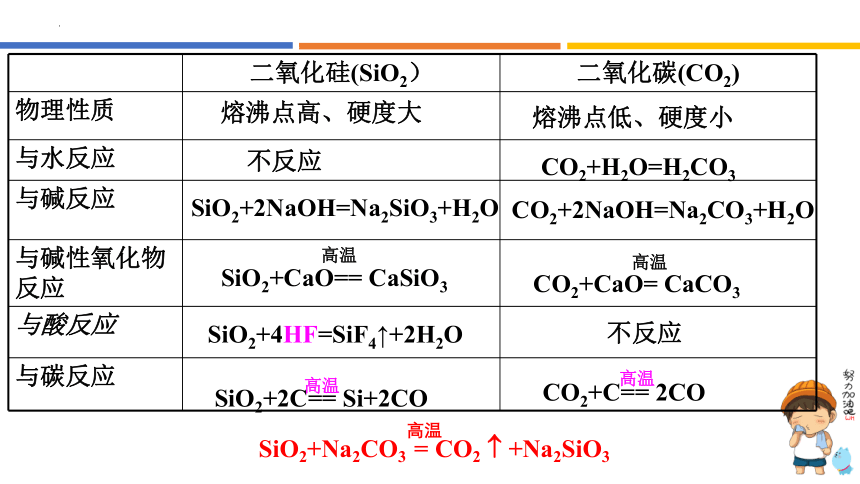
二氧化硅(SiO2) 二氧化碳(CO2)
物理性质
与水反应
与碱反应
与碱性氧化物反应
与酸反应
与碳反应
高温
熔沸点高、硬度大
熔沸点低、硬度小
不反应
CO2+H2O=H2CO3
SiO2+2NaOH=Na2SiO3+H2O
CO2+2NaOH=Na2CO3+H2O
SiO2+CaO== CaSiO3
CO2+CaO= CaCO3
高温
SiO2+4HF=SiF4↑+2H2O
不反应
SiO2+2C== Si+2CO
高温
CO2+C== 2CO
高温
SiO2+Na2CO3 = CO2 +Na2SiO3
高温
课堂·习题
1.地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是( )
A.熔点很高
B.与水反应生成对应的酸
C.坚硬
D.可与烧碱反应生成盐
B
【思考】二氧化硅不溶于水,不跟水反应,如何来制备H2SiO3
实验4-1
现 象
结 论
化学方程式
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3的水溶液呈碱性,
硅酸难溶于水
滴入酚酞溶液呈红色,
滴入盐酸有白色胶状沉淀产生
通入CO2呢?
强酸
弱酸
可溶性硅酸盐与其它酸反应制得的。
Na2SiO3+CO2+H2O = Na2CO3+H2SiO3↓
制取原理:较强酸制较弱酸。
1.物理性质
硅酸是一种 溶于水的 胶状物。
2.化学性质
白色
不
H2SiO3===H2O+SiO2
加热
3.用途
硅酸干凝胶 “硅胶”
干燥剂
催化剂的载体
硅酸凝胶
H2SiO3
二、硅酸(H2SiO3)
(1)弱酸性:
(2)不稳定性:
酸性太弱(不能使石蕊试液变红)
干燥剂的分类
干燥剂
酸性干燥剂:
浓硫酸、硅酸、P2O5
碱性干燥剂:
碱石灰、生石灰
中性干燥剂:
CaCl2
(不能干燥碱性气体)
(不能干燥酸性气体)
(不能干燥氨气、乙醇)
知识拓展
(一)二氧化硅
物理性质:
化学性质:
用途:
(二)硅酸
制备:
物理性质:
化学性质:
用途:
一、二氧化硅(SiO2)和硅酸(H2SiO3)
光导纤维,石英玻璃等
酸性氧化物 //
不溶于水的白色胶状沉淀
熔点、硬度、不溶于水
酸性、不稳定性
硅酸盐 + 酸
干燥剂和催化剂载体等
特性与HF
知识总结 能力提升
例1.下列说法正确的是( )
A.硅酸不溶于水,因此不与NaOH溶液反应
B.根据SiO2+CaCO3 CaSiO3+CO2↑的反应,可推知硅酸酸性比碳酸酸性强
C.CO2气体通入硅酸钠溶液中可以制得硅酸
D.SiO2溶于水显酸性
C
课堂·习题
例2. 下列关于硅酸的说法正确的是 ( )
A.硅酸可以通过SiO2和水的化合反应直接制得
B.用反应Na2SiO3+2HCl===2NaCl+H2SiO3↓制取硅酸是利用了可溶性酸制难溶性酸的性质
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.硅胶可用作袋装食品的干燥剂
D
课堂·习题
例3、为确认盐酸、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
(1)锥形瓶中装某可溶性正盐溶液,
分液漏斗所盛试剂应为______。
(2)装置B所盛的试剂是
___________________,
其作用是________________________。
(3)装置C所盛试剂是_____________,C中反应的离子方程式是______________________________。
盐酸
饱和NaHCO3溶液
除去CO2中的HCl气体
Na2SiO3溶液
课堂·习题
链接·高考
例4.将过量的CO2分别通入① CaCl2溶液;② Na2SiO3溶液;③ Ca(OH)2溶液;④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④ B.②④
C.①②③ D.①②④
B
1.硅酸盐是由硅、氧和金属组成的化合物的总称。
特点:结构复杂,除K2SiO3 、 Na2SiO3 、 ( NH4 )2SiO3铵以外均难溶于水,化学性质很稳定。
高岭石: Al2Si2O5(OH)4
石棉:CaMg3Si4O12
沸石:Na2Al2Si3O8(OH)4
云母:K2Al6Si6O20(OH)4
三、硅酸盐
高岭石{Al2Si2O5(OH)4}:
石棉{CaMg3Si4O12}:
云母{KAl3Si3O10(OH)2}:
改写成氧化物的形式
活泼金属氧化物 → 较活泼金属氧化物 → 二氧化硅 → 水
Al2O3 · 2SiO2 ·2H2O
CaO· 3MgO· 4SiO2
K2O· 3Al2O3 · 6SiO2· 2H2O
练习1:改写成氧化物形式
玻璃{Na2CaSi6O14}:
黏土{Al2Si2O5(OH)4}:
Na2O · CaO· 6SiO2
Al2O3 · 2SiO2· 2H2O
1.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x,y的数值分别是( )
A. 7,2 B. 5,4
C. 6,3 D. 3,6
B
硅酸钠水溶液俗称为水玻璃,是无色黏稠状液体。
硅酸钠可用作肥皂填料、用水玻璃浸泡过的木材或织物可防火、防腐蚀。
水玻璃可保存于玻璃瓶中,但不能使用玻璃塞,要用橡胶塞。
2.硅酸钠(Na2SiO3)
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓
硅酸钠溶液在空气中易变质,反应的化学方程式为:
硅酸盐工业
1 玻璃
原料:石灰石、纯碱、石英砂
Na2SiO3 、CaSiO3 、SiO2
原理:
CaCO3+SiO2 = CaSiO3 + CO2↑
高温
Na2CO3+SiO2 = Na2SiO3 + CO2 ↑
高温
主要成份
辨析:普通玻璃、石英玻璃
普通玻璃: Na2O·CaO·6SiO2
2 陶瓷
以黏土为主要原料,经高温烧结而成
3 水泥
原料:黏土、石灰石、适量石膏等
性能用途:水硬性、建筑材料、钢筋混凝土
万丈高楼平地起,穿针引线是水泥。
晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料。
四、硅单质
单质硅有晶体和无定形两种。晶体硅是带有金属光泽的灰黑色固体,熔点高,硬度大,有脆性,在常温下化学性质不活泼。
Si+2F2=SiF4
Si+4HF=SiF4 +2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2 ↑
1:常温下,只和氢氟酸、氟气、强碱反应。
2:加热情况下,硅也能跟一些非金属反应。高温下化学性质活泼
Si+2Cl2 = SiCl4
Si+O2 = SiO2
Si+ C = SiC
2Mg+ Si = Mg2Si
高温
高温
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
Ⅰ.高温下用碳还原二氧化硅制得粗硅;
Ⅱ.粗硅与干燥的HCl气体反应制得SiHCl3:
Si+3HCl==SiHCl3+H2;
Ⅲ.SiHCl3与过量H2在1000~1100 ℃反应制得纯硅。
300℃
3:硅的工业制法
C
高温
二
氧
化
硅
粗
硅
粗
三
氯
化
硅
纯
三
氯
化
硅
高
纯
硅
HCl
高温
H2
高温
精
馏
SiCl4 + 2H2 = Si + 4HCl
高温
SiO2 + 2C = Si + 2CO↑
高温
硅可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制成太阳能电池,可制成有良好导磁性、耐酸性的合金。在美国旧金山,有个最大的高科技工业园区,称之为“硅谷”。
4.硅的用途
硅太阳能电池
大规模集成电路
CPU、芯片
制备纯硅的主要步骤如下:
①高温下 用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体在300℃反应制得SiHCl3:
Si+3HCl = SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84. 7℃),提纯SiHCl3采用的方法为: 。
SiO2 + 2C = Si + 2CO
高温
分馏
能力提升
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是______ ,装置C中的烧瓶需要加热,其目的是: ___________________
②反应一段时间后,装置D中观察到的现象是______
装置D不能采用普通玻璃管的原因是 ______
装置D中发生反应的化学方程式为。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 ______
浓硫酸
使滴入烧瓶中的 SiHCI3 气化
有固体物质生成
在反应温度下,普通玻璃会软化
排尽装置中的空气
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水
c.NaOH溶液 d.KSCN溶液
e.Na2SO3溶液
bd
1不能通过化合反应来制取的物质是 ( )
A. SiCl4
B. H2SiO3
C. Na2O2
D. CaSiO3
B
2:下列物品或设备:
①水泥路面 ②门窗玻璃
③水晶镜片 ④石英钟表
⑤玛瑙手镯 ⑥硅太阳能电池
⑦光导纤维 ⑧计算机芯片
所用材料为SiO2或要用到SiO2的是( )
A.⑥⑧ B.①②⑦⑧
C.①②③④⑤⑦ D.全部
C
3.下列离子方程式书写正确的是( )
A.往澄清石灰水中通入过量的二氧化碳:
Ca2++2OH-+CO2=CaCO3↓+H2O
B.往硅酸钠溶液中通入足量二氧化碳:
C.小苏打溶液中加足量澄清石灰水:
2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.硅酸与烧碱溶液中和:
H2SiO3+2OH-=SiO32-+2H2O
D
SiO32- + H2O + CO2 = CO3 2-+ H2SiO3↓
4、有一粗铝内含Fe和Si,取等质量样品两份,分别投入足量的稀盐酸和稀强碱中,放出等物质的量的气体,则Fe和Si的关系为( )
A.物质的量比为1:1
B.物质的量比为2:1
C.物质的量比为1:2
D.物质的量比为2:3
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
