专题7 第2单元 课题1 氨气 课件(共30张PPT) 2022-2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题7 第2单元 课题1 氨气 课件(共30张PPT) 2022-2023学年下学期高一化学苏教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 473.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 11:11:32 | ||
图片预览











文档简介
(共30张PPT)
专题7
氮与社会可持续发展
第二单元 重要的含氮化工原料
课题1 氨气
学 习 目 标
1. 能运用化学变化的规律认识氨气的主要性质,如氨气的溶解性、氨水的碱性、氨气能与酸反应以及氨气的还原性。
2. 认识氨气在生产中的应用。
活 动 方 案
1. 阅读教材,了解氨气的物理性质,实验室制取氨气时应怎样收集?
【答案】 因为氨气密度比空气小,易溶于水,所以实验室制取氨气时只能采用向下排空气法收集。
2. 氨气为什么极易液化?工业上为什么常用液氨作制冷剂?
【答案】 由于氨分子间容易形成氢键,所以氨气容易液化,液化时会放出大量的热;液氨汽化时要吸收大量的热,使周围的环境温度急剧下降,所以液氨在工业上常用作制冷剂。
活动一:了解氨气的物理性质及物理性质的应用
1. 观察下列实验,填写实验报告。
活动二:探究氨气的性质
【实验1】 在干燥的烧瓶内充满氨气,塞上
带有玻璃管和胶头滴管(预先吸入少量水)的胶
塞。按右图组装实验装置。打开橡皮管上的止水
夹,挤压胶头滴管,观察现象。
【实验2】 在一支洁净的试管中滴加几滴浓氨水,将湿润的红色石蕊试纸(或pH试纸)粘在玻璃棒一端靠近试管口,观察试纸颜色的变化情况。
【实验3】 在一只洁净的烧杯中放两个棉花球,分别在两个棉花球上滴几滴浓氨水和浓盐酸,用表面皿盖住烧杯口,观察现象。
实验序号 实验现象 主要结论
实验1
实验2
实验3
烧瓶内形成红色喷泉
湿润的红色石蕊试纸变蓝
表面皿下有白烟生成
氨气极易溶于水,溶于水的氨气与水反应生成NH3·H2O,溶液显碱性
氨气的水溶液显碱性
氨水挥发出的氨气与盐酸挥发出的氯化氢反应生成氯化铵固体,所以产生白烟
2. 阅读教材,了解氨气溶于水后与水的反应,讨论喷泉实验中形成红色喷泉的原因和湿润的红色石蕊试纸变蓝的原因。
【答案】 氨气极易溶于水,常温常压下,1 体积水大约可溶解700体积氨气。氨气溶于水形成的溶液为氨水。氨水中的氨分子大部分与水结合成一水合氨(NH3·H2O),一水合氨可部分电离出铵根离子和氢氧根离子,所以氨水显弱碱性。
3. 讨论新制氨水中主要存在哪些微粒?
【答案】 分子:NH3、H2O、NH3·H2O;离子:NH、OH-、H+(H+的量极少)。
4. 阅读教材,了解一般为什么不能直接用氨水作肥料?
【答案】 用氨水作氮肥,成本较低,但氨水易挥发,直接施用,肥效低,浓度较大时还会烧伤作物茎叶,必须加大量的水稀释。氨水对眼睛、呼吸道等有强烈的刺激作用,储存、运输和施用的要求较高。
5. 氨与酸能发生反应,如与盐酸、硫酸均可反应生成铵盐:
NH3+HCl===NH4Cl
2NH3+H2SO4===(NH4)2SO4
生成的铵盐即为铵态氮肥。阅读教材,了解铵态氮肥的优点。
【答案】 铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易被农作物吸收。因此,固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
1. 阅读教材,从氨分子中氮元素化合价角度,讨论氨气为什么具有还原性。写出氨催化氧化反应的化学方程式。以及后续怎样生产硝酸?
【答案】 NH3是氮的最低价(-3价)化合物,在一定条件下与氧化剂作用时,NH3中的N可以失去电子,化合价升高,NH3表现出还原性,作还原剂。在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在下,氨与氧气反应生成一氧化氮和水,并放热。这一反应叫作氨的催化氧化,是工业制备硝酸的重要反应之一。
活动三:了解氨气的还原性
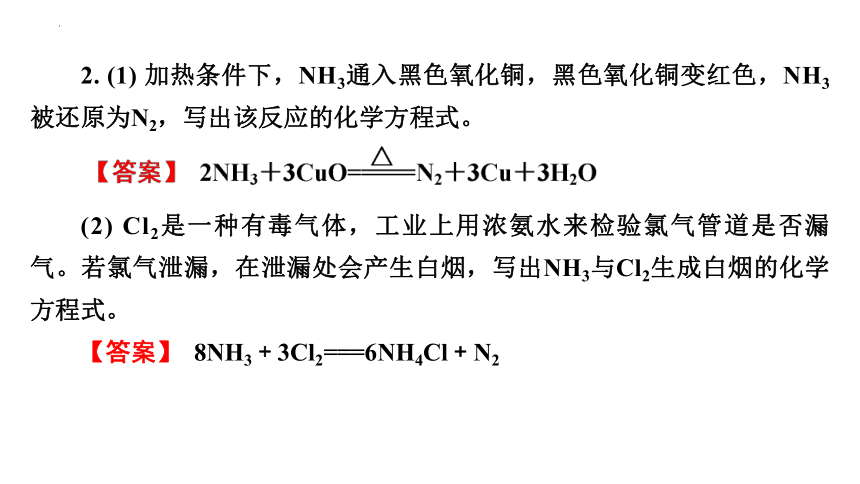
2. (1) 加热条件下,NH3通入黑色氧化铜,黑色氧化铜变红色,NH3被还原为N2,写出该反应的化学方程式。
(2) Cl2是一种有毒气体,工业上用浓氨水来检验氯气管道是否漏气。若氯气泄漏,在泄漏处会产生白烟,写出NH3与Cl2生成白烟的化学方程式。
【答案】 8NH3+3Cl2===6NH4Cl+N2
课 堂 反 馈
2
4
5
1
3
7
9
6
8
1. 下列有关氨的叙述正确的是( )
①氨气极易溶于水,可以用来做喷泉实验 ②可用湿润的蓝色石蕊试纸检验氨气 ③可用向上排空气法收集氨气 ④氨易液化,工业上可用氨作制冷剂 ⑤实验室制取的氨气可用碱石灰干燥
A. ①②③ B. ②③④
C. ③④⑤ D. ①④⑤
2
4
5
1
3
7
9
6
8
【解析】 氨气极易溶于水,使容器内压强减小,可以用来做喷泉实验,①正确;氨气的水溶液呈碱性,可用湿润的红色石蕊试纸检验氨气,②错误;氨气的密度比空气的小,可用向下排空气法收集氨气,③错误;氨易液化,液氨汽化时吸热,工业上可用氨作制冷剂,④正确;氨气是碱性气体,实验室制取的氨气可用碱石灰干燥,⑤正确。
【答案】 D
2
4
5
1
3
7
9
6
8
2
4
5
1
3
7
9
6
8
【答案】 D
2
4
5
3
7
9
6
8
3. 下列现象不能用于检验NH3的是( )
A. 气体遇浓盐酸产生白烟
B. 气体使湿润的蓝色石蕊试纸变红
C. 气体通入酚酞溶液中,溶液变红
D. 气体使湿润的红色石蕊试纸变蓝
1
2
4
5
3
7
9
6
8
1
【解析】 氨气遇氯化氢气体产生氯化铵固体小颗粒,出现白烟现象,A正确;氨气不能使湿润的蓝色石蕊试纸变红,B错误;氨气极易溶于水产生弱碱一水合氨,一水合氨电离产生氢氧根离子和铵根离子,氢氧根离子能使酚酞溶液变红,C正确;氨气和水反应产生NH3·H2O,NH3·H2O电离产生氢氧根离子,从而使湿润的红色石蕊试纸变蓝,D正确。
【答案】 B
2
4
5
3
7
9
6
8
4. 下列叙述不正确的是( )
A. NH3的喷泉实验说明氨气极易溶于水
B. NO和NH3均可用排空气法收集
C. NH3中的N元素只具有还原性
D. NH3遇到挥发性强酸能产生白烟
1
【解析】 NH3的喷泉实验说明氨气极易溶于水,A正确;NO能被氧气氧化生成NO2,所以不能用排空气法收集,NH3可用向下排空气法收集,B错误;NH3中的氮元素为-3价,为氮元素的最低价,只具有还原性,C正确;NH3遇到挥发性强酸能产生白烟,如与浓盐酸相遇产生氯化铵固体小颗粒,D正确。
【答案】 B
2
4
5
3
7
9
6
8
1
【解析】 氮催化氧化生成NO,C错误。
【答案】 C
2
4
5
3
7
9
6
8
6. 下图是检验NH3性质的两个实验,下列说法正确的是( )
1
A. 两个实验均体现了NH3是碱性气体
B. 两个实验均体现了NH3易挥发
C. 两个实验均体现了NH3易溶于水
D. 两个实验均体现了NH3是还原性气体
2
4
5
3
7
9
6
8
1
【解析】 实验甲中NH3极易溶于水,产生红色喷泉,体现了氨的水溶液呈碱性;实验乙中蘸有浓盐酸和浓氨水的玻璃棒靠近产生白烟,其原因是氨水挥发出的NH3与浓盐酸挥发出的HCl反应生成NH4Cl固体,说明NH3是碱性气体。
【答案】 A
2
4
5
3
7
9
6
8
7. 浓氨水可用于检验氯气管道是否漏气,其反应为3Cl2+8NH3=== N2+6NH4Cl。下列说法错误的是( )
A. 该反应一定伴随有能量变化
B. 该反应在理论上可以设计成原电池
C. 该反应同时有离子键和共价键的断裂与形成
D. 将浓氨水置于氯气管道附近,若出现白烟,说明氯气管道漏气
1
2
4
5
3
7
9
6
8
1
【解析】 反应过程中存在旧键的断裂和新键的形成,反应过程中一定伴随有能量变化,A正确;该反应是常温下可以自发进行的氧化还原反应,理论上可以设计成原电池,B正确;反应过程中,有共价键的断裂,无离子键的断裂,有离子键和共价键的形成,C错误;将浓氨水置于氯气管道附近,若出现白烟,说明有NH4Cl生成,则氯气管道漏气,D正确。
【答案】 C
2
4
5
3
7
9
6
8
8. 如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。下列各组试剂不满足题意的是( )
1
选项 a(干燥气体) b(液体)
A Cl2 饱和NaOH溶液
B SO2 饱和 NaOH溶液
C NO2 水
D NH3 1 mol·L-1盐酸
2
4
5
3
7
9
6
8
1
【解析】 Cl2与饱和NaOH溶液反应生成氯化钠、次氯酸钠,Cl2能完全溶于饱和氢氧化钠溶液,所以能形成喷泉实验,最终液体几乎充满烧瓶,A满足题意;SO2能完全溶于氢氧化钠溶液,所以能形成喷泉实验,最终液体几乎充满烧瓶,B满足题意;二氧化氮和水反应生成硝酸和NO,NO难溶于水,最终液体不能几乎充满烧瓶,C不满足题意;NH3极易溶于水,也能与盐酸反应,所以能形成喷泉实验,最终液体几乎充满烧瓶,D满足题意。
【答案】 C
2
4
5
3
7
9
6
8
9. 某化学兴趣小组利用下列图示装置探究氨的性质。
1
(1) ①中湿润的红色石蕊试纸________,化学方程式为___________ _________________。
(2) 向②中滴入浓盐酸,现象为__________________,化学方程式为_________________________。
变蓝
NH3+H2O
===NH3·H2O
产生白烟
NH3+HCl===NH4Cl
2
4
5
3
7
9
6
8
(3) 将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催
化氧化的化学方程式:____________________________________,该反应________(填“吸热”或“放热”),锥形瓶中出现白烟,该物质的化学式为____________。
1
放热
NH4NO3
谢谢观看
Thank you for watching
专题7
氮与社会可持续发展
第二单元 重要的含氮化工原料
课题1 氨气
学 习 目 标
1. 能运用化学变化的规律认识氨气的主要性质,如氨气的溶解性、氨水的碱性、氨气能与酸反应以及氨气的还原性。
2. 认识氨气在生产中的应用。
活 动 方 案
1. 阅读教材,了解氨气的物理性质,实验室制取氨气时应怎样收集?
【答案】 因为氨气密度比空气小,易溶于水,所以实验室制取氨气时只能采用向下排空气法收集。
2. 氨气为什么极易液化?工业上为什么常用液氨作制冷剂?
【答案】 由于氨分子间容易形成氢键,所以氨气容易液化,液化时会放出大量的热;液氨汽化时要吸收大量的热,使周围的环境温度急剧下降,所以液氨在工业上常用作制冷剂。
活动一:了解氨气的物理性质及物理性质的应用
1. 观察下列实验,填写实验报告。
活动二:探究氨气的性质
【实验1】 在干燥的烧瓶内充满氨气,塞上
带有玻璃管和胶头滴管(预先吸入少量水)的胶
塞。按右图组装实验装置。打开橡皮管上的止水
夹,挤压胶头滴管,观察现象。
【实验2】 在一支洁净的试管中滴加几滴浓氨水,将湿润的红色石蕊试纸(或pH试纸)粘在玻璃棒一端靠近试管口,观察试纸颜色的变化情况。
【实验3】 在一只洁净的烧杯中放两个棉花球,分别在两个棉花球上滴几滴浓氨水和浓盐酸,用表面皿盖住烧杯口,观察现象。
实验序号 实验现象 主要结论
实验1
实验2
实验3
烧瓶内形成红色喷泉
湿润的红色石蕊试纸变蓝
表面皿下有白烟生成
氨气极易溶于水,溶于水的氨气与水反应生成NH3·H2O,溶液显碱性
氨气的水溶液显碱性
氨水挥发出的氨气与盐酸挥发出的氯化氢反应生成氯化铵固体,所以产生白烟
2. 阅读教材,了解氨气溶于水后与水的反应,讨论喷泉实验中形成红色喷泉的原因和湿润的红色石蕊试纸变蓝的原因。
【答案】 氨气极易溶于水,常温常压下,1 体积水大约可溶解700体积氨气。氨气溶于水形成的溶液为氨水。氨水中的氨分子大部分与水结合成一水合氨(NH3·H2O),一水合氨可部分电离出铵根离子和氢氧根离子,所以氨水显弱碱性。
3. 讨论新制氨水中主要存在哪些微粒?
【答案】 分子:NH3、H2O、NH3·H2O;离子:NH、OH-、H+(H+的量极少)。
4. 阅读教材,了解一般为什么不能直接用氨水作肥料?
【答案】 用氨水作氮肥,成本较低,但氨水易挥发,直接施用,肥效低,浓度较大时还会烧伤作物茎叶,必须加大量的水稀释。氨水对眼睛、呼吸道等有强烈的刺激作用,储存、运输和施用的要求较高。
5. 氨与酸能发生反应,如与盐酸、硫酸均可反应生成铵盐:
NH3+HCl===NH4Cl
2NH3+H2SO4===(NH4)2SO4
生成的铵盐即为铵态氮肥。阅读教材,了解铵态氮肥的优点。
【答案】 铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易被农作物吸收。因此,固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
1. 阅读教材,从氨分子中氮元素化合价角度,讨论氨气为什么具有还原性。写出氨催化氧化反应的化学方程式。以及后续怎样生产硝酸?
【答案】 NH3是氮的最低价(-3价)化合物,在一定条件下与氧化剂作用时,NH3中的N可以失去电子,化合价升高,NH3表现出还原性,作还原剂。在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在下,氨与氧气反应生成一氧化氮和水,并放热。这一反应叫作氨的催化氧化,是工业制备硝酸的重要反应之一。
活动三:了解氨气的还原性
2. (1) 加热条件下,NH3通入黑色氧化铜,黑色氧化铜变红色,NH3被还原为N2,写出该反应的化学方程式。
(2) Cl2是一种有毒气体,工业上用浓氨水来检验氯气管道是否漏气。若氯气泄漏,在泄漏处会产生白烟,写出NH3与Cl2生成白烟的化学方程式。
【答案】 8NH3+3Cl2===6NH4Cl+N2
课 堂 反 馈
2
4
5
1
3
7
9
6
8
1. 下列有关氨的叙述正确的是( )
①氨气极易溶于水,可以用来做喷泉实验 ②可用湿润的蓝色石蕊试纸检验氨气 ③可用向上排空气法收集氨气 ④氨易液化,工业上可用氨作制冷剂 ⑤实验室制取的氨气可用碱石灰干燥
A. ①②③ B. ②③④
C. ③④⑤ D. ①④⑤
2
4
5
1
3
7
9
6
8
【解析】 氨气极易溶于水,使容器内压强减小,可以用来做喷泉实验,①正确;氨气的水溶液呈碱性,可用湿润的红色石蕊试纸检验氨气,②错误;氨气的密度比空气的小,可用向下排空气法收集氨气,③错误;氨易液化,液氨汽化时吸热,工业上可用氨作制冷剂,④正确;氨气是碱性气体,实验室制取的氨气可用碱石灰干燥,⑤正确。
【答案】 D
2
4
5
1
3
7
9
6
8
2
4
5
1
3
7
9
6
8
【答案】 D
2
4
5
3
7
9
6
8
3. 下列现象不能用于检验NH3的是( )
A. 气体遇浓盐酸产生白烟
B. 气体使湿润的蓝色石蕊试纸变红
C. 气体通入酚酞溶液中,溶液变红
D. 气体使湿润的红色石蕊试纸变蓝
1
2
4
5
3
7
9
6
8
1
【解析】 氨气遇氯化氢气体产生氯化铵固体小颗粒,出现白烟现象,A正确;氨气不能使湿润的蓝色石蕊试纸变红,B错误;氨气极易溶于水产生弱碱一水合氨,一水合氨电离产生氢氧根离子和铵根离子,氢氧根离子能使酚酞溶液变红,C正确;氨气和水反应产生NH3·H2O,NH3·H2O电离产生氢氧根离子,从而使湿润的红色石蕊试纸变蓝,D正确。
【答案】 B
2
4
5
3
7
9
6
8
4. 下列叙述不正确的是( )
A. NH3的喷泉实验说明氨气极易溶于水
B. NO和NH3均可用排空气法收集
C. NH3中的N元素只具有还原性
D. NH3遇到挥发性强酸能产生白烟
1
【解析】 NH3的喷泉实验说明氨气极易溶于水,A正确;NO能被氧气氧化生成NO2,所以不能用排空气法收集,NH3可用向下排空气法收集,B错误;NH3中的氮元素为-3价,为氮元素的最低价,只具有还原性,C正确;NH3遇到挥发性强酸能产生白烟,如与浓盐酸相遇产生氯化铵固体小颗粒,D正确。
【答案】 B
2
4
5
3
7
9
6
8
1
【解析】 氮催化氧化生成NO,C错误。
【答案】 C
2
4
5
3
7
9
6
8
6. 下图是检验NH3性质的两个实验,下列说法正确的是( )
1
A. 两个实验均体现了NH3是碱性气体
B. 两个实验均体现了NH3易挥发
C. 两个实验均体现了NH3易溶于水
D. 两个实验均体现了NH3是还原性气体
2
4
5
3
7
9
6
8
1
【解析】 实验甲中NH3极易溶于水,产生红色喷泉,体现了氨的水溶液呈碱性;实验乙中蘸有浓盐酸和浓氨水的玻璃棒靠近产生白烟,其原因是氨水挥发出的NH3与浓盐酸挥发出的HCl反应生成NH4Cl固体,说明NH3是碱性气体。
【答案】 A
2
4
5
3
7
9
6
8
7. 浓氨水可用于检验氯气管道是否漏气,其反应为3Cl2+8NH3=== N2+6NH4Cl。下列说法错误的是( )
A. 该反应一定伴随有能量变化
B. 该反应在理论上可以设计成原电池
C. 该反应同时有离子键和共价键的断裂与形成
D. 将浓氨水置于氯气管道附近,若出现白烟,说明氯气管道漏气
1
2
4
5
3
7
9
6
8
1
【解析】 反应过程中存在旧键的断裂和新键的形成,反应过程中一定伴随有能量变化,A正确;该反应是常温下可以自发进行的氧化还原反应,理论上可以设计成原电池,B正确;反应过程中,有共价键的断裂,无离子键的断裂,有离子键和共价键的形成,C错误;将浓氨水置于氯气管道附近,若出现白烟,说明有NH4Cl生成,则氯气管道漏气,D正确。
【答案】 C
2
4
5
3
7
9
6
8
8. 如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。下列各组试剂不满足题意的是( )
1
选项 a(干燥气体) b(液体)
A Cl2 饱和NaOH溶液
B SO2 饱和 NaOH溶液
C NO2 水
D NH3 1 mol·L-1盐酸
2
4
5
3
7
9
6
8
1
【解析】 Cl2与饱和NaOH溶液反应生成氯化钠、次氯酸钠,Cl2能完全溶于饱和氢氧化钠溶液,所以能形成喷泉实验,最终液体几乎充满烧瓶,A满足题意;SO2能完全溶于氢氧化钠溶液,所以能形成喷泉实验,最终液体几乎充满烧瓶,B满足题意;二氧化氮和水反应生成硝酸和NO,NO难溶于水,最终液体不能几乎充满烧瓶,C不满足题意;NH3极易溶于水,也能与盐酸反应,所以能形成喷泉实验,最终液体几乎充满烧瓶,D满足题意。
【答案】 C
2
4
5
3
7
9
6
8
9. 某化学兴趣小组利用下列图示装置探究氨的性质。
1
(1) ①中湿润的红色石蕊试纸________,化学方程式为___________ _________________。
(2) 向②中滴入浓盐酸,现象为__________________,化学方程式为_________________________。
变蓝
NH3+H2O
===NH3·H2O
产生白烟
NH3+HCl===NH4Cl
2
4
5
3
7
9
6
8
(3) 将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催
化氧化的化学方程式:____________________________________,该反应________(填“吸热”或“放热”),锥形瓶中出现白烟,该物质的化学式为____________。
1
放热
NH4NO3
谢谢观看
Thank you for watching
