专题6 第2单元 化学反应中的热 课件(共46张PPT) 2022-2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题6 第2单元 化学反应中的热 课件(共46张PPT) 2022-2023学年下学期高一化学苏教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 725.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 13:59:27 | ||
图片预览










文档简介
(共46张PPT)
专题6
化学反应与能量变化
第二单元 化学反应中的热
学 习 目 标
1. 认识物质具有能量,认识吸热反应与放热反应。
2. 了解化学反应体系能量改变与化学键的断裂和形成有关。
3. 了解焓变与反应热的关系,能书写热化学方程式。
4. 能从微观的角度解释宏观化学现象,知道化学键的断裂和形成是化学反应中能量变化的主要原因,理解能量守恒定律,初步建立起科学的能量观。
5. 能列举提高燃料燃烧效率的方法,合理利用化石燃料,减少燃料对环境的污染,说明开发高能清洁燃料的重要性。
活 动 方 案
1. 阅读教材,了解化学反应中的能量变化情况。
【答案】 化学反应都伴随着能量变化,反应物转化为生成物的同时,必然发生能量变化,反应中化学能可以转化为热能、光能、电能等,热能、光能、电能等也可以转化为化学能,如制水煤气、植物的光合作用、水的电解等。
活动一:探究放热反应、吸热反应
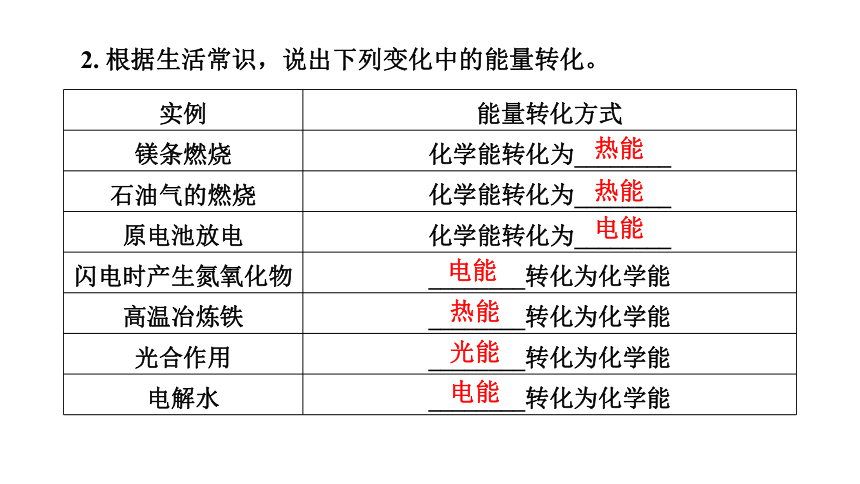
2. 根据生活常识,说出下列变化中的能量转化。
实例 能量转化方式
镁条燃烧 化学能转化为________
石油气的燃烧 化学能转化为________
原电池放电 化学能转化为________
闪电时产生氮氧化物 ________转化为化学能
高温冶炼铁 ________转化为化学能
光合作用 ________转化为化学能
电解水 ________转化为化学能
热能
热能
电能
电能
热能
光能
电能
3. 完成下列实验,记录实验现象,分析得出实验结论。
【实验1】 向一支试管中放入用砂纸打磨光亮的镁条,加入 5 mL 2 mol·L-1盐酸,用手触摸试管外壁,感受试管外壁的温度变化。
【实验2】 向100 mL烧杯中加入约20 g经研磨的八水合氢氧化钡晶体[Ba(OH)2·8H2O],然后加入约10 g氯化铵晶体,用玻璃棒搅拌,使之充分混合。在烧杯下垫一块沾有水的玻璃片,一段时间后提起烧杯,观察实验现象。用手触摸烧杯外壁,感受温度变化。
实验 现象 结论
实验1 ____________ 反应________
实验2 ______________________________________ 反应________
外壁发热
放热
外壁冰冷,玻璃片与烧杯间结冰黏在一起
吸热
【思考】
(1) 浓硫酸溶于水、水蒸气液化时均向外释放热量,它们属于放热反应吗?为什么?
【答案】 不属于。吸热反应、放热反应均是指化学反应,而浓硫酸溶于水、水蒸气液化过程中均无新物质生成,都不属于化学变化,因而都不属于放热反应。
(2) 需要加热才能进行的反应一定是吸热反应吗?常温下能进行的反应一定是放热反应吗?试举例说明。
【答案】 需要加热才能进行的反应不一定是吸热反应,如煤炭的燃烧是放热反应,但需要加热才能引燃;常温下能进行的反应不一定是放热反应,如常温下氢氧化钡晶体与NH4Cl晶体的反应是吸热反应。
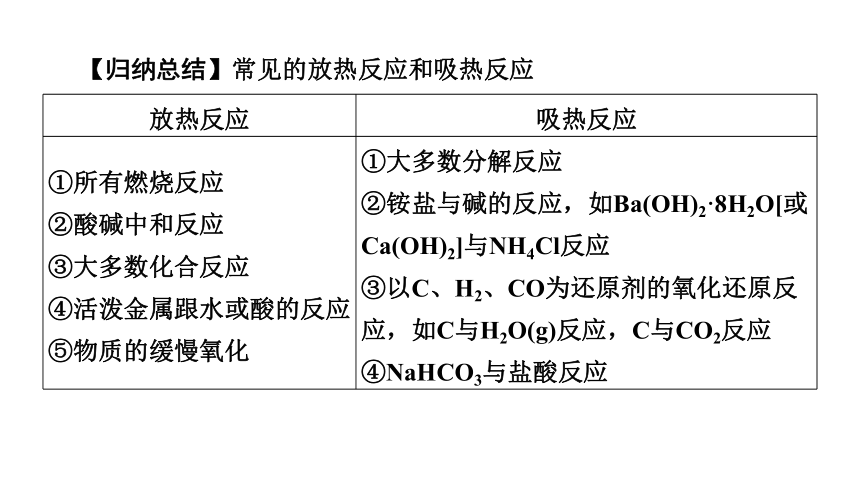
【归纳总结】常见的放热反应和吸热反应
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O[或Ca(OH)2]与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸反应
1. 阅读教材,如何定量表示一个特定反应放出或吸收的热量?热化学方程式与普通方程式有什么不同?反应(1)(2)分别表示的意义是什么?
CaCO3(s)===CaO(s)+CO2(g) ΔH=178.2 kJ·mol-1 (1)
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1 (2)
活动二:探究热化学方程式的书写与意义
【答案】 用热化学方程式可以定量表示一个特定反应放出或吸收的热量。热化学方程式与普通方程式有以下差异:书写热化学方程式时,反应物、生成物的聚集状态要标注,气体—g,液体—l,固体—s,水溶液—aq;热化学方程式中各种物质化学式前面的化学计量数表示该物质的物质的量,不是物质的分子数或原子数,所以热化学方程式的化学计量数可以是整数,也可以是分数;热化学方程式中用ΔH标注了反应中的能量变化。
反应(1)中,1 mol CaCO3完全分解生成1 mol CaO和1 mol CO2气体,需要吸收178.2 kJ的热量;反应(2)中,1 mol C与1 mol O2完全反应生成1 mol CO2气体,可放出393.6 kJ的热量。
2. 讨论热化学方程式中的ΔH的含义,ΔH的正、负表示什么意义?与哪些因素有关,与化学计量数有什么关系?
【答案】 热化学方程式中用ΔH表示反应吸收或放出的热量,单位kJ·mol-1。ΔH小于0的反应是放热反应,ΔH大于0的反应是吸热反应。焓变与对应的化学方程式有关,与反应物、生成物的聚集状态有关,因此,书写热化学方程式时必须注明物质的状态,才能体现出热化学方程式的意义。热化学方程式中的ΔH与反应物的物质的量有关,前面的化学计量数与ΔH相对应,如果化学计量数加倍,那么ΔH也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
CH4>H2>CO
阅读教材,学习利用键能估算化学反应中的能量变化。
断开气态物质中1 mol某种共价键生成气态原子需要吸收的能量,就是该共价键的键能。共价键的键能越大,该共价键越牢固。部分共价键的键能如下表所示:
活动三:化学反应中的能量变化与化学键的关系
共价键 键能/(kJ·mol-1) 共价键 键能/(kJ·mol-1)
H—H 436.4 C—C 347.7
Cl—Cl 242.7 H—Cl 431.8
H—O 462.8 N≡N 941.7
1. 化学反应中需要断开反应物中的化学键,并形成生成物中新的化学键。断开化学键需要吸收能量,形成化学键需要放出能量。从化学键角度分析,什么情况下反应放热?什么情况下反应吸热?
【答案】 断开化学键所吸收的能量小于形成化学键所放出的能量,则该反应过程中放出能量,即为放热反应;断开化学键所吸收的能量大于形成化学键所放出的能量,则该反应过程中吸收能量,即为吸热反应。
共价键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436 243 431
反应中破坏或形成共价键的物质的量/mol
反应中破坏或形成共价键的总能量/kJ
反应热(标明吸热或者放热及其数值) 1
1
2
679
862
放热183 kJ
3. 已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。
根据图示完成下列各题。
(1) 该反应中反应物的总能量________(填“高于”或“低于”)生成物的总能量。
(2) 1 mol NO(g)分子中的化学键断裂时要吸收__________kJ能量。
(3) 断裂1 mol N≡N吸收的能量值x为__________。
低于
632
946
1. 分析下图化学反应中反应物、生成物能量的变化。
活动四:放热反应、吸热反应与反应物、生成物的能量关系
从能量角度分析,什么反应是吸热反应?什么反应是放热反应?
【答案】 当反应物的总能量低于生成物的总能量时,反应是吸热反应;当反应物的总能量高于生成物的总能量时,反应是放热反应。
2. 探究反应物、生成物总能量的大小与化学反应能量变化的关系。观察①②两个反应中的能量变化图,回答有关问题。
① ②
(1) 比较①②两个反应中反应物总能量与生成物总能量的大小。
【答案】 反应①中,反应物总能量高于生成物总能量;反应②中,反应物总能量低于生成物总能量。
(2) 依据能量守恒的观念分析,①②两个反应是放热反应,还是吸热反应?
【答案】 反应①是放热反应,反应②是吸热反应。
1. 阅读教材,为什么质量相同的不同燃料完全燃烧放出的热量不等?什么是热值?
【答案】 不同燃料的热值不等。热值是指一定条件下单位质量的可燃物完全燃烧所放出的热量。
活动五:探究燃料燃烧释放的能量
2. 下面是5种燃料的热值。
物质 天然气 石油 煤炭 氢气 甲醇
热值/(kJ·g-1) 约56 约48 约33 143 23
氢气的热值为143 kJ·g-1表示的意义是什么?
【答案】 一定条件下,1 g氢气完全燃烧放出的热量为143 kJ。
3. 从键能角度如何计算各种燃料燃烧放出的热量?
【答案】 各种物质燃烧放出的热量等于形成生成物分子的化学键放出的总能量与燃烧时断裂反应物分子的化学键吸收的总能量之差。
4. 当今世界使用最多的能源是什么能源?包括哪些?
【答案】 化石能源仍然是当今世界使用最多的能源,主要包括煤、石油、天然气。
5. 我国是非常依赖化石燃料的国家,尤其是煤炭,讨论燃烧化石燃料有哪些问题?化学工作者从哪些方面努力探索解决燃料燃烧中存在的问题?
1. 为什么氢气是一种非常理想的清洁能源?大规模应用氢气作燃料面临什么困境?
【答案】 氢气热值高,燃烧产物是水,无污染,符合低碳要求,所以是一种清洁燃料、未来理想的绿色燃料。目前,制氢和储氢已成为全球瞩目的课题。将太阳能转化为电能,再将水催化电解获得氢气,其中最关键的高效、廉价、绿色的催化技术已有突破性的进展。
氢气密度小,熔点低,难液化,贮存液氢的容器要求高。科学家正致力于研究具备良好吸收和释放氢气性能的合金(如镧镍合金等),这将为解决氢气贮存问题开辟新的方向。贮氢合金在一定条件下吸收氢气形成金属氢化物,在加热时可释放出氢气。
活动六:探究氢能源的应用前景、太阳能的利用
2. 阅读教材,了解氢气作为燃料的广泛应用。
【答案】 氢气作为燃料,已有广泛的应用。发射人造卫星和载人飞船的运载火箭常用液氢作燃料。我国于1980年研制成功低温条件下也容易发动且对电动机腐蚀作用小的氢动力汽车。2017年10月,我国的氢燃料混合动力有轨电车在世界上首次投入商业运行。利用氢燃料电池发电,逐步取代当前污染环境、不可再生的化石燃料,大幅度降低成本,最终形成“无碳”的清洁能源。化学科学发展将在极大程度上促进现有的石油经济体系向氢经济结构转型,实现绿色发展目标。
3. 阅读教材,了解太阳能的转化。
(1) 植物体是怎样利用光能的?动物是怎样利用光能的?
【答案】 植物体内的叶绿素等物质在光照条件下将水、二氧化碳转化为葡萄糖,进而生成淀粉、纤维素,其本质是发生了光能―→化学能的转换。
动物摄入体内的淀粉、纤维素能水解转化为葡萄糖,葡萄糖氧化生成二氧化碳和水,释放热量,供给生命活动的需要。
(2) 人类直接利用太阳能有哪些方式?
【答案】 主要有两种方式:光-热转换、光-电转换。
课 堂 反 馈
2
4
5
1
3
7
9
6
8
1. (2021·宿迁沭阳高一下期中)下列属于吸热反应的是( )
A. 氢气在氯气中燃烧
B. 铝热反应
C. Ba(OH)2·8H2O和NH4Cl固体反应
D. 硝酸与氢氧化钠溶液反应
【解析】 氢氧化钡晶体与氯化铵固体反应是吸热反应,燃烧反应、中和反应、铝热反应均为放热反应。
【答案】 C
2
4
5
1
3
7
9
6
8
2. 下列说法正确的是( )
A. 化学反应中的能量变化都表现为热量的变化
B. 需要加热才能发生的反应一定是吸热反应
C. 能量变化必然伴随发生化学反应
D. 反应物的总能量高于生成物的总能量的反应是放热反应
【解析】 化学反应中的能量变化表现为多种形式,如光能、电能、热能等,不都表现为热量的变化,A错误;需要加热才能发生的反应不一定是吸热反应,如铝热反应,B错误;物质状态的改变也会引起能量变化,如气态水转化为液态水,该过程释放热量,但该过程是物理变化,所以能量变化不一定伴随发生化学反应,C错误;反应物的总能量高于生成物的总能量的反应是放热反应,D正确。
【答案】 D
2
4
5
3
7
9
6
8
1
【解析】 过程1为旧键的断裂,吸收能量,过程2为新键的形成,放出能量,A、B错误;反应物的总能量大于生成物的总能量,为放热反应,C正确;由图示可知,过程1吸收的能量小于过程2放出的能量,D错误。
【答案】 C
2
4
5
3
7
9
6
8
4. (2021·扬州高一下期末)白磷和红磷的能量转化关系如图所示,下列说法正确的是( )
A. 白磷和红磷互为同位素
B. 白磷转化为红磷是物理变化
C. 白磷转化为红磷时放出热量
D. 相同条件下,白磷的稳定性大于红磷
1
【解析】 白磷和红磷互为同素异形体,A错误;白磷转化为红磷,有新物质生成,为化学变化,B错误;白磷的能量高于红磷,白磷转化为红磷为放热反应,C正确;红磷的能量低,更稳定,D错误。
【答案】 C
2
4
5
3
7
9
6
8
5. 下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应
②化学反应的发生一定会伴随能量变化
③反应是放热还是吸热是由反应物和生成物所具有的总能量的相对大小决定的
④旧化学键断裂说明一定发生了化学反应
A. ③④ B. ①②
C. ②③ D. ②③④
1
2
4
5
3
7
9
6
8
1
【解析】 ①需要加热才能发生的反应不一定是吸热反应,例如碳燃烧,错误;②化学反应的发生一定会伴随能量变化,正确;③从宏观角度来说,反应物的总能量高于生成物的总能量,反应放热,反之吸热,正确;④旧化学键断裂时不一定发生化学反应,如NaCl溶于水的过程中也有化学键断裂,但没有发生化学反应,错误。②③正确,故选C。
【答案】 C
2
4
5
3
7
9
6
8
1
【答案】 B
2
4
5
3
7
9
6
8
7. 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A. H2O的分解反应是放热反应
B. 氢能源已被普遍使用
C. 2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的总能量
D. 氢气不易储存和运输,无开发利用价值
1
2
4
5
3
7
9
6
8
1
【解析】 2H2O(l)===2H2(g)+O2(g)是吸热反应,说明2 mol液态H2O具有的总能量低于 2 mol H2和1 mol O2的总能量。因为由水制取H2耗能多且H2不易储存和运输,所以氢能源利用并未普及,但发展前景广阔。
【答案】 C
2
4
5
3
7
9
6
8
8. 工业合成氨是人工固氮的重要方法。2007年,化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图所示。下列说法不正确的是( )
A. ①中N2、H2分子中均是单键
B. ②―→③需要吸收能量
C. 该过程表示了化学变化中包含旧化学键的断裂
D. 该过程表示了化学变化中包含新化学键的形成
1
2
4
5
3
7
9
6
8
1
【解析】 ①中H2分子中是单键,N2分子中是三键,不是单键,A错误;②→③,N2、H2分子中化学键断裂,化学键断裂时要吸收能量,B正确;化学变化中一定存在旧化学键的断裂和新化学键的形成,C正确,D正确。
【答案】 A
2
4
5
3
7
9
6
8
9. (1) 在25 ℃、101 kPa的条件下,请完成下列各题。
1
①由H+H―→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ 的能量;由Cl2―→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ 的能量。
②对于反应H2(g)+Cl2(g)===2HCl(g),测得生成2 mol HCl(g)时,反应过程中放出183 kJ的热量,则断开1 mol H—Cl键所需的能量是__________kJ。
放出
吸收
431
2
4
5
3
7
9
6
8
1
相等
放出
45.5
谢谢观看
Thank you for watching
专题6
化学反应与能量变化
第二单元 化学反应中的热
学 习 目 标
1. 认识物质具有能量,认识吸热反应与放热反应。
2. 了解化学反应体系能量改变与化学键的断裂和形成有关。
3. 了解焓变与反应热的关系,能书写热化学方程式。
4. 能从微观的角度解释宏观化学现象,知道化学键的断裂和形成是化学反应中能量变化的主要原因,理解能量守恒定律,初步建立起科学的能量观。
5. 能列举提高燃料燃烧效率的方法,合理利用化石燃料,减少燃料对环境的污染,说明开发高能清洁燃料的重要性。
活 动 方 案
1. 阅读教材,了解化学反应中的能量变化情况。
【答案】 化学反应都伴随着能量变化,反应物转化为生成物的同时,必然发生能量变化,反应中化学能可以转化为热能、光能、电能等,热能、光能、电能等也可以转化为化学能,如制水煤气、植物的光合作用、水的电解等。
活动一:探究放热反应、吸热反应
2. 根据生活常识,说出下列变化中的能量转化。
实例 能量转化方式
镁条燃烧 化学能转化为________
石油气的燃烧 化学能转化为________
原电池放电 化学能转化为________
闪电时产生氮氧化物 ________转化为化学能
高温冶炼铁 ________转化为化学能
光合作用 ________转化为化学能
电解水 ________转化为化学能
热能
热能
电能
电能
热能
光能
电能
3. 完成下列实验,记录实验现象,分析得出实验结论。
【实验1】 向一支试管中放入用砂纸打磨光亮的镁条,加入 5 mL 2 mol·L-1盐酸,用手触摸试管外壁,感受试管外壁的温度变化。
【实验2】 向100 mL烧杯中加入约20 g经研磨的八水合氢氧化钡晶体[Ba(OH)2·8H2O],然后加入约10 g氯化铵晶体,用玻璃棒搅拌,使之充分混合。在烧杯下垫一块沾有水的玻璃片,一段时间后提起烧杯,观察实验现象。用手触摸烧杯外壁,感受温度变化。
实验 现象 结论
实验1 ____________ 反应________
实验2 ______________________________________ 反应________
外壁发热
放热
外壁冰冷,玻璃片与烧杯间结冰黏在一起
吸热
【思考】
(1) 浓硫酸溶于水、水蒸气液化时均向外释放热量,它们属于放热反应吗?为什么?
【答案】 不属于。吸热反应、放热反应均是指化学反应,而浓硫酸溶于水、水蒸气液化过程中均无新物质生成,都不属于化学变化,因而都不属于放热反应。
(2) 需要加热才能进行的反应一定是吸热反应吗?常温下能进行的反应一定是放热反应吗?试举例说明。
【答案】 需要加热才能进行的反应不一定是吸热反应,如煤炭的燃烧是放热反应,但需要加热才能引燃;常温下能进行的反应不一定是放热反应,如常温下氢氧化钡晶体与NH4Cl晶体的反应是吸热反应。
【归纳总结】常见的放热反应和吸热反应
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O[或Ca(OH)2]与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸反应
1. 阅读教材,如何定量表示一个特定反应放出或吸收的热量?热化学方程式与普通方程式有什么不同?反应(1)(2)分别表示的意义是什么?
CaCO3(s)===CaO(s)+CO2(g) ΔH=178.2 kJ·mol-1 (1)
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1 (2)
活动二:探究热化学方程式的书写与意义
【答案】 用热化学方程式可以定量表示一个特定反应放出或吸收的热量。热化学方程式与普通方程式有以下差异:书写热化学方程式时,反应物、生成物的聚集状态要标注,气体—g,液体—l,固体—s,水溶液—aq;热化学方程式中各种物质化学式前面的化学计量数表示该物质的物质的量,不是物质的分子数或原子数,所以热化学方程式的化学计量数可以是整数,也可以是分数;热化学方程式中用ΔH标注了反应中的能量变化。
反应(1)中,1 mol CaCO3完全分解生成1 mol CaO和1 mol CO2气体,需要吸收178.2 kJ的热量;反应(2)中,1 mol C与1 mol O2完全反应生成1 mol CO2气体,可放出393.6 kJ的热量。
2. 讨论热化学方程式中的ΔH的含义,ΔH的正、负表示什么意义?与哪些因素有关,与化学计量数有什么关系?
【答案】 热化学方程式中用ΔH表示反应吸收或放出的热量,单位kJ·mol-1。ΔH小于0的反应是放热反应,ΔH大于0的反应是吸热反应。焓变与对应的化学方程式有关,与反应物、生成物的聚集状态有关,因此,书写热化学方程式时必须注明物质的状态,才能体现出热化学方程式的意义。热化学方程式中的ΔH与反应物的物质的量有关,前面的化学计量数与ΔH相对应,如果化学计量数加倍,那么ΔH也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
CH4>H2>CO
阅读教材,学习利用键能估算化学反应中的能量变化。
断开气态物质中1 mol某种共价键生成气态原子需要吸收的能量,就是该共价键的键能。共价键的键能越大,该共价键越牢固。部分共价键的键能如下表所示:
活动三:化学反应中的能量变化与化学键的关系
共价键 键能/(kJ·mol-1) 共价键 键能/(kJ·mol-1)
H—H 436.4 C—C 347.7
Cl—Cl 242.7 H—Cl 431.8
H—O 462.8 N≡N 941.7
1. 化学反应中需要断开反应物中的化学键,并形成生成物中新的化学键。断开化学键需要吸收能量,形成化学键需要放出能量。从化学键角度分析,什么情况下反应放热?什么情况下反应吸热?
【答案】 断开化学键所吸收的能量小于形成化学键所放出的能量,则该反应过程中放出能量,即为放热反应;断开化学键所吸收的能量大于形成化学键所放出的能量,则该反应过程中吸收能量,即为吸热反应。
共价键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436 243 431
反应中破坏或形成共价键的物质的量/mol
反应中破坏或形成共价键的总能量/kJ
反应热(标明吸热或者放热及其数值) 1
1
2
679
862
放热183 kJ
3. 已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。
根据图示完成下列各题。
(1) 该反应中反应物的总能量________(填“高于”或“低于”)生成物的总能量。
(2) 1 mol NO(g)分子中的化学键断裂时要吸收__________kJ能量。
(3) 断裂1 mol N≡N吸收的能量值x为__________。
低于
632
946
1. 分析下图化学反应中反应物、生成物能量的变化。
活动四:放热反应、吸热反应与反应物、生成物的能量关系
从能量角度分析,什么反应是吸热反应?什么反应是放热反应?
【答案】 当反应物的总能量低于生成物的总能量时,反应是吸热反应;当反应物的总能量高于生成物的总能量时,反应是放热反应。
2. 探究反应物、生成物总能量的大小与化学反应能量变化的关系。观察①②两个反应中的能量变化图,回答有关问题。
① ②
(1) 比较①②两个反应中反应物总能量与生成物总能量的大小。
【答案】 反应①中,反应物总能量高于生成物总能量;反应②中,反应物总能量低于生成物总能量。
(2) 依据能量守恒的观念分析,①②两个反应是放热反应,还是吸热反应?
【答案】 反应①是放热反应,反应②是吸热反应。
1. 阅读教材,为什么质量相同的不同燃料完全燃烧放出的热量不等?什么是热值?
【答案】 不同燃料的热值不等。热值是指一定条件下单位质量的可燃物完全燃烧所放出的热量。
活动五:探究燃料燃烧释放的能量
2. 下面是5种燃料的热值。
物质 天然气 石油 煤炭 氢气 甲醇
热值/(kJ·g-1) 约56 约48 约33 143 23
氢气的热值为143 kJ·g-1表示的意义是什么?
【答案】 一定条件下,1 g氢气完全燃烧放出的热量为143 kJ。
3. 从键能角度如何计算各种燃料燃烧放出的热量?
【答案】 各种物质燃烧放出的热量等于形成生成物分子的化学键放出的总能量与燃烧时断裂反应物分子的化学键吸收的总能量之差。
4. 当今世界使用最多的能源是什么能源?包括哪些?
【答案】 化石能源仍然是当今世界使用最多的能源,主要包括煤、石油、天然气。
5. 我国是非常依赖化石燃料的国家,尤其是煤炭,讨论燃烧化石燃料有哪些问题?化学工作者从哪些方面努力探索解决燃料燃烧中存在的问题?
1. 为什么氢气是一种非常理想的清洁能源?大规模应用氢气作燃料面临什么困境?
【答案】 氢气热值高,燃烧产物是水,无污染,符合低碳要求,所以是一种清洁燃料、未来理想的绿色燃料。目前,制氢和储氢已成为全球瞩目的课题。将太阳能转化为电能,再将水催化电解获得氢气,其中最关键的高效、廉价、绿色的催化技术已有突破性的进展。
氢气密度小,熔点低,难液化,贮存液氢的容器要求高。科学家正致力于研究具备良好吸收和释放氢气性能的合金(如镧镍合金等),这将为解决氢气贮存问题开辟新的方向。贮氢合金在一定条件下吸收氢气形成金属氢化物,在加热时可释放出氢气。
活动六:探究氢能源的应用前景、太阳能的利用
2. 阅读教材,了解氢气作为燃料的广泛应用。
【答案】 氢气作为燃料,已有广泛的应用。发射人造卫星和载人飞船的运载火箭常用液氢作燃料。我国于1980年研制成功低温条件下也容易发动且对电动机腐蚀作用小的氢动力汽车。2017年10月,我国的氢燃料混合动力有轨电车在世界上首次投入商业运行。利用氢燃料电池发电,逐步取代当前污染环境、不可再生的化石燃料,大幅度降低成本,最终形成“无碳”的清洁能源。化学科学发展将在极大程度上促进现有的石油经济体系向氢经济结构转型,实现绿色发展目标。
3. 阅读教材,了解太阳能的转化。
(1) 植物体是怎样利用光能的?动物是怎样利用光能的?
【答案】 植物体内的叶绿素等物质在光照条件下将水、二氧化碳转化为葡萄糖,进而生成淀粉、纤维素,其本质是发生了光能―→化学能的转换。
动物摄入体内的淀粉、纤维素能水解转化为葡萄糖,葡萄糖氧化生成二氧化碳和水,释放热量,供给生命活动的需要。
(2) 人类直接利用太阳能有哪些方式?
【答案】 主要有两种方式:光-热转换、光-电转换。
课 堂 反 馈
2
4
5
1
3
7
9
6
8
1. (2021·宿迁沭阳高一下期中)下列属于吸热反应的是( )
A. 氢气在氯气中燃烧
B. 铝热反应
C. Ba(OH)2·8H2O和NH4Cl固体反应
D. 硝酸与氢氧化钠溶液反应
【解析】 氢氧化钡晶体与氯化铵固体反应是吸热反应,燃烧反应、中和反应、铝热反应均为放热反应。
【答案】 C
2
4
5
1
3
7
9
6
8
2. 下列说法正确的是( )
A. 化学反应中的能量变化都表现为热量的变化
B. 需要加热才能发生的反应一定是吸热反应
C. 能量变化必然伴随发生化学反应
D. 反应物的总能量高于生成物的总能量的反应是放热反应
【解析】 化学反应中的能量变化表现为多种形式,如光能、电能、热能等,不都表现为热量的变化,A错误;需要加热才能发生的反应不一定是吸热反应,如铝热反应,B错误;物质状态的改变也会引起能量变化,如气态水转化为液态水,该过程释放热量,但该过程是物理变化,所以能量变化不一定伴随发生化学反应,C错误;反应物的总能量高于生成物的总能量的反应是放热反应,D正确。
【答案】 D
2
4
5
3
7
9
6
8
1
【解析】 过程1为旧键的断裂,吸收能量,过程2为新键的形成,放出能量,A、B错误;反应物的总能量大于生成物的总能量,为放热反应,C正确;由图示可知,过程1吸收的能量小于过程2放出的能量,D错误。
【答案】 C
2
4
5
3
7
9
6
8
4. (2021·扬州高一下期末)白磷和红磷的能量转化关系如图所示,下列说法正确的是( )
A. 白磷和红磷互为同位素
B. 白磷转化为红磷是物理变化
C. 白磷转化为红磷时放出热量
D. 相同条件下,白磷的稳定性大于红磷
1
【解析】 白磷和红磷互为同素异形体,A错误;白磷转化为红磷,有新物质生成,为化学变化,B错误;白磷的能量高于红磷,白磷转化为红磷为放热反应,C正确;红磷的能量低,更稳定,D错误。
【答案】 C
2
4
5
3
7
9
6
8
5. 下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应
②化学反应的发生一定会伴随能量变化
③反应是放热还是吸热是由反应物和生成物所具有的总能量的相对大小决定的
④旧化学键断裂说明一定发生了化学反应
A. ③④ B. ①②
C. ②③ D. ②③④
1
2
4
5
3
7
9
6
8
1
【解析】 ①需要加热才能发生的反应不一定是吸热反应,例如碳燃烧,错误;②化学反应的发生一定会伴随能量变化,正确;③从宏观角度来说,反应物的总能量高于生成物的总能量,反应放热,反之吸热,正确;④旧化学键断裂时不一定发生化学反应,如NaCl溶于水的过程中也有化学键断裂,但没有发生化学反应,错误。②③正确,故选C。
【答案】 C
2
4
5
3
7
9
6
8
1
【答案】 B
2
4
5
3
7
9
6
8
7. 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A. H2O的分解反应是放热反应
B. 氢能源已被普遍使用
C. 2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的总能量
D. 氢气不易储存和运输,无开发利用价值
1
2
4
5
3
7
9
6
8
1
【解析】 2H2O(l)===2H2(g)+O2(g)是吸热反应,说明2 mol液态H2O具有的总能量低于 2 mol H2和1 mol O2的总能量。因为由水制取H2耗能多且H2不易储存和运输,所以氢能源利用并未普及,但发展前景广阔。
【答案】 C
2
4
5
3
7
9
6
8
8. 工业合成氨是人工固氮的重要方法。2007年,化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图所示。下列说法不正确的是( )
A. ①中N2、H2分子中均是单键
B. ②―→③需要吸收能量
C. 该过程表示了化学变化中包含旧化学键的断裂
D. 该过程表示了化学变化中包含新化学键的形成
1
2
4
5
3
7
9
6
8
1
【解析】 ①中H2分子中是单键,N2分子中是三键,不是单键,A错误;②→③,N2、H2分子中化学键断裂,化学键断裂时要吸收能量,B正确;化学变化中一定存在旧化学键的断裂和新化学键的形成,C正确,D正确。
【答案】 A
2
4
5
3
7
9
6
8
9. (1) 在25 ℃、101 kPa的条件下,请完成下列各题。
1
①由H+H―→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ 的能量;由Cl2―→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ 的能量。
②对于反应H2(g)+Cl2(g)===2HCl(g),测得生成2 mol HCl(g)时,反应过程中放出183 kJ的热量,则断开1 mol H—Cl键所需的能量是__________kJ。
放出
吸收
431
2
4
5
3
7
9
6
8
1
相等
放出
45.5
谢谢观看
Thank you for watching
