专题6 第1单元 课题2 化学反应的限度 化学平衡状态课件(共38张PPT)2022-2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题6 第1单元 课题2 化学反应的限度 化学平衡状态课件(共38张PPT)2022-2023学年下学期高一化学苏教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1010.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 16:00:49 | ||
图片预览










文档简介
(共38张PPT)
专题6
化学反应与能量变化
第一单元 化学反应速率与反应限度
课题2 化学反应的限度 化学平衡状态
学 习 目 标
1. 了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡状态。
2. 能描述化学平衡状态,判断化学反应是否达到平衡。
3. 体会从限度和快慢两个方面去认识和调控化学反应的重要性。
活 动 方 案
1. 回顾氯气与水的反应,哪些证据可以说明该反应不能反应完全,即反应具有一定的限度?如何证明氯水中存在氯气分子,领悟可逆反应的概念。
活动一:认识可逆反应
2. 一定条件下,许多反应有一定限度,反应物不能完全转化为生成物,请你根据所学知识,列举具有一定限度反应的案例。常温下,在0.1 mol·L-1 CH3COOH溶液中,大约只有1%的醋酸分子电离成离子,醋酸的电离有一定的限度吗?用电离方程式表示醋酸的电离过程。
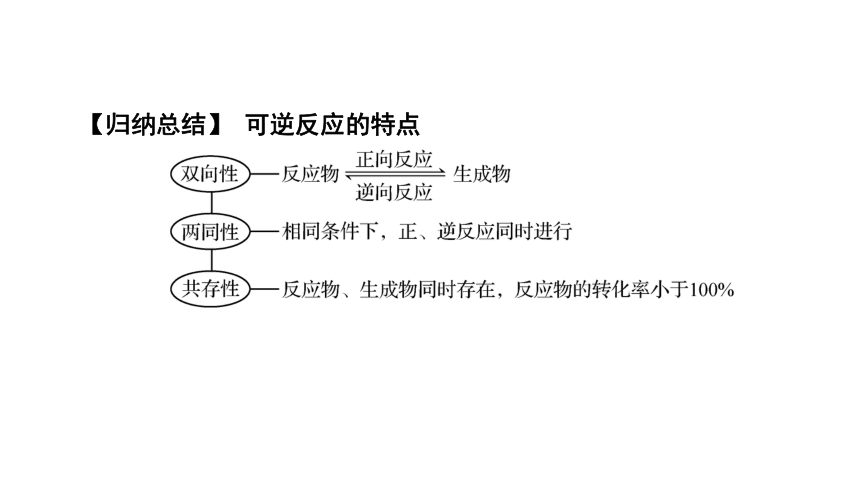
【归纳总结】 可逆反应的特点
FeCl3溶液和KI溶液在常温下能发生如下反应:
2Fe3++2I-===2Fe2++I2
1. 取5 mL 0.1 mol·L-1 KI溶液,向其中加入1 mL 0.1 mol·L-1 FeCl3溶液,振荡,观察实验现象。
2. 继续向上述溶液中加入2 mL苯,充分振荡后静置,观察实验现象。
3. 分液后,重复步骤2的操作2~3次,将下层溶液分装在两支洁净的试管中,向其中一支试管中滴加5~6滴15%硫氰化钾(KSCN)溶液,观察并比较两支试管中溶液的颜色。(KSCN溶液遇到Fe3+变为红色,该反应可用于检验溶液中的Fe3+)
活动二:实验探究化学反应的限度
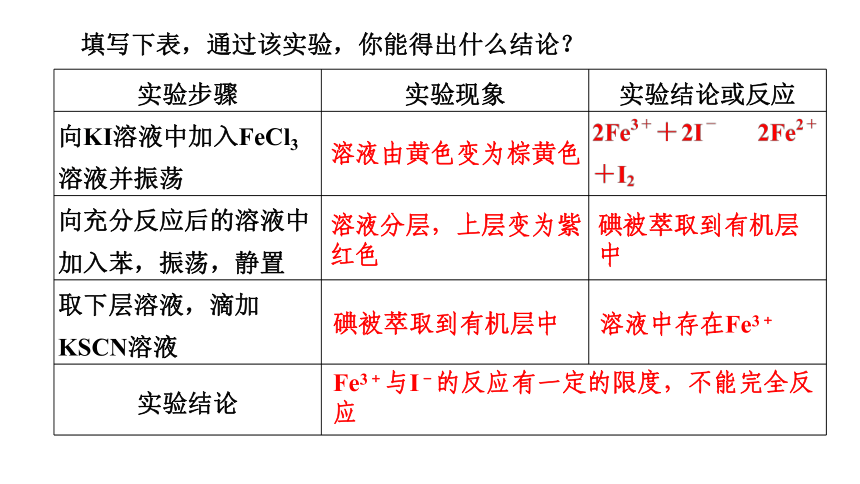
填写下表,通过该实验,你能得出什么结论?
实验步骤 实验现象 实验结论或反应
向KI溶液中加入FeCl3溶液并振荡
向充分反应后的溶液中加入苯,振荡,静置
取下层溶液,滴加KSCN溶液
实验结论
溶液由黄色变为棕黄色
溶液分层,上层变为紫红色
碘被萃取到有机层中
碘被萃取到有机层中
溶液中存在Fe3+
Fe3+与I-的反应有一定的限度,不能完全反应
1. 理论分析化学反应限度与平衡状态的建立。
(1) 事实表明,许多反应是可逆的,在同一条件下向正反应方向进行的同时,也在向逆反应方向进行。对于一般的可逆反应,请你描述随着反应的进行,反应物浓度、生成物浓度的变化趋势。
【答案】 随着反应的进行,反应物浓度逐渐减小,生成物浓度逐渐增大。
活动三:化学平衡状态
(2) 在一定条件下,正反应速率等于逆反应速率,反应物浓度和生成物浓度不再改变的状态叫作化学平衡状态。对于一般的可逆反应,在坐标系中画出正、逆反应速率随反应时间变化的曲线图。
【答案】
2. 以Fe3+与 I-的反应为例,分析反应中离子浓度变化和正、逆反应速率变化,画出反应过程中正、逆反应速率与反应时间的关系曲线,学习平衡状态的概念。
【答案】 开始时,Fe3+和I-的浓度都很大,正反应速率较大,逆反应速率为0,随着反应的进行,反应物的浓度下降,正反应速率逐渐减小,生成物的浓度逐渐增大,逆反应速率逐渐增大。当正、逆反应速率相等时,反应物、生成物的浓度不再变化,即反应达到化学平衡状态。
3. 探究平衡状态与平衡标志。
(1) 根据理论探究,达到平衡时反应的正反应速率和逆反应速率是相等的,反应速率不再变化,那么此时反应物、生成物的浓度会变化吗?正、逆反应速率均为0吗?
【答案】 达到平衡状态时,正、逆反应速率不变,反应物、生成物的浓度也不再变化,但正、逆反应仍在进行,正、逆反应速率均不为0。
(2) 化学平衡的本质特征是什么?为什么说化学平衡是动态平衡?平衡状态一般有什么特点或标志?
【答案】 化学平衡的本质特征是v(正)=v(逆)≠ 0,由于反应仍在进行,所以化学平衡是一种动态平衡。外界条件一定时,平衡时一般各组分的百分含量一定(不是相等);体积一定时,各物质的浓度不再变化,体系颜色不再变化。
【归纳总结】
(1) 化学平衡状态判断“三关注”
①关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器。
②关注反应特点,是等体积反应,还是非等体积反应。
③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
课 堂 反 馈
2
4
5
1
3
7
6
8
【解析】 反应开始时,反应物的浓度最大,正反应速率最大,生成物的浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物的浓度逐渐减小,正反应速率逐渐减小,生成物的浓度逐渐增大,逆反应速率逐渐增大,达到平衡状态时正、逆反应速率相等,但不为零,B错误,C、D正确。
【答案】 B
2
4
5
1
3
7
6
8
【解析】 含18O的一氧化碳和H2O正向反应生成含18O的二氧化碳,同时含18O的二氧化碳和H2又逆向反应生成了一氧化碳和水,故最终CO、H2O和CO2中都含有18O。
【答案】 D
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【解析】 该反应是可逆反应,不能完全转化,A错误;温度升高,正、逆反应速率均增大,B正确;平衡状态为动态平衡,v(正)=v(逆)>0,C错误;达到平衡状态时,各物质的物质的量浓度不一定成比例,D错误。
【答案】 B
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【答案】 B
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【答案】 C
2
4
5
3
7
6
8
A. 12 s时,A的转化率为25%
B. 化学计量数之比b∶c=1∶2
C. 0~2 s,D的平均反应速率为0.1 mol·L-1·s-1
D. 图中两曲线相交时,A的消耗速率等于A的生成速率
1
2
4
5
3
7
6
8
1
【解析】 12 s时,A的物质的量浓度减少了0.6 mol·L-1,转化率为75%,A错误;12 s时,B的物质的量减少0.2 mol·L-1×2 L=0.4 mol,此时C增加 0.8 mol,b∶c=1∶2,B正确;D为固体,浓度为常数,不能表示化学反应速率,C错误;A、B曲线相交时,正向建立平衡,A的消耗速率大于A的生成速率,D错误。
【答案】 B
2
4
5
3
7
6
8
1
【解析】 采用极值法分析,若氧气全部反应,则N2、O2和N2O的浓度分别为1.0 mol·L-1、0、4.0 mol·L-1,若N2O(g)全部反应,则N2、O2和N2O的浓度分别为5.0 mol·L-1、 2 mol·L-1、0,所以1.0 mol·L-1<c(N2)<5.0 mol·L-1、0<c(O2)<2.0 mol·L-1、0<c(N2O)<4.0 mol·L-1,反应不可能完全转化,所以只有c(O2)=1.5 mol·L-1符合题意。故选A。
【答案】 A
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
(1) 3~9 min内,v(H2)=______________mol·L-1·min-1。
1
0.125
2
4
5
3
7
6
8
(2) 能说明上述反应达到平衡状态的是______(填字母)。
A. 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B. 混合气体的密度不随时间的变化而变化
C. 单位时间内消耗3 mol H2,同时生成1 mol H2O
D. CO2的体积分数在混合气体中保持不变
1
D
2
4
5
3
7
6
8
1
【解析】 A项,反应中CO2与CH3OH的物质的量浓度之比为1∶1(即题图中交叉点),此时反应还在正向进行中,没有达到平衡状态;B项,密度是混合气体的质量和容器容积的比值,在反应过程中气体总质量和容器容积始终保持不变,所以混合气体的密度不随时间的变化而变化,不能说明反应达到平衡状态;C项,单位时间内消耗3 mol H2,同时生成 1 mol H2O,均表示正反应速率,不能说明反应达到平衡状态;D项,CO2的体积分数在混合气体中保持不变,说明反应达到平衡状态。
2
4
5
3
7
6
8
(3) 平衡时CO2的转化率为__________。
1
75%
2
4
5
3
7
6
8
(4) 平衡时混合气体中CH3OH(g)的体积分数是__________。
1
30%
2
4
5
3
7
6
8
(5) 一定温度下,9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)3 min时v正(CH3OH)。
1
【解析】 随着反应的进行,正反应速率逐渐减小,则 3 min 时的v正(CH3OH)>9 min时v正(CH3OH),9 min时反应达到平衡状态,正、逆反应速率相等,则9 min 时v逆(CH3OH)小于3 min时v正(CH3OH)。
小于
谢谢观看
Thank you for watching
专题6
化学反应与能量变化
第一单元 化学反应速率与反应限度
课题2 化学反应的限度 化学平衡状态
学 习 目 标
1. 了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡状态。
2. 能描述化学平衡状态,判断化学反应是否达到平衡。
3. 体会从限度和快慢两个方面去认识和调控化学反应的重要性。
活 动 方 案
1. 回顾氯气与水的反应,哪些证据可以说明该反应不能反应完全,即反应具有一定的限度?如何证明氯水中存在氯气分子,领悟可逆反应的概念。
活动一:认识可逆反应
2. 一定条件下,许多反应有一定限度,反应物不能完全转化为生成物,请你根据所学知识,列举具有一定限度反应的案例。常温下,在0.1 mol·L-1 CH3COOH溶液中,大约只有1%的醋酸分子电离成离子,醋酸的电离有一定的限度吗?用电离方程式表示醋酸的电离过程。
【归纳总结】 可逆反应的特点
FeCl3溶液和KI溶液在常温下能发生如下反应:
2Fe3++2I-===2Fe2++I2
1. 取5 mL 0.1 mol·L-1 KI溶液,向其中加入1 mL 0.1 mol·L-1 FeCl3溶液,振荡,观察实验现象。
2. 继续向上述溶液中加入2 mL苯,充分振荡后静置,观察实验现象。
3. 分液后,重复步骤2的操作2~3次,将下层溶液分装在两支洁净的试管中,向其中一支试管中滴加5~6滴15%硫氰化钾(KSCN)溶液,观察并比较两支试管中溶液的颜色。(KSCN溶液遇到Fe3+变为红色,该反应可用于检验溶液中的Fe3+)
活动二:实验探究化学反应的限度
填写下表,通过该实验,你能得出什么结论?
实验步骤 实验现象 实验结论或反应
向KI溶液中加入FeCl3溶液并振荡
向充分反应后的溶液中加入苯,振荡,静置
取下层溶液,滴加KSCN溶液
实验结论
溶液由黄色变为棕黄色
溶液分层,上层变为紫红色
碘被萃取到有机层中
碘被萃取到有机层中
溶液中存在Fe3+
Fe3+与I-的反应有一定的限度,不能完全反应
1. 理论分析化学反应限度与平衡状态的建立。
(1) 事实表明,许多反应是可逆的,在同一条件下向正反应方向进行的同时,也在向逆反应方向进行。对于一般的可逆反应,请你描述随着反应的进行,反应物浓度、生成物浓度的变化趋势。
【答案】 随着反应的进行,反应物浓度逐渐减小,生成物浓度逐渐增大。
活动三:化学平衡状态
(2) 在一定条件下,正反应速率等于逆反应速率,反应物浓度和生成物浓度不再改变的状态叫作化学平衡状态。对于一般的可逆反应,在坐标系中画出正、逆反应速率随反应时间变化的曲线图。
【答案】
2. 以Fe3+与 I-的反应为例,分析反应中离子浓度变化和正、逆反应速率变化,画出反应过程中正、逆反应速率与反应时间的关系曲线,学习平衡状态的概念。
【答案】 开始时,Fe3+和I-的浓度都很大,正反应速率较大,逆反应速率为0,随着反应的进行,反应物的浓度下降,正反应速率逐渐减小,生成物的浓度逐渐增大,逆反应速率逐渐增大。当正、逆反应速率相等时,反应物、生成物的浓度不再变化,即反应达到化学平衡状态。
3. 探究平衡状态与平衡标志。
(1) 根据理论探究,达到平衡时反应的正反应速率和逆反应速率是相等的,反应速率不再变化,那么此时反应物、生成物的浓度会变化吗?正、逆反应速率均为0吗?
【答案】 达到平衡状态时,正、逆反应速率不变,反应物、生成物的浓度也不再变化,但正、逆反应仍在进行,正、逆反应速率均不为0。
(2) 化学平衡的本质特征是什么?为什么说化学平衡是动态平衡?平衡状态一般有什么特点或标志?
【答案】 化学平衡的本质特征是v(正)=v(逆)≠ 0,由于反应仍在进行,所以化学平衡是一种动态平衡。外界条件一定时,平衡时一般各组分的百分含量一定(不是相等);体积一定时,各物质的浓度不再变化,体系颜色不再变化。
【归纳总结】
(1) 化学平衡状态判断“三关注”
①关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器。
②关注反应特点,是等体积反应,还是非等体积反应。
③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
课 堂 反 馈
2
4
5
1
3
7
6
8
【解析】 反应开始时,反应物的浓度最大,正反应速率最大,生成物的浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物的浓度逐渐减小,正反应速率逐渐减小,生成物的浓度逐渐增大,逆反应速率逐渐增大,达到平衡状态时正、逆反应速率相等,但不为零,B错误,C、D正确。
【答案】 B
2
4
5
1
3
7
6
8
【解析】 含18O的一氧化碳和H2O正向反应生成含18O的二氧化碳,同时含18O的二氧化碳和H2又逆向反应生成了一氧化碳和水,故最终CO、H2O和CO2中都含有18O。
【答案】 D
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【解析】 该反应是可逆反应,不能完全转化,A错误;温度升高,正、逆反应速率均增大,B正确;平衡状态为动态平衡,v(正)=v(逆)>0,C错误;达到平衡状态时,各物质的物质的量浓度不一定成比例,D错误。
【答案】 B
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【答案】 B
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【答案】 C
2
4
5
3
7
6
8
A. 12 s时,A的转化率为25%
B. 化学计量数之比b∶c=1∶2
C. 0~2 s,D的平均反应速率为0.1 mol·L-1·s-1
D. 图中两曲线相交时,A的消耗速率等于A的生成速率
1
2
4
5
3
7
6
8
1
【解析】 12 s时,A的物质的量浓度减少了0.6 mol·L-1,转化率为75%,A错误;12 s时,B的物质的量减少0.2 mol·L-1×2 L=0.4 mol,此时C增加 0.8 mol,b∶c=1∶2,B正确;D为固体,浓度为常数,不能表示化学反应速率,C错误;A、B曲线相交时,正向建立平衡,A的消耗速率大于A的生成速率,D错误。
【答案】 B
2
4
5
3
7
6
8
1
【解析】 采用极值法分析,若氧气全部反应,则N2、O2和N2O的浓度分别为1.0 mol·L-1、0、4.0 mol·L-1,若N2O(g)全部反应,则N2、O2和N2O的浓度分别为5.0 mol·L-1、 2 mol·L-1、0,所以1.0 mol·L-1<c(N2)<5.0 mol·L-1、0<c(O2)<2.0 mol·L-1、0<c(N2O)<4.0 mol·L-1,反应不可能完全转化,所以只有c(O2)=1.5 mol·L-1符合题意。故选A。
【答案】 A
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
(1) 3~9 min内,v(H2)=______________mol·L-1·min-1。
1
0.125
2
4
5
3
7
6
8
(2) 能说明上述反应达到平衡状态的是______(填字母)。
A. 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B. 混合气体的密度不随时间的变化而变化
C. 单位时间内消耗3 mol H2,同时生成1 mol H2O
D. CO2的体积分数在混合气体中保持不变
1
D
2
4
5
3
7
6
8
1
【解析】 A项,反应中CO2与CH3OH的物质的量浓度之比为1∶1(即题图中交叉点),此时反应还在正向进行中,没有达到平衡状态;B项,密度是混合气体的质量和容器容积的比值,在反应过程中气体总质量和容器容积始终保持不变,所以混合气体的密度不随时间的变化而变化,不能说明反应达到平衡状态;C项,单位时间内消耗3 mol H2,同时生成 1 mol H2O,均表示正反应速率,不能说明反应达到平衡状态;D项,CO2的体积分数在混合气体中保持不变,说明反应达到平衡状态。
2
4
5
3
7
6
8
(3) 平衡时CO2的转化率为__________。
1
75%
2
4
5
3
7
6
8
(4) 平衡时混合气体中CH3OH(g)的体积分数是__________。
1
30%
2
4
5
3
7
6
8
(5) 一定温度下,9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)3 min时v正(CH3OH)。
1
【解析】 随着反应的进行,正反应速率逐渐减小,则 3 min 时的v正(CH3OH)>9 min时v正(CH3OH),9 min时反应达到平衡状态,正、逆反应速率相等,则9 min 时v逆(CH3OH)小于3 min时v正(CH3OH)。
小于
谢谢观看
Thank you for watching
