人教版(2019) 必修 第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物5.1.4不同价态含硫物质的转化.pptx(共16张PPT)
文档属性
| 名称 | 人教版(2019) 必修 第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物5.1.4不同价态含硫物质的转化.pptx(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 44.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 15:40:07 | ||
图片预览



文档简介
(共16张PPT)
吴 彦
硫的转化
——不同价态含硫物质的转化
第五章 化工生产中的重要非金属元素
第1节 硫及其化合物(4)
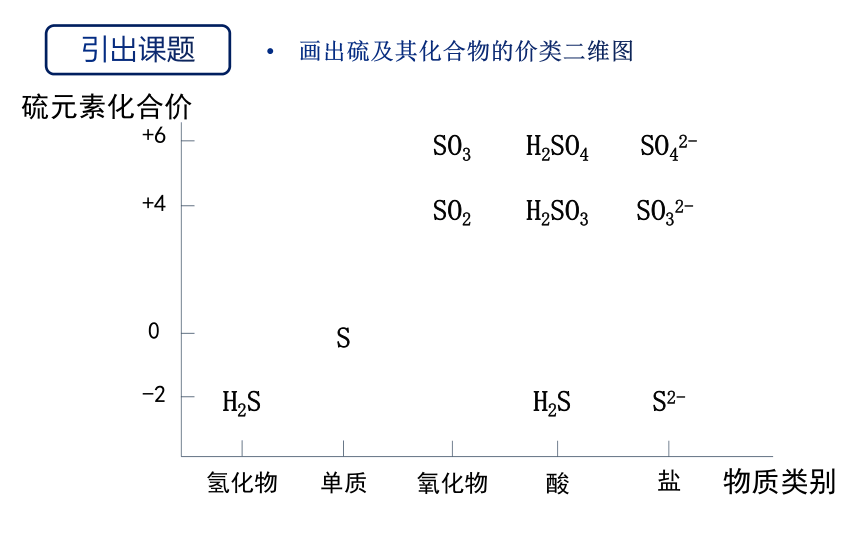
引出课题
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
画出硫及其化合物的价类二维图
方法导引
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
从氧化还原的角度说明-2价、0价、+4价、+6价硫元素在反应中表现出什么性质?
从氧化还原的角度分析如何实现其相互转化?
方法导引
常见的氧化剂:
常见的还原剂:
酸性KMnO4溶液、硝酸、浓硫酸、氯气(氯水)、氧气等
氢气、一氧化碳、金属单质、Na2SO3溶液、二氧化硫等
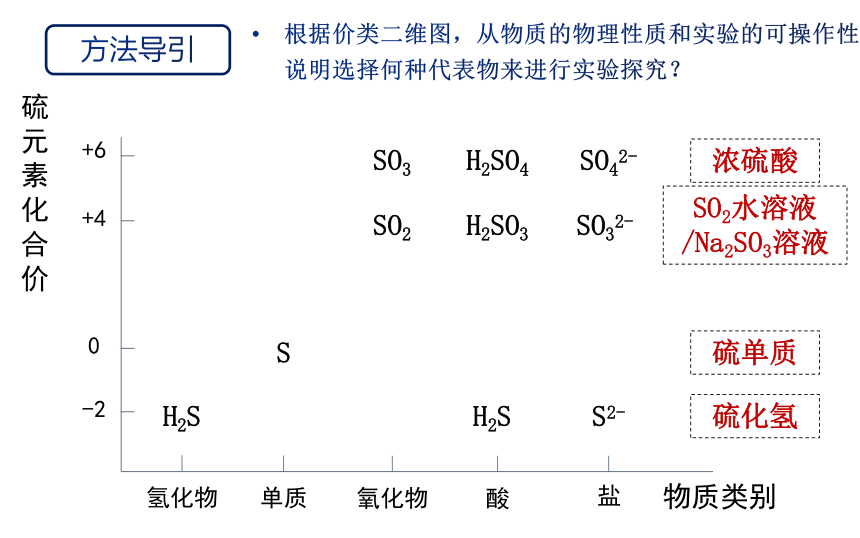
根据价类二维图,从物质的物理性质和实验的可操作性说明选择何种代表物来进行实验探究?
从氧化还原的角度说明-2价、0价、+4价、+6价硫元素在反应中表现出什么性质?
从氧化还原的角度分析如何实现其相互转化?
方法导引
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
硫单质
SO2水溶液/Na2SO3溶液
浓硫酸
硫化氢
根据价类二维图,从物质的物理性质和实验的可操作性说明选择何种代表物来进行实验探究?
设计实验
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
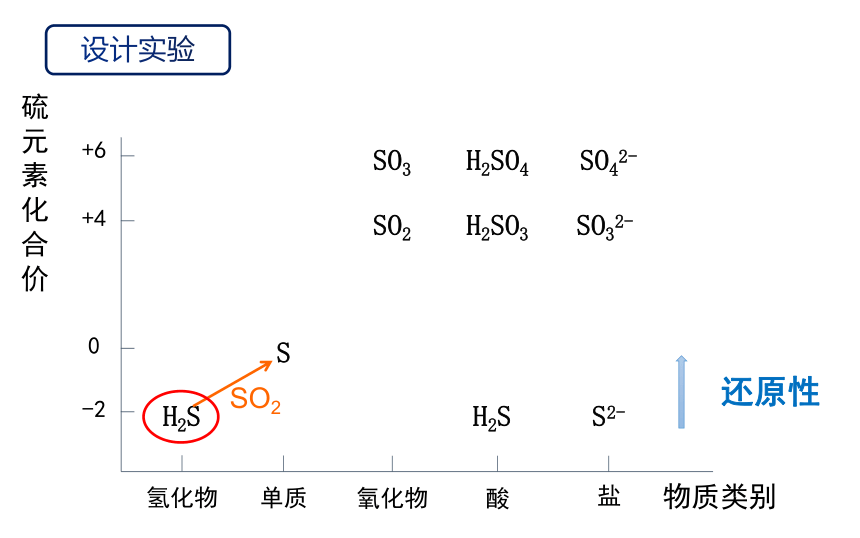
硫元素化合价
SO2
还原性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
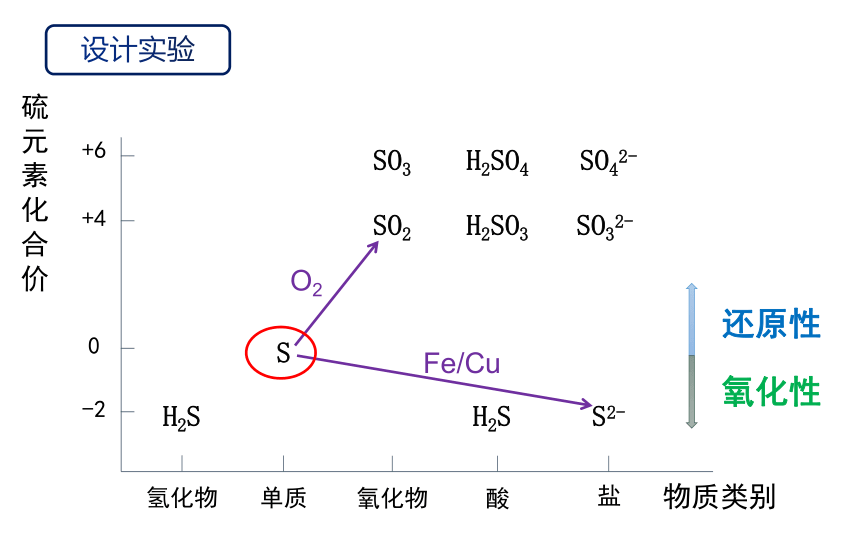
硫元素化合价
Fe/Cu
O2
设计实验
还原性
氧化性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
H2S/Na2S
O2
Cl2
KMnO4
设计实验
还原性
氧化性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
H2S/Na2S
Cl2
KMnO4
设计实验
还原性
氧化性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
H2S/Na2S
Cl2
设计实验
还原性
氧化性
5SO32-+2MnO4-+6H+=2Mn2++3H2O+5SO42-
6H++2S2-+SO32-+=3S↓++3H2O
KMnO4
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
研究规律
S
S
S
S
-2
0
+4
+6
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
研究规律
方案 价态变化 起始物质 生产物质 选择试剂 预测现象
1 -2→0 Na2S S H2SO3 产生淡黄色沉淀
2 0→-2 S FeS Fe 燃烧、生成黑色固体
3 0→+4 S SO2 O2 燃烧、产生蓝色火焰,有刺激性气味
4 +4→0 SO2 S H2S 产生淡黄色沉淀
5 +6→+4 H2SO4 SO2 Cu 有刺激性气味的气体生成,溶液变蓝
6 +4→+6 Na2SO3 Na2SO4 O2 无明显现象
选择合适的试剂(氧化剂或还原剂),实现起始物质向生成物质的转化,并预测实验现象。
研究规律
化学实验设计
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。例如,设计“不同价态含硫物质的转化”实验,当确定了要实现的转化关系后,需要明确转化前后的含硫物质是哪些,通过怎样的反应(氧化/还原)实现转化,用到的氧化剂或还原剂是什么,等等。
进行化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
课堂小结
S
S
S
S
-2
0
+4
+6
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
今日作业
1.梳理课堂笔记。
2.【练透】第三课时。
吴 彦
硫的转化
——不同价态含硫物质的转化
第五章 化工生产中的重要非金属元素
第1节 硫及其化合物(4)
引出课题
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
画出硫及其化合物的价类二维图
方法导引
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
从氧化还原的角度说明-2价、0价、+4价、+6价硫元素在反应中表现出什么性质?
从氧化还原的角度分析如何实现其相互转化?
方法导引
常见的氧化剂:
常见的还原剂:
酸性KMnO4溶液、硝酸、浓硫酸、氯气(氯水)、氧气等
氢气、一氧化碳、金属单质、Na2SO3溶液、二氧化硫等
根据价类二维图,从物质的物理性质和实验的可操作性说明选择何种代表物来进行实验探究?
从氧化还原的角度说明-2价、0价、+4价、+6价硫元素在反应中表现出什么性质?
从氧化还原的角度分析如何实现其相互转化?
方法导引
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
硫单质
SO2水溶液/Na2SO3溶液
浓硫酸
硫化氢
根据价类二维图,从物质的物理性质和实验的可操作性说明选择何种代表物来进行实验探究?
设计实验
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
SO2
还原性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
Fe/Cu
O2
设计实验
还原性
氧化性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
H2S/Na2S
O2
Cl2
KMnO4
设计实验
还原性
氧化性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
H2S/Na2S
Cl2
KMnO4
设计实验
还原性
氧化性
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
H2S/Na2S
Cl2
设计实验
还原性
氧化性
5SO32-+2MnO4-+6H+=2Mn2++3H2O+5SO42-
6H++2S2-+SO32-+=3S↓++3H2O
KMnO4
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
研究规律
S
S
S
S
-2
0
+4
+6
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
研究规律
方案 价态变化 起始物质 生产物质 选择试剂 预测现象
1 -2→0 Na2S S H2SO3 产生淡黄色沉淀
2 0→-2 S FeS Fe 燃烧、生成黑色固体
3 0→+4 S SO2 O2 燃烧、产生蓝色火焰,有刺激性气味
4 +4→0 SO2 S H2S 产生淡黄色沉淀
5 +6→+4 H2SO4 SO2 Cu 有刺激性气味的气体生成,溶液变蓝
6 +4→+6 Na2SO3 Na2SO4 O2 无明显现象
选择合适的试剂(氧化剂或还原剂),实现起始物质向生成物质的转化,并预测实验现象。
研究规律
化学实验设计
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。例如,设计“不同价态含硫物质的转化”实验,当确定了要实现的转化关系后,需要明确转化前后的含硫物质是哪些,通过怎样的反应(氧化/还原)实现转化,用到的氧化剂或还原剂是什么,等等。
进行化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
物质类别
氢化物
单质
氧化物
酸
盐
-2
0
+4
+6
S
SO2
H2SO3
H2S
SO3
H2SO4
SO32-
SO42-
H2S
S2-
硫元素化合价
课堂小结
S
S
S
S
-2
0
+4
+6
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
今日作业
1.梳理课堂笔记。
2.【练透】第三课时。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
