专题7 第2单元 课题2 硝酸 课件(共34张PPT) 2022-2023学年高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题7 第2单元 课题2 硝酸 课件(共34张PPT) 2022-2023学年高一下学期化学苏教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 592.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 15:22:40 | ||
图片预览








文档简介
(共34张PPT)
专题7
氮与社会可持续发展
第二单元 重要的含氮化工原料
课题2 硝酸
学 习 目 标
1. 了解硝酸的物理性质和化学性质(酸性、强氧化性、不稳定性)。
2. 认识浓硝酸在常温下与铁、铝的钝化作用。
3. 了解浓、稀硝酸的主要性质和在生产中的应用。
活 动 方 案
1. 观察老师展示的试剂瓶中的浓硝酸,讨论、学习硝酸的物理性质。
【答案】 硝酸是一种无色、易挥发、具有刺激性气味的液体,能与水以任意比互溶,沸点为 83 ℃,密度为1.42 g·cm-3。
2. 浓硝酸密封保存在玻璃瓶中,为什么?打开瓶塞(一般是塑料塞)看到什么现象?
【答案】 浓硝酸易挥发,所以要密封保存在玻璃瓶中。打开瓶塞可看到瓶口产生白雾,是挥发出的硝酸分子与空气中的水蒸气形成的酸雾。
活动一:了解硝酸的物理性质
1. 为什么试剂瓶中的浓硝酸往往略显黄色?
活动二:分析浓硝酸的颜色及原因
2. 实验室中的浓硝酸常保存在无色试剂瓶中吗?
【答案】 不是,为防止HNO3见光分解,浓硝酸通常保存在棕色试剂瓶中。
1. 完成下列实验报告。
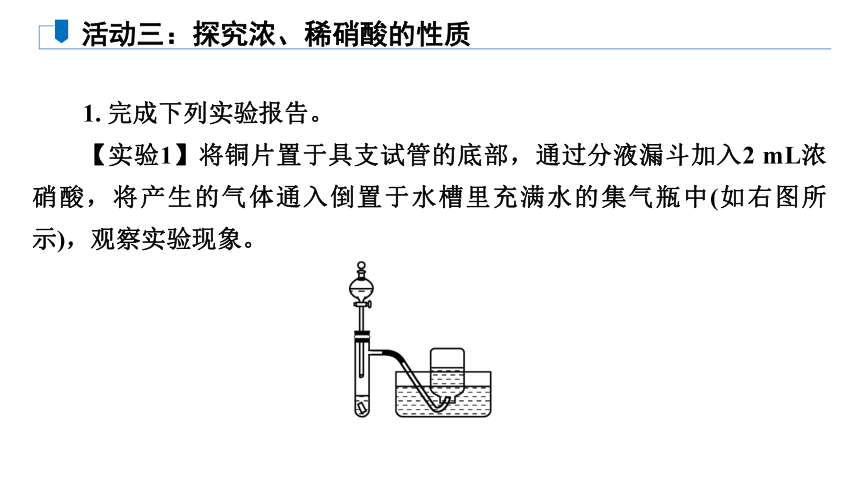
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2 mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(如右图所示),观察实验现象。
活动三:探究浓、稀硝酸的性质
【实验2】在上述装置中,用分液漏斗向试管内加5 mL水,稀释硝酸,继续收集产生的气体,观察实验现象。
【实验3】将一小块木炭放在酒精灯上加热至红热,然后投入盛有浓硝酸的试管中。
【实验4】将一段除去表面氧化膜的光亮铁圈(或铝圈)用细铁丝系好,轻轻放到盛有浓硝酸的烧杯中,片刻后小心取出,再浸入CuSO4溶液中,取出后用玻璃棒轻轻敲击铁圈(或铝圈),观察变化。
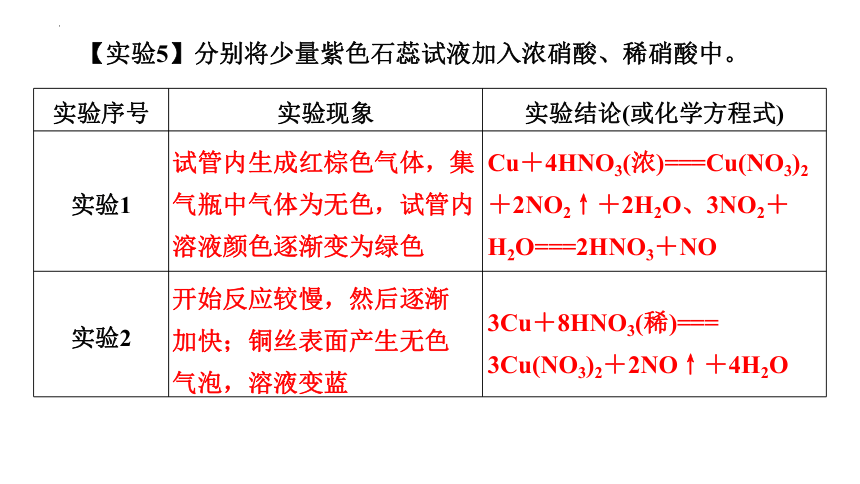
【实验5】分别将少量紫色石蕊试液加入浓硝酸、稀硝酸中。
实验序号 实验现象 实验结论(或化学方程式)
实验1
实验2
试管内生成红棕色气体,集气瓶中气体为无色,试管内溶液颜色逐渐变为绿色
开始反应较慢,然后逐渐加快;铜丝表面产生无色气泡,溶液变蓝
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
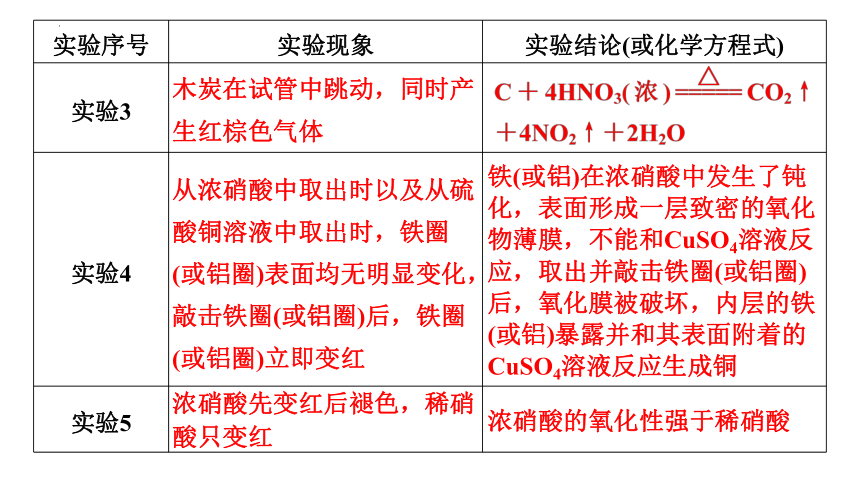
实验序号 实验现象 实验结论(或化学方程式)
实验3
实验4
实验5
木炭在试管中跳动,同时产生红棕色气体
从浓硝酸中取出时以及从硫酸铜溶液中取出时,铁圈(或铝圈)表面均无明显变化,敲击铁圈(或铝圈)后,铁圈(或铝圈)立即变红
铁(或铝)在浓硝酸中发生了钝化,表面形成一层致密的氧化物薄膜,不能和CuSO4溶液反应,取出并敲击铁圈(或铝圈)后,氧化膜被破坏,内层的铁(或铝)暴露并和其表面附着的CuSO4溶液反应生成铜
浓硝酸先变红后褪色,稀硝酸只变红
浓硝酸的氧化性强于稀硝酸
2. 讨论:硝酸的浓度与还原产物的化合价有什么关系?
【答案】 硝酸浓度越大,其还原产物中氮元素的价态越高;硝酸浓度越小,其还原产物中氮元素的价态越低。
3. 讨论:工业生产中怎样储存运输浓硝酸?
【答案】 用铝制或铁制容器储存运输浓硝酸。
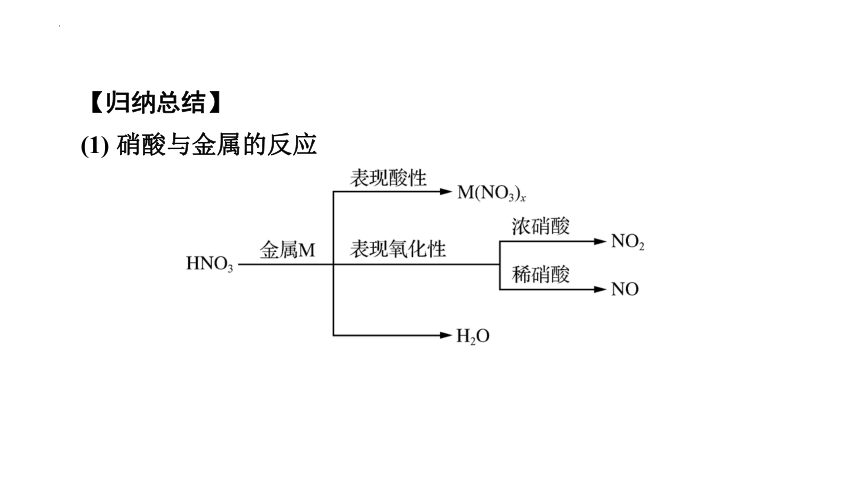
【归纳总结】
(1) 硝酸与金属的反应
①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属,如3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O;
②活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同;
③常温下,浓硝酸能使Fe、Al钝化,因此可用铝或铁制容器贮存浓硝酸。
工业制备流程图
活动四:了解硝酸的工业生产
工业生产硝酸流程如下:
(1) 氨在催化剂的作用下与氧气发生反应,生成一氧化氮。
(2) 一氧化氮进一步被氧气氧化,生成二氧化氮。
【答案】 2NO+O2===2NO2
(3) 用水吸收二氧化氮,生成硝酸。
写出上述制备硝酸的化学方程式。
【答案】 3NO2+H2O===2HNO3+NO
1. 思维模型
活动五:硝酸与金属反应的相关计算
2. 计算方法(以Cu与硝酸反应为例)
(1) 原子守恒法:反应前所有的N只存在于HNO3中,反应后含N的物质有HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,若HNO3过量,则过量HNO3中也含N,则有n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n(HNO3)剩。
3. 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生标准状况下的一氧化氮和二氧化氮混合气体共11.2 L。请回答下列问题:
(1) 产生一氧化氮的体积为______________L(标准状况下)。
(2) 待反应结束后,向溶液中加入V mL a mol·L-1的氢氧化钠溶液,
恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸的浓度为____________ mol·L-1(不必化简)。
(3) 欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要氧气___________mol。
5.824
0.255
课 堂 反 馈
2
4
5
1
3
7
6
8
1. (2020·扬州期末)下列有关浓硝酸的说法正确的是( )
A. 保存在无色试剂瓶中 B. 易挥发
C. 常温下与铁反应放出氢气 D. 受热不分解
【解析】 浓硝酸见光易分解,应该保存在棕色试剂瓶中,A错误;硝酸的沸点低,所以浓硝酸具有挥发性,易挥发,B正确;浓硝酸的氧化性强,常温时可使铁发生钝化,不能生成氢气,C错误;浓硝酸不稳定,受热易分解,D错误。
【答案】 B
2
4
5
1
3
7
6
8
2. 我国清代《本草纲目拾遗》记录无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A. 氨水 B. 硝酸
C. 醋 D. 卤水
【解析】 根据所给四种物质的氧化性的强弱可判断,该强水为硝酸,硝酸具有强氧化性,可溶解大部分金属。故选B。
【答案】 B
2
4
5
3
7
6
8
3. 已知3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,则下列说法不正确的是( )
A. Cu作还原剂,HNO3作氧化剂
B. HNO3在该反应中只有部分表现出了氧化性
C. 每生成22.4 L(标准状况)NO,有3 mol电子转移
D. 如果有8 mol HNO3被还原,则生成了2 mol NO
1
【解析】 由化学方程式知,8 mol HNO3参加反应,生成2 mol NO,则被还原的HNO3为2 mol,D错误。
【答案】 D
2
4
5
3
7
6
8
4. 下列事实与括号中物质的性质对应关系正确的是( )
A. 浓硫酸与蔗糖混合后变黑(浓硫酸的吸水性)
B. 浓硫酸可以用来干燥Cl2、CO等气体(浓硫酸的脱水性)
C. 常温下,可用铝制容器盛装浓硝酸(浓硝酸的强氧化性)
D. 一般用棕色试剂瓶盛放硝酸(硝酸的挥发性)
1
【解析】 蔗糖与浓硫酸混合后变黑,体现浓硫酸的脱水性,A错误;浓硫酸具有吸水性,且与氯气和一氧化碳不反应,可以干燥氯气和一氧化碳气体,B错误;浓硝酸具有强氧化性,常温下能够使铝发生钝化,所以常温下可用铝制容器盛装浓硝酸,C正确;浓硝酸具有不稳定性,见光易分解,所以一般用棕色试剂瓶盛放硝酸,D错误。
【答案】 C
2
4
5
3
7
6
8
5. 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法不正确的是( )
1
A. 关闭活塞1,加入稀硝酸至液面a处
B. 在装置左侧稍加热可以增大稀硝酸与铜的反应速率
C. 通过关闭或开启活塞1可以控制反应的进行
D. 反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
2
4
5
3
7
6
8
1
【解析】 关闭活塞1,U形管内的空气无法排出,将无法加液体到液面a处,A错误;加热可以增大稀硝酸与铜的反应速率,B正确;关闭活塞1,生成的NO把稀硝酸压向右边,使铜丝与稀硝酸分离,C正确;想证明该气体为NO,必须使NO与O2接触,生成红棕色的NO2,D正确。
【答案】 A
2
4
5
3
7
6
8
6. 将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A. 反应速率:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
1
【解析】 硝酸越浓,氧化性越强,所以浓硝酸和铜反应速率大,A错误。根据化学方程式Cu+4HNO3(浓)===Cu(NO3)2+2H2O+2NO2↑和3Cu+8HNO3(稀)===3Cu(NO3)2+4H2O+2NO↑可知,B正确,C错误。反应中消耗的铜一样多,所以转移的电子数一样多,D错误。
【答案】 B
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【解析】 该反应没有副产物生成,原子完全利用,无污染物产生,符合绿色化学理念,A不符合题意;该反应无污染物产生,符合绿色化学理念,B不符合题意;该反应生成了二氧化硫,对环境有污染,不符合绿色化学理念,C符合题意;该反应没有污染物生成,符合绿色化学理念,D不符合题意。
【答案】 C
2
4
5
3
7
6
8
8. 向盛有一定量浓硝酸的试管中加入6.4 g铜片发生反应。
(1) 开始阶段,观察到的现象为________________________________ __________________________,反应的化学方程式是_________________ ________________________________。
(2) 反应结束后,铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式是_____________________________ ____________________。
1
铜片逐渐溶解,溶液由无色变为
蓝色,产生红棕色的气体
Cu+4HNO3(浓)
===Cu(NO3)2+2NO2↑+2H2O
+2NO↑+4H2O
2
4
5
3
7
6
8
(3) 若6.4 g铜片消耗完时,共产生气体2.8 L(标准状况),则整个反应过程中所消耗的硝酸的物质的量是_________________。
(4) 浓硝酸通常保存在棕色试剂瓶中,原因是____________________ _____________________(用化学方程式表示)。
(5) 工业上氨催化氧化的化学方程式为________________________ ____________。
1
0.325 mol
4NO2↑+O2↑+2H2O
6H2O
谢谢观看
Thank you for watching
专题7
氮与社会可持续发展
第二单元 重要的含氮化工原料
课题2 硝酸
学 习 目 标
1. 了解硝酸的物理性质和化学性质(酸性、强氧化性、不稳定性)。
2. 认识浓硝酸在常温下与铁、铝的钝化作用。
3. 了解浓、稀硝酸的主要性质和在生产中的应用。
活 动 方 案
1. 观察老师展示的试剂瓶中的浓硝酸,讨论、学习硝酸的物理性质。
【答案】 硝酸是一种无色、易挥发、具有刺激性气味的液体,能与水以任意比互溶,沸点为 83 ℃,密度为1.42 g·cm-3。
2. 浓硝酸密封保存在玻璃瓶中,为什么?打开瓶塞(一般是塑料塞)看到什么现象?
【答案】 浓硝酸易挥发,所以要密封保存在玻璃瓶中。打开瓶塞可看到瓶口产生白雾,是挥发出的硝酸分子与空气中的水蒸气形成的酸雾。
活动一:了解硝酸的物理性质
1. 为什么试剂瓶中的浓硝酸往往略显黄色?
活动二:分析浓硝酸的颜色及原因
2. 实验室中的浓硝酸常保存在无色试剂瓶中吗?
【答案】 不是,为防止HNO3见光分解,浓硝酸通常保存在棕色试剂瓶中。
1. 完成下列实验报告。
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2 mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(如右图所示),观察实验现象。
活动三:探究浓、稀硝酸的性质
【实验2】在上述装置中,用分液漏斗向试管内加5 mL水,稀释硝酸,继续收集产生的气体,观察实验现象。
【实验3】将一小块木炭放在酒精灯上加热至红热,然后投入盛有浓硝酸的试管中。
【实验4】将一段除去表面氧化膜的光亮铁圈(或铝圈)用细铁丝系好,轻轻放到盛有浓硝酸的烧杯中,片刻后小心取出,再浸入CuSO4溶液中,取出后用玻璃棒轻轻敲击铁圈(或铝圈),观察变化。
【实验5】分别将少量紫色石蕊试液加入浓硝酸、稀硝酸中。
实验序号 实验现象 实验结论(或化学方程式)
实验1
实验2
试管内生成红棕色气体,集气瓶中气体为无色,试管内溶液颜色逐渐变为绿色
开始反应较慢,然后逐渐加快;铜丝表面产生无色气泡,溶液变蓝
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
实验序号 实验现象 实验结论(或化学方程式)
实验3
实验4
实验5
木炭在试管中跳动,同时产生红棕色气体
从浓硝酸中取出时以及从硫酸铜溶液中取出时,铁圈(或铝圈)表面均无明显变化,敲击铁圈(或铝圈)后,铁圈(或铝圈)立即变红
铁(或铝)在浓硝酸中发生了钝化,表面形成一层致密的氧化物薄膜,不能和CuSO4溶液反应,取出并敲击铁圈(或铝圈)后,氧化膜被破坏,内层的铁(或铝)暴露并和其表面附着的CuSO4溶液反应生成铜
浓硝酸先变红后褪色,稀硝酸只变红
浓硝酸的氧化性强于稀硝酸
2. 讨论:硝酸的浓度与还原产物的化合价有什么关系?
【答案】 硝酸浓度越大,其还原产物中氮元素的价态越高;硝酸浓度越小,其还原产物中氮元素的价态越低。
3. 讨论:工业生产中怎样储存运输浓硝酸?
【答案】 用铝制或铁制容器储存运输浓硝酸。
【归纳总结】
(1) 硝酸与金属的反应
①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属,如3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O;
②活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同;
③常温下,浓硝酸能使Fe、Al钝化,因此可用铝或铁制容器贮存浓硝酸。
工业制备流程图
活动四:了解硝酸的工业生产
工业生产硝酸流程如下:
(1) 氨在催化剂的作用下与氧气发生反应,生成一氧化氮。
(2) 一氧化氮进一步被氧气氧化,生成二氧化氮。
【答案】 2NO+O2===2NO2
(3) 用水吸收二氧化氮,生成硝酸。
写出上述制备硝酸的化学方程式。
【答案】 3NO2+H2O===2HNO3+NO
1. 思维模型
活动五:硝酸与金属反应的相关计算
2. 计算方法(以Cu与硝酸反应为例)
(1) 原子守恒法:反应前所有的N只存在于HNO3中,反应后含N的物质有HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,若HNO3过量,则过量HNO3中也含N,则有n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n(HNO3)剩。
3. 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生标准状况下的一氧化氮和二氧化氮混合气体共11.2 L。请回答下列问题:
(1) 产生一氧化氮的体积为______________L(标准状况下)。
(2) 待反应结束后,向溶液中加入V mL a mol·L-1的氢氧化钠溶液,
恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸的浓度为____________ mol·L-1(不必化简)。
(3) 欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要氧气___________mol。
5.824
0.255
课 堂 反 馈
2
4
5
1
3
7
6
8
1. (2020·扬州期末)下列有关浓硝酸的说法正确的是( )
A. 保存在无色试剂瓶中 B. 易挥发
C. 常温下与铁反应放出氢气 D. 受热不分解
【解析】 浓硝酸见光易分解,应该保存在棕色试剂瓶中,A错误;硝酸的沸点低,所以浓硝酸具有挥发性,易挥发,B正确;浓硝酸的氧化性强,常温时可使铁发生钝化,不能生成氢气,C错误;浓硝酸不稳定,受热易分解,D错误。
【答案】 B
2
4
5
1
3
7
6
8
2. 我国清代《本草纲目拾遗》记录无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A. 氨水 B. 硝酸
C. 醋 D. 卤水
【解析】 根据所给四种物质的氧化性的强弱可判断,该强水为硝酸,硝酸具有强氧化性,可溶解大部分金属。故选B。
【答案】 B
2
4
5
3
7
6
8
3. 已知3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,则下列说法不正确的是( )
A. Cu作还原剂,HNO3作氧化剂
B. HNO3在该反应中只有部分表现出了氧化性
C. 每生成22.4 L(标准状况)NO,有3 mol电子转移
D. 如果有8 mol HNO3被还原,则生成了2 mol NO
1
【解析】 由化学方程式知,8 mol HNO3参加反应,生成2 mol NO,则被还原的HNO3为2 mol,D错误。
【答案】 D
2
4
5
3
7
6
8
4. 下列事实与括号中物质的性质对应关系正确的是( )
A. 浓硫酸与蔗糖混合后变黑(浓硫酸的吸水性)
B. 浓硫酸可以用来干燥Cl2、CO等气体(浓硫酸的脱水性)
C. 常温下,可用铝制容器盛装浓硝酸(浓硝酸的强氧化性)
D. 一般用棕色试剂瓶盛放硝酸(硝酸的挥发性)
1
【解析】 蔗糖与浓硫酸混合后变黑,体现浓硫酸的脱水性,A错误;浓硫酸具有吸水性,且与氯气和一氧化碳不反应,可以干燥氯气和一氧化碳气体,B错误;浓硝酸具有强氧化性,常温下能够使铝发生钝化,所以常温下可用铝制容器盛装浓硝酸,C正确;浓硝酸具有不稳定性,见光易分解,所以一般用棕色试剂瓶盛放硝酸,D错误。
【答案】 C
2
4
5
3
7
6
8
5. 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法不正确的是( )
1
A. 关闭活塞1,加入稀硝酸至液面a处
B. 在装置左侧稍加热可以增大稀硝酸与铜的反应速率
C. 通过关闭或开启活塞1可以控制反应的进行
D. 反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
2
4
5
3
7
6
8
1
【解析】 关闭活塞1,U形管内的空气无法排出,将无法加液体到液面a处,A错误;加热可以增大稀硝酸与铜的反应速率,B正确;关闭活塞1,生成的NO把稀硝酸压向右边,使铜丝与稀硝酸分离,C正确;想证明该气体为NO,必须使NO与O2接触,生成红棕色的NO2,D正确。
【答案】 A
2
4
5
3
7
6
8
6. 将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A. 反应速率:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
1
【解析】 硝酸越浓,氧化性越强,所以浓硝酸和铜反应速率大,A错误。根据化学方程式Cu+4HNO3(浓)===Cu(NO3)2+2H2O+2NO2↑和3Cu+8HNO3(稀)===3Cu(NO3)2+4H2O+2NO↑可知,B正确,C错误。反应中消耗的铜一样多,所以转移的电子数一样多,D错误。
【答案】 B
2
4
5
3
7
6
8
1
2
4
5
3
7
6
8
1
【解析】 该反应没有副产物生成,原子完全利用,无污染物产生,符合绿色化学理念,A不符合题意;该反应无污染物产生,符合绿色化学理念,B不符合题意;该反应生成了二氧化硫,对环境有污染,不符合绿色化学理念,C符合题意;该反应没有污染物生成,符合绿色化学理念,D不符合题意。
【答案】 C
2
4
5
3
7
6
8
8. 向盛有一定量浓硝酸的试管中加入6.4 g铜片发生反应。
(1) 开始阶段,观察到的现象为________________________________ __________________________,反应的化学方程式是_________________ ________________________________。
(2) 反应结束后,铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式是_____________________________ ____________________。
1
铜片逐渐溶解,溶液由无色变为
蓝色,产生红棕色的气体
Cu+4HNO3(浓)
===Cu(NO3)2+2NO2↑+2H2O
+2NO↑+4H2O
2
4
5
3
7
6
8
(3) 若6.4 g铜片消耗完时,共产生气体2.8 L(标准状况),则整个反应过程中所消耗的硝酸的物质的量是_________________。
(4) 浓硝酸通常保存在棕色试剂瓶中,原因是____________________ _____________________(用化学方程式表示)。
(5) 工业上氨催化氧化的化学方程式为________________________ ____________。
1
0.325 mol
4NO2↑+O2↑+2H2O
6H2O
谢谢观看
Thank you for watching
