安徽省淮北市濉溪县淮海中学2022~2023学年九年级下学期开学模拟化学试题(word 解析版)
文档属性
| 名称 | 安徽省淮北市濉溪县淮海中学2022~2023学年九年级下学期开学模拟化学试题(word 解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 414.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 15:16:44 | ||
图片预览




文档简介
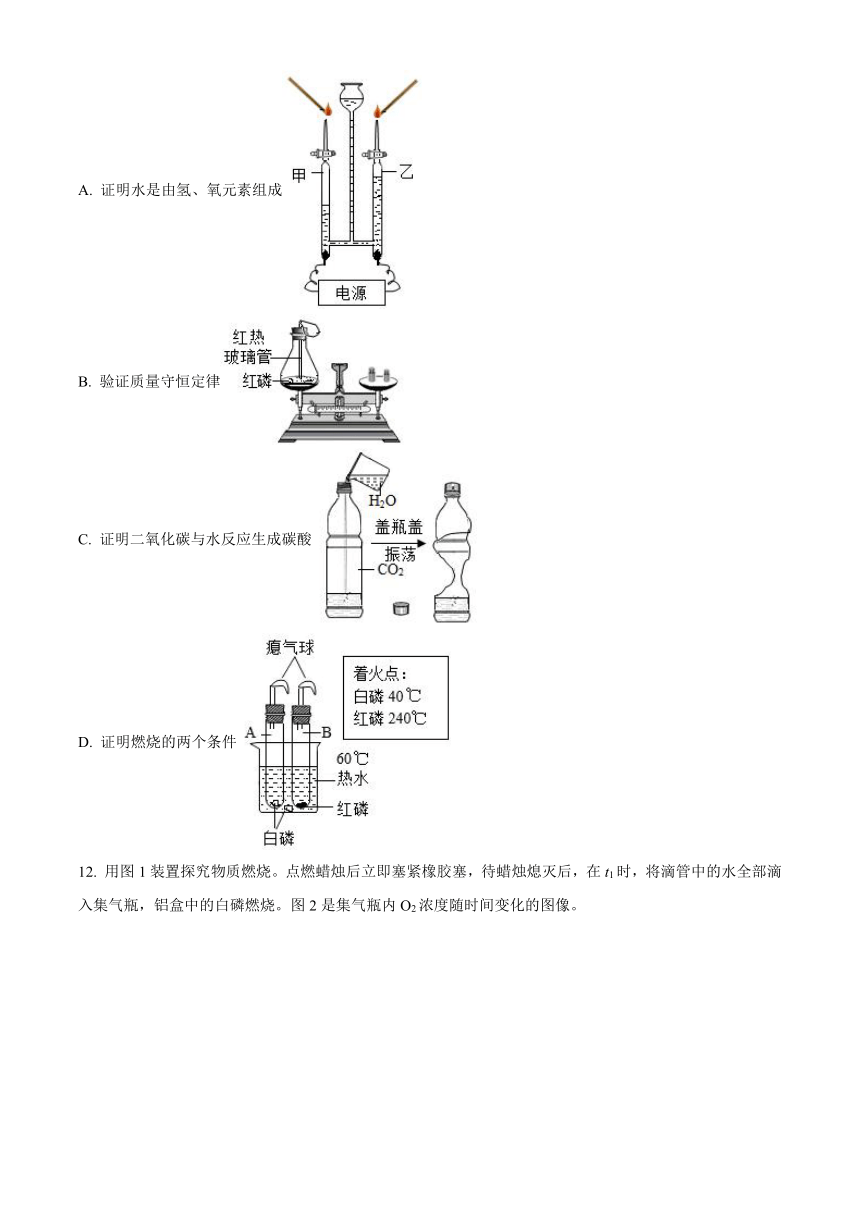
2022~2023学年度下学期九年级化学开学模拟试题
附相对原子质量:H-1;C-12;N-14;O-16;Ca-40。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1. 下列说法中,发生了化学变化的是
A. 高炉炼铁 B. 石油分馏
C. 分离液态空气法制氧气 D. 电灯通入稀有气体发出有色光
2. 化学与人类生活、社会可持续发展密切相关,环境保护问题已经引起人们广泛的关注,下列说法不利于环境保护的是
A. 加快化石燃料的开采与使用 B. 推广新能源汽车替代燃油汽车
C. 推广使用节能环保材料 D. 用晶体硅制作太阳能电池将太阳能直接转化为电能
3. 稀土有“工业维生素”的美誉。铥是一种重要的稀土元素,铥元素在元素周期表中的部分信息如图所示。下列说法错误的是
A. 铥元素属于金属元素 B. 铥元素的原子序数为69
C. 铥原子的核外电子数为69 D. 铥的相对原子质量为168.9 g
4. 下列基本实验操作正确的是
A. 用橡皮塞塞住试管 B. 如热液体
C. 过滤 D. 滴加液体
5. 最近科学家发现,水在﹣157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠。下列关于这种“高密度液态水”的说法正确的是
A. 化学性质与普通水不同 B. 分子不再运动
C. 氢、氧两种原子的个数比为2:1 D. 分子间的间隔比普通水大
6. 味精是重要的调味品,其主要成分为谷氨酸钠(C5H8NNaO4)。下列说法错误的是
A. 谷氨酸钠由五种元素组成 B. 谷氨酸钠中氧元素质量分数最大
C. 谷氨酸钠由19个原子构成 D. 谷氨酸钠燃烧可能产生导致酸雨的气体
7. 据报道,科学家开发出一种新型催化剂,能在光照下将二氧化碳转化为甲烷(反应的微观过程如下图所示)。下列有关该反应的说法正确的是
A. 反应前后氧元素的化合价没有改变
B. 反应的二氧化碳和水的质量比为11:9
C. 反应前后元素的个数和种类均不变
D. 生成的甲烷和氧气的分子个数比为1:1
8. 下列对实验现象的描述,正确的是
A. 向氯化钙溶液中通入适量的二氧化碳气体,无白色沉淀产生
B. 电解水时可观察到正极与负极产生的气体体积比约为2:1
C. 一氧化碳与氧化铁反应的实验中,玻璃管中的黑色固体变成红色
D. 硫在空气中燃烧产生微弱的淡蓝色火焰,生成二氧化硫
9. 分类是化学常用的方法。下列分类方法正确的是
A 金属:金、铁、金刚石 B. 可再生能源:天然气、酒精、沼气
C. 氧化物:干冰、水、液氧 D. 混合物:空气、医用酒精、石油
10. 逻辑推理是化学学习常用的思维方法,下列推理正确的是
A. 点燃可燃性气体前要验纯,所以点燃一氧化碳前一定要验纯
B. 分子由原子构成,所以分子一定比原子大
C. 离子是带电荷的粒子,所以带电荷的粒子一定是离子
D. 单质是由同种元素组成的物质,则只含一种元素的物质一定是单质
11. 下列不能达到实验目的的是
A. 证明水是由氢、氧元素组成
B. 验证质量守恒定律
C. 证明二氧化碳与水反应生成碳酸
D. 证明燃烧的两个条件
12. 用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法不正确的是
A. 0-t1内,O2浓度下降与蜡烛燃烧有关
B. 生石灰的作用是与水反应放热,引燃白磷
C. 该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同
D. 滴入水后,CO2浓度可能下降
二、本大题包括5小题,共28分
13. 阅读下列短文,回答问题。
超临界二氧化碳是指温度低于31.26℃,压力高于72.9个大气压时,CO2形成气态与液态交融在一起的流体,超临界CO2在减压、升温又可变成普通气体。超临界CO2流体具有惊人的溶解能力,可用它作为高效绿色的环保溶剂,尤其是用来提取中草药中的有效成分。
水在温度、压强分别超过374℃和219个大气压时转变为超临界状态。超临界水能够与氧气以任意比例互溶,因此在高温高压下,可将有机物不经过燃烧直接完全氧化为清洁的H2O、CO2,该技术称为超临界水氧化技术。如550℃时,在密闭容器中,测得乙醇(C2H6O)在超临界水中的氧化结果如图所示。
(1)文中超临界CO2流体是____________(填“纯净物”或“混合物”)。
(2)写出乙醇完全燃烧时的化学方程式________。
(3)下列说法正确的是 (填字母序号)。
A. 形成不同物质的超临界流体所需条件不同
B. 超临界CO2流体与普通CO2气体化学性质不同
C. 物质形成超临界流体后所含分子不再运动
D. 超临界CO2溶解中草药中的有效成分后减压、升温可与之分离
E. 超临界水氧化技术相对物质直接燃烧具有的优点是节能、环保
(4)图中CO分布分数先增后降的原因是_______。
14. 化学是一门以实验为基础的自然科学。实验室有如图1装置:
(1)仪器a的名称______。
(2)用A装置制取氧气,发生反应的方程式为______。
(3)用装置C制二氧化碳该装置所具有优点是______。当关闭止水夹,多孔隔板处依次观察到的现象是______(用字母e、f、g对如图2所示现象进行排序)。
(4)二氧化碳只能用E收集原因______。
15. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和硫酸锌,同学们设计了如图实验方案。试回答:
(1)固体B是___________,固体D是___________。
(2)写出向固体B中加入足量稀盐酸发生的化学方程式___________。
(3)方案中X是___________,废液的质量___________(填“大于”、“小于”或“等于”)滤液A的质量。
16. 某化学兴趣小组利用如图1实验装置探究铁生锈的条件。
【提出问题】铁生锈的条件是什么?
【设计实验】取3根无锈的铁丝设计如图1所示的三个实验。
【实验现象】实验Ⅰ中铁丝生锈,当铁丝足量,时间足够长,打开止水夹后,还能观察到的现象是___________。
【实验结论】对比实验___________(填序号),可以得出铁生锈需要氧气:得出“铁生锈需要与氧气接触”这一结论所依据现象是___________。对比实验___________(填序号),可以得出铁生锈需要水。
【拓展延伸】小明发现,海边铁制渔船上的锈迹比江边铁制渔船的多,他提出问题:海水会加快铁的生锈吗?为验证这一问题,设计如图2所示实验,并按照下表药品进行A、B两个实验,根据实验数据绘制图3.
实验 实验药品
实验A 长5 cm、直径1 mm铁丝,15 mL蒸馏水
实验B 长5 cm、一定粗细铁丝,15 mL海水
①实验B中铁丝的直径最好是___________。
②根据图3,说明铁生锈会___________(选填“吸收”或“放出”)热量。
③根据图3,可以得出结论___________。
【反思交流】
暖宝宝反应原理与铁锈蚀原理相同。根据以上探究分析,为了加快暖宝宝发热速度,原料中除铁粉和活性炭外,还可以加入___________(填物质类别或名称)。暖宝宝发热时,铁粉与氧气、水蒸气在催化剂作用下迅速的发生反应生成氢氧化铁。请写出该反应的化学方程式___________。
17. 某化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数。取12.5 g样品和稀盐酸放入如图甲所示装置,当将过量稀盐酸全部加入锥形瓶中,充分反应后,天平示数的变化如图乙所示。
【提示】石灰石中其它杂质成分与盐酸不反应,浓硫酸有吸水性,可将水蒸气留在装置中。
(1)由图乙可得本实验产生二氧化碳的质量为___________。
(2)计算石灰石样品中CaCO3的质量分数。(写出计算过程)
(3)若将装置中的浓硫酸撤掉,则实验后计算得到的碳酸钙的质量分数会___________(填“偏大”“偏小”或“不变”)
答案解析
附相对原子质量:H-1;C-12;N-14;O-16;Ca-40。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1. 下列说法中,发生了化学变化的是
A. 高炉炼铁 B. 石油分馏
C. 分离液态空气法制氧气 D. 电灯通入稀有气体发出有色光
【答案】A
【解析】
【详解】A.高炉炼铁是铁矿石与一氧化碳在高温下生成了生铁和二氧化碳,高炉炼铁发生了化学变化。
B.石油的分馏是利用石油中各成分的沸点不同,将它们分离,过程中没有新物质生成,属于物理变化。
C.分离液态空气制氧气是根据液态氧和液态氮沸点不同,液态氮先分离出去,剩下的主要是液态氧。过程中没有新物质生成,属于物理变化。
D.稀有气体通电时发光过程中没有新物质生成,属于物理变化。
综上所述:选择A。
2. 化学与人类生活、社会可持续发展密切相关,环境保护问题已经引起人们广泛的关注,下列说法不利于环境保护的是
A. 加快化石燃料的开采与使用 B. 推广新能源汽车替代燃油汽车
C. 推广使用节能环保材料 D. 用晶体硅制作太阳能电池将太阳能直接转化为电能
【答案】A
【解析】
【详解】A.加快化石燃料的开采和使用,会造成资源浪费,且会产生大量的污染物,污染环境,符合题意;
B.推广新能源汽车替代燃油汽车,可以减少化石燃料的使用,减少污染物的排放,保护环境,不符合题意;
C.推广使用节能环保材料,可以节约能源,减少污染物的排放,保护环境,不符合题意;
D.用晶体硅制作太阳能电池将太阳能直接转化为电能,可以节约能源,减少污染物的排放,不符合题意。
故选A。
3. 稀土有“工业维生素”的美誉。铥是一种重要的稀土元素,铥元素在元素周期表中的部分信息如图所示。下列说法错误的是
A. 铥元素属于金属元素 B. 铥元素的原子序数为69
C. 铥原子的核外电子数为69 D. 铥的相对原子质量为168.9 g
【答案】D
【解析】
【详解】A.铥元素属于金属元素,带“金”字旁的都是金属元素,故A正确;
B.如图所示,左上角的数字是原子序数,铥元素的原子序数为69,故B正确;
C.如图所示,左上角的数字是原子序数,原子序数=质子数=核外电子数,则铥原子的核外电子数为69,故C正确;
D.相对原子质量是一个比值,单位是“1”,常省略不写,不是“g”,故D错误。
故选:D。
4. 下列基本实验操作正确的是
A. 用橡皮塞塞住试管 B. 如热液体
C. 过滤 D. 滴加液体
【答案】D
【解析】
【详解】A.用橡皮塞塞住试管,不用把试管抵在桌面上,避免将试管弄破,故A错误;
B.给液体加热时,液体的体积不能超过试管容积的,故B错误;
C.过滤时,应用玻璃棒引流,故C错误;
D.滴加液体时,胶头滴管应竖直悬空于试管口正上方,否则会污染试剂,故D正确。
故选D。
5. 最近科学家发现,水在﹣157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠。下列关于这种“高密度液态水”的说法正确的是
A. 化学性质与普通水不同 B. 分子不再运动
C. 氢、氧两种原子的个数比为2:1 D. 分子间的间隔比普通水大
【答案】C
【解析】
【详解】试题分析:水在﹣157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠。这种“高密度液态水”本身仍然是水,所以氢、氧两种原子的个数比为2:1。故选C.
考点:基本概念和原理
6. 味精是重要的调味品,其主要成分为谷氨酸钠(C5H8NNaO4)。下列说法错误的是
A. 谷氨酸钠由五种元素组成 B. 谷氨酸钠中氧元素质量分数最大
C. 谷氨酸钠由19个原子构成 D. 谷氨酸钠燃烧可能产生导致酸雨的气体
【答案】C
【解析】
【详解】A.由谷氨酸钠的化学式可知,谷氨酸钠由碳、氢、氮、钠、氧五种元素组成,说法正确,故不符合题意;
B.根据化合物中某元素质量分数公式:可知,某元素的质量越大,其质量分数越大,由谷氨酸钠的化学式可知,碳、氢、氮、钠、氧五种元素的质量依次为:、、、、,可知,氧元素的质量最大,所以氧元素质量分数最大,说法正确,故不符合题意;
C.由谷氨酸钠的化学式可知,谷氨酸钠是由谷氨酸钠分子构成的,1个谷氨酸钠分子由5个碳原子、8个氢原子、1个氮原子、1个钠原子和4个氧原子,即19个原子构成,说法错误,故符合题意;
D.由谷氨酸钠的化学式可知,谷氨酸钠中含有氮元素,根据质量守恒定律可知,燃烧后可能生成氮的氧化物,所以谷氨酸钠燃烧可能产生导致酸雨的气体,说法正确,故不符合题意。
故选C。
7. 据报道,科学家开发出一种新型催化剂,能在光照下将二氧化碳转化为甲烷(反应的微观过程如下图所示)。下列有关该反应的说法正确的是
A. 反应前后氧元素的化合价没有改变
B. 反应的二氧化碳和水的质量比为11:9
C. 反应前后元素的个数和种类均不变
D. 生成的甲烷和氧气的分子个数比为1:1
【答案】B
【解析】
【详解】A.反应前氧元素化合价为-2价,反应后生成氧气中氧元素的化合价为0价,化合价发生改变,故A错误;
B.在光照和催化剂条件下,二氧化碳和水生成甲烷和氧气,方程式为 ,反应中二氧化碳和水的质量比为44:36=11:9,故B正确;
C、元素只论种类不论个数,故C错误;
D、由质量守恒定律可知,反应后生成的甲烷和氧气的分子个数比为1:2,故D错误;
故选B。
8. 下列对实验现象的描述,正确的是
A. 向氯化钙溶液中通入适量的二氧化碳气体,无白色沉淀产生
B. 电解水时可观察到正极与负极产生的气体体积比约为2:1
C. 一氧化碳与氧化铁反应的实验中,玻璃管中的黑色固体变成红色
D. 硫在空气中燃烧产生微弱的淡蓝色火焰,生成二氧化硫
【答案】A
【解析】
【详解】A、向氯化钙溶液中通入适量的二氧化碳气体,不反应,无白色沉淀产生,故选项说法正确;
B、电解水时可观察到正极与负极产生的气体体积比约为1:2,故选项说法错误;
C、一氧化碳与氧化铁反应的实验中,玻璃管中的红色固体变成黑色,故选项说法错误;
D、硫在空气中燃烧产生微弱的淡蓝色火焰,生成二氧化硫是实验结论而不是实验现象,故选项说法错误。
故选A。
9. 分类是化学常用的方法。下列分类方法正确的是
A. 金属:金、铁、金刚石 B. 可再生能源:天然气、酒精、沼气
C. 氧化物:干冰、水、液氧 D. 混合物:空气、医用酒精、石油
【答案】D
【解析】
【详解】A. 金和铁属于金属,而金刚石是碳,不属于金属,不符合题意;
B. 酒精和沼气都属于可再生能源,而天然气属于不可再生能源,不符合题意;
C.干冰是二氧化碳,由碳元素和氧元素组成,属于氧化物,水由氢元素和氧元素组成,属于氧化物,而液氧是氧气,由氧元素组成,属于单质,不符合题意;
D.空气中有氮气、氧气等多种物质,属于混合物,医用酒精中含有酒精和水,属于混合物,石油属于混合物,符合题意。
故选D。
10. 逻辑推理是化学学习常用的思维方法,下列推理正确的是
A. 点燃可燃性气体前要验纯,所以点燃一氧化碳前一定要验纯
B. 分子由原子构成,所以分子一定比原子大
C. 离子是带电荷的粒子,所以带电荷的粒子一定是离子
D. 单质是由同种元素组成的物质,则只含一种元素的物质一定是单质
【答案】A
【解析】
【详解】A.可燃性气体不纯时点燃会发生爆炸,则点燃之前要验纯,一氧化碳为可燃性气体,则点燃之前要验纯,该选项推理正确;
B.分子是由原子构成,则分子一定比构成它的原子大,但分子不一定比其它原子大,该选项推理不正确;
C.离子是带电荷的粒子,但原子中,质子和电子也带电,则带电荷的粒子不一定是离子,该选项推理不正确;
D.单质是由同种元素组成的纯净物,则只含有一种元素的物质不一定是单质,还可能是混合物,该选项推理不正确。
故选A。
11. 下列不能达到实验目的的是
A. 证明水是由氢、氧元素组成
B. 验证质量守恒定律
C. 证明二氧化碳与水反应生成碳酸
D. 证明燃烧的两个条件
【答案】C
【解析】
【详解】A.用燃着的木条分别检验两极产生的气体,甲管气体能燃烧,产生淡蓝色的火焰,即为氢气,乙管能够使燃着的木条燃烧更旺,即为氧气,即电解水生成氢气和氧气,氢气是由氢元素组成的,氧气是由氧元素组成的,根据质量守恒定律,反应前后元素种类不变,故可证明水是由氢元素和氧元素组成的,故A能达到实验目的;
B.红磷与氧气点燃生成五氧化二磷,该反应在密闭容器中进行,没有物质逸出,反应前后容器中物质的总质量不变,故可用于验证质量守恒定律,故B能达到实验目的;
C.向装有二氧化碳的塑料瓶中加少量水,振荡后,塑料瓶变瘪,不能证明二氧化碳与水反应生成碳酸,也可能是因为二氧化碳溶于水,塑料瓶中的气体减少,压强减小,导致塑料瓶变瘪,故C不能达到实验目的;
D.试管A中的白磷燃烧,试管B中的红磷不燃烧,说明燃烧需要温度达到可燃物的着火点;试管A中的白磷燃烧,烧杯中的白磷不燃烧,说明燃烧需要与氧气接触,故该实验可以证明燃烧的两个条件,故D能达到实验目的;
故选C。
12. 用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法不正确的是
A. 0-t1内,O2浓度下降与蜡烛燃烧有关
B. 生石灰的作用是与水反应放热,引燃白磷
C. 该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同
D. 滴入水后,CO2浓度可能下降
【答案】C
【解析】
【详解】A.在0-t1时间内,蜡烛燃烧消耗瓶内空气中的氧气,使瓶内压强浓度下降。A正确。
B.生石灰与水反应放出大量的热,使瓶内温度升高,温度易得到白磷的着火点40℃。B正确。
C.据图2可知白磷和蜡烛燃烧需要的最低O2浓度不同。C错。
D.瓶内滴入水后,部分二氧化碳能溶于水或与水反应,CO2浓度可能下降。D正确。
综上所述:选择C。
二、本大题包括5小题,共28分
13. 阅读下列短文,回答问题。
超临界二氧化碳是指温度低于31.26℃,压力高于72.9个大气压时,CO2形成气态与液态交融在一起的流体,超临界CO2在减压、升温又可变成普通气体。超临界CO2流体具有惊人的溶解能力,可用它作为高效绿色的环保溶剂,尤其是用来提取中草药中的有效成分。
水在温度、压强分别超过374℃和219个大气压时转变为超临界状态。超临界水能够与氧气以任意比例互溶,因此在高温高压下,可将有机物不经过燃烧直接完全氧化为清洁的H2O、CO2,该技术称为超临界水氧化技术。如550℃时,在密闭容器中,测得乙醇(C2H6O)在超临界水中的氧化结果如图所示。
(1)文中超临界CO2流体是____________(填“纯净物”或“混合物”)。
(2)写出乙醇完全燃烧时的化学方程式________。
(3)下列说法正确的是 (填字母序号)。
A. 形成不同物质的超临界流体所需条件不同
B. 超临界CO2流体与普通CO2气体化学性质不同
C. 物质形成超临界流体后所含分子不再运动
D. 超临界CO2溶解中草药中的有效成分后减压、升温可与之分离
E. 超临界水氧化技术相对物质直接燃烧具有优点是节能、环保
(4)图中CO分布分数先增后降的原因是_______。
【答案】(1)纯净物 (2) (3)ADE
(4)超临界水氧化乙醇首先生成一氧化碳,然后再氧化成二氧化碳
【解析】
【小问1详解】
超临界二氧化碳是指温度低于31.26℃,压力高于72.9个大气压时,CO2形成气态与液态交融在一起的流体,只含有二氧化碳一种物质,属于纯净物。
【小问2详解】
乙醇燃烧和氧气反应生成水和二氧化碳,反应的化学方程式为。
【小问3详解】
A.由题干可知,形成超临界二氧化碳、超临界水条件不同,故形成不同物质的超临界流体所需条件不同,正确;
B. 超临界CO2流体与普通CO2气体都是由二氧化碳分子构成的,化学性质相同,错误;
C.原子、分子永远在不同的运动,错误;
D.超临界CO2溶解中草药中的有效成分后减压、升温,超临界CO2在减压、升温又可变成普通气体,可与之分离,正确;
E.由题干可知,在高温高压下,可将有机物不经过燃烧直接完全氧化为清洁H2O、CO2,该技术称为超临界水氧化技术;超临界水氧化技术相对物质直接燃烧具有的优点是节能、环保,正确;
故选ADE。
【小问4详解】
CO分布分数先增后降的原因是超临界水氧化乙醇首先生成一氧化碳,然后再氧化成二氧化碳。
14. 化学是一门以实验为基础的自然科学。实验室有如图1装置:
(1)仪器a的名称______。
(2)用A装置制取氧气,发生反应的方程式为______。
(3)用装置C制二氧化碳该装置所具有的优点是______。当关闭止水夹,多孔隔板处依次观察到的现象是______(用字母e、f、g对如图2所示现象进行排序)。
(4)二氧化碳只能用E收集原因______。
【答案】(1)锥形瓶 (2)
(3)①可以随时控制反应的发生与停止 ②g→f→e
(4)二氧化碳能溶于水,且密度比空气大
【解析】
【小问1详解】
仪器a的名称是锥形瓶。
【小问2详解】
用A装置制取氧气,反应物的状态是固体,反应条件需要加热,由于试管口未放棉花,则应为加热氯酸钾和二氧化锰的混合物制取氧气,氯酸钾在二氧化锰催化和加热条件下生成氯化钾和氧气,该反应的化学方程式为2KClO32KCl+3O2↑。
【小问3详解】
装置C能通过关闭或打开止水夹控制反应的发生和停止。用装置C制取二氧化碳时,当关闭止水夹,试管内气体增多,压强增大,使得长颈漏斗内液面上升,试管内液面下降,逐渐下降到多孔隔板以下,反应物分离,反应停止,故多孔隔板处依次观察到的现象是gfe。
【小问4详解】
二氧化碳能溶于水,不能采用排水法收集;二氧化碳的密度比空气大,只能采用向上排空气法收集。
【点睛】本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气和二氧化碳气体的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键。
15. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和硫酸锌,同学们设计了如图实验方案。试回答:
(1)固体B是___________,固体D是___________。
(2)写出向固体B中加入足量稀盐酸发生的化学方程式___________。
(3)方案中X是___________,废液的质量___________(填“大于”、“小于”或“等于”)滤液A的质量。
【答案】(1) ①铁##Fe ②铜##Cu
(2)
(3)①锌##Zn ②大于
【解析】
【小问1详解】
固体A是铁、铜、锌的混合物,能被磁铁吸引的是铁,则固体B是铁;固体C是剩下的铜、锌,锌与稀硫酸反应,铜不能,所以固体D是铜。【小问2详解】
固体B是铁,固体B中加入足量稀盐酸即铁与稀盐酸反应生成氯化亚铁和氢气。化学方程式。
【小问3详解】
含有CuSO4、ZnSO4、FeSO4的废液加入过量x,得到的固体A是铁、铜、锌的混合物和滤液A,滤液A蒸发至干得到硫酸锌,说明x是锌;
由反应的质量比可知,废液的质量大于滤液A的质量。
16. 某化学兴趣小组利用如图1实验装置探究铁生锈的条件。
【提出问题】铁生锈的条件是什么?
【设计实验】取3根无锈的铁丝设计如图1所示的三个实验。
【实验现象】实验Ⅰ中铁丝生锈,当铁丝足量,时间足够长,打开止水夹后,还能观察到的现象是___________。
【实验结论】对比实验___________(填序号),可以得出铁生锈需要氧气:得出“铁生锈需要与氧气接触”这一结论所依据的现象是___________。对比实验___________(填序号),可以得出铁生锈需要水。
【拓展延伸】小明发现,海边铁制渔船上的锈迹比江边铁制渔船的多,他提出问题:海水会加快铁的生锈吗?为验证这一问题,设计如图2所示实验,并按照下表药品进行A、B两个实验,根据实验数据绘制图3.
实验 实验药品
实验A 长5 cm、直径1 mm铁丝,15 mL蒸馏水
实验B 长5 cm、一定粗细的铁丝,15 mL海水
①实验B中铁丝的直径最好是___________。
②根据图3,说明铁生锈会___________(选填“吸收”或“放出”)热量。
③根据图3,可以得出结论___________。
【反思交流】
暖宝宝反应原理与铁锈蚀原理相同。根据以上探究分析,为了加快暖宝宝发热速度,原料中除铁粉和活性炭外,还可以加入___________(填物质类别或名称)。暖宝宝发热时,铁粉与氧气、水蒸气在催化剂作用下迅速的发生反应生成氢氧化铁。请写出该反应的化学方程式___________。
【答案】 ①右边液面下降,左边液面上升至刻度1 ②Ⅰ、Ⅲ ③实验Ⅰ中铁生锈,实验Ⅲ中铁不能生锈 ④Ⅰ、Ⅱ ⑤1mm ⑥放出 ⑦海水会加快铁的生锈 ⑧氯化钠(合理即可) ⑨
【解析】
【详解】实验现象:实验I中铁丝生锈,消耗了氧气,当铁丝足量,时间足够长,能将装置内氧气耗尽,由于消耗了氧气,装置内压强减小,氧气约占空气体积的,故打开止水夹,可观察到的现象是:右边液面下降,左边液面上升至刻度1;
实验结论:实验Ⅰ中铁与氧气和水接触,生锈,实验Ⅲ中铁只与水接触,不生锈,故对比实验Ⅰ、Ⅲ,可以得到铁生锈需要氧气;依据的现象是:实验Ⅰ中铁生锈,实验Ⅲ中铁不能生锈;
实验Ⅰ中铁与氧气和水接触,生锈,实验Ⅱ中铁只与氧气接触,不生锈,故对比实验Ⅰ、Ⅱ,说明铁生锈需要水;
拓展延伸:①该实验是探究海水能否加快铁的锈蚀,故除了水的种类不同,其它因素均应相同,故实验B里铁丝的直径最好是1 mm;
②根据图3,铁生锈过程中温度逐渐升高,说明铁生锈会放出热量;
③根据图3,在其它条件相同的情况下,实验2中温度上升的快,说明海水会加快铁的生锈;
反思交流:暖宝宝反应原理与铁锈蚀原理相同。由以上实验可知,海水会加速铁的锈蚀,海水中含氯化钠,故为了加快暖宝宝发热速度,原料中除铁粉和活性炭外,还可以加入氯化钠等;
铁粉与氧气、水蒸气在催化剂作用下迅速的发生反应生成氢氧化铁,该反应的化学方程式为:。
17. 某化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数。取12.5g样品和稀盐酸放入如图甲所示装置,当将过量稀盐酸全部加入锥形瓶中,充分反应后,天平示数的变化如图乙所示。
【提示】石灰石中其它杂质成分与盐酸不反应,浓硫酸有吸水性,可将水蒸气留在装置中。
(1)由图乙可得本实验产生二氧化碳的质量为___________。
(2)计算石灰石样品中CaCO3质量分数。(写出计算过程)
(3)若将装置中的浓硫酸撤掉,则实验后计算得到的碳酸钙的质量分数会___________(填“偏大”“偏小”或“不变”)
【答案】(1)4.4 g
(2)设石灰石样品中CaCO3的质量为x,则
解得x=10 g
则石灰石样品中CaCO3的质量分数为
答:石灰石样品中CaCO3的质量分数为80%。 (3)偏大
【解析】
【小问1详解】
根据质量守恒定律可知,生成的二氧化碳的质量为310.4 g-306 g=4.4 g。
【小问2详解】
见答案。
【小问3详解】
浓硫酸具有吸水性,能干燥生成的二氧化碳,若将浓硫酸撤掉,则产生的二氧化碳气体会带走一部分水,从而减少的质量偏大,则计算得到的碳酸钙的质量分数会偏大。
附相对原子质量:H-1;C-12;N-14;O-16;Ca-40。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1. 下列说法中,发生了化学变化的是
A. 高炉炼铁 B. 石油分馏
C. 分离液态空气法制氧气 D. 电灯通入稀有气体发出有色光
2. 化学与人类生活、社会可持续发展密切相关,环境保护问题已经引起人们广泛的关注,下列说法不利于环境保护的是
A. 加快化石燃料的开采与使用 B. 推广新能源汽车替代燃油汽车
C. 推广使用节能环保材料 D. 用晶体硅制作太阳能电池将太阳能直接转化为电能
3. 稀土有“工业维生素”的美誉。铥是一种重要的稀土元素,铥元素在元素周期表中的部分信息如图所示。下列说法错误的是
A. 铥元素属于金属元素 B. 铥元素的原子序数为69
C. 铥原子的核外电子数为69 D. 铥的相对原子质量为168.9 g
4. 下列基本实验操作正确的是
A. 用橡皮塞塞住试管 B. 如热液体
C. 过滤 D. 滴加液体
5. 最近科学家发现,水在﹣157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠。下列关于这种“高密度液态水”的说法正确的是
A. 化学性质与普通水不同 B. 分子不再运动
C. 氢、氧两种原子的个数比为2:1 D. 分子间的间隔比普通水大
6. 味精是重要的调味品,其主要成分为谷氨酸钠(C5H8NNaO4)。下列说法错误的是
A. 谷氨酸钠由五种元素组成 B. 谷氨酸钠中氧元素质量分数最大
C. 谷氨酸钠由19个原子构成 D. 谷氨酸钠燃烧可能产生导致酸雨的气体
7. 据报道,科学家开发出一种新型催化剂,能在光照下将二氧化碳转化为甲烷(反应的微观过程如下图所示)。下列有关该反应的说法正确的是
A. 反应前后氧元素的化合价没有改变
B. 反应的二氧化碳和水的质量比为11:9
C. 反应前后元素的个数和种类均不变
D. 生成的甲烷和氧气的分子个数比为1:1
8. 下列对实验现象的描述,正确的是
A. 向氯化钙溶液中通入适量的二氧化碳气体,无白色沉淀产生
B. 电解水时可观察到正极与负极产生的气体体积比约为2:1
C. 一氧化碳与氧化铁反应的实验中,玻璃管中的黑色固体变成红色
D. 硫在空气中燃烧产生微弱的淡蓝色火焰,生成二氧化硫
9. 分类是化学常用的方法。下列分类方法正确的是
A 金属:金、铁、金刚石 B. 可再生能源:天然气、酒精、沼气
C. 氧化物:干冰、水、液氧 D. 混合物:空气、医用酒精、石油
10. 逻辑推理是化学学习常用的思维方法,下列推理正确的是
A. 点燃可燃性气体前要验纯,所以点燃一氧化碳前一定要验纯
B. 分子由原子构成,所以分子一定比原子大
C. 离子是带电荷的粒子,所以带电荷的粒子一定是离子
D. 单质是由同种元素组成的物质,则只含一种元素的物质一定是单质
11. 下列不能达到实验目的的是
A. 证明水是由氢、氧元素组成
B. 验证质量守恒定律
C. 证明二氧化碳与水反应生成碳酸
D. 证明燃烧的两个条件
12. 用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法不正确的是
A. 0-t1内,O2浓度下降与蜡烛燃烧有关
B. 生石灰的作用是与水反应放热,引燃白磷
C. 该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同
D. 滴入水后,CO2浓度可能下降
二、本大题包括5小题,共28分
13. 阅读下列短文,回答问题。
超临界二氧化碳是指温度低于31.26℃,压力高于72.9个大气压时,CO2形成气态与液态交融在一起的流体,超临界CO2在减压、升温又可变成普通气体。超临界CO2流体具有惊人的溶解能力,可用它作为高效绿色的环保溶剂,尤其是用来提取中草药中的有效成分。
水在温度、压强分别超过374℃和219个大气压时转变为超临界状态。超临界水能够与氧气以任意比例互溶,因此在高温高压下,可将有机物不经过燃烧直接完全氧化为清洁的H2O、CO2,该技术称为超临界水氧化技术。如550℃时,在密闭容器中,测得乙醇(C2H6O)在超临界水中的氧化结果如图所示。
(1)文中超临界CO2流体是____________(填“纯净物”或“混合物”)。
(2)写出乙醇完全燃烧时的化学方程式________。
(3)下列说法正确的是 (填字母序号)。
A. 形成不同物质的超临界流体所需条件不同
B. 超临界CO2流体与普通CO2气体化学性质不同
C. 物质形成超临界流体后所含分子不再运动
D. 超临界CO2溶解中草药中的有效成分后减压、升温可与之分离
E. 超临界水氧化技术相对物质直接燃烧具有的优点是节能、环保
(4)图中CO分布分数先增后降的原因是_______。
14. 化学是一门以实验为基础的自然科学。实验室有如图1装置:
(1)仪器a的名称______。
(2)用A装置制取氧气,发生反应的方程式为______。
(3)用装置C制二氧化碳该装置所具有优点是______。当关闭止水夹,多孔隔板处依次观察到的现象是______(用字母e、f、g对如图2所示现象进行排序)。
(4)二氧化碳只能用E收集原因______。
15. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和硫酸锌,同学们设计了如图实验方案。试回答:
(1)固体B是___________,固体D是___________。
(2)写出向固体B中加入足量稀盐酸发生的化学方程式___________。
(3)方案中X是___________,废液的质量___________(填“大于”、“小于”或“等于”)滤液A的质量。
16. 某化学兴趣小组利用如图1实验装置探究铁生锈的条件。
【提出问题】铁生锈的条件是什么?
【设计实验】取3根无锈的铁丝设计如图1所示的三个实验。
【实验现象】实验Ⅰ中铁丝生锈,当铁丝足量,时间足够长,打开止水夹后,还能观察到的现象是___________。
【实验结论】对比实验___________(填序号),可以得出铁生锈需要氧气:得出“铁生锈需要与氧气接触”这一结论所依据现象是___________。对比实验___________(填序号),可以得出铁生锈需要水。
【拓展延伸】小明发现,海边铁制渔船上的锈迹比江边铁制渔船的多,他提出问题:海水会加快铁的生锈吗?为验证这一问题,设计如图2所示实验,并按照下表药品进行A、B两个实验,根据实验数据绘制图3.
实验 实验药品
实验A 长5 cm、直径1 mm铁丝,15 mL蒸馏水
实验B 长5 cm、一定粗细铁丝,15 mL海水
①实验B中铁丝的直径最好是___________。
②根据图3,说明铁生锈会___________(选填“吸收”或“放出”)热量。
③根据图3,可以得出结论___________。
【反思交流】
暖宝宝反应原理与铁锈蚀原理相同。根据以上探究分析,为了加快暖宝宝发热速度,原料中除铁粉和活性炭外,还可以加入___________(填物质类别或名称)。暖宝宝发热时,铁粉与氧气、水蒸气在催化剂作用下迅速的发生反应生成氢氧化铁。请写出该反应的化学方程式___________。
17. 某化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数。取12.5 g样品和稀盐酸放入如图甲所示装置,当将过量稀盐酸全部加入锥形瓶中,充分反应后,天平示数的变化如图乙所示。
【提示】石灰石中其它杂质成分与盐酸不反应,浓硫酸有吸水性,可将水蒸气留在装置中。
(1)由图乙可得本实验产生二氧化碳的质量为___________。
(2)计算石灰石样品中CaCO3的质量分数。(写出计算过程)
(3)若将装置中的浓硫酸撤掉,则实验后计算得到的碳酸钙的质量分数会___________(填“偏大”“偏小”或“不变”)
答案解析
附相对原子质量:H-1;C-12;N-14;O-16;Ca-40。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1. 下列说法中,发生了化学变化的是
A. 高炉炼铁 B. 石油分馏
C. 分离液态空气法制氧气 D. 电灯通入稀有气体发出有色光
【答案】A
【解析】
【详解】A.高炉炼铁是铁矿石与一氧化碳在高温下生成了生铁和二氧化碳,高炉炼铁发生了化学变化。
B.石油的分馏是利用石油中各成分的沸点不同,将它们分离,过程中没有新物质生成,属于物理变化。
C.分离液态空气制氧气是根据液态氧和液态氮沸点不同,液态氮先分离出去,剩下的主要是液态氧。过程中没有新物质生成,属于物理变化。
D.稀有气体通电时发光过程中没有新物质生成,属于物理变化。
综上所述:选择A。
2. 化学与人类生活、社会可持续发展密切相关,环境保护问题已经引起人们广泛的关注,下列说法不利于环境保护的是
A. 加快化石燃料的开采与使用 B. 推广新能源汽车替代燃油汽车
C. 推广使用节能环保材料 D. 用晶体硅制作太阳能电池将太阳能直接转化为电能
【答案】A
【解析】
【详解】A.加快化石燃料的开采和使用,会造成资源浪费,且会产生大量的污染物,污染环境,符合题意;
B.推广新能源汽车替代燃油汽车,可以减少化石燃料的使用,减少污染物的排放,保护环境,不符合题意;
C.推广使用节能环保材料,可以节约能源,减少污染物的排放,保护环境,不符合题意;
D.用晶体硅制作太阳能电池将太阳能直接转化为电能,可以节约能源,减少污染物的排放,不符合题意。
故选A。
3. 稀土有“工业维生素”的美誉。铥是一种重要的稀土元素,铥元素在元素周期表中的部分信息如图所示。下列说法错误的是
A. 铥元素属于金属元素 B. 铥元素的原子序数为69
C. 铥原子的核外电子数为69 D. 铥的相对原子质量为168.9 g
【答案】D
【解析】
【详解】A.铥元素属于金属元素,带“金”字旁的都是金属元素,故A正确;
B.如图所示,左上角的数字是原子序数,铥元素的原子序数为69,故B正确;
C.如图所示,左上角的数字是原子序数,原子序数=质子数=核外电子数,则铥原子的核外电子数为69,故C正确;
D.相对原子质量是一个比值,单位是“1”,常省略不写,不是“g”,故D错误。
故选:D。
4. 下列基本实验操作正确的是
A. 用橡皮塞塞住试管 B. 如热液体
C. 过滤 D. 滴加液体
【答案】D
【解析】
【详解】A.用橡皮塞塞住试管,不用把试管抵在桌面上,避免将试管弄破,故A错误;
B.给液体加热时,液体的体积不能超过试管容积的,故B错误;
C.过滤时,应用玻璃棒引流,故C错误;
D.滴加液体时,胶头滴管应竖直悬空于试管口正上方,否则会污染试剂,故D正确。
故选D。
5. 最近科学家发现,水在﹣157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠。下列关于这种“高密度液态水”的说法正确的是
A. 化学性质与普通水不同 B. 分子不再运动
C. 氢、氧两种原子的个数比为2:1 D. 分子间的间隔比普通水大
【答案】C
【解析】
【详解】试题分析:水在﹣157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠。这种“高密度液态水”本身仍然是水,所以氢、氧两种原子的个数比为2:1。故选C.
考点:基本概念和原理
6. 味精是重要的调味品,其主要成分为谷氨酸钠(C5H8NNaO4)。下列说法错误的是
A. 谷氨酸钠由五种元素组成 B. 谷氨酸钠中氧元素质量分数最大
C. 谷氨酸钠由19个原子构成 D. 谷氨酸钠燃烧可能产生导致酸雨的气体
【答案】C
【解析】
【详解】A.由谷氨酸钠的化学式可知,谷氨酸钠由碳、氢、氮、钠、氧五种元素组成,说法正确,故不符合题意;
B.根据化合物中某元素质量分数公式:可知,某元素的质量越大,其质量分数越大,由谷氨酸钠的化学式可知,碳、氢、氮、钠、氧五种元素的质量依次为:、、、、,可知,氧元素的质量最大,所以氧元素质量分数最大,说法正确,故不符合题意;
C.由谷氨酸钠的化学式可知,谷氨酸钠是由谷氨酸钠分子构成的,1个谷氨酸钠分子由5个碳原子、8个氢原子、1个氮原子、1个钠原子和4个氧原子,即19个原子构成,说法错误,故符合题意;
D.由谷氨酸钠的化学式可知,谷氨酸钠中含有氮元素,根据质量守恒定律可知,燃烧后可能生成氮的氧化物,所以谷氨酸钠燃烧可能产生导致酸雨的气体,说法正确,故不符合题意。
故选C。
7. 据报道,科学家开发出一种新型催化剂,能在光照下将二氧化碳转化为甲烷(反应的微观过程如下图所示)。下列有关该反应的说法正确的是
A. 反应前后氧元素的化合价没有改变
B. 反应的二氧化碳和水的质量比为11:9
C. 反应前后元素的个数和种类均不变
D. 生成的甲烷和氧气的分子个数比为1:1
【答案】B
【解析】
【详解】A.反应前氧元素化合价为-2价,反应后生成氧气中氧元素的化合价为0价,化合价发生改变,故A错误;
B.在光照和催化剂条件下,二氧化碳和水生成甲烷和氧气,方程式为 ,反应中二氧化碳和水的质量比为44:36=11:9,故B正确;
C、元素只论种类不论个数,故C错误;
D、由质量守恒定律可知,反应后生成的甲烷和氧气的分子个数比为1:2,故D错误;
故选B。
8. 下列对实验现象的描述,正确的是
A. 向氯化钙溶液中通入适量的二氧化碳气体,无白色沉淀产生
B. 电解水时可观察到正极与负极产生的气体体积比约为2:1
C. 一氧化碳与氧化铁反应的实验中,玻璃管中的黑色固体变成红色
D. 硫在空气中燃烧产生微弱的淡蓝色火焰,生成二氧化硫
【答案】A
【解析】
【详解】A、向氯化钙溶液中通入适量的二氧化碳气体,不反应,无白色沉淀产生,故选项说法正确;
B、电解水时可观察到正极与负极产生的气体体积比约为1:2,故选项说法错误;
C、一氧化碳与氧化铁反应的实验中,玻璃管中的红色固体变成黑色,故选项说法错误;
D、硫在空气中燃烧产生微弱的淡蓝色火焰,生成二氧化硫是实验结论而不是实验现象,故选项说法错误。
故选A。
9. 分类是化学常用的方法。下列分类方法正确的是
A. 金属:金、铁、金刚石 B. 可再生能源:天然气、酒精、沼气
C. 氧化物:干冰、水、液氧 D. 混合物:空气、医用酒精、石油
【答案】D
【解析】
【详解】A. 金和铁属于金属,而金刚石是碳,不属于金属,不符合题意;
B. 酒精和沼气都属于可再生能源,而天然气属于不可再生能源,不符合题意;
C.干冰是二氧化碳,由碳元素和氧元素组成,属于氧化物,水由氢元素和氧元素组成,属于氧化物,而液氧是氧气,由氧元素组成,属于单质,不符合题意;
D.空气中有氮气、氧气等多种物质,属于混合物,医用酒精中含有酒精和水,属于混合物,石油属于混合物,符合题意。
故选D。
10. 逻辑推理是化学学习常用的思维方法,下列推理正确的是
A. 点燃可燃性气体前要验纯,所以点燃一氧化碳前一定要验纯
B. 分子由原子构成,所以分子一定比原子大
C. 离子是带电荷的粒子,所以带电荷的粒子一定是离子
D. 单质是由同种元素组成的物质,则只含一种元素的物质一定是单质
【答案】A
【解析】
【详解】A.可燃性气体不纯时点燃会发生爆炸,则点燃之前要验纯,一氧化碳为可燃性气体,则点燃之前要验纯,该选项推理正确;
B.分子是由原子构成,则分子一定比构成它的原子大,但分子不一定比其它原子大,该选项推理不正确;
C.离子是带电荷的粒子,但原子中,质子和电子也带电,则带电荷的粒子不一定是离子,该选项推理不正确;
D.单质是由同种元素组成的纯净物,则只含有一种元素的物质不一定是单质,还可能是混合物,该选项推理不正确。
故选A。
11. 下列不能达到实验目的的是
A. 证明水是由氢、氧元素组成
B. 验证质量守恒定律
C. 证明二氧化碳与水反应生成碳酸
D. 证明燃烧的两个条件
【答案】C
【解析】
【详解】A.用燃着的木条分别检验两极产生的气体,甲管气体能燃烧,产生淡蓝色的火焰,即为氢气,乙管能够使燃着的木条燃烧更旺,即为氧气,即电解水生成氢气和氧气,氢气是由氢元素组成的,氧气是由氧元素组成的,根据质量守恒定律,反应前后元素种类不变,故可证明水是由氢元素和氧元素组成的,故A能达到实验目的;
B.红磷与氧气点燃生成五氧化二磷,该反应在密闭容器中进行,没有物质逸出,反应前后容器中物质的总质量不变,故可用于验证质量守恒定律,故B能达到实验目的;
C.向装有二氧化碳的塑料瓶中加少量水,振荡后,塑料瓶变瘪,不能证明二氧化碳与水反应生成碳酸,也可能是因为二氧化碳溶于水,塑料瓶中的气体减少,压强减小,导致塑料瓶变瘪,故C不能达到实验目的;
D.试管A中的白磷燃烧,试管B中的红磷不燃烧,说明燃烧需要温度达到可燃物的着火点;试管A中的白磷燃烧,烧杯中的白磷不燃烧,说明燃烧需要与氧气接触,故该实验可以证明燃烧的两个条件,故D能达到实验目的;
故选C。
12. 用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法不正确的是
A. 0-t1内,O2浓度下降与蜡烛燃烧有关
B. 生石灰的作用是与水反应放热,引燃白磷
C. 该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同
D. 滴入水后,CO2浓度可能下降
【答案】C
【解析】
【详解】A.在0-t1时间内,蜡烛燃烧消耗瓶内空气中的氧气,使瓶内压强浓度下降。A正确。
B.生石灰与水反应放出大量的热,使瓶内温度升高,温度易得到白磷的着火点40℃。B正确。
C.据图2可知白磷和蜡烛燃烧需要的最低O2浓度不同。C错。
D.瓶内滴入水后,部分二氧化碳能溶于水或与水反应,CO2浓度可能下降。D正确。
综上所述:选择C。
二、本大题包括5小题,共28分
13. 阅读下列短文,回答问题。
超临界二氧化碳是指温度低于31.26℃,压力高于72.9个大气压时,CO2形成气态与液态交融在一起的流体,超临界CO2在减压、升温又可变成普通气体。超临界CO2流体具有惊人的溶解能力,可用它作为高效绿色的环保溶剂,尤其是用来提取中草药中的有效成分。
水在温度、压强分别超过374℃和219个大气压时转变为超临界状态。超临界水能够与氧气以任意比例互溶,因此在高温高压下,可将有机物不经过燃烧直接完全氧化为清洁的H2O、CO2,该技术称为超临界水氧化技术。如550℃时,在密闭容器中,测得乙醇(C2H6O)在超临界水中的氧化结果如图所示。
(1)文中超临界CO2流体是____________(填“纯净物”或“混合物”)。
(2)写出乙醇完全燃烧时的化学方程式________。
(3)下列说法正确的是 (填字母序号)。
A. 形成不同物质的超临界流体所需条件不同
B. 超临界CO2流体与普通CO2气体化学性质不同
C. 物质形成超临界流体后所含分子不再运动
D. 超临界CO2溶解中草药中的有效成分后减压、升温可与之分离
E. 超临界水氧化技术相对物质直接燃烧具有优点是节能、环保
(4)图中CO分布分数先增后降的原因是_______。
【答案】(1)纯净物 (2) (3)ADE
(4)超临界水氧化乙醇首先生成一氧化碳,然后再氧化成二氧化碳
【解析】
【小问1详解】
超临界二氧化碳是指温度低于31.26℃,压力高于72.9个大气压时,CO2形成气态与液态交融在一起的流体,只含有二氧化碳一种物质,属于纯净物。
【小问2详解】
乙醇燃烧和氧气反应生成水和二氧化碳,反应的化学方程式为。
【小问3详解】
A.由题干可知,形成超临界二氧化碳、超临界水条件不同,故形成不同物质的超临界流体所需条件不同,正确;
B. 超临界CO2流体与普通CO2气体都是由二氧化碳分子构成的,化学性质相同,错误;
C.原子、分子永远在不同的运动,错误;
D.超临界CO2溶解中草药中的有效成分后减压、升温,超临界CO2在减压、升温又可变成普通气体,可与之分离,正确;
E.由题干可知,在高温高压下,可将有机物不经过燃烧直接完全氧化为清洁H2O、CO2,该技术称为超临界水氧化技术;超临界水氧化技术相对物质直接燃烧具有的优点是节能、环保,正确;
故选ADE。
【小问4详解】
CO分布分数先增后降的原因是超临界水氧化乙醇首先生成一氧化碳,然后再氧化成二氧化碳。
14. 化学是一门以实验为基础的自然科学。实验室有如图1装置:
(1)仪器a的名称______。
(2)用A装置制取氧气,发生反应的方程式为______。
(3)用装置C制二氧化碳该装置所具有的优点是______。当关闭止水夹,多孔隔板处依次观察到的现象是______(用字母e、f、g对如图2所示现象进行排序)。
(4)二氧化碳只能用E收集原因______。
【答案】(1)锥形瓶 (2)
(3)①可以随时控制反应的发生与停止 ②g→f→e
(4)二氧化碳能溶于水,且密度比空气大
【解析】
【小问1详解】
仪器a的名称是锥形瓶。
【小问2详解】
用A装置制取氧气,反应物的状态是固体,反应条件需要加热,由于试管口未放棉花,则应为加热氯酸钾和二氧化锰的混合物制取氧气,氯酸钾在二氧化锰催化和加热条件下生成氯化钾和氧气,该反应的化学方程式为2KClO32KCl+3O2↑。
【小问3详解】
装置C能通过关闭或打开止水夹控制反应的发生和停止。用装置C制取二氧化碳时,当关闭止水夹,试管内气体增多,压强增大,使得长颈漏斗内液面上升,试管内液面下降,逐渐下降到多孔隔板以下,反应物分离,反应停止,故多孔隔板处依次观察到的现象是gfe。
【小问4详解】
二氧化碳能溶于水,不能采用排水法收集;二氧化碳的密度比空气大,只能采用向上排空气法收集。
【点睛】本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气和二氧化碳气体的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键。
15. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和硫酸锌,同学们设计了如图实验方案。试回答:
(1)固体B是___________,固体D是___________。
(2)写出向固体B中加入足量稀盐酸发生的化学方程式___________。
(3)方案中X是___________,废液的质量___________(填“大于”、“小于”或“等于”)滤液A的质量。
【答案】(1) ①铁##Fe ②铜##Cu
(2)
(3)①锌##Zn ②大于
【解析】
【小问1详解】
固体A是铁、铜、锌的混合物,能被磁铁吸引的是铁,则固体B是铁;固体C是剩下的铜、锌,锌与稀硫酸反应,铜不能,所以固体D是铜。【小问2详解】
固体B是铁,固体B中加入足量稀盐酸即铁与稀盐酸反应生成氯化亚铁和氢气。化学方程式。
【小问3详解】
含有CuSO4、ZnSO4、FeSO4的废液加入过量x,得到的固体A是铁、铜、锌的混合物和滤液A,滤液A蒸发至干得到硫酸锌,说明x是锌;
由反应的质量比可知,废液的质量大于滤液A的质量。
16. 某化学兴趣小组利用如图1实验装置探究铁生锈的条件。
【提出问题】铁生锈的条件是什么?
【设计实验】取3根无锈的铁丝设计如图1所示的三个实验。
【实验现象】实验Ⅰ中铁丝生锈,当铁丝足量,时间足够长,打开止水夹后,还能观察到的现象是___________。
【实验结论】对比实验___________(填序号),可以得出铁生锈需要氧气:得出“铁生锈需要与氧气接触”这一结论所依据的现象是___________。对比实验___________(填序号),可以得出铁生锈需要水。
【拓展延伸】小明发现,海边铁制渔船上的锈迹比江边铁制渔船的多,他提出问题:海水会加快铁的生锈吗?为验证这一问题,设计如图2所示实验,并按照下表药品进行A、B两个实验,根据实验数据绘制图3.
实验 实验药品
实验A 长5 cm、直径1 mm铁丝,15 mL蒸馏水
实验B 长5 cm、一定粗细的铁丝,15 mL海水
①实验B中铁丝的直径最好是___________。
②根据图3,说明铁生锈会___________(选填“吸收”或“放出”)热量。
③根据图3,可以得出结论___________。
【反思交流】
暖宝宝反应原理与铁锈蚀原理相同。根据以上探究分析,为了加快暖宝宝发热速度,原料中除铁粉和活性炭外,还可以加入___________(填物质类别或名称)。暖宝宝发热时,铁粉与氧气、水蒸气在催化剂作用下迅速的发生反应生成氢氧化铁。请写出该反应的化学方程式___________。
【答案】 ①右边液面下降,左边液面上升至刻度1 ②Ⅰ、Ⅲ ③实验Ⅰ中铁生锈,实验Ⅲ中铁不能生锈 ④Ⅰ、Ⅱ ⑤1mm ⑥放出 ⑦海水会加快铁的生锈 ⑧氯化钠(合理即可) ⑨
【解析】
【详解】实验现象:实验I中铁丝生锈,消耗了氧气,当铁丝足量,时间足够长,能将装置内氧气耗尽,由于消耗了氧气,装置内压强减小,氧气约占空气体积的,故打开止水夹,可观察到的现象是:右边液面下降,左边液面上升至刻度1;
实验结论:实验Ⅰ中铁与氧气和水接触,生锈,实验Ⅲ中铁只与水接触,不生锈,故对比实验Ⅰ、Ⅲ,可以得到铁生锈需要氧气;依据的现象是:实验Ⅰ中铁生锈,实验Ⅲ中铁不能生锈;
实验Ⅰ中铁与氧气和水接触,生锈,实验Ⅱ中铁只与氧气接触,不生锈,故对比实验Ⅰ、Ⅱ,说明铁生锈需要水;
拓展延伸:①该实验是探究海水能否加快铁的锈蚀,故除了水的种类不同,其它因素均应相同,故实验B里铁丝的直径最好是1 mm;
②根据图3,铁生锈过程中温度逐渐升高,说明铁生锈会放出热量;
③根据图3,在其它条件相同的情况下,实验2中温度上升的快,说明海水会加快铁的生锈;
反思交流:暖宝宝反应原理与铁锈蚀原理相同。由以上实验可知,海水会加速铁的锈蚀,海水中含氯化钠,故为了加快暖宝宝发热速度,原料中除铁粉和活性炭外,还可以加入氯化钠等;
铁粉与氧气、水蒸气在催化剂作用下迅速的发生反应生成氢氧化铁,该反应的化学方程式为:。
17. 某化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数。取12.5g样品和稀盐酸放入如图甲所示装置,当将过量稀盐酸全部加入锥形瓶中,充分反应后,天平示数的变化如图乙所示。
【提示】石灰石中其它杂质成分与盐酸不反应,浓硫酸有吸水性,可将水蒸气留在装置中。
(1)由图乙可得本实验产生二氧化碳的质量为___________。
(2)计算石灰石样品中CaCO3质量分数。(写出计算过程)
(3)若将装置中的浓硫酸撤掉,则实验后计算得到的碳酸钙的质量分数会___________(填“偏大”“偏小”或“不变”)
【答案】(1)4.4 g
(2)设石灰石样品中CaCO3的质量为x,则
解得x=10 g
则石灰石样品中CaCO3的质量分数为
答:石灰石样品中CaCO3的质量分数为80%。 (3)偏大
【解析】
【小问1详解】
根据质量守恒定律可知,生成的二氧化碳的质量为310.4 g-306 g=4.4 g。
【小问2详解】
见答案。
【小问3详解】
浓硫酸具有吸水性,能干燥生成的二氧化碳,若将浓硫酸撤掉,则产生的二氧化碳气体会带走一部分水,从而减少的质量偏大,则计算得到的碳酸钙的质量分数会偏大。
同课章节目录
