化学人教版(2019)选择性必修1 2-1-2影响化学反应速率的因素 课件(共26张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2-1-2影响化学反应速率的因素 课件(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 550.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-08 15:41:53 | ||
图片预览







文档简介
(共26张PPT)
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素
大象牙膏
影响化学反应速率的因素有哪些?
思考
选择1个你认为可能会影响化学反应速率的因素,利用现有的药品,设计实验。
【实验药品】
0.1 mol/L H2SO4 溶液, 0.5 mol/L H2SO4 溶液,0.1 mol/L Na2S2O3溶液、二氧化锰粉末、5% H2O2、蒸馏水、热水等
提示: Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑ + S↓+ H2O
实验探究
1. 你们探究的是哪种影响速率因素?
2. 你们研究哪一个反应?
3. 你们的实验方案是什么?
4. 你们准备记录什么数据或如何比较反应快慢?
交流设计
0.1 mol/L H2SO4 溶液, 0.5 mol/L H2SO4 溶液,0.1 mol/L Na2S2O3溶液、二氧化锰粉末、5% H2O2、蒸馏水、热水等
浓度 温度 催化剂 压强……
2mL0.1mol/L Na2S2O3
+ 2mL 0.1mol/L H2SO4
浓度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
2mL 0.1mol/L Na2S2O3
+ 2mL0.5mol/L H2SO4
实验探究
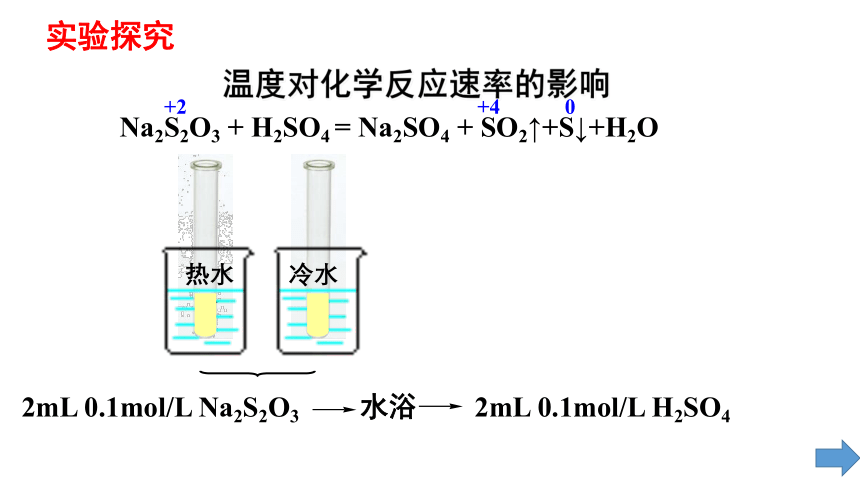
温度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
2mL 0.1mol/L Na2S2O3 水浴 2mL 0.1mol/L H2SO4
热水
冷水
实验探究
在两支试管中分别加入2mL 5%的H2O2溶液,再向其中一支H2O2溶液中加入少量二氧化锰粉末,比较二者的化学反应速率。
加入试剂 5%的H2O2溶液+二氧化锰粉末 5%的H2O2溶液
产生气泡快慢
结 论
催化剂对化学反应速率的影响
实验探究
如何利用化学原理解释以上实验规律呢?
几个核心概念:
有效碰撞、活化分子、活化能、单位体积内活化分子数、活化分子百分数
反应速率快慢分析模型:
反应速率越快
单位时间内
有效碰撞
几率越 。
单位体积内
活化分子数越 。
大
多
重点诠释
【温故知新,构建模型 】
抽象概念模型化,原理模型再简化
=
--普通分子
重点诠释
活化分子百分数
单位体积内活化分子数
浓度增大
v
有效碰撞
浓度对反应速率的影响
重点诠释
活化分子百分数
单位体积内活化分子数
温度升高
v
有效碰撞
温度对反应速率的影响
一方面
另一方面
重点诠释
活化分子百分数
单位体积内活化分子数
催化剂
v
有效碰撞
催化剂对反应速率的影响
重点诠释
增大压强,
化学反应速率如何改变呢?
浓度
温度
催化剂
【问题1】缩小体积,增大压强,速率如何改变?
N2+3H2 2NH3
讨论:对于反应
难点突破
【问题2】恒容条件下,充入He 气,增大压强,反应速率
如何改变?
【问题3】恒容条件下,中充入N2气,反应速率如何改变?
【问题4】恒压条件下,中充入He气,反应速率如何改变?
问题1、缩小体积,增大压强,速率如何改变?
N2+3H2 2NH3
讨论:对于反应
难点突破
N2+3H2 2NH3
问题2、恒容条件下,充入He 气,增大压强,反应速率如何改变?
讨论:对于反应
He分子
活化分子
增大 压强 ,
化学反应速率?
难点突破
N2+3H2 2NH3
问题3、恒容条件下,中充入N2气,反应速率如何改变?
问题4、恒压条件下,中充入He气,反应速率如何改变?
讨论:例1、对于反应
难点突破
例2.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率的影响是什么?
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
例3、对于反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) 改变其中一个反应条件对反应速率的影响状况。
瞬时速率
改变的条件 正反应速率 逆反应速率
1、增加Fe的量
2、增大水蒸气浓度
3、将容器体积缩小一半
4、保持体积不变,充氮气
5、保持压强不变,充氮气
6、升高温度
7、加催化剂
知识迁移
影响化学反应速率的因素
化学反应速率
内因(主因) :反应物本身性质
外因
浓度
温度
催化剂
压强
……
本堂小结
揭秘大象牙膏
5% H2O2还是30% H2O2
?
试剂:H2O2溶液,洗洁精,KI溶液
KI溶液的作用
1.同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的是( )
①锌粒 ②锌片 ③锌粉 ④5%的盐酸 ⑤10%的盐酸 ⑥15%的盐酸 ⑦加热 ⑧用冷水冷却 ⑨不断振荡 ⑩迅速混合后静置
A.②⑥⑦⑩ B.①④⑧⑩
C.③⑤⑦⑨ D.③⑥⑦⑨
D
学习评价
2.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度
③增大压强 ④移去生成物
⑤加入正催化剂
A.①②③ B.①②③⑤
C.②⑤ D.①②③④⑤
C
学习评价
3.下列有关有效碰撞理论和活化能的认识,正确的是 ( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大。
B.温度升高,分子动能增加,单位体积内活化分子数增多,故反应速率增大。
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大。
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率。
B
学习评价
谢 谢
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素
大象牙膏
影响化学反应速率的因素有哪些?
思考
选择1个你认为可能会影响化学反应速率的因素,利用现有的药品,设计实验。
【实验药品】
0.1 mol/L H2SO4 溶液, 0.5 mol/L H2SO4 溶液,0.1 mol/L Na2S2O3溶液、二氧化锰粉末、5% H2O2、蒸馏水、热水等
提示: Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑ + S↓+ H2O
实验探究
1. 你们探究的是哪种影响速率因素?
2. 你们研究哪一个反应?
3. 你们的实验方案是什么?
4. 你们准备记录什么数据或如何比较反应快慢?
交流设计
0.1 mol/L H2SO4 溶液, 0.5 mol/L H2SO4 溶液,0.1 mol/L Na2S2O3溶液、二氧化锰粉末、5% H2O2、蒸馏水、热水等
浓度 温度 催化剂 压强……
2mL0.1mol/L Na2S2O3
+ 2mL 0.1mol/L H2SO4
浓度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
2mL 0.1mol/L Na2S2O3
+ 2mL0.5mol/L H2SO4
实验探究
温度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
2mL 0.1mol/L Na2S2O3 水浴 2mL 0.1mol/L H2SO4
热水
冷水
实验探究
在两支试管中分别加入2mL 5%的H2O2溶液,再向其中一支H2O2溶液中加入少量二氧化锰粉末,比较二者的化学反应速率。
加入试剂 5%的H2O2溶液+二氧化锰粉末 5%的H2O2溶液
产生气泡快慢
结 论
催化剂对化学反应速率的影响
实验探究
如何利用化学原理解释以上实验规律呢?
几个核心概念:
有效碰撞、活化分子、活化能、单位体积内活化分子数、活化分子百分数
反应速率快慢分析模型:
反应速率越快
单位时间内
有效碰撞
几率越 。
单位体积内
活化分子数越 。
大
多
重点诠释
【温故知新,构建模型 】
抽象概念模型化,原理模型再简化
=
--普通分子
重点诠释
活化分子百分数
单位体积内活化分子数
浓度增大
v
有效碰撞
浓度对反应速率的影响
重点诠释
活化分子百分数
单位体积内活化分子数
温度升高
v
有效碰撞
温度对反应速率的影响
一方面
另一方面
重点诠释
活化分子百分数
单位体积内活化分子数
催化剂
v
有效碰撞
催化剂对反应速率的影响
重点诠释
增大压强,
化学反应速率如何改变呢?
浓度
温度
催化剂
【问题1】缩小体积,增大压强,速率如何改变?
N2+3H2 2NH3
讨论:对于反应
难点突破
【问题2】恒容条件下,充入He 气,增大压强,反应速率
如何改变?
【问题3】恒容条件下,中充入N2气,反应速率如何改变?
【问题4】恒压条件下,中充入He气,反应速率如何改变?
问题1、缩小体积,增大压强,速率如何改变?
N2+3H2 2NH3
讨论:对于反应
难点突破
N2+3H2 2NH3
问题2、恒容条件下,充入He 气,增大压强,反应速率如何改变?
讨论:对于反应
He分子
活化分子
增大 压强 ,
化学反应速率?
难点突破
N2+3H2 2NH3
问题3、恒容条件下,中充入N2气,反应速率如何改变?
问题4、恒压条件下,中充入He气,反应速率如何改变?
讨论:例1、对于反应
难点突破
例2.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率的影响是什么?
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
例3、对于反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) 改变其中一个反应条件对反应速率的影响状况。
瞬时速率
改变的条件 正反应速率 逆反应速率
1、增加Fe的量
2、增大水蒸气浓度
3、将容器体积缩小一半
4、保持体积不变,充氮气
5、保持压强不变,充氮气
6、升高温度
7、加催化剂
知识迁移
影响化学反应速率的因素
化学反应速率
内因(主因) :反应物本身性质
外因
浓度
温度
催化剂
压强
……
本堂小结
揭秘大象牙膏
5% H2O2还是30% H2O2
?
试剂:H2O2溶液,洗洁精,KI溶液
KI溶液的作用
1.同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的是( )
①锌粒 ②锌片 ③锌粉 ④5%的盐酸 ⑤10%的盐酸 ⑥15%的盐酸 ⑦加热 ⑧用冷水冷却 ⑨不断振荡 ⑩迅速混合后静置
A.②⑥⑦⑩ B.①④⑧⑩
C.③⑤⑦⑨ D.③⑥⑦⑨
D
学习评价
2.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度
③增大压强 ④移去生成物
⑤加入正催化剂
A.①②③ B.①②③⑤
C.②⑤ D.①②③④⑤
C
学习评价
3.下列有关有效碰撞理论和活化能的认识,正确的是 ( )
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大。
B.温度升高,分子动能增加,单位体积内活化分子数增多,故反应速率增大。
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大。
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率。
B
学习评价
谢 谢
