高中化学人教版(2019)选择性必修1学案(含答案) 2.1.2影响化学反应速率的因素 活化能
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1学案(含答案) 2.1.2影响化学反应速率的因素 活化能 | 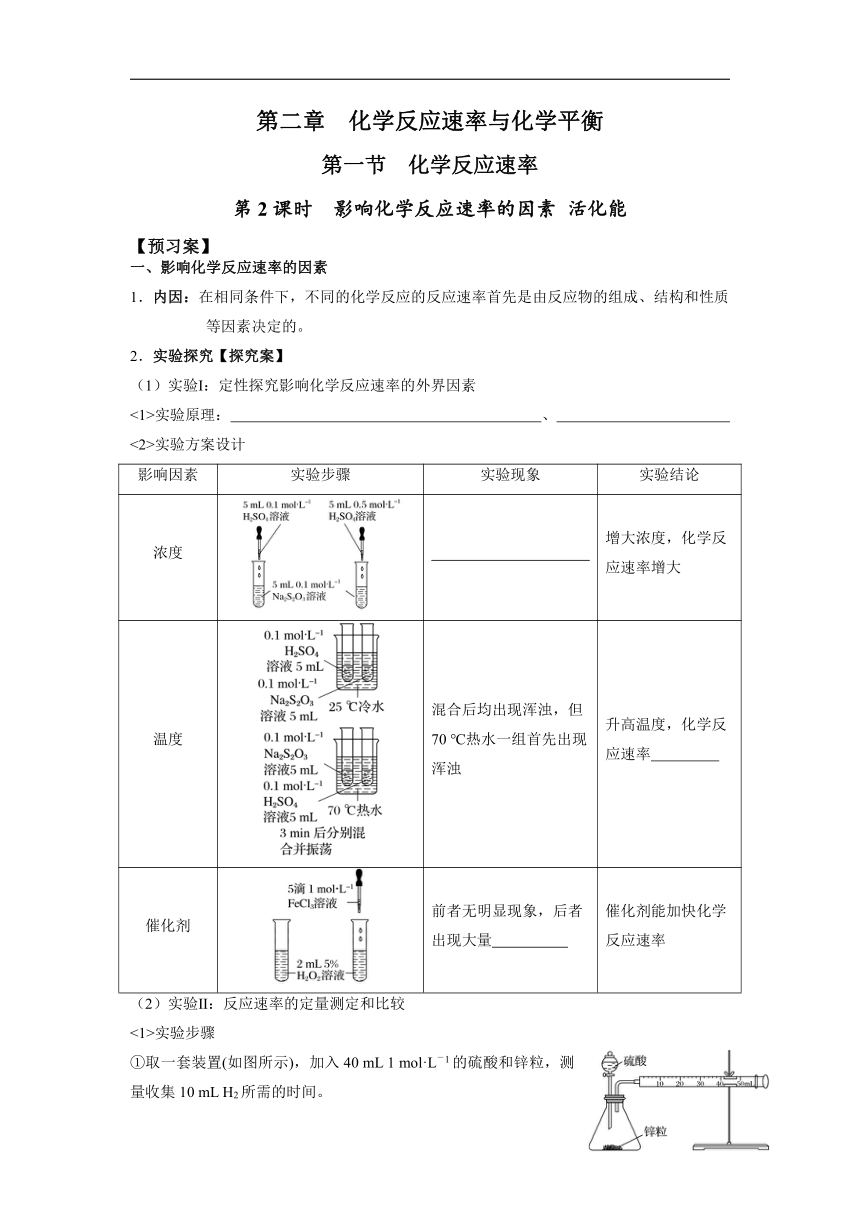 | |
| 格式 | zip | ||
| 文件大小 | 562.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-09 08:17:14 | ||
图片预览


文档简介
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素 活化能
【预习案】
一、影响化学反应速率的因素
1.内因:在相同条件下,不同的化学反应的反应速率首先是由反应物的组成、结构和性质等因素决定的。
2.实验探究【探究案】
(1)实验Ⅰ:定性探究影响化学反应速率的外界因素
<1>实验原理: 、
<2>实验方案设计
影响因素 实验步骤 实验现象 实验结论
浓度 增大浓度,化学反应速率增大
温度 混合后均出现浑浊,但70 ℃热水一组首先出现浑浊 升高温度,化学反应速率
催化剂 前者无明显现象,后者出现大量 催化剂能加快化学反应速率
(2)实验Ⅱ:反应速率的定量测定和比较
<1>实验步骤
①取一套装置(如图所示),加入40 mL 1 mol·L-1的硫酸和锌粒,测量收集10 mL H2所需的时间。
②取另一套装置,加入40 mL 4 mol·L-1的硫酸和锌粒,测量收集10 mL H2所需的时间。
加入试剂 反应时间(填“长”或“短”) 反应速率(填“快”或“慢”)
40 mL 1 mol·L-1硫酸 长 慢
40 mL 4 mol·L-1硫酸 短 快
<2>实验现象:锌与稀硫酸反应产生 ,收集10 mL气体,②所用时间比①所用时间 。
<3>实验结果
<4>实验结论:4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应的速率 。
3.外因
(1)在一般情况下,当其他条件相同时,增大反应物 ,化学反应速率 ;降低反应物浓度,化学反应速率减小。升高温度,化学反应速率 ;降低温度,化学反应速率 。催化剂可以改变化学反应速率。
(2)大量实验证明,温度每升高 ℃,化学反应速率通常增大为原来的 倍。这表明温度对反应速率的影响非常显著。
(3)压强对化学反应速率的影响
①研究对象:对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成 。
②影响规律:对于有气体参加的化学反应,在相同温度下, 压强(减小容器容积),反应速率 ;减小压强(增大容器容积),反应速率减小。
二、活化能
1.有效碰撞理论
(1)基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中每一步反应都称为 。
(2)反应机理:先后进行的基元反应反映了化学反应的 ,反应历程又称反应机理。
(3)基元反应发生的先决条件:基元反应发生的先决条件是反应物的分子必须发生 ,但是并不是每一次分子碰撞都能发生 。
(4)有效碰撞
(5)活化能和活化分子
①活化分子:能够发生 的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是 的。
②活化能:活化分子具有的 与反应物分子具有的平均能量之差,叫做反应的 。
(6)反应物、生成物的能量与活化能的关系图
2.基元反应发生经历的过程
3.有效碰撞理论对影响化学反应速率因素的解释
(1)浓度:反应物浓度增大→单位体积内活化分子数 →单位时间内 的次数增加→反应速率增大;反之,反应速率减小。
(2)压强:增大 →气体体积 →反应物浓度 →单位体积内活化分子数增多→单位时间内 的次数增加→反应速率增大;反之,反应速率减小。
即压强对化学反应速率的影响,可转化成 对化学反应速率的影响。
(3)温度:升高温度→ 的百分数增大→单位时间内有效碰撞的次数 → 反应速率增大;反之,反应速率减小。
(4)催化剂:使用催化剂→改变了反应的历程,反应的 降低→活化分子的 增大→单位时间内有效碰撞的几率增加→反应速率加快。
【训练案】
1.在一密闭容器中充入1 mol H2和1 mol I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次平衡时反应速率一定加快
2.在1 L的密闭容器中,碳酸钙与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论错误的是
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=0.1 mol·L-1. min-1
3.下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
4.如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,活化分子的百分数不变,但反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
题号 1 2 3 4
答案
参考答案
一、 Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O 2H2O22H2O+O2↑
均出现浑浊,但后者出现浑浊更快 增大 气泡 气泡 短 快 浓度 增大 增大 减小 10 2~4 反比 增大 增大
二、基元反应 反应历程 碰撞 化学反应 有效碰撞 一定 平均能量 活化能 增多 有效碰撞 压强 缩小 增大 有效碰撞 浓度 活化分子 增加 活化能 百分数
【训练案】AACC
第一节 化学反应速率
第2课时 影响化学反应速率的因素 活化能
【预习案】
一、影响化学反应速率的因素
1.内因:在相同条件下,不同的化学反应的反应速率首先是由反应物的组成、结构和性质等因素决定的。
2.实验探究【探究案】
(1)实验Ⅰ:定性探究影响化学反应速率的外界因素
<1>实验原理: 、
<2>实验方案设计
影响因素 实验步骤 实验现象 实验结论
浓度 增大浓度,化学反应速率增大
温度 混合后均出现浑浊,但70 ℃热水一组首先出现浑浊 升高温度,化学反应速率
催化剂 前者无明显现象,后者出现大量 催化剂能加快化学反应速率
(2)实验Ⅱ:反应速率的定量测定和比较
<1>实验步骤
①取一套装置(如图所示),加入40 mL 1 mol·L-1的硫酸和锌粒,测量收集10 mL H2所需的时间。
②取另一套装置,加入40 mL 4 mol·L-1的硫酸和锌粒,测量收集10 mL H2所需的时间。
加入试剂 反应时间(填“长”或“短”) 反应速率(填“快”或“慢”)
40 mL 1 mol·L-1硫酸 长 慢
40 mL 4 mol·L-1硫酸 短 快
<2>实验现象:锌与稀硫酸反应产生 ,收集10 mL气体,②所用时间比①所用时间 。
<3>实验结果
<4>实验结论:4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应的速率 。
3.外因
(1)在一般情况下,当其他条件相同时,增大反应物 ,化学反应速率 ;降低反应物浓度,化学反应速率减小。升高温度,化学反应速率 ;降低温度,化学反应速率 。催化剂可以改变化学反应速率。
(2)大量实验证明,温度每升高 ℃,化学反应速率通常增大为原来的 倍。这表明温度对反应速率的影响非常显著。
(3)压强对化学反应速率的影响
①研究对象:对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成 。
②影响规律:对于有气体参加的化学反应,在相同温度下, 压强(减小容器容积),反应速率 ;减小压强(增大容器容积),反应速率减小。
二、活化能
1.有效碰撞理论
(1)基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中每一步反应都称为 。
(2)反应机理:先后进行的基元反应反映了化学反应的 ,反应历程又称反应机理。
(3)基元反应发生的先决条件:基元反应发生的先决条件是反应物的分子必须发生 ,但是并不是每一次分子碰撞都能发生 。
(4)有效碰撞
(5)活化能和活化分子
①活化分子:能够发生 的分子。
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是 的。
②活化能:活化分子具有的 与反应物分子具有的平均能量之差,叫做反应的 。
(6)反应物、生成物的能量与活化能的关系图
2.基元反应发生经历的过程
3.有效碰撞理论对影响化学反应速率因素的解释
(1)浓度:反应物浓度增大→单位体积内活化分子数 →单位时间内 的次数增加→反应速率增大;反之,反应速率减小。
(2)压强:增大 →气体体积 →反应物浓度 →单位体积内活化分子数增多→单位时间内 的次数增加→反应速率增大;反之,反应速率减小。
即压强对化学反应速率的影响,可转化成 对化学反应速率的影响。
(3)温度:升高温度→ 的百分数增大→单位时间内有效碰撞的次数 → 反应速率增大;反之,反应速率减小。
(4)催化剂:使用催化剂→改变了反应的历程,反应的 降低→活化分子的 增大→单位时间内有效碰撞的几率增加→反应速率加快。
【训练案】
1.在一密闭容器中充入1 mol H2和1 mol I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次平衡时反应速率一定加快
2.在1 L的密闭容器中,碳酸钙与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论错误的是
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=0.1 mol·L-1. min-1
3.下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
4.如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,活化分子的百分数不变,但反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
题号 1 2 3 4
答案
参考答案
一、 Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O 2H2O22H2O+O2↑
均出现浑浊,但后者出现浑浊更快 增大 气泡 气泡 短 快 浓度 增大 增大 减小 10 2~4 反比 增大 增大
二、基元反应 反应历程 碰撞 化学反应 有效碰撞 一定 平均能量 活化能 增多 有效碰撞 压强 缩小 增大 有效碰撞 浓度 活化分子 增加 活化能 百分数
【训练案】AACC
