3.3.4 晶体类型的判断和不同晶体熔沸点的比较 课件 (共26张PPT)高二化学同步(人教版2019选择性必修2)
文档属性
| 名称 | 3.3.4 晶体类型的判断和不同晶体熔沸点的比较 课件 (共26张PPT)高二化学同步(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 15.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-09 08:24:08 | ||
图片预览







文档简介
(共26张PPT)
第三节 金属晶体与离子晶体
课时4
晶体类型、不同晶体熔沸点的比较
第三章 晶体结构与性质
学习
目标
PART
01
PART
02
熔点、沸点高低的比较
PART
03
晶体类型的判断
四类晶体的比较
01
四类晶体的
比较
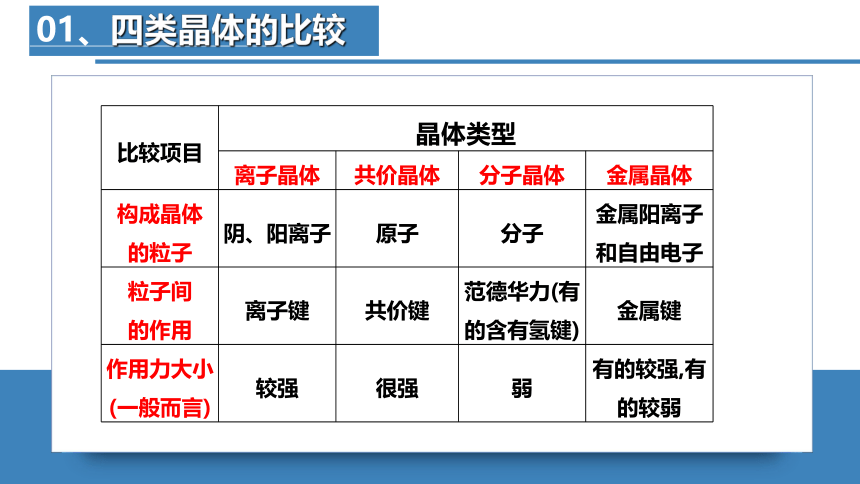
01、四类晶体的比较
比较项目 晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
构成晶体 的粒子 阴、阳离子 原子 分子 金属阳离子
和自由电子
粒子间 的作用 离子键 共价键 范德华力(有的含有氢键) 金属键
作用力大小 (一般而言) 较强 很强 弱 有的较强,有的较弱
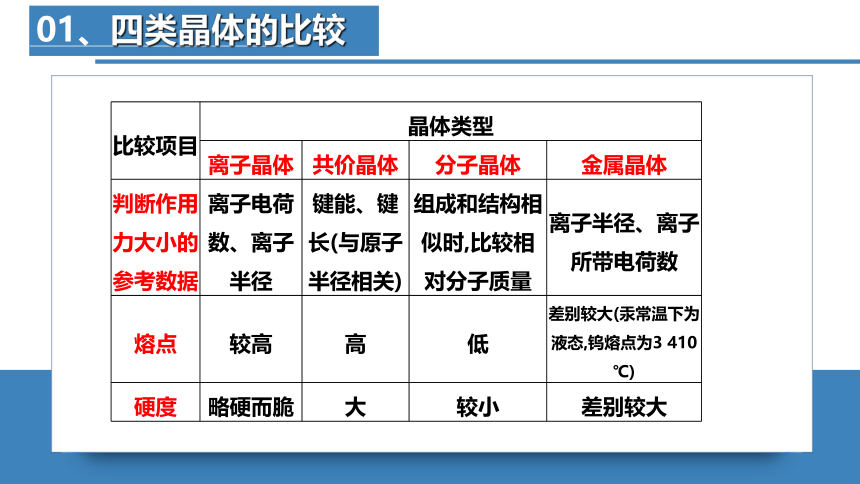
01、四类晶体的比较
比较项目 晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
判断作用 力大小的 参考数据 离子电荷数、离子半径 键能、键长(与原子半径相关) 组成和结构相似时,比较相对分子质量 离子半径、离子所带电荷数
熔点 较高 高 低 差别较大(汞常温下为液态,钨熔点为3 410 ℃)
硬度 略硬而脆 大 较小 差别较大
01、四类晶体的比较
比较项目 晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
导热和 导电性 不良导体 (熔融后或溶于水导电) 不良导体 不良导体(部分溶于水发生电离后导电) 良导体
溶解性 多数易溶 一般不溶 相似相溶 一般不溶于水,少数与水反应
机械加工性能 不良 不良 不良 优良
延展性 差 差 差 优良
02
晶体类型的判断
02、晶体类型的判断
(3)由阴、阳离子通过离子键形成的晶体属于离子晶体
(4)由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体
(1)由分子通过分子间作用力形成的晶体属于分子晶体
(2)由原子通过共价键形成的晶体属于共价晶体
1.根据构成晶体的微粒和粒子间的作用力类别进行判断
02、晶体类型的判断
(3)常见的共价晶体单质有金刚石、晶体硼、晶体硅、晶体锗等;常见的共价晶体化合物有碳化硅、SiO2、氮化硅、氮化硼等
(4)金属单质与合金属于金属晶体
(1)活泼金属的氧化物(如Na2O、Al2O3等)、强碱[如KOH、Ba(OH)2等]和绝大多数的盐类是离子晶体
(2)大多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体
2、依据物质的分类判断
02、晶体类型的判断
所以熔点由高到低顺序一般为共价晶体>离子晶体>分子晶体
共价晶体的熔点高,常在一千至几千摄氏度;离子晶体的熔点较高,常在数百至一千余摄氏度;分子晶体的熔点较低,常在数百摄氏度以下至很低温度;金属晶体多数熔点高,但也有熔点相当低的。
3、依据晶体的熔点判断
02、晶体类型的判断
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子,也能导电
(4)电金属晶体是电的良导体
(1)离子晶体在水溶液中及熔融状态下导电
(2)共价晶体一般为非导体,但晶体硅、锗等能导电
4、依据导电性判断
02、晶体类型的判断
(3)分子晶体硬度小且较脆
(4)金属晶体多数硬度大,但也有硬度较小的,且具有延展性
(1)离子晶体硬而脆
(2)共价晶体硬度大
5、依据硬度和机械性能判断
03
熔点、沸点高低的比较
03、熔点、沸点高低的比较
晶体的熔、沸点受组成晶体的粒子之间的作用力类型和强弱的影响。分子晶体中存在的是分子间作用力,比化学键弱得多,因此其熔、沸点比较低,
原子晶体中原子之间以共价键结合,金属晶体中是金属阳离子和自由电子之间形成的金属键,离子晶体中是离子键,这些作用都是化学键,比分子间作用力强得多,因此它们的熔、沸点一般比分子晶体要高。但是由于各类化学键又存在强弱的差异,所以又有不同。另外,即使是同一类型的化学键,由于成键主体不同,也会存在差异。
03、熔点、沸点高低的比较
不同类型的晶体一般来说,晶体的熔、沸点是:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等金属的熔、沸点很高,汞、铯等金属的熔、沸点很低。
03、熔点、沸点高低的比较
1、同类型的晶体——共价晶体
①晶体的熔、沸点高低取决于共价键的键长和键能。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。
一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
03、熔点、沸点高低的比较
2、同类型的晶体——金属晶体
②合金的熔点比组成合金的纯金属低
①金属离子半径越小,离子所带电荷数越多,
其金属键越强,金属的熔、沸点越高
03、熔点、沸点高低的比较
3、同类型的晶体——离子晶体
②离子所带的电荷数的影响大于离子半径的影响
①一般地,离子所带的电荷数越多,离子半径越小,
则离子间的作用力就越强,其离子晶体的熔、沸点就越高
03、熔点、沸点高低的比较
4、同类型的晶体——分子晶体
①分子间作用力:组成和结构相似的物质,随相对分子质量的增大,分子间作用力增大,其熔、沸点升高。如F203、熔点、沸点高低的比较
5、同类型的晶体——分子晶体
②氢键:物质的分子间有氢键,其熔、沸点就高。如H2O、H2S、H2Se、H2Te。如按范德华力的影响应该是沸点:H2O1.实现下列变化时,需克服相同类型作用力的是
A.二氧化硅和干冰的熔化B.氯化钠和铁的熔化C.烧碱和金刚砂的熔化D.冰和干冰的熔化
D
2.下列说法正确的是
A.干冰属于原子晶体
B.CH4分子中含有极性共价键,所以是极性分子
C.所有的金属元素都分布在d区和ds区
D.离子键、氢键、范德华力本质上都是静电作用
D
3、用“>”或“<”填空:
(1)晶体熔点:CF4 CCl4 CBr4 CI4
(2)硬度:金刚石 碳化硅 晶体硅
(3)熔点:Na Mg Al
(4)熔点:NaF NaCl NaBr NaI
(5)熔点:SiO2 NaCl CO2
< < <
> >
< <
> >
> > >
4.下列有关化学用语使用正确的是
A.氯化钠熔化时离子键被破坏
B.晶体中分子间作用力越大,分子越稳定
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金刚石、SiC、NaF、H2S、H2O的熔点依次降低
A
5.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是
①SiO2与CO2②NH4Cl与NaOH③O2与N2④晶体氖与白磷⑤NaCl与AlCl3⑥C3N4(硬度大,熔点高)与SiC
A.①③⑥ B.②③⑥ C.②③④ D.①⑤⑥
B
6.下列晶体熔、沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
A.①②③④⑤⑥⑦⑧
B.①②⑤④③⑥⑦⑧
C.①②⑤④③⑦⑥⑧
D.⑥⑤④③②①⑦⑧
B
第三节 金属晶体与离子晶体
课时4
晶体类型、不同晶体熔沸点的比较
第三章 晶体结构与性质
学习
目标
PART
01
PART
02
熔点、沸点高低的比较
PART
03
晶体类型的判断
四类晶体的比较
01
四类晶体的
比较
01、四类晶体的比较
比较项目 晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
构成晶体 的粒子 阴、阳离子 原子 分子 金属阳离子
和自由电子
粒子间 的作用 离子键 共价键 范德华力(有的含有氢键) 金属键
作用力大小 (一般而言) 较强 很强 弱 有的较强,有的较弱
01、四类晶体的比较
比较项目 晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
判断作用 力大小的 参考数据 离子电荷数、离子半径 键能、键长(与原子半径相关) 组成和结构相似时,比较相对分子质量 离子半径、离子所带电荷数
熔点 较高 高 低 差别较大(汞常温下为液态,钨熔点为3 410 ℃)
硬度 略硬而脆 大 较小 差别较大
01、四类晶体的比较
比较项目 晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
导热和 导电性 不良导体 (熔融后或溶于水导电) 不良导体 不良导体(部分溶于水发生电离后导电) 良导体
溶解性 多数易溶 一般不溶 相似相溶 一般不溶于水,少数与水反应
机械加工性能 不良 不良 不良 优良
延展性 差 差 差 优良
02
晶体类型的判断
02、晶体类型的判断
(3)由阴、阳离子通过离子键形成的晶体属于离子晶体
(4)由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体
(1)由分子通过分子间作用力形成的晶体属于分子晶体
(2)由原子通过共价键形成的晶体属于共价晶体
1.根据构成晶体的微粒和粒子间的作用力类别进行判断
02、晶体类型的判断
(3)常见的共价晶体单质有金刚石、晶体硼、晶体硅、晶体锗等;常见的共价晶体化合物有碳化硅、SiO2、氮化硅、氮化硼等
(4)金属单质与合金属于金属晶体
(1)活泼金属的氧化物(如Na2O、Al2O3等)、强碱[如KOH、Ba(OH)2等]和绝大多数的盐类是离子晶体
(2)大多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体
2、依据物质的分类判断
02、晶体类型的判断
所以熔点由高到低顺序一般为共价晶体>离子晶体>分子晶体
共价晶体的熔点高,常在一千至几千摄氏度;离子晶体的熔点较高,常在数百至一千余摄氏度;分子晶体的熔点较低,常在数百摄氏度以下至很低温度;金属晶体多数熔点高,但也有熔点相当低的。
3、依据晶体的熔点判断
02、晶体类型的判断
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子,也能导电
(4)电金属晶体是电的良导体
(1)离子晶体在水溶液中及熔融状态下导电
(2)共价晶体一般为非导体,但晶体硅、锗等能导电
4、依据导电性判断
02、晶体类型的判断
(3)分子晶体硬度小且较脆
(4)金属晶体多数硬度大,但也有硬度较小的,且具有延展性
(1)离子晶体硬而脆
(2)共价晶体硬度大
5、依据硬度和机械性能判断
03
熔点、沸点高低的比较
03、熔点、沸点高低的比较
晶体的熔、沸点受组成晶体的粒子之间的作用力类型和强弱的影响。分子晶体中存在的是分子间作用力,比化学键弱得多,因此其熔、沸点比较低,
原子晶体中原子之间以共价键结合,金属晶体中是金属阳离子和自由电子之间形成的金属键,离子晶体中是离子键,这些作用都是化学键,比分子间作用力强得多,因此它们的熔、沸点一般比分子晶体要高。但是由于各类化学键又存在强弱的差异,所以又有不同。另外,即使是同一类型的化学键,由于成键主体不同,也会存在差异。
03、熔点、沸点高低的比较
不同类型的晶体一般来说,晶体的熔、沸点是:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等金属的熔、沸点很高,汞、铯等金属的熔、沸点很低。
03、熔点、沸点高低的比较
1、同类型的晶体——共价晶体
①晶体的熔、沸点高低取决于共价键的键长和键能。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。
一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
03、熔点、沸点高低的比较
2、同类型的晶体——金属晶体
②合金的熔点比组成合金的纯金属低
①金属离子半径越小,离子所带电荷数越多,
其金属键越强,金属的熔、沸点越高
03、熔点、沸点高低的比较
3、同类型的晶体——离子晶体
②离子所带的电荷数的影响大于离子半径的影响
①一般地,离子所带的电荷数越多,离子半径越小,
则离子间的作用力就越强,其离子晶体的熔、沸点就越高
03、熔点、沸点高低的比较
4、同类型的晶体——分子晶体
①分子间作用力:组成和结构相似的物质,随相对分子质量的增大,分子间作用力增大,其熔、沸点升高。如F2
5、同类型的晶体——分子晶体
②氢键:物质的分子间有氢键,其熔、沸点就高。如H2O、H2S、H2Se、H2Te。如按范德华力的影响应该是沸点:H2O
A.二氧化硅和干冰的熔化B.氯化钠和铁的熔化C.烧碱和金刚砂的熔化D.冰和干冰的熔化
D
2.下列说法正确的是
A.干冰属于原子晶体
B.CH4分子中含有极性共价键,所以是极性分子
C.所有的金属元素都分布在d区和ds区
D.离子键、氢键、范德华力本质上都是静电作用
D
3、用“>”或“<”填空:
(1)晶体熔点:CF4 CCl4 CBr4 CI4
(2)硬度:金刚石 碳化硅 晶体硅
(3)熔点:Na Mg Al
(4)熔点:NaF NaCl NaBr NaI
(5)熔点:SiO2 NaCl CO2
< < <
> >
< <
> >
> > >
4.下列有关化学用语使用正确的是
A.氯化钠熔化时离子键被破坏
B.晶体中分子间作用力越大,分子越稳定
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金刚石、SiC、NaF、H2S、H2O的熔点依次降低
A
5.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是
①SiO2与CO2②NH4Cl与NaOH③O2与N2④晶体氖与白磷⑤NaCl与AlCl3⑥C3N4(硬度大,熔点高)与SiC
A.①③⑥ B.②③⑥ C.②③④ D.①⑤⑥
B
6.下列晶体熔、沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
A.①②③④⑤⑥⑦⑧
B.①②⑤④③⑥⑦⑧
C.①②⑤④③⑦⑥⑧
D.⑥⑤④③②①⑦⑧
B
