到实验室去:探究金属的性质 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学
文档属性
| 名称 | 到实验室去:探究金属的性质 同步练习(含答案) 2022-2023学年鲁教版(五四制)九年级全册化学 |  | |
| 格式 | zip | ||
| 文件大小 | 75.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-09 09:34:40 | ||
图片预览


文档简介
到实验室去:探究金属的性质 同步练习
一、单选题
1.下列实验方案中,能达到实验目的是( )
选项 实验目的 实验方案
A 除去混入CO2中的O2 通过炽热的木炭层
B 从AgNO3和Zn(NO3)2的混合溶液中得到Ag 加入少量的铜粉,过滤
C 除去CuO粉末中含有的MnO2 加入过量的过氧化氢溶液
D 从CaCO3和CaO的混合粉末中得到CaCO3 加入足量的稀盐酸,过滤
A.A B.B C.C D.D
2.将质量为4g的铁片放入200g质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤干燥后称得质量为4.4g,这表明反应中()
A.析出了0.4g铜 B.有4g铁参加了反应
C.析出了3.2g铜 D.有20g硫酸铜参加了反应
3.中国铁锅盛行世界,铝制炊具正在被淘汰.下面对铁、铝两种金属的叙述中,错误的是( )
A.铁与盐酸反应生成FeCl3
B.铝与盐酸反应生成AlCl3
C.铁的金属活动性不如铝的金属活动性强
D.常见化合物中,铁有+2、+3价,铝只有+3价
4.将一定量的木炭在盛有32g氧气的密闭容器中燃烧(氧气完全反应),将生成的气体通入足量的澄清石灰水中,生成50g沉淀.生成气体中碳元素的质量分数为( )
A.12% B.24% C.36% D.50%
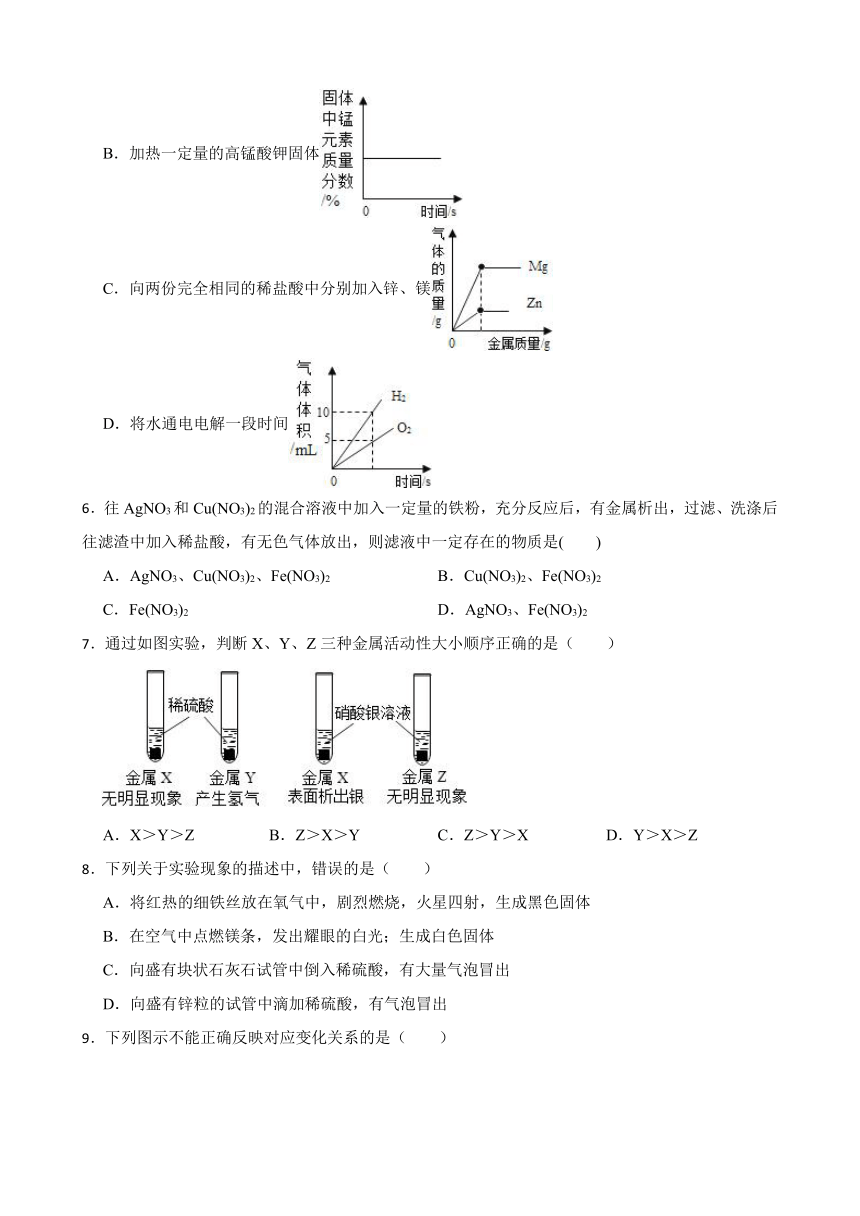
5.下列图象能正确反映对应变化关系的是( )
A.向一定量的二氧化锰中加入过氧化氢溶液
B.加热一定量的高锰酸钾固体
C.向两份完全相同的稀盐酸中分别加入锌、镁
D.将水通电电解一段时间
6.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在的物质是( )
A.AgNO3、Cu(NO3)2、Fe(NO3)2 B.Cu(NO3)2、Fe(NO3)2
C.Fe(NO3)2 D.AgNO3、Fe(NO3)2
7.通过如图实验,判断X、Y、Z三种金属活动性大小顺序正确的是( )
A.X>Y>Z B.Z>X>Y C.Z>Y>X D.Y>X>Z
8.下列关于实验现象的描述中,错误的是( )
A.将红热的细铁丝放在氧气中,剧烈燃烧,火星四射,生成黑色固体
B.在空气中点燃镁条,发出耀眼的白光;生成白色固体
C.向盛有块状石灰石试管中倒入稀硫酸,有大量气泡冒出
D.向盛有锌粒的试管中滴加稀硫酸,有气泡冒出
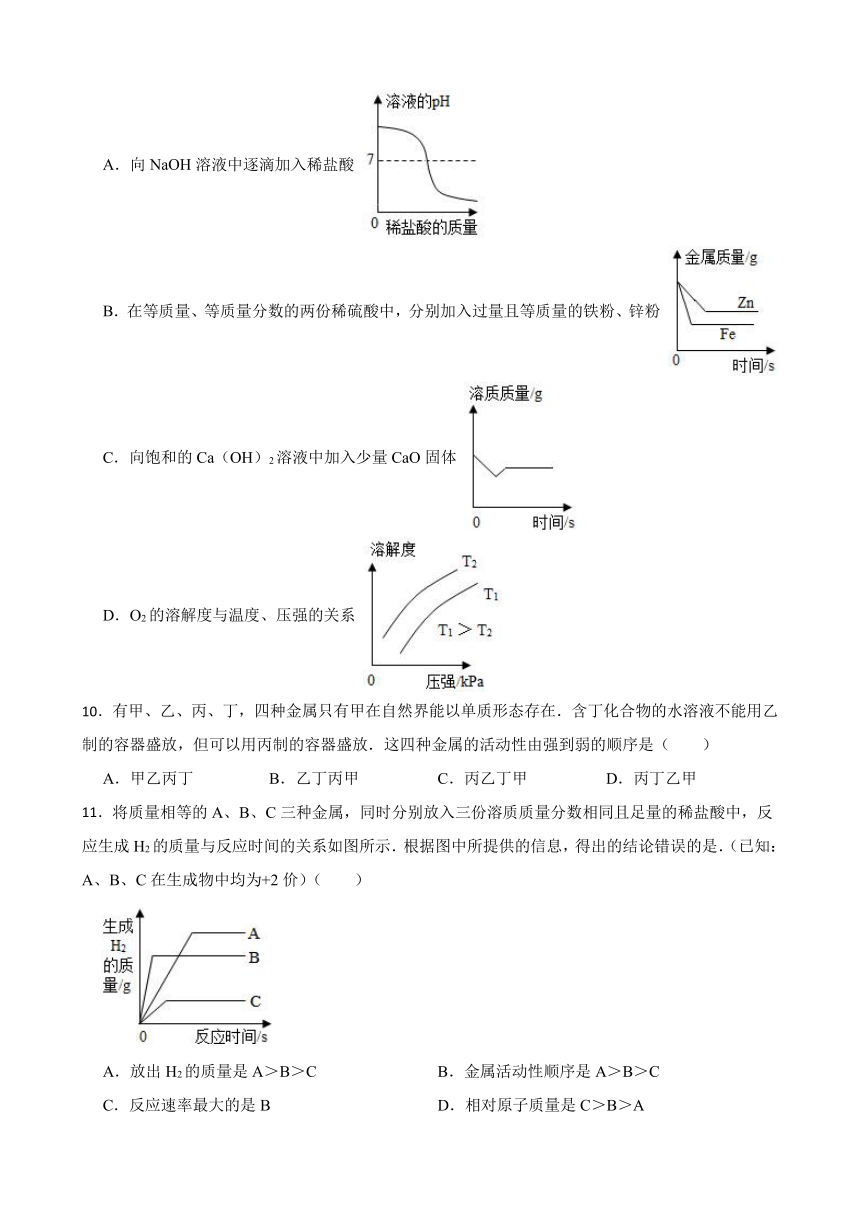
9.下列图示不能正确反映对应变化关系的是( )
A.向NaOH溶液中逐滴加入稀盐酸
B.在等质量、等质量分数的两份稀硫酸中,分别加入过量且等质量的铁粉、锌粉
C.向饱和的Ca(OH)2溶液中加入少量CaO固体
D.O2的溶解度与温度、压强的关系
10.有甲、乙、丙、丁,四种金属只有甲在自然界能以单质形态存在.含丁化合物的水溶液不能用乙制的容器盛放,但可以用丙制的容器盛放.这四种金属的活动性由强到弱的顺序是( )
A.甲乙丙丁 B.乙丁丙甲 C.丙乙丁甲 D.丙丁乙甲
11.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论错误的是.(已知:A、B、C在生成物中均为+2价)( )
A.放出H2的质量是A>B>C B.金属活动性顺序是A>B>C
C.反应速率最大的是B D.相对原子质量是C>B>A
12.下列对金属和金属材料的认识中,错误的是( )
A.真金不怕火炼是因为金的熔点高
B.回收废旧金属有利于节约金属资源
C.用铁、铝制作炊具主要是因为它们有良好的导热性
D.黄铜片和铜片互相刻画,铜片上会留下明显的划痕
二、填空题
13.金属的用途很广,我们应该节约和保护金属资源,请用所学化学知识回答下列问题:
(1)铁制品长期裸露在室外易生锈,铁生锈实际上是铁与空气中的 等发生化学反应的过程;
(2)为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前,先要除去铁制品表面的铁锈。用稀盐酸除去铁锈的化学反应方程式是 。
(3)将X、Z、Y三种金属片分别放入稀硫酸中,Y、Z表面有气泡产生,X没有明显现象,再把Y、Z分别放入FeSO4溶液中,发现放入Y的FeSO4溶液逐渐变成无色,而放入Z的FeSO4溶液和Z表面都没有明显现象。根据上述实验判断,X、Y、Z三种金属的活动性由强到弱的顺序是 。
14.人类的生活和生产都离不开金属材料.
(1)铁生锈的条件是:铁与空气和 直接接触.
(2)根据铁生锈的条件,自行车支架采取的防锈措施是 .
(3)某同学为了验证镁、铁、铜的活动性顺序,他选择了打磨过的铁丝,你认为他还需要先的另外两种溶液是 溶液和 溶液.请根据选定的试剂写出上述实验中发生反应的一个化学方程式 .
15.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 ;
②实验二中,若出现 现象,可证明铁的活动性强于铜,该反应的化学方程式为 .
16.将洁净的铁丝放入蓝色的硫酸铜溶液观察到现象是① ,② .
17.金属与人类生活息息相关.
(1)生铁和钢是世界上用量最大的 (填“金属”或“合成”)材料,钢铁制品在 中易生锈.
(2)焊锡与其组成金属相比具有 的特性,可用来焊接电子元件.
(3)将铁粉投入含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则该溶质是 .
18.将Zn加入AgNO3和Cu(NO3)2的混合溶液中,充分反应后过滤。写出一定发生的反应的化学方程式 ;若滤液呈蓝色,则滤液中一定含有的溶质是 ;所得滤液质量可能不变的原因是 。
三、综合题
19.金属材料广泛应用于生产、生活中。
(1)Fe2O3中Fe元素的化合价为 价。
(2)写出用盐酸除去铁表面铁锈的化学方程式 。
(3)合金是在金属中 某些金属或非金属制得的具有金属特征的物质,钢的含碳量为 。
(4)向含有Fe(NO3)2和Cu(NO3)2的混合溶液中加入一定质量的镁粉,充分反应后过滤向滤渣中加入稀硫酸,
有气泡产生,则滤渣中一定含有的物质是 (填化学式), 滤液中可能含有的物质是 (填化学式)。
(5)现有氧化铁和铁的混合物120 g,将混合物在加热条件下与足量的一氧化碳充分反应,得到固体物质96 g,则混合物中氧化铁的质量分数为 。(计算结果精确到0.1%)
20.铁是生产、生活中应用很广泛的一种金属,下列是与铁的性质有关的部分实验图,
请回答下列问题。
(1)A中细铁线燃烧生成黑色固体的化学方程式是 。
(2)B中铁钉最易生锈的部位是 (填“a”、“b”或“c”)。
(3)C中刚开始无气泡产生,溶液颜色逐渐由无色变为黄色,此时试管内反应的化学方程式是 。
(4)D中反应一段时间后,试管内固体质量比反应前增大,据此推断,试管内溶液质量与反应前相比 (填“增大”、“不变”或“减小”)。化学方程式为 。
21.从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 ;在过程中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式 ,该反应属于的基本反应类型是 。判断步骤②硫酸是否适量的依据是 。若没有稀硫酸,步骤②可以加入适量的 溶液。
(4)将某Fe-Cu合金样品20g,放入足量的稀硫酸中,产生氢气质量与反应时间的关系如图。实验测得20g该合金样品与70.6g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数 。(写出计算过程)
22.在相同质量的镁、铝、铁(表面均无杂质及氧化物)中,所含原子个数由少到多的顺序为 (直接用金属的元素符号表示,并用“<”进行连接,下同).分别加入到相同质量、相同浓度的稀硫酸中,充分反应金属均有剩余,产生氢气质量大小关系是 .
答案解析部分
1.【答案】B
2.【答案】C
3.【答案】A
4.【答案】C
5.【答案】D
6.【答案】C
7.【答案】D
8.【答案】C
9.【答案】B
10.【答案】B
11.【答案】B
12.【答案】A
13.【答案】(1)氧气和水蒸气
(2)
(3)Y>Z>X
14.【答案】水;喷漆 ;氯化镁;硫酸铜;Fe+CuSO4=FeSO4+Cu
15.【答案】选取的酸的种类不同;铁丝表面出现红色物质,溶液由蓝色变成浅绿色;Fe+CuSO4=FeSO4+Cu
16.【答案】铁丝表面附着了一层红色固体;溶液颜色由蓝色变成浅绿色
17.【答案】金属;潮湿的空气;熔点低;Fe(NO3)2
18.【答案】;Zn(NO3)2、Cu(NO3)2(或硝酸锌、硝酸铜);锌与硝酸银溶液反应使溶液质量减少,锌与硝酸铜溶液反应使溶液质量增加,所得滤液质量可能不变
19.【答案】(1)+3
(2)
(3)加热熔合;0.03%~2%
(4)Fe 、Cu;Fe(NO3)2
(5)66.7%
20.【答案】(1)3Fe+2O2 Fe3O4
(2)b
(3)Fe2O3+6HCl═2FeCl3+3H2O
(4)减小;Fe+CuSO4═FeSO4+Cu
21.【答案】(1)铁;铜
(2)过滤;引流
(3);置换反应;向溶液中加入镁,观察有无气泡产生;硫酸铜
(4)20g该合金样品与70.6g某稀硫酸恰好完全反应,所得溶液为硫酸亚铁溶液,设生成硫酸亚铁的质量为x,合金中铁的质量为y,则 解得x=15.2g,y=5.6g; 所得溶液的质量为70.6g+5.6g-0.2g=76g; 故所得溶液中溶质的质量分数为 。
22.【答案】Fe<Al<Mg;Fe=Al=Mg
一、单选题
1.下列实验方案中,能达到实验目的是( )
选项 实验目的 实验方案
A 除去混入CO2中的O2 通过炽热的木炭层
B 从AgNO3和Zn(NO3)2的混合溶液中得到Ag 加入少量的铜粉,过滤
C 除去CuO粉末中含有的MnO2 加入过量的过氧化氢溶液
D 从CaCO3和CaO的混合粉末中得到CaCO3 加入足量的稀盐酸,过滤
A.A B.B C.C D.D
2.将质量为4g的铁片放入200g质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤干燥后称得质量为4.4g,这表明反应中()
A.析出了0.4g铜 B.有4g铁参加了反应
C.析出了3.2g铜 D.有20g硫酸铜参加了反应
3.中国铁锅盛行世界,铝制炊具正在被淘汰.下面对铁、铝两种金属的叙述中,错误的是( )
A.铁与盐酸反应生成FeCl3
B.铝与盐酸反应生成AlCl3
C.铁的金属活动性不如铝的金属活动性强
D.常见化合物中,铁有+2、+3价,铝只有+3价
4.将一定量的木炭在盛有32g氧气的密闭容器中燃烧(氧气完全反应),将生成的气体通入足量的澄清石灰水中,生成50g沉淀.生成气体中碳元素的质量分数为( )
A.12% B.24% C.36% D.50%
5.下列图象能正确反映对应变化关系的是( )
A.向一定量的二氧化锰中加入过氧化氢溶液
B.加热一定量的高锰酸钾固体
C.向两份完全相同的稀盐酸中分别加入锌、镁
D.将水通电电解一段时间
6.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出,则滤液中一定存在的物质是( )
A.AgNO3、Cu(NO3)2、Fe(NO3)2 B.Cu(NO3)2、Fe(NO3)2
C.Fe(NO3)2 D.AgNO3、Fe(NO3)2
7.通过如图实验,判断X、Y、Z三种金属活动性大小顺序正确的是( )
A.X>Y>Z B.Z>X>Y C.Z>Y>X D.Y>X>Z
8.下列关于实验现象的描述中,错误的是( )
A.将红热的细铁丝放在氧气中,剧烈燃烧,火星四射,生成黑色固体
B.在空气中点燃镁条,发出耀眼的白光;生成白色固体
C.向盛有块状石灰石试管中倒入稀硫酸,有大量气泡冒出
D.向盛有锌粒的试管中滴加稀硫酸,有气泡冒出
9.下列图示不能正确反映对应变化关系的是( )
A.向NaOH溶液中逐滴加入稀盐酸
B.在等质量、等质量分数的两份稀硫酸中,分别加入过量且等质量的铁粉、锌粉
C.向饱和的Ca(OH)2溶液中加入少量CaO固体
D.O2的溶解度与温度、压强的关系
10.有甲、乙、丙、丁,四种金属只有甲在自然界能以单质形态存在.含丁化合物的水溶液不能用乙制的容器盛放,但可以用丙制的容器盛放.这四种金属的活动性由强到弱的顺序是( )
A.甲乙丙丁 B.乙丁丙甲 C.丙乙丁甲 D.丙丁乙甲
11.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论错误的是.(已知:A、B、C在生成物中均为+2价)( )
A.放出H2的质量是A>B>C B.金属活动性顺序是A>B>C
C.反应速率最大的是B D.相对原子质量是C>B>A
12.下列对金属和金属材料的认识中,错误的是( )
A.真金不怕火炼是因为金的熔点高
B.回收废旧金属有利于节约金属资源
C.用铁、铝制作炊具主要是因为它们有良好的导热性
D.黄铜片和铜片互相刻画,铜片上会留下明显的划痕
二、填空题
13.金属的用途很广,我们应该节约和保护金属资源,请用所学化学知识回答下列问题:
(1)铁制品长期裸露在室外易生锈,铁生锈实际上是铁与空气中的 等发生化学反应的过程;
(2)为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前,先要除去铁制品表面的铁锈。用稀盐酸除去铁锈的化学反应方程式是 。
(3)将X、Z、Y三种金属片分别放入稀硫酸中,Y、Z表面有气泡产生,X没有明显现象,再把Y、Z分别放入FeSO4溶液中,发现放入Y的FeSO4溶液逐渐变成无色,而放入Z的FeSO4溶液和Z表面都没有明显现象。根据上述实验判断,X、Y、Z三种金属的活动性由强到弱的顺序是 。
14.人类的生活和生产都离不开金属材料.
(1)铁生锈的条件是:铁与空气和 直接接触.
(2)根据铁生锈的条件,自行车支架采取的防锈措施是 .
(3)某同学为了验证镁、铁、铜的活动性顺序,他选择了打磨过的铁丝,你认为他还需要先的另外两种溶液是 溶液和 溶液.请根据选定的试剂写出上述实验中发生反应的一个化学方程式 .
15.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 ;
②实验二中,若出现 现象,可证明铁的活动性强于铜,该反应的化学方程式为 .
16.将洁净的铁丝放入蓝色的硫酸铜溶液观察到现象是① ,② .
17.金属与人类生活息息相关.
(1)生铁和钢是世界上用量最大的 (填“金属”或“合成”)材料,钢铁制品在 中易生锈.
(2)焊锡与其组成金属相比具有 的特性,可用来焊接电子元件.
(3)将铁粉投入含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则该溶质是 .
18.将Zn加入AgNO3和Cu(NO3)2的混合溶液中,充分反应后过滤。写出一定发生的反应的化学方程式 ;若滤液呈蓝色,则滤液中一定含有的溶质是 ;所得滤液质量可能不变的原因是 。
三、综合题
19.金属材料广泛应用于生产、生活中。
(1)Fe2O3中Fe元素的化合价为 价。
(2)写出用盐酸除去铁表面铁锈的化学方程式 。
(3)合金是在金属中 某些金属或非金属制得的具有金属特征的物质,钢的含碳量为 。
(4)向含有Fe(NO3)2和Cu(NO3)2的混合溶液中加入一定质量的镁粉,充分反应后过滤向滤渣中加入稀硫酸,
有气泡产生,则滤渣中一定含有的物质是 (填化学式), 滤液中可能含有的物质是 (填化学式)。
(5)现有氧化铁和铁的混合物120 g,将混合物在加热条件下与足量的一氧化碳充分反应,得到固体物质96 g,则混合物中氧化铁的质量分数为 。(计算结果精确到0.1%)
20.铁是生产、生活中应用很广泛的一种金属,下列是与铁的性质有关的部分实验图,
请回答下列问题。
(1)A中细铁线燃烧生成黑色固体的化学方程式是 。
(2)B中铁钉最易生锈的部位是 (填“a”、“b”或“c”)。
(3)C中刚开始无气泡产生,溶液颜色逐渐由无色变为黄色,此时试管内反应的化学方程式是 。
(4)D中反应一段时间后,试管内固体质量比反应前增大,据此推断,试管内溶液质量与反应前相比 (填“增大”、“不变”或“减小”)。化学方程式为 。
21.从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 ;在过程中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式 ,该反应属于的基本反应类型是 。判断步骤②硫酸是否适量的依据是 。若没有稀硫酸,步骤②可以加入适量的 溶液。
(4)将某Fe-Cu合金样品20g,放入足量的稀硫酸中,产生氢气质量与反应时间的关系如图。实验测得20g该合金样品与70.6g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数 。(写出计算过程)
22.在相同质量的镁、铝、铁(表面均无杂质及氧化物)中,所含原子个数由少到多的顺序为 (直接用金属的元素符号表示,并用“<”进行连接,下同).分别加入到相同质量、相同浓度的稀硫酸中,充分反应金属均有剩余,产生氢气质量大小关系是 .
答案解析部分
1.【答案】B
2.【答案】C
3.【答案】A
4.【答案】C
5.【答案】D
6.【答案】C
7.【答案】D
8.【答案】C
9.【答案】B
10.【答案】B
11.【答案】B
12.【答案】A
13.【答案】(1)氧气和水蒸气
(2)
(3)Y>Z>X
14.【答案】水;喷漆 ;氯化镁;硫酸铜;Fe+CuSO4=FeSO4+Cu
15.【答案】选取的酸的种类不同;铁丝表面出现红色物质,溶液由蓝色变成浅绿色;Fe+CuSO4=FeSO4+Cu
16.【答案】铁丝表面附着了一层红色固体;溶液颜色由蓝色变成浅绿色
17.【答案】金属;潮湿的空气;熔点低;Fe(NO3)2
18.【答案】;Zn(NO3)2、Cu(NO3)2(或硝酸锌、硝酸铜);锌与硝酸银溶液反应使溶液质量减少,锌与硝酸铜溶液反应使溶液质量增加,所得滤液质量可能不变
19.【答案】(1)+3
(2)
(3)加热熔合;0.03%~2%
(4)Fe 、Cu;Fe(NO3)2
(5)66.7%
20.【答案】(1)3Fe+2O2 Fe3O4
(2)b
(3)Fe2O3+6HCl═2FeCl3+3H2O
(4)减小;Fe+CuSO4═FeSO4+Cu
21.【答案】(1)铁;铜
(2)过滤;引流
(3);置换反应;向溶液中加入镁,观察有无气泡产生;硫酸铜
(4)20g该合金样品与70.6g某稀硫酸恰好完全反应,所得溶液为硫酸亚铁溶液,设生成硫酸亚铁的质量为x,合金中铁的质量为y,则 解得x=15.2g,y=5.6g; 所得溶液的质量为70.6g+5.6g-0.2g=76g; 故所得溶液中溶质的质量分数为 。
22.【答案】Fe<Al<Mg;Fe=Al=Mg
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
