人教版九年级化学下册《生活中常见的盐》(第1课时)课件(25页)
文档属性
| 名称 | 人教版九年级化学下册《生活中常见的盐》(第1课时)课件(25页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-10 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
指出下列物质中那些是酸 碱 盐 氧化物
H2O CaCO3 HCl H2O2 Na2CO3 Fe2O3 Ca(OH)2 MnO2 H2SO4 NaOH CuSO4
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3
酸:在水溶液中解离出的阳离子全部是氢离子的化合物.
碱:在水溶液中解离出的阴离子全部是氢氧根离子的化合物.
盐:由金属离子(铵根离子)和酸根离子构成的化合物.
生活中的盐:指食盐(主要成分NaCl)
第十一单元 盐 化肥
课题1
生活中常见的盐
氯化钠晶体
高锰酸钾KMnO4
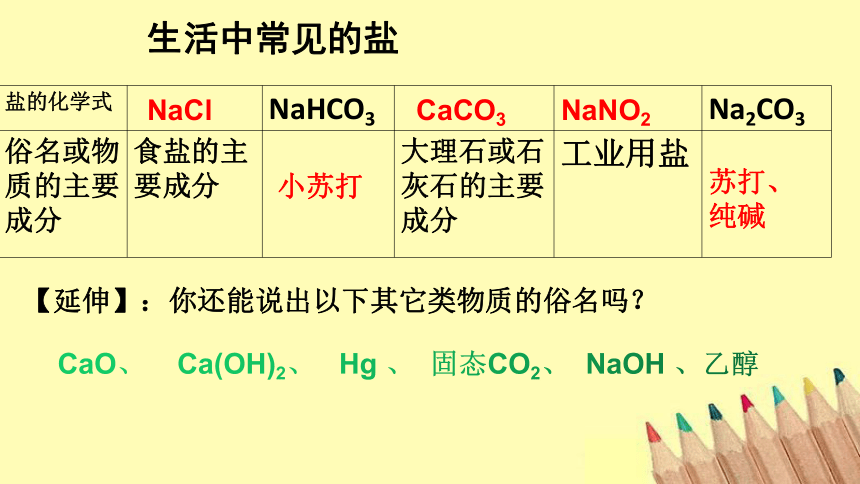
生活中常见的盐
氯化钠 天空之镜的镜面
生活中常见的盐
盐的化学式 NaHCO3 Na2CO3
俗名或物质的主要成分 食盐的主要成分 大理石或石灰石的主要成分 工业用盐
【延伸】:你还能说出以下其它类物质的俗名吗?
CaO、 Ca(OH)2、 Hg 、 固态CO2、 NaOH 、乙醇
NaCl
小苏打
CaCO3
NaNO2
苏打、
纯碱
食盐
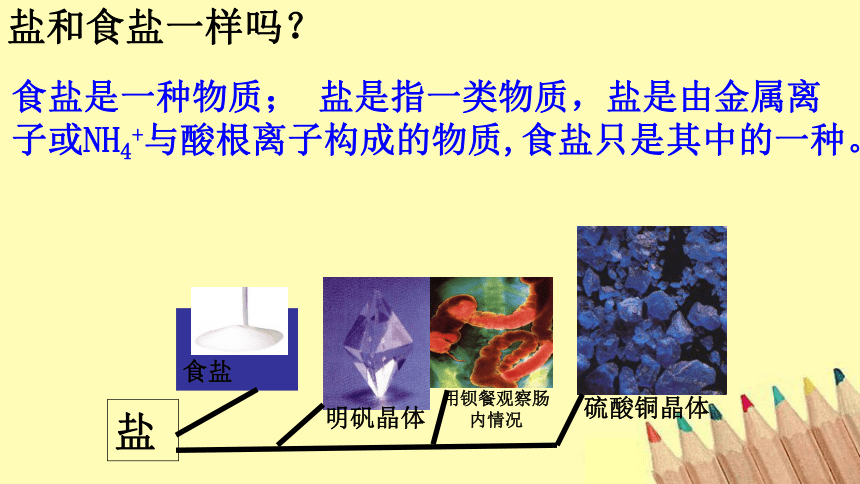
食盐是一种物质; 盐是指一类物质,盐是由金属离子或NH4+与酸根离子构成的物质,食盐只是其中的一种。
盐和食盐一样吗?
盐
明矾晶体
用钡餐观察肠内情况
硫酸铜晶体
一、氯化钠:NaCl
氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味。氯化钠也是人体的正常生活活动所必不可少的。人体内所含的氯化钠大部分以离子形式存在于体液中。钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要(成人每天约需3-5g食盐)但长期食用过多食盐也不利于人体健康。如运动过度,出汗太多时,体内的Na+、Cl- 和K+大为降低,就会使肌肉和神经反应受到影响,导致恶心、呕吐、衰竭和肌肉痉挛等现象。因此,运动员在训练或比赛前后,需喝特别配制的饮料,补充失去的盐分。
氯化钠与人体健康
白色固体,有咸味,熔点为801℃,易溶于水,其溶解度随温度的升高变化不大。
1.物理性质
1、医疗上的生理盐水(含NaCl 0.9%)
2、农业上可用氯化钠溶液来选种;
3、工业上可以用氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等。
4、腌渍蔬菜、鱼、肉、蛋等,腌制成的食品不仅风味独特,还可以延长保存时间。
5、公路上的积雪也可以用氯化钠来消除。
2.氯化钠的用途
公安人员破案时,常将一种无色的硝酸银溶液雾喷在作案人员用过的器皿或纸张的表面上,以此来获得与案件有关联人员的指纹,你知道这是为什么吗?原来人体内的每一个活着的细胞都在进行着新陈代谢,只要存在着新陈代谢,就会产生水分、无机盐等物质,无机盐中以氯化钠的含量为最多,所以皮肤每时每刻都在往外排泄着含有氯化钠的汗液,向指纹印上喷硝酸银溶液,指纹印上的氯化钠就会与硝酸银反应生成氯化银白色沉淀。氯化银见光易分解,经过日光照射,氯化银分解出银颗粒,从而显示棕黑色的指纹,这是刑侦中常用方法,用这种办法,可以检测出比用碘蒸汽法更长时间之前的指纹。
小资料
现象:
化学方程式:
NaCl+AgNO3=AgCl↓+NaNO3
(1)、氯化钠溶液与硝酸银溶液反应
产生白色沉淀
Cl-的检验:用硝酸银溶液和稀硝酸
3.化学性质
小资料 我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。
侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
附:候德榜联合制纯碱原理
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3 +NaCl=NH4Cl+ NaHCO3↓
③2NaHCO3△Na2CO3+CO2↑+H2O
【演示实验11-1】
二、碳酸钠的化学性质:
(1)Na22CO3溶液呈碱性
(2)Na2CO3能与稀盐酸反应
(3)碳酸钠溶液能与Ca(OH)2或Ba(OH)2溶液反应
探究碳酸钠的性质
(1)取5g碳酸钠粉末于小烧杯中,加入2ml蒸馏水,搅拌
(2)取少量步骤(1)中的溶液与试管中,滴加无色酚酞溶液
(3)取5g碳酸钠粉末于小烧杯中,加入2ml稀盐酸,将产生气体通入澄清石灰水现象:
白色固体溶解,有气泡产生,澄清石灰水变浑浊
溶液变红
三、碳酸氢钠的化学性质
补充拓展:
含有碳酸氢根离子(HCO3-)的盐,受热时易分解。如图:给碳酸氢钠固体充分加热后,管底有白色固体(Na2CO3)产生,大试管口出现水珠,澄清石灰水变浑浊。试写该反应化学方程式。
2NaHCO3==Na2CO3+H2O+CO2↑
(1)检验溶液酸碱性
(2)实验11-1第二段
(3)受热易分解
三、碳酸氢钠的化学性质:
(1)碳酸氢钠溶液呈碱性
(2)碳酸氢钠能与稀盐酸反应
(3)碳酸氢钠受热易分解
2NaHCO3==Na2CO3+H2O+CO2↑
【回顾】
四、碳酸钙
CaCO3+2 HCl==CaCl2+H2O+CO2↑
盐酸腐蚀含CaCO3的建材
2.化学性质:
CaCO3 =CaO +CO2↑
高温
1.物理性质:
(1).能与稀盐酸反应
白色固体,难溶于水
(2).高温易分解
⒈ 碳酸钠的用途。
玻璃
造纸
纺织
洗涤剂
五.碳酸钠、碳酸氢钠、碳酸钙的用途
2. NaHCO3的用途。
发酵粉
3. 碳酸钙的用途。
石灰石——建筑、保健品、日用品的原材料。
大理石——建筑材料。
五、碳酸钠、碳酸氢钠和碳酸钙性质和用途
名称 (俗称) 碳酸钠Na2CO3 碳酸氢钠 NaHCO3 碳酸钙CaCO3
物理 性质
主要 用途
化 学 性 质
易溶于水的
白色粉末
可溶于水的
白色粉末
难溶于水的白色固体
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分、治疗胃酸过多的药剂
可作补钙剂。石灰石、大理石作作建筑材料、也用于实验室制取二氧化碳
⑴水溶液呈碱性
⑵能与盐酸反应
Na2CO3+2HCl=
2NaCl+H2O+CO2
⑶能与石灰水反应
Na2CO3+Ca(OH)2=
CaCO3 ↓+2NaOH
⑴水溶液呈碱性
⑵能与盐酸反应
NaHCO3+HCl=
NaCl+H2O+CO2
⑶受热易分解
2NaHCO3 =
Na2CO3+H2O+CO2
⑴能与盐酸反应
CaCO3+2HCl=
CaCl2+H2O+CO2
⑵高温煅烧易分解
CaCO3 = CaO+CO2
高温
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
仔细观察这三个化学方程式,你有何发现?
含有CO32-、HCO3-盐与酸反应都生成CO2
【思考】设计实验方案检验鸡蛋壳或水垢中存在CO32-?
总结:六.CO32-的检验方法
1.取少量待测物于试管中
2.滴加适量稀盐酸
3.将产生的气体通入澄清石灰水
七.硫酸铜——CuSO4
(1)俗称:
CuSO4﹒5H2O 胆矾或蓝矾
(2)物理性质:
硫酸铜白色粉末,易溶于水,溶液呈蓝色
(3)化学性质:
①与金属反应
CuSO4+Fe=Cu+FeSO4
②与碱溶液反应
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
③ 与盐溶液反应
CuSO4+BaCl2=BaSO4↓+CuCl2
1、下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
A
C
课堂训练
3、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
课堂训练
(1)可用作洗涤剂的是(填序号,下同)_____;
(2)可用作调味剂的_____________________;
(3)可用作补钙剂和牙膏填充剂的是________;
(4)可用于生产玻璃的是_________________;
(5)可用作发酵粉和治疗胃酸过多症的是_____;
b
c
b
d
a
4、下列物质:
课堂训练
a食盐;b纯碱;c碳酸氢钠;d碳酸钙
指出下列物质中那些是酸 碱 盐 氧化物
H2O CaCO3 HCl H2O2 Na2CO3 Fe2O3 Ca(OH)2 MnO2 H2SO4 NaOH CuSO4
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3
酸:在水溶液中解离出的阳离子全部是氢离子的化合物.
碱:在水溶液中解离出的阴离子全部是氢氧根离子的化合物.
盐:由金属离子(铵根离子)和酸根离子构成的化合物.
生活中的盐:指食盐(主要成分NaCl)
第十一单元 盐 化肥
课题1
生活中常见的盐
氯化钠晶体
高锰酸钾KMnO4
生活中常见的盐
氯化钠 天空之镜的镜面
生活中常见的盐
盐的化学式 NaHCO3 Na2CO3
俗名或物质的主要成分 食盐的主要成分 大理石或石灰石的主要成分 工业用盐
【延伸】:你还能说出以下其它类物质的俗名吗?
CaO、 Ca(OH)2、 Hg 、 固态CO2、 NaOH 、乙醇
NaCl
小苏打
CaCO3
NaNO2
苏打、
纯碱
食盐
食盐是一种物质; 盐是指一类物质,盐是由金属离子或NH4+与酸根离子构成的物质,食盐只是其中的一种。
盐和食盐一样吗?
盐
明矾晶体
用钡餐观察肠内情况
硫酸铜晶体
一、氯化钠:NaCl
氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味。氯化钠也是人体的正常生活活动所必不可少的。人体内所含的氯化钠大部分以离子形式存在于体液中。钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要(成人每天约需3-5g食盐)但长期食用过多食盐也不利于人体健康。如运动过度,出汗太多时,体内的Na+、Cl- 和K+大为降低,就会使肌肉和神经反应受到影响,导致恶心、呕吐、衰竭和肌肉痉挛等现象。因此,运动员在训练或比赛前后,需喝特别配制的饮料,补充失去的盐分。
氯化钠与人体健康
白色固体,有咸味,熔点为801℃,易溶于水,其溶解度随温度的升高变化不大。
1.物理性质
1、医疗上的生理盐水(含NaCl 0.9%)
2、农业上可用氯化钠溶液来选种;
3、工业上可以用氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等。
4、腌渍蔬菜、鱼、肉、蛋等,腌制成的食品不仅风味独特,还可以延长保存时间。
5、公路上的积雪也可以用氯化钠来消除。
2.氯化钠的用途
公安人员破案时,常将一种无色的硝酸银溶液雾喷在作案人员用过的器皿或纸张的表面上,以此来获得与案件有关联人员的指纹,你知道这是为什么吗?原来人体内的每一个活着的细胞都在进行着新陈代谢,只要存在着新陈代谢,就会产生水分、无机盐等物质,无机盐中以氯化钠的含量为最多,所以皮肤每时每刻都在往外排泄着含有氯化钠的汗液,向指纹印上喷硝酸银溶液,指纹印上的氯化钠就会与硝酸银反应生成氯化银白色沉淀。氯化银见光易分解,经过日光照射,氯化银分解出银颗粒,从而显示棕黑色的指纹,这是刑侦中常用方法,用这种办法,可以检测出比用碘蒸汽法更长时间之前的指纹。
小资料
现象:
化学方程式:
NaCl+AgNO3=AgCl↓+NaNO3
(1)、氯化钠溶液与硝酸银溶液反应
产生白色沉淀
Cl-的检验:用硝酸银溶液和稀硝酸
3.化学性质
小资料 我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。
侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
附:候德榜联合制纯碱原理
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3 +NaCl=NH4Cl+ NaHCO3↓
③2NaHCO3△Na2CO3+CO2↑+H2O
【演示实验11-1】
二、碳酸钠的化学性质:
(1)Na22CO3溶液呈碱性
(2)Na2CO3能与稀盐酸反应
(3)碳酸钠溶液能与Ca(OH)2或Ba(OH)2溶液反应
探究碳酸钠的性质
(1)取5g碳酸钠粉末于小烧杯中,加入2ml蒸馏水,搅拌
(2)取少量步骤(1)中的溶液与试管中,滴加无色酚酞溶液
(3)取5g碳酸钠粉末于小烧杯中,加入2ml稀盐酸,将产生气体通入澄清石灰水现象:
白色固体溶解,有气泡产生,澄清石灰水变浑浊
溶液变红
三、碳酸氢钠的化学性质
补充拓展:
含有碳酸氢根离子(HCO3-)的盐,受热时易分解。如图:给碳酸氢钠固体充分加热后,管底有白色固体(Na2CO3)产生,大试管口出现水珠,澄清石灰水变浑浊。试写该反应化学方程式。
2NaHCO3==Na2CO3+H2O+CO2↑
(1)检验溶液酸碱性
(2)实验11-1第二段
(3)受热易分解
三、碳酸氢钠的化学性质:
(1)碳酸氢钠溶液呈碱性
(2)碳酸氢钠能与稀盐酸反应
(3)碳酸氢钠受热易分解
2NaHCO3==Na2CO3+H2O+CO2↑
【回顾】
四、碳酸钙
CaCO3+2 HCl==CaCl2+H2O+CO2↑
盐酸腐蚀含CaCO3的建材
2.化学性质:
CaCO3 =CaO +CO2↑
高温
1.物理性质:
(1).能与稀盐酸反应
白色固体,难溶于水
(2).高温易分解
⒈ 碳酸钠的用途。
玻璃
造纸
纺织
洗涤剂
五.碳酸钠、碳酸氢钠、碳酸钙的用途
2. NaHCO3的用途。
发酵粉
3. 碳酸钙的用途。
石灰石——建筑、保健品、日用品的原材料。
大理石——建筑材料。
五、碳酸钠、碳酸氢钠和碳酸钙性质和用途
名称 (俗称) 碳酸钠Na2CO3 碳酸氢钠 NaHCO3 碳酸钙CaCO3
物理 性质
主要 用途
化 学 性 质
易溶于水的
白色粉末
可溶于水的
白色粉末
难溶于水的白色固体
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分、治疗胃酸过多的药剂
可作补钙剂。石灰石、大理石作作建筑材料、也用于实验室制取二氧化碳
⑴水溶液呈碱性
⑵能与盐酸反应
Na2CO3+2HCl=
2NaCl+H2O+CO2
⑶能与石灰水反应
Na2CO3+Ca(OH)2=
CaCO3 ↓+2NaOH
⑴水溶液呈碱性
⑵能与盐酸反应
NaHCO3+HCl=
NaCl+H2O+CO2
⑶受热易分解
2NaHCO3 =
Na2CO3+H2O+CO2
⑴能与盐酸反应
CaCO3+2HCl=
CaCl2+H2O+CO2
⑵高温煅烧易分解
CaCO3 = CaO+CO2
高温
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
仔细观察这三个化学方程式,你有何发现?
含有CO32-、HCO3-盐与酸反应都生成CO2
【思考】设计实验方案检验鸡蛋壳或水垢中存在CO32-?
总结:六.CO32-的检验方法
1.取少量待测物于试管中
2.滴加适量稀盐酸
3.将产生的气体通入澄清石灰水
七.硫酸铜——CuSO4
(1)俗称:
CuSO4﹒5H2O 胆矾或蓝矾
(2)物理性质:
硫酸铜白色粉末,易溶于水,溶液呈蓝色
(3)化学性质:
①与金属反应
CuSO4+Fe=Cu+FeSO4
②与碱溶液反应
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
③ 与盐溶液反应
CuSO4+BaCl2=BaSO4↓+CuCl2
1、下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐
B.氢氧化钠、苛性钠
C.碳酸钠、纯碱
D.碳酸氢钠、小苏打
2、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品
A
C
课堂训练
3、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C
A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
课堂训练
(1)可用作洗涤剂的是(填序号,下同)_____;
(2)可用作调味剂的_____________________;
(3)可用作补钙剂和牙膏填充剂的是________;
(4)可用于生产玻璃的是_________________;
(5)可用作发酵粉和治疗胃酸过多症的是_____;
b
c
b
d
a
4、下列物质:
课堂训练
a食盐;b纯碱;c碳酸氢钠;d碳酸钙
同课章节目录
