3.3.《盐类的水解》说课与讲课课件(共34张PPT)2022-2023学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.3.《盐类的水解》说课与讲课课件(共34张PPT)2022-2023学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-09 09:34:01 | ||
图片预览



文档简介
(共34张PPT)
普通高中课程标准实验教科书 化学反应原理(选修)
第三章 第2节
盐类的水解
一、教材分析
二、学情分析
五、板书设计
四、教学程序
三、教法学法
教材分析
地位
作用
教学
目标
重点
难点
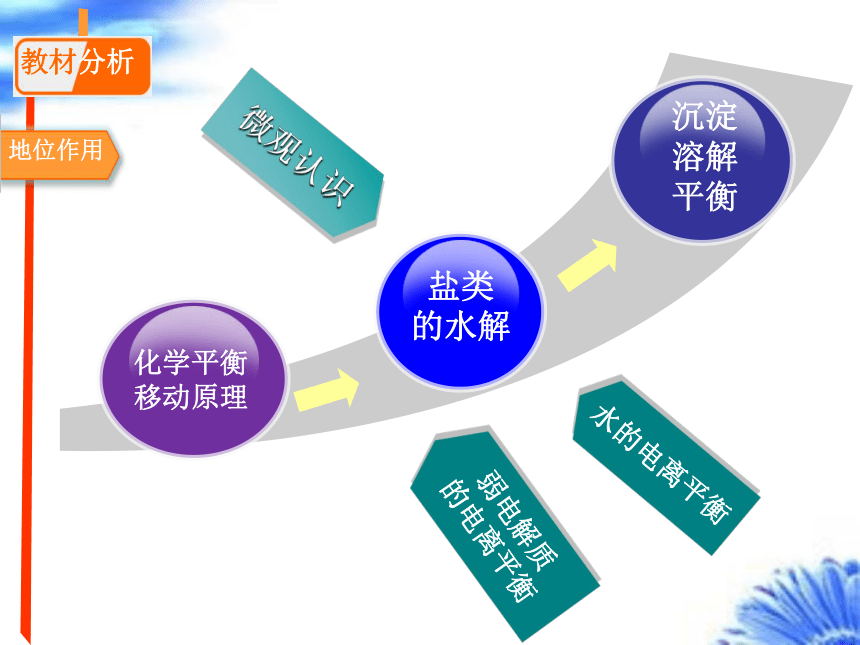
沉淀
溶解
平衡
化学平衡移动原理
教材分析
地位作用
微观认识
水的电离平衡
盐类
的水解
弱电解质
的电离平衡
过程与方法
。
情感态度与价值观
教材分析
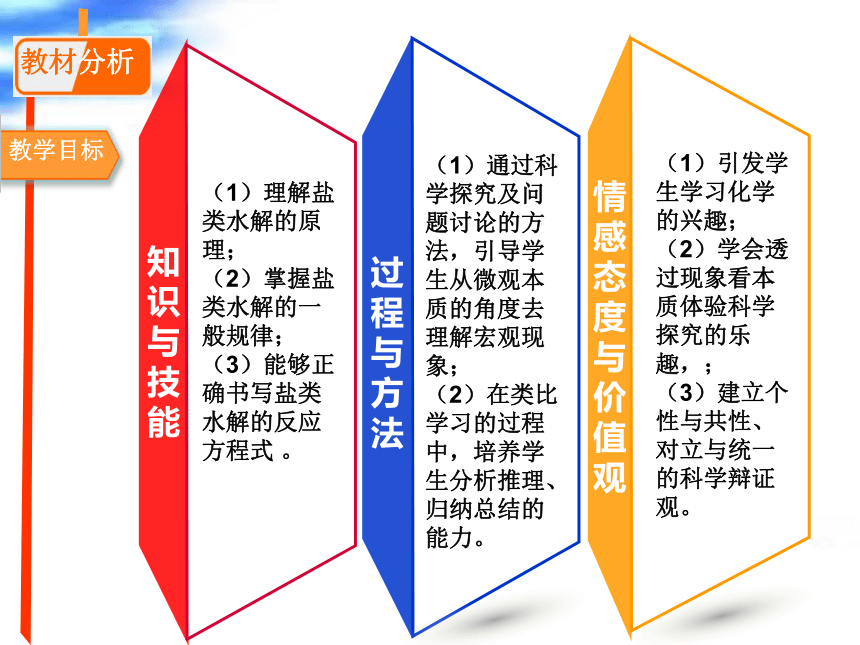
教学目标
知识与技能
(1)理解盐类水解的原理;
(2)掌握盐类水解的一般规律;
(3)能够正确书写盐类水解的反应方程式 。
(1)通过科学探究及问题讨论的方法,引导学生从微观本质的角度去理解宏观现象;
(2)在类比学习的过程中,培养学生分析推理、归纳总结的能力。
(1)引发学生学习化学的兴趣;
(2)学会透过现象看本质体验科学探究的乐趣,;
(3)建立个性与共性、对立与统一的科学辩证观。
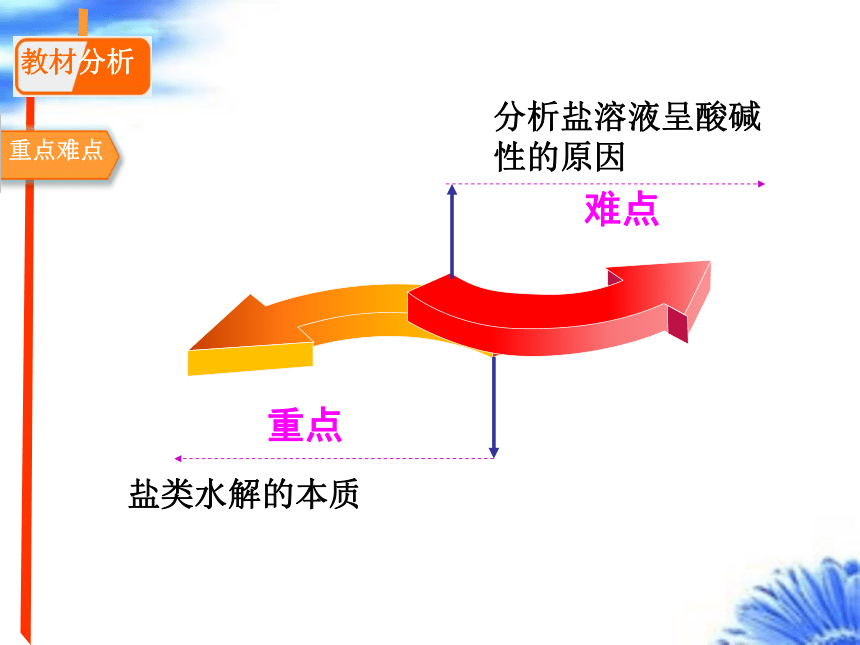
重点
盐类水解的本质
难点
教材分析
重点难点
分析盐溶液呈酸碱性的原因
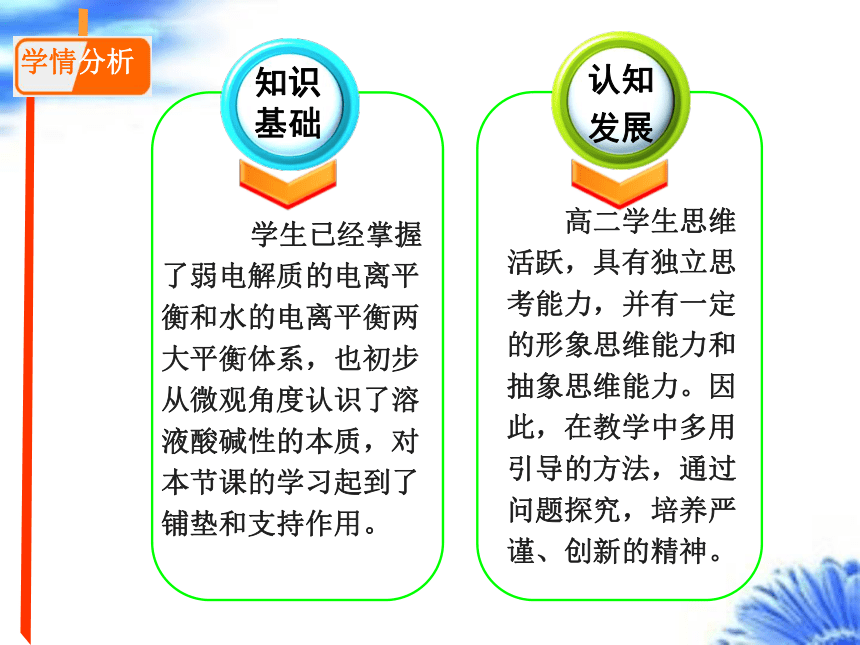
知识基础
认知
发展
高二学生思维活跃,具有独立思考能力,并有一定的形象思维能力和抽象思维能力。因此,在教学中多用引导的方法,通过问题探究,培养严谨、创新的精神。
学生已经掌握了弱电解质的电离平衡和水的电离平衡两大平衡体系,也初步从微观角度认识了溶液酸碱性的本质,对本节课的学习起到了铺垫和支持作用。
学情分析
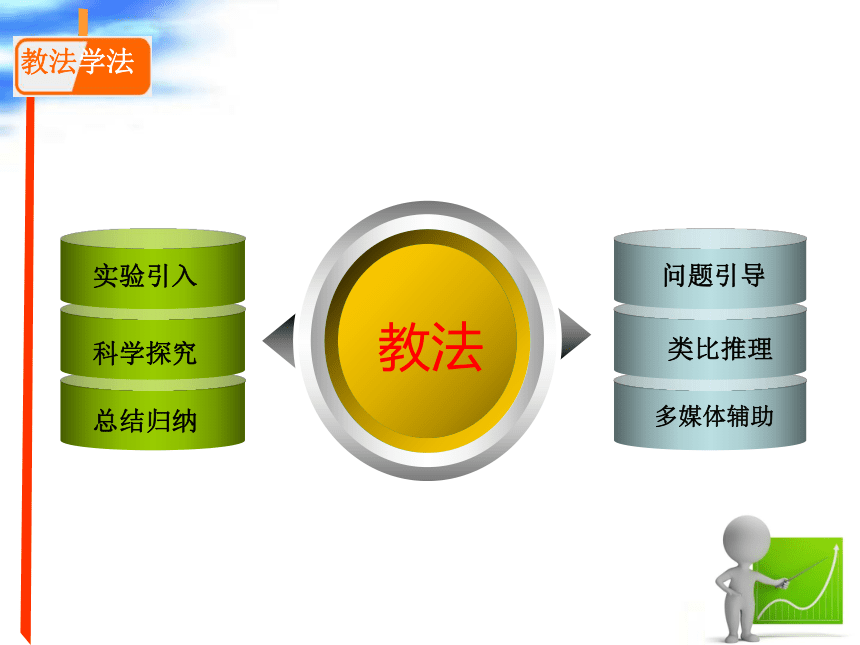
教法学法
教法
实验引入
科学探究
总结归纳
问题引导
类比推理
多媒体辅助
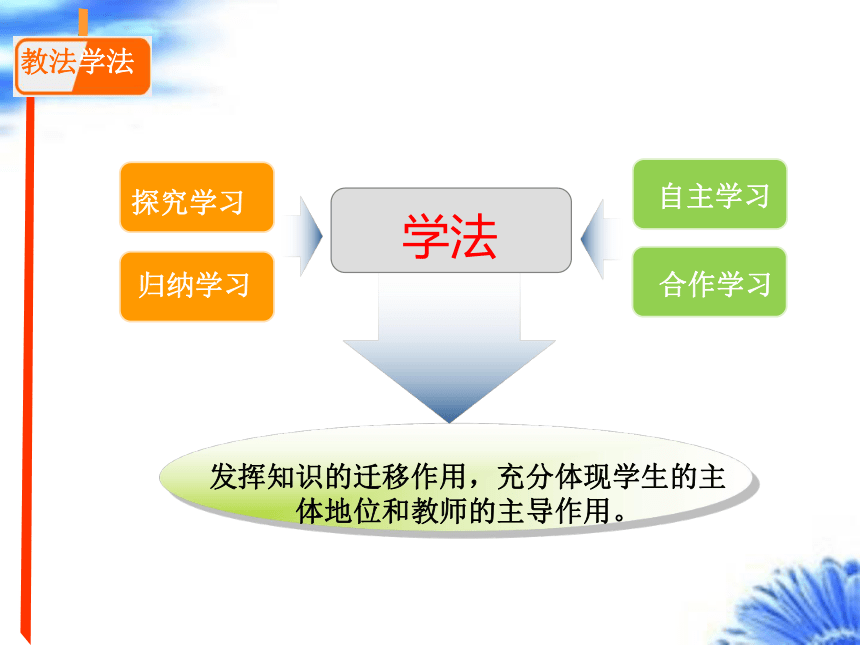
教法学法
探究学习
归纳学习
自主学习
合作学习
发挥知识的迁移作用,充分体现学生的主体地位和教师的主导作用。
学法
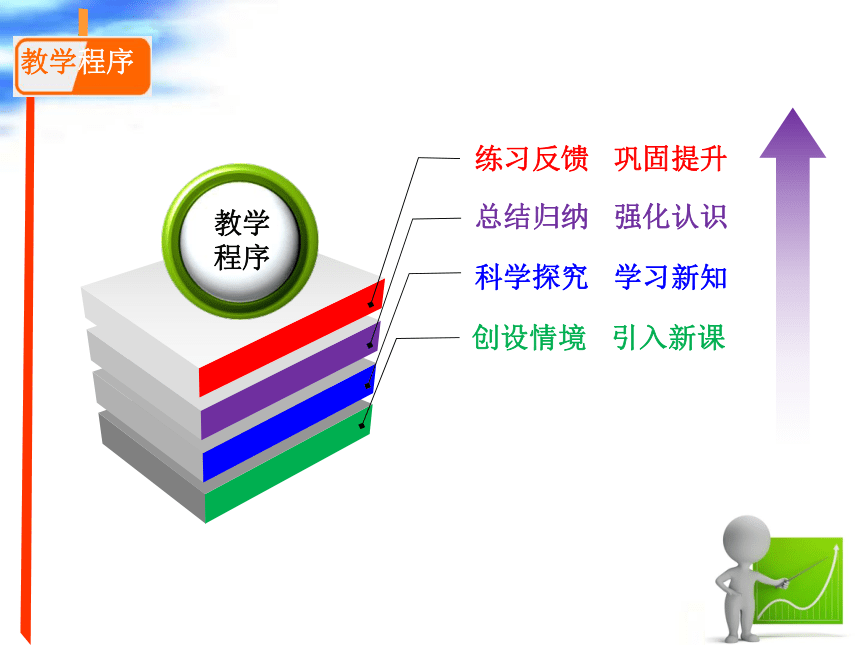
教学程序
教学程序
总结归纳 强化认识
练习反馈 巩固提升
科学探究 学习新知
创设情境 引入新课
创设情境,引入新课
教学程序
为什么有的盐溶液显酸性或碱性,而有的盐溶液却是中性呢?
通过酸碱性实验提出问题,激发学生的好奇心和求知欲,使学生明确学习目标,让学生带着疑问进入课堂学习。
聚焦
问题
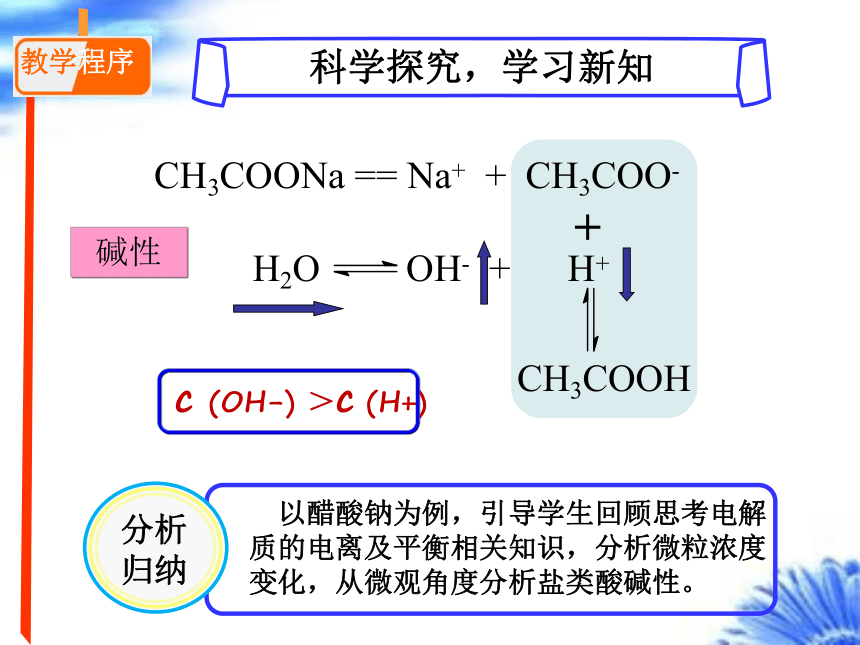
以醋酸钠为例,引导学生回顾思考电解质的电离及平衡相关知识,分析微粒浓度变化,从微观角度分析盐类酸碱性。
教学程序
分析归纳
科学探究,学习新知
CH3COONa == Na+ + CH3COO-
H2O OH- + H+
CH3COOH
+
c (OH-) >c (H+)
碱性
深入探究
教学程序
结合化学方程式与离子方程式,让学生主动参与,积极分析讨论,突破重点难点,使课堂生动、有趣。
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
化学方程式:
离子方程式:
弱酸的阴离子 + 水 弱酸电解质 + 氢氧根离子
教学程序
小组讨论,深入探究
交流 研讨
让学生类比CH3COONa溶液酸碱性的分析过程进行小组讨论,NH4Cl 溶液显酸性的原因,独立写出反应方程式,收获知识和能力的双重提升。
NH4Cl == Cl- + NH4+
H2O H+ + OH-
NH3·H2O
+
c (H+) >c (OH-)
酸性
深入探究
教学程序
结合实例逐项分析,使学生理解盐类的水解条件、实质、规律等知识,突破重点难点,培养学生的分析推理、总结归纳能力。
总结归纳,强化认识
教学程序
结合板书对本节课内容进行整合归纳,使学生得以复习巩固和提升,把握重点难点。
归纳总结
盐类水解方程式的书写
一、盐类的水解过程:
二、水解的条件:
三、水解的实质:
四、水解的规律:
融会贯通
解决课堂一开始提出的问题,解除同学们的疑惑,增加课堂的完整性。同时给出一道练习题,以达到巩固和提升的目的。
教学程序
练习反馈,巩固提升
下列各组物质加入到水中,因促进水的电离而使溶液呈酸性的是( )
A. 硫酸
B. 氢氧化钠
C. 氯化铵
D. 醋酸钠
学无止境,留下疑问
教学程序
留下疑问
在掌握本节课知识的基础上,提出新的问题,引导学生课下积极探索。
前面我们已经掌握多元弱酸(例:碳酸)是分步电离的,那么他们对应的盐(例:碳酸钠)的水解反应是如何进行的呢?
板书设计
盐类的水解
本板书设计有利于学生准确把握知识的内在联系和整体结构,层次清楚,重点突出。
一、定义:
二、条件:
三、实质:
四、规律:
谢谢!
为什么有的盐溶液显酸性或碱性,而有的盐溶液却是中性呢?
用PH试纸分别测定浓度均为0.1 mol/L 的CH3COONa、NH4Cl、NaCl的盐溶液的酸碱性。
盐类的水解
第三章 第2节
CH3COONa == Na+ + CH3COO-
H2O OH- + H+
CH3COOH
+
为什么CH3COONa溶液显碱性?
c (OH-) >c (H+)
碱性
在CH3COONa溶液中存在哪些电离过程?
CH3COONa + H2O CH3COOH + NaOH
化学方程式:
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
化学方程式:
离子方程式:
弱酸的阴离子 + 水 弱酸电解质 + 氢氧根离子
刚刚我们测得NH4Cl溶液显酸性,请同学们类比CH3COONa溶液酸碱性的分析过程进行小组讨论,分析 NH4Cl 溶液为什么显酸性?
NH4Cl == Cl- + NH4+
H2O H+ + OH-
NH3·H2O
+
c (H+) >c (OH-)
酸性
化学方程式:
离子方程式:
NH4+ + H2O NH3 · H2O + H+
NH4Cl + H2O NH3 · H2O + HCl
弱碱阳离子 + 水 弱碱电解质 + 氢离子
NH4Cl 溶液为什么显酸性?
CH3COONa = Na+ + CH3COO-
NH4Cl = Cl- + NH4+
H2O H + + OH -
在盐溶液中,由盐电离产生的离子与水电离产生的H+或OH-结合生成弱电解质的反应就叫做盐类的水解反应。
CH3COOH
NH3·H2O
盐类的水解定义:
NH4Cl
NaCl
CH3COONa
能否水解
能
能
不能
CH3COO-
NH4+
--
对水的电离平衡
影响
右移
右移
不影响
溶液的酸碱性
碱性
酸性
中性
引起水解的离子
实例
类型
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
盐类水解的条件:
盐必须溶于水,且电离出弱酸阴离子或弱碱阳离子。
NH4Cl
NaCl
CH3COONa
能否水解
能
能
不能
CH3COO-
NH4+
--
对水的电离平衡
影响
右移
右移
不影响
溶液的酸碱性
碱性
酸性
中性
引起水解的离子
实例
类型
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
盐类水解的实质:
破坏了水的电离平衡,促进了水的电离。
NH4Cl
NaCl
CH3COONa
能否水解
能
能
不能
CH3COO-
NH4+
--
对水的电离平衡
影响
右移
右移
不影响
溶液的酸碱性
碱性
酸性
中性
引起水解的离子
实例
类型
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
盐类水解的规律:
有弱才水解,越弱越水解;
谁强显谁性,同强显中性。
课堂小结
一、盐类的水解过程:
二、水解的条件:
盐必须溶于水,且电离出弱酸阴离子或弱碱阳离子。
在盐溶液中,由盐电离产生的离子与水电离产生的H+或OH-结合生成弱电解质的反应。
三、水解的实质:
破坏了水的电离平衡,促进了水的电离。
四、水解的规律:
有弱才水解,越弱越水解;
谁强显谁性,同强显中性。
盐类水解方程式的书写
牛刀小试
C
下列各组物质加入到水中,因促进水的电离而使溶液呈酸性的是( )
A. 硫酸
B. 氢氧化钠
C. 氯化铵
D. 醋酸钠
学无止境
前面我们已经掌握多元弱酸(例:碳酸)是分步电离的,那么他们对应的盐(例:碳酸钠)的水解反应是如何进行的呢?
谢谢大家!
普通高中课程标准实验教科书 化学反应原理(选修)
第三章 第2节
盐类的水解
一、教材分析
二、学情分析
五、板书设计
四、教学程序
三、教法学法
教材分析
地位
作用
教学
目标
重点
难点
沉淀
溶解
平衡
化学平衡移动原理
教材分析
地位作用
微观认识
水的电离平衡
盐类
的水解
弱电解质
的电离平衡
过程与方法
。
情感态度与价值观
教材分析
教学目标
知识与技能
(1)理解盐类水解的原理;
(2)掌握盐类水解的一般规律;
(3)能够正确书写盐类水解的反应方程式 。
(1)通过科学探究及问题讨论的方法,引导学生从微观本质的角度去理解宏观现象;
(2)在类比学习的过程中,培养学生分析推理、归纳总结的能力。
(1)引发学生学习化学的兴趣;
(2)学会透过现象看本质体验科学探究的乐趣,;
(3)建立个性与共性、对立与统一的科学辩证观。
重点
盐类水解的本质
难点
教材分析
重点难点
分析盐溶液呈酸碱性的原因
知识基础
认知
发展
高二学生思维活跃,具有独立思考能力,并有一定的形象思维能力和抽象思维能力。因此,在教学中多用引导的方法,通过问题探究,培养严谨、创新的精神。
学生已经掌握了弱电解质的电离平衡和水的电离平衡两大平衡体系,也初步从微观角度认识了溶液酸碱性的本质,对本节课的学习起到了铺垫和支持作用。
学情分析
教法学法
教法
实验引入
科学探究
总结归纳
问题引导
类比推理
多媒体辅助
教法学法
探究学习
归纳学习
自主学习
合作学习
发挥知识的迁移作用,充分体现学生的主体地位和教师的主导作用。
学法
教学程序
教学程序
总结归纳 强化认识
练习反馈 巩固提升
科学探究 学习新知
创设情境 引入新课
创设情境,引入新课
教学程序
为什么有的盐溶液显酸性或碱性,而有的盐溶液却是中性呢?
通过酸碱性实验提出问题,激发学生的好奇心和求知欲,使学生明确学习目标,让学生带着疑问进入课堂学习。
聚焦
问题
以醋酸钠为例,引导学生回顾思考电解质的电离及平衡相关知识,分析微粒浓度变化,从微观角度分析盐类酸碱性。
教学程序
分析归纳
科学探究,学习新知
CH3COONa == Na+ + CH3COO-
H2O OH- + H+
CH3COOH
+
c (OH-) >c (H+)
碱性
深入探究
教学程序
结合化学方程式与离子方程式,让学生主动参与,积极分析讨论,突破重点难点,使课堂生动、有趣。
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
化学方程式:
离子方程式:
弱酸的阴离子 + 水 弱酸电解质 + 氢氧根离子
教学程序
小组讨论,深入探究
交流 研讨
让学生类比CH3COONa溶液酸碱性的分析过程进行小组讨论,NH4Cl 溶液显酸性的原因,独立写出反应方程式,收获知识和能力的双重提升。
NH4Cl == Cl- + NH4+
H2O H+ + OH-
NH3·H2O
+
c (H+) >c (OH-)
酸性
深入探究
教学程序
结合实例逐项分析,使学生理解盐类的水解条件、实质、规律等知识,突破重点难点,培养学生的分析推理、总结归纳能力。
总结归纳,强化认识
教学程序
结合板书对本节课内容进行整合归纳,使学生得以复习巩固和提升,把握重点难点。
归纳总结
盐类水解方程式的书写
一、盐类的水解过程:
二、水解的条件:
三、水解的实质:
四、水解的规律:
融会贯通
解决课堂一开始提出的问题,解除同学们的疑惑,增加课堂的完整性。同时给出一道练习题,以达到巩固和提升的目的。
教学程序
练习反馈,巩固提升
下列各组物质加入到水中,因促进水的电离而使溶液呈酸性的是( )
A. 硫酸
B. 氢氧化钠
C. 氯化铵
D. 醋酸钠
学无止境,留下疑问
教学程序
留下疑问
在掌握本节课知识的基础上,提出新的问题,引导学生课下积极探索。
前面我们已经掌握多元弱酸(例:碳酸)是分步电离的,那么他们对应的盐(例:碳酸钠)的水解反应是如何进行的呢?
板书设计
盐类的水解
本板书设计有利于学生准确把握知识的内在联系和整体结构,层次清楚,重点突出。
一、定义:
二、条件:
三、实质:
四、规律:
谢谢!
为什么有的盐溶液显酸性或碱性,而有的盐溶液却是中性呢?
用PH试纸分别测定浓度均为0.1 mol/L 的CH3COONa、NH4Cl、NaCl的盐溶液的酸碱性。
盐类的水解
第三章 第2节
CH3COONa == Na+ + CH3COO-
H2O OH- + H+
CH3COOH
+
为什么CH3COONa溶液显碱性?
c (OH-) >c (H+)
碱性
在CH3COONa溶液中存在哪些电离过程?
CH3COONa + H2O CH3COOH + NaOH
化学方程式:
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
化学方程式:
离子方程式:
弱酸的阴离子 + 水 弱酸电解质 + 氢氧根离子
刚刚我们测得NH4Cl溶液显酸性,请同学们类比CH3COONa溶液酸碱性的分析过程进行小组讨论,分析 NH4Cl 溶液为什么显酸性?
NH4Cl == Cl- + NH4+
H2O H+ + OH-
NH3·H2O
+
c (H+) >c (OH-)
酸性
化学方程式:
离子方程式:
NH4+ + H2O NH3 · H2O + H+
NH4Cl + H2O NH3 · H2O + HCl
弱碱阳离子 + 水 弱碱电解质 + 氢离子
NH4Cl 溶液为什么显酸性?
CH3COONa = Na+ + CH3COO-
NH4Cl = Cl- + NH4+
H2O H + + OH -
在盐溶液中,由盐电离产生的离子与水电离产生的H+或OH-结合生成弱电解质的反应就叫做盐类的水解反应。
CH3COOH
NH3·H2O
盐类的水解定义:
NH4Cl
NaCl
CH3COONa
能否水解
能
能
不能
CH3COO-
NH4+
--
对水的电离平衡
影响
右移
右移
不影响
溶液的酸碱性
碱性
酸性
中性
引起水解的离子
实例
类型
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
盐类水解的条件:
盐必须溶于水,且电离出弱酸阴离子或弱碱阳离子。
NH4Cl
NaCl
CH3COONa
能否水解
能
能
不能
CH3COO-
NH4+
--
对水的电离平衡
影响
右移
右移
不影响
溶液的酸碱性
碱性
酸性
中性
引起水解的离子
实例
类型
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
盐类水解的实质:
破坏了水的电离平衡,促进了水的电离。
NH4Cl
NaCl
CH3COONa
能否水解
能
能
不能
CH3COO-
NH4+
--
对水的电离平衡
影响
右移
右移
不影响
溶液的酸碱性
碱性
酸性
中性
引起水解的离子
实例
类型
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
盐类水解的规律:
有弱才水解,越弱越水解;
谁强显谁性,同强显中性。
课堂小结
一、盐类的水解过程:
二、水解的条件:
盐必须溶于水,且电离出弱酸阴离子或弱碱阳离子。
在盐溶液中,由盐电离产生的离子与水电离产生的H+或OH-结合生成弱电解质的反应。
三、水解的实质:
破坏了水的电离平衡,促进了水的电离。
四、水解的规律:
有弱才水解,越弱越水解;
谁强显谁性,同强显中性。
盐类水解方程式的书写
牛刀小试
C
下列各组物质加入到水中,因促进水的电离而使溶液呈酸性的是( )
A. 硫酸
B. 氢氧化钠
C. 氯化铵
D. 醋酸钠
学无止境
前面我们已经掌握多元弱酸(例:碳酸)是分步电离的,那么他们对应的盐(例:碳酸钠)的水解反应是如何进行的呢?
谢谢大家!
