5.1.1.硫及其化合物课件(共20张ppt)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.1.硫及其化合物课件(共20张ppt)2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 19.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-09 09:36:39 | ||
图片预览







文档简介
第一节 硫及其化合物
课时1 硫和二氧化硫
硫
S
S2 -
得2e-
氧化性
-2
0
+4
+6
S
HS-S2-
SO3
SO42-
H2SO4
+2
S2O32--
SO2
SO32-
HSO3-
H2SO3
游离态:火山喷口附近或地壳的岩层
化合态:
硫化物:
硫酸盐:
有机物:
硫铁矿(FeS2) 、黄铜矿(CuFeS2)
生石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)、钡餐(BaSO4)
天然气、石油、煤、蛋白质
+2 -1
+2 +2 -2
过硫化亚铁
第三周期第ⅥA族
一、S
1、物性:
黄色晶体、难溶于水、微溶于酒精、易溶于CS2
2、化性:
①与O2:
②与金属:
③与非金属:
S+O2==SO2
?
与量无关,产物不为SO3
纯氧中:蓝紫色火焰 空气中:淡蓝色火焰
(1)还原性:
(2)氧化性:
Fe+S==FeS(黑色难溶)
?
2Cu+S==Cu2S(黑色难溶)
?
Cl2/Br2变价金属至最最高价
S/I2变价金属至最低价
H2+S(g)==H2S(臭鸡蛋气味)
?
氧化性:SHg+S==HgS(朱砂/丹砂)
(3)氧化性、还原性
3S+6NaOH==Na2SO3+2Na2S+3H2O
?
S+ OH--==SO32--+ S2--
?
氧化剂:还原剂=2:1
6
3
2
+3H2O
4e--
SO32--+ S2-- == S↓
+6H+
2
3
+3H2O
SO32--和S2--在碱性下可共存,酸性下不共存
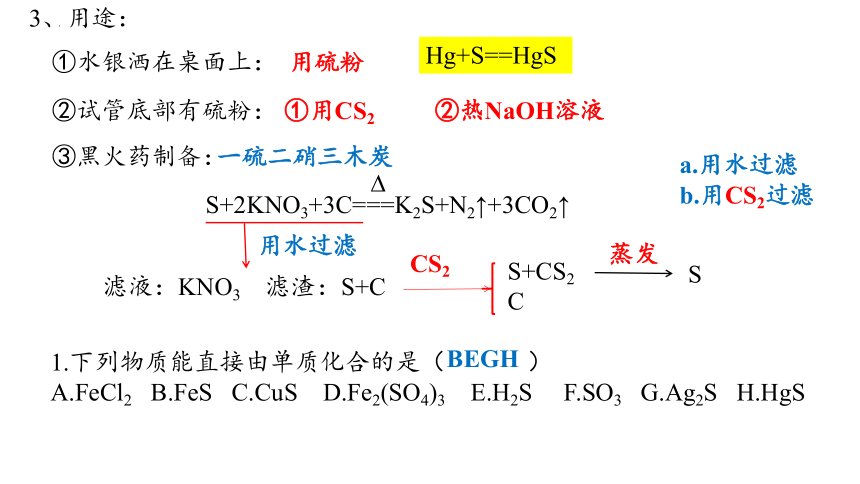
3、用途:
①水银洒在桌面上:
②试管底部有硫粉:
③黑火药制备:
用硫粉
Hg+S==HgS
①用CS2
②热NaOH溶液
S+2KNO3+3C===K2S+N2↑+3CO2↑
一硫二硝三木炭
?
用水过滤
滤液:KNO3 滤渣:S+C
CS2
S+CS2
C
蒸发
S
a.用水过滤
b.用CS2过滤
1.下列物质能直接由单质化合的是( )
A.FeCl2 B.FeS C.CuS D.Fe2(SO4)3 E.H2S F.SO3 G.Ag2S H.HgS
BEGH
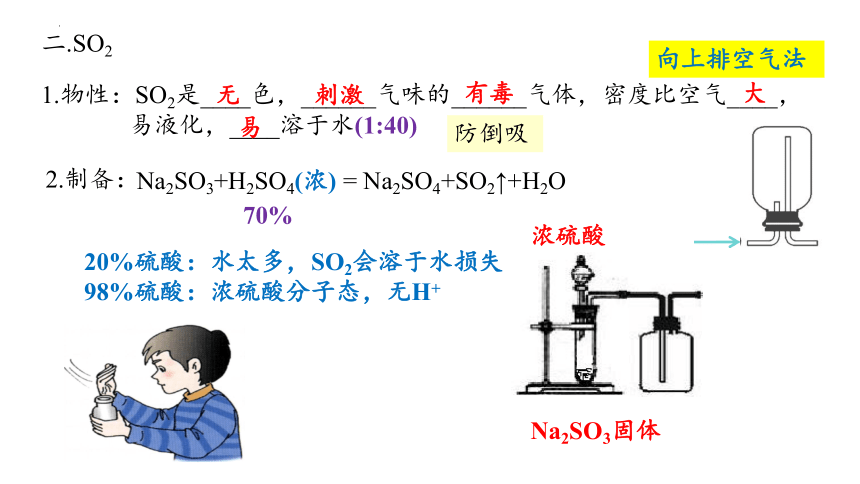
二.SO2
1.物性:SO2是____色,______气味的______气体,密度比空气____,
易液化,____溶于水(1:40)
无
刺激
有毒
大
易
向上排空气法
2.制备:
Na2SO3+H2SO4(浓) = Na2SO4+SO2↑+H2O
70%
浓硫酸
Na2SO3固体
防倒吸
20%硫酸:水太多,SO2会溶于水损失
98%硫酸:浓硫酸分子态,无H+
3、化性:
②与水:
SO2+H2O?H2SO3
①与紫(蓝)色石蕊试液:
变红
SO2为H2SO3的酸酐
(1)酸性氧化物
实验现象
实验结论
试管内液面上升
pH试纸测得溶液的pH小于7
SO2易溶于水
SO2水溶液显酸性
2H2+O2==2H2O
?
2H2O==2H2+O2
电解
【可逆反应】在相同条件下既能向正反应方向进行,同时又能向逆反应方向进行的反应。在可逆反应的化学方程式中用“?”表示。
?
③与NaOH溶液:
SO2(少)+2NaOH==Na2SO3+H2O
SO2(过)+NaOH==NaHSO3
NaOH的酚酞溶液:
④与Ca(OH)2/Ba(OH)2溶液:
SO2(少)+Ba(OH)2==BaSO3↓+H2O
2SO2(过)+Ba(OH)2==Ba(HSO3)2
⑤与CaO:
SO2+CaO==CaSO3
⑥与Na2SO3:
SO2+H2O+Na2SO3==2NaHSO3
⑦与NaHCO3:
Na2CO3
Na2SiO3
SO2(少)+2NaHCO3==Na2SO3+2CO2+H2O
红色褪去
CO2(SO2):
CO2(HCl):
饱和NaHCO3
酸性:H2SO3 >H2CO3
燃煤中添加一定量的生石(钙基固硫)
不可鉴别SO2、CO2
SO2(过)+NaHCO3==NaHSO3+CO2
SO2--------------------------------------------------------------------SO42--
氧化剂
MnO4-- Cl2 (氯水) 溴水 碘水 Fe3+ HNO3 O2 Na2O2
SO2+ MnO4-- == SO42--+ Mn2+
5
2
+2H2O
5
2
+4H+
紫红色褪去
SO2+Cl2 == SO42--+ Cl--
+4H+
2
+2H2O
SO2+Br2+2H2O== SO42--+2Br--+4H+
SO2+I2 +2H2O == SO42--+2 I--+4H+
SO2+X2+2H2O==H2SO4+2HX
黄绿色褪去
橙色褪去
棕褐色褪去
SO2+ NO3-- == SO42--+ NO
3
2
+2H2O
3
2
+4H+
2SO2+O2 ? 2SO3
催化剂(V2O5)
?
10e--
2e--
2e--
2e--
6e--
4e--
2molSO2与1molO2,生成SO3 2mol,转移电子 4mol
<
<
SO3标况下非气体
酸性↑,pH↓,
漂白性↓
Fe3++SO2 == Fe2++SO42--
2
+2H2O
2
+4H+
黄色褪去
(2)还原性
Na2O2 +SO2 = Na2SO4
2e--
Ba(NO3)2产生白沉
SO2-------------------------S
还原剂
H2S K2S
SO2+ H2S== S↓
2
3
+2H2O
SO2+ S2-- == S↓
氧化剂
氧产2
/还产1
还原剂
4e--
淡黄色固体
2
+4H+
3
+2H2O
(3)氧化性
品红 → 褪色 → 恢复原色
(4)漂白性
SO2
加热
【实验5-2】探究SO2的漂白性
{5940675A-B579-460E-94D1-54222C63F5DA}
SO2
Ca(ClO)2/ClO2/氯水/HClO/H2O2/Na2O2/O3
活性炭/胶体
反应类型
变化
特点
应用范围
化合
氧化还原
吸附
化学
化学
物理
可逆,加热或久置后恢复原来颜色
不可逆
处理后可重复使用
品红/红墨水/有色毛发/丝绸/纸浆/草帽
几乎所有有机物质
品红/石蕊/红墨水
几乎所有有机物质
品红/石蕊/红墨水
(4)漂白性
非氧还
①选择性
②化合型
③暂时性
拓展:漂白性
{5940675A-B579-460E-94D1-54222C63F5DA}
SO2
Cl2
等物质的量SO2、Cl2
品红
紫色石蕊
褪色
褪色
加热,恢复颜色的是SO2
不褪色
变红
先变红后褪色
变红
SO2+Cl2+2H2O==H2SO4+2HCl
酸性↑,pH↓,漂白性↓
判断正误
A.SO2具有漂白性,所以能使品红溶液和酸性KMnO4溶液、溴水、紫色石蕊试液褪色且常作食品的漂白剂
B.能使品红褪色的不一定是SO2
√
×
漂白性
还原性
酸性
有毒,适量用于红酒保鲜(还原性)
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
浓硫酸
Na2SO3固体
品红
溶液
溴水
KMnO4溶液
石蕊
试液
氢硫酸
(H2S)
NaOH酚酞溶液
制备SO2
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
收集SO2
褪色
漂白性
橙色
褪去
还原性
紫红色
褪去
FeCl3溶液?
黄色褪去
淀粉I2溶液
蓝色褪去
黄色
固体
氧化性
红色褪去
变红
酸性
Ba(OH)2/澄清石灰水
先白色↓,后溶解
向上排空气
酸化Ba(NO3)2
白色沉淀BaSO4
拓展:SO2性质
如何验证SO2漂白性可逆?
当品红溶液褪色,关闭分液漏斗活塞,给品红加热,恢复为红色
尾气处理
SO2+2OH--=SO32--+H2O
拓展:鉴别CO2、SO2
{5940675A-B579-460E-94D1-54222C63F5DA}
SO2
CO2
气味
品红
溴水
酸性KMnO4
FeCl3溶液
HNO3
酸化Ba(NO3)2
H2S
澄清石灰水/Ba(OH)2
BaCl2溶液/NaHCO3溶液
紫色石蕊
刺激气味
无味
褪色
橙色褪去
紫红色褪去
黄色褪去
气体
白色沉淀
黄色固体
白色沉淀-溶解
√
√
√
√
√
√
√
√
不反应,无现象
×
×
除酸性氧化物性质
变红
×
拓展:对比产物
{5940675A-B579-460E-94D1-54222C63F5DA}
BaCl2溶液
Ba(NO3)2溶液
BaCl2+NH3(NaOH)/Ba(OH)2
SO2
CO2
SO3
不反应无沉淀
不反应无沉淀
BaSO4沉淀
BaSO4沉淀
不反应无沉淀
BaSO4沉淀
BaSO3沉淀
BaCO3沉淀
BaSO4沉淀
Q:向BaCl2溶液中通SO2无现象,加入下列物质能产生沉淀的是( )
1.HCl 2.CO2 3.NH3 4.Cl2 5.O2
6.H2S 7.HNO3 8.H2O2 9.溴水/碘水 10.Fe3+
11.NaOH 12.NO2
BaSO3↓
BaSO4↓
BaSO4↓
S↓
BaSO4↓
BaSO4↓
BaSO4↓
BaSO4↓
BaSO4↓
H2SO3
H2CO3
H2SO4
BaSO3↓
SO3标况下固体
拓展:检验CO2、SO2
1.检验CO2和SO2的混合气体
检验SO2
除SO2
检验CO2
检验SO2除尽
品红
澄清石灰水
酸性KMnO4
品红
褪色
紫红色褪去
不褪色
变浑浊
B紫红色没有完全褪去, D中变浑浊
2.检验SO2中有无CO2
除SO2
检验CO2
澄清石灰水
酸性KMnO4
变浑浊
Q:如何证明有CO2 ?
C中品红不褪色,D变浑浊
酸性KMnO4
酸性KMnO4
紫红色没有完全褪去
拓展:除杂
除SO2
{5940675A-B579-460E-94D1-54222C63F5DA}
CO2(SO2)
SO2(SO3)
CO2(HCl)
SO2(HCl)
Cl2(HCl)
试剂
1.CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,两瓶中所装的试剂依次应该是( )
A.NaOH 浓硫酸 B.浓硫酸 NaOH
C.饱和NaHCO3 浓硫酸 D.浓硫酸 Na2CO3
先除杂后干燥
除H2O
C
饱和NaHCO3
/溴水/KMnO4
饱和NaHSO3
溶液
饱和NaHCO3
溶液
饱和NaHSO3
溶液
饱和食
盐水
分离:冷凝-SO3(固体)
急性中毒,破坏肝脏
呼吸道疾病
过敏
酸雨
漂白有色织物
制硫酸
防腐剂
红酒--杀菌
过量
适量
三、SO2用途
PH<5.6
SO2+H2O?H2SO3
2H2SO3+O2==2H2SO4
酸雨放置一段时间后,酸性增强
四、其他含硫化合物
1.硫代硫酸钠Na2S2O3(俗名:大苏打、海波)
(1)制备:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
(2)性质:酸性歧化,碱性稳定
S2O32--+2H+=SO2↑+S↓+H2O
2.过二硫酸H2S2O8
+6
H2S2O8+2H2O=2H2SO4+H2O2
2H2S+O2(少)==2S↓+2H2O
2H2S+3O2(过)==2SO2+2H2O
②与O2
2、H2S
(1)与碱
过量H2S+KOH
少量H2S+KOH
H2S+2OH--
==S2--+2H2O
H2S+OH--
=HS--+H2O
H2S+ Fe3+==S↓+ Fe2+
(2)还原性
①与Fe3+
?
?
2
2
+2H+
CuSO4溶液检验
(3)制备
FeS+稀H2SO4
碱石灰干燥
课时1 硫和二氧化硫
硫
S
S2 -
得2e-
氧化性
-2
0
+4
+6
S
HS-S2-
SO3
SO42-
H2SO4
+2
S2O32--
SO2
SO32-
HSO3-
H2SO3
游离态:火山喷口附近或地壳的岩层
化合态:
硫化物:
硫酸盐:
有机物:
硫铁矿(FeS2) 、黄铜矿(CuFeS2)
生石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)、钡餐(BaSO4)
天然气、石油、煤、蛋白质
+2 -1
+2 +2 -2
过硫化亚铁
第三周期第ⅥA族
一、S
1、物性:
黄色晶体、难溶于水、微溶于酒精、易溶于CS2
2、化性:
①与O2:
②与金属:
③与非金属:
S+O2==SO2
?
与量无关,产物不为SO3
纯氧中:蓝紫色火焰 空气中:淡蓝色火焰
(1)还原性:
(2)氧化性:
Fe+S==FeS(黑色难溶)
?
2Cu+S==Cu2S(黑色难溶)
?
Cl2/Br2变价金属至最最高价
S/I2变价金属至最低价
H2+S(g)==H2S(臭鸡蛋气味)
?
氧化性:S
(3)氧化性、还原性
3S+6NaOH==Na2SO3+2Na2S+3H2O
?
S+ OH--==SO32--+ S2--
?
氧化剂:还原剂=2:1
6
3
2
+3H2O
4e--
SO32--+ S2-- == S↓
+6H+
2
3
+3H2O
SO32--和S2--在碱性下可共存,酸性下不共存
3、用途:
①水银洒在桌面上:
②试管底部有硫粉:
③黑火药制备:
用硫粉
Hg+S==HgS
①用CS2
②热NaOH溶液
S+2KNO3+3C===K2S+N2↑+3CO2↑
一硫二硝三木炭
?
用水过滤
滤液:KNO3 滤渣:S+C
CS2
S+CS2
C
蒸发
S
a.用水过滤
b.用CS2过滤
1.下列物质能直接由单质化合的是( )
A.FeCl2 B.FeS C.CuS D.Fe2(SO4)3 E.H2S F.SO3 G.Ag2S H.HgS
BEGH
二.SO2
1.物性:SO2是____色,______气味的______气体,密度比空气____,
易液化,____溶于水(1:40)
无
刺激
有毒
大
易
向上排空气法
2.制备:
Na2SO3+H2SO4(浓) = Na2SO4+SO2↑+H2O
70%
浓硫酸
Na2SO3固体
防倒吸
20%硫酸:水太多,SO2会溶于水损失
98%硫酸:浓硫酸分子态,无H+
3、化性:
②与水:
SO2+H2O?H2SO3
①与紫(蓝)色石蕊试液:
变红
SO2为H2SO3的酸酐
(1)酸性氧化物
实验现象
实验结论
试管内液面上升
pH试纸测得溶液的pH小于7
SO2易溶于水
SO2水溶液显酸性
2H2+O2==2H2O
?
2H2O==2H2+O2
电解
【可逆反应】在相同条件下既能向正反应方向进行,同时又能向逆反应方向进行的反应。在可逆反应的化学方程式中用“?”表示。
?
③与NaOH溶液:
SO2(少)+2NaOH==Na2SO3+H2O
SO2(过)+NaOH==NaHSO3
NaOH的酚酞溶液:
④与Ca(OH)2/Ba(OH)2溶液:
SO2(少)+Ba(OH)2==BaSO3↓+H2O
2SO2(过)+Ba(OH)2==Ba(HSO3)2
⑤与CaO:
SO2+CaO==CaSO3
⑥与Na2SO3:
SO2+H2O+Na2SO3==2NaHSO3
⑦与NaHCO3:
Na2CO3
Na2SiO3
SO2(少)+2NaHCO3==Na2SO3+2CO2+H2O
红色褪去
CO2(SO2):
CO2(HCl):
饱和NaHCO3
酸性:H2SO3 >H2CO3
燃煤中添加一定量的生石(钙基固硫)
不可鉴别SO2、CO2
SO2(过)+NaHCO3==NaHSO3+CO2
SO2--------------------------------------------------------------------SO42--
氧化剂
MnO4-- Cl2 (氯水) 溴水 碘水 Fe3+ HNO3 O2 Na2O2
SO2+ MnO4-- == SO42--+ Mn2+
5
2
+2H2O
5
2
+4H+
紫红色褪去
SO2+Cl2 == SO42--+ Cl--
+4H+
2
+2H2O
SO2+Br2+2H2O== SO42--+2Br--+4H+
SO2+I2 +2H2O == SO42--+2 I--+4H+
SO2+X2+2H2O==H2SO4+2HX
黄绿色褪去
橙色褪去
棕褐色褪去
SO2+ NO3-- == SO42--+ NO
3
2
+2H2O
3
2
+4H+
2SO2+O2 ? 2SO3
催化剂(V2O5)
?
10e--
2e--
2e--
2e--
6e--
4e--
2molSO2与1molO2,生成SO3 2mol,转移电子 4mol
<
<
SO3标况下非气体
酸性↑,pH↓,
漂白性↓
Fe3++SO2 == Fe2++SO42--
2
+2H2O
2
+4H+
黄色褪去
(2)还原性
Na2O2 +SO2 = Na2SO4
2e--
Ba(NO3)2产生白沉
SO2-------------------------S
还原剂
H2S K2S
SO2+ H2S== S↓
2
3
+2H2O
SO2+ S2-- == S↓
氧化剂
氧产2
/还产1
还原剂
4e--
淡黄色固体
2
+4H+
3
+2H2O
(3)氧化性
品红 → 褪色 → 恢复原色
(4)漂白性
SO2
加热
【实验5-2】探究SO2的漂白性
{5940675A-B579-460E-94D1-54222C63F5DA}
SO2
Ca(ClO)2/ClO2/氯水/HClO/H2O2/Na2O2/O3
活性炭/胶体
反应类型
变化
特点
应用范围
化合
氧化还原
吸附
化学
化学
物理
可逆,加热或久置后恢复原来颜色
不可逆
处理后可重复使用
品红/红墨水/有色毛发/丝绸/纸浆/草帽
几乎所有有机物质
品红/石蕊/红墨水
几乎所有有机物质
品红/石蕊/红墨水
(4)漂白性
非氧还
①选择性
②化合型
③暂时性
拓展:漂白性
{5940675A-B579-460E-94D1-54222C63F5DA}
SO2
Cl2
等物质的量SO2、Cl2
品红
紫色石蕊
褪色
褪色
加热,恢复颜色的是SO2
不褪色
变红
先变红后褪色
变红
SO2+Cl2+2H2O==H2SO4+2HCl
酸性↑,pH↓,漂白性↓
判断正误
A.SO2具有漂白性,所以能使品红溶液和酸性KMnO4溶液、溴水、紫色石蕊试液褪色且常作食品的漂白剂
B.能使品红褪色的不一定是SO2
√
×
漂白性
还原性
酸性
有毒,适量用于红酒保鲜(还原性)
①Cl2 ②Na2O2 ③Ca(ClO)2 ④活性炭 ⑤SO2
浓硫酸
Na2SO3固体
品红
溶液
溴水
KMnO4溶液
石蕊
试液
氢硫酸
(H2S)
NaOH酚酞溶液
制备SO2
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
收集SO2
褪色
漂白性
橙色
褪去
还原性
紫红色
褪去
FeCl3溶液?
黄色褪去
淀粉I2溶液
蓝色褪去
黄色
固体
氧化性
红色褪去
变红
酸性
Ba(OH)2/澄清石灰水
先白色↓,后溶解
向上排空气
酸化Ba(NO3)2
白色沉淀BaSO4
拓展:SO2性质
如何验证SO2漂白性可逆?
当品红溶液褪色,关闭分液漏斗活塞,给品红加热,恢复为红色
尾气处理
SO2+2OH--=SO32--+H2O
拓展:鉴别CO2、SO2
{5940675A-B579-460E-94D1-54222C63F5DA}
SO2
CO2
气味
品红
溴水
酸性KMnO4
FeCl3溶液
HNO3
酸化Ba(NO3)2
H2S
澄清石灰水/Ba(OH)2
BaCl2溶液/NaHCO3溶液
紫色石蕊
刺激气味
无味
褪色
橙色褪去
紫红色褪去
黄色褪去
气体
白色沉淀
黄色固体
白色沉淀-溶解
√
√
√
√
√
√
√
√
不反应,无现象
×
×
除酸性氧化物性质
变红
×
拓展:对比产物
{5940675A-B579-460E-94D1-54222C63F5DA}
BaCl2溶液
Ba(NO3)2溶液
BaCl2+NH3(NaOH)/Ba(OH)2
SO2
CO2
SO3
不反应无沉淀
不反应无沉淀
BaSO4沉淀
BaSO4沉淀
不反应无沉淀
BaSO4沉淀
BaSO3沉淀
BaCO3沉淀
BaSO4沉淀
Q:向BaCl2溶液中通SO2无现象,加入下列物质能产生沉淀的是( )
1.HCl 2.CO2 3.NH3 4.Cl2 5.O2
6.H2S 7.HNO3 8.H2O2 9.溴水/碘水 10.Fe3+
11.NaOH 12.NO2
BaSO3↓
BaSO4↓
BaSO4↓
S↓
BaSO4↓
BaSO4↓
BaSO4↓
BaSO4↓
BaSO4↓
H2SO3
H2CO3
H2SO4
BaSO3↓
SO3标况下固体
拓展:检验CO2、SO2
1.检验CO2和SO2的混合气体
检验SO2
除SO2
检验CO2
检验SO2除尽
品红
澄清石灰水
酸性KMnO4
品红
褪色
紫红色褪去
不褪色
变浑浊
B紫红色没有完全褪去, D中变浑浊
2.检验SO2中有无CO2
除SO2
检验CO2
澄清石灰水
酸性KMnO4
变浑浊
Q:如何证明有CO2 ?
C中品红不褪色,D变浑浊
酸性KMnO4
酸性KMnO4
紫红色没有完全褪去
拓展:除杂
除SO2
{5940675A-B579-460E-94D1-54222C63F5DA}
CO2(SO2)
SO2(SO3)
CO2(HCl)
SO2(HCl)
Cl2(HCl)
试剂
1.CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,两瓶中所装的试剂依次应该是( )
A.NaOH 浓硫酸 B.浓硫酸 NaOH
C.饱和NaHCO3 浓硫酸 D.浓硫酸 Na2CO3
先除杂后干燥
除H2O
C
饱和NaHCO3
/溴水/KMnO4
饱和NaHSO3
溶液
饱和NaHCO3
溶液
饱和NaHSO3
溶液
饱和食
盐水
分离:冷凝-SO3(固体)
急性中毒,破坏肝脏
呼吸道疾病
过敏
酸雨
漂白有色织物
制硫酸
防腐剂
红酒--杀菌
过量
适量
三、SO2用途
PH<5.6
SO2+H2O?H2SO3
2H2SO3+O2==2H2SO4
酸雨放置一段时间后,酸性增强
四、其他含硫化合物
1.硫代硫酸钠Na2S2O3(俗名:大苏打、海波)
(1)制备:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
(2)性质:酸性歧化,碱性稳定
S2O32--+2H+=SO2↑+S↓+H2O
2.过二硫酸H2S2O8
+6
H2S2O8+2H2O=2H2SO4+H2O2
2H2S+O2(少)==2S↓+2H2O
2H2S+3O2(过)==2SO2+2H2O
②与O2
2、H2S
(1)与碱
过量H2S+KOH
少量H2S+KOH
H2S+2OH--
==S2--+2H2O
H2S+OH--
=HS--+H2O
H2S+ Fe3+==S↓+ Fe2+
(2)还原性
①与Fe3+
?
?
2
2
+2H+
CuSO4溶液检验
(3)制备
FeS+稀H2SO4
碱石灰干燥
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
