2023年人教版高中化学选择性必修3教学课件 ★★ 章末检测试卷(一)(共50张PPT)
文档属性
| 名称 | 2023年人教版高中化学选择性必修3教学课件 ★★ 章末检测试卷(一)(共50张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-09 15:50:59 | ||
图片预览







文档简介
(共50张PPT)
章末检测试卷(一)
(时间:90分钟 满分:100分)
2023年人教版高中化学选择性必修3 ★★
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.中国《诗词大会》不仅弘扬了中国传统文化,还蕴含了许多化学知识,下列诗词与蒸馏原理有关的是
A.日照香炉生紫烟,遥看瀑布挂前川
B.千淘万漉虽辛苦,吹尽狂沙始到金
C.折戟沉沙铁未销,自将磨洗认前朝
D.千锤万凿出深山,烈火焚烧若等闲
解析 A项,由于瀑布飞泻,水汽蒸腾而上,在丽日照耀下,仿佛香炉峰冉冉升起了紫烟,“烟”实际上是水产生的雾气,与蒸馏原理有关。
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
2.下列有机物中,属于烃的衍生物且含有两种官能团的是
A.CH3Cl B.CH3CH2OH
C.CH2==CHBr D.CH2==CH2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
解析 A、B属于烃的衍生物但只有一种官能团,
C中CH2==CHBr中含有碳碳双键和碳溴键,
D属于烃类物质。
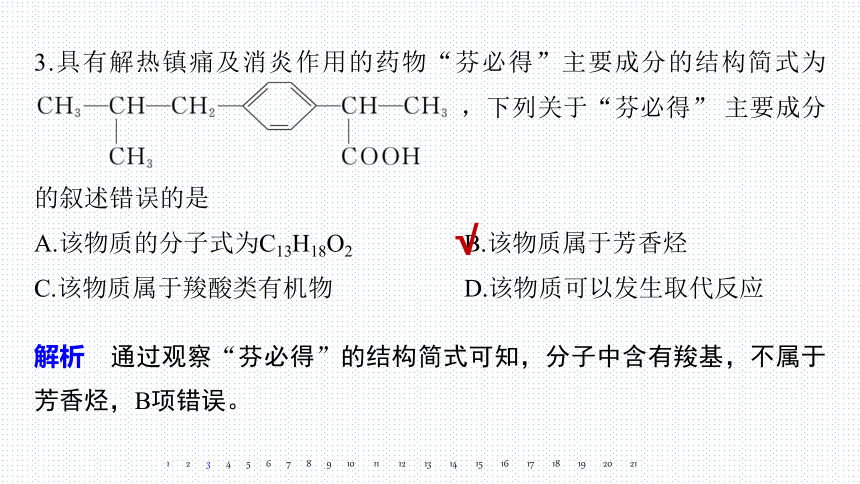
3.具有解热镇痛及消炎作用的药物“芬必得”主要成分的结构简式为
,下列关于“芬必得” 主要成分
的叙述错误的是
A.该物质的分子式为C13H18O2 B.该物质属于芳香烃
C.该物质属于羧酸类有机物 D.该物质可以发生取代反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 通过观察“芬必得”的结构简式可知,分子中含有羧基,不属于芳香烃,B项错误。
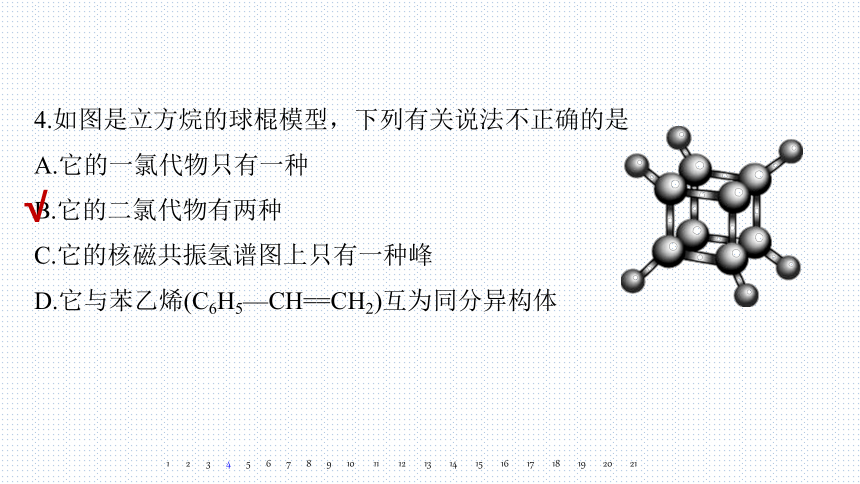
4.如图是立方烷的球棍模型,下列有关说法不正确的是
A.它的一氯代物只有一种
B.它的二氯代物有两种
C.它的核磁共振氢谱图上只有一种峰
D.它与苯乙烯(C6H5—CH==CH2)互为同分异构体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
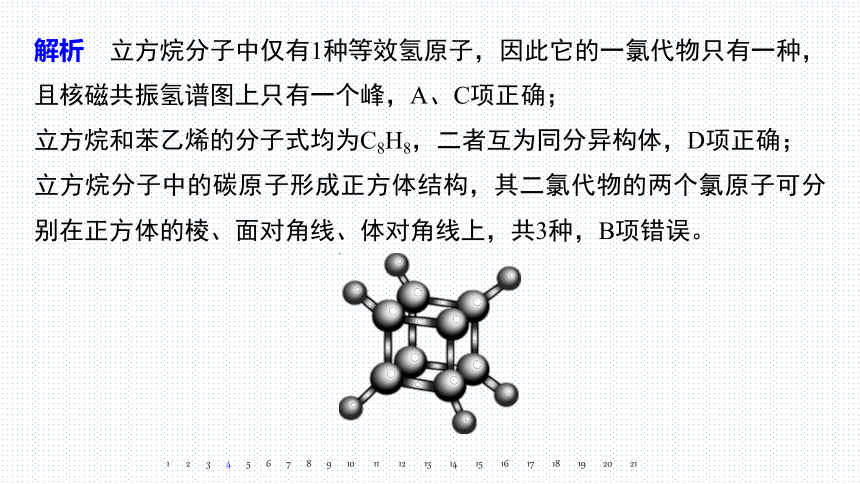
解析 立方烷分子中仅有1种等效氢原子,因此它的一氯代物只有一种,且核磁共振氢谱图上只有一个峰,A、C项正确;
立方烷和苯乙烯的分子式均为C8H8,二者互为同分异构体,D项正确;
立方烷分子中的碳原子形成正方体结构,其二氯代物的两个氯原子可分别在正方体的棱、面对角线、体对角线上,共3种,B项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
5.随着科学技术的发展,人们可以利用很多先进的方法和手段来测定有机物的组成和结构。下列说法正确的是
A.李比希元素分析仪可以测定有机物的结构简式
B.质谱仪能根据最小的碎片离子确定有机物的相对分子质量
C.红外光谱分析能测出各种化学键和官能团
D.对有机物CH3CH(OH)CH3进行核磁共振分析,能得到4个峰,且峰面积
之比为1∶1∶3∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 李比希最早提出测定有机化合物中碳、氢元素质量分数的方法,A错误;
质谱仪测定的最大质荷比为相对分子质量,则利用质谱仪可以测定有机物的相对分子质量,B错误;
有机物CH3CH(OH)CH3有3种等效氢原子,核磁共振分析有3个峰,且峰面积之比为1∶1∶6,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
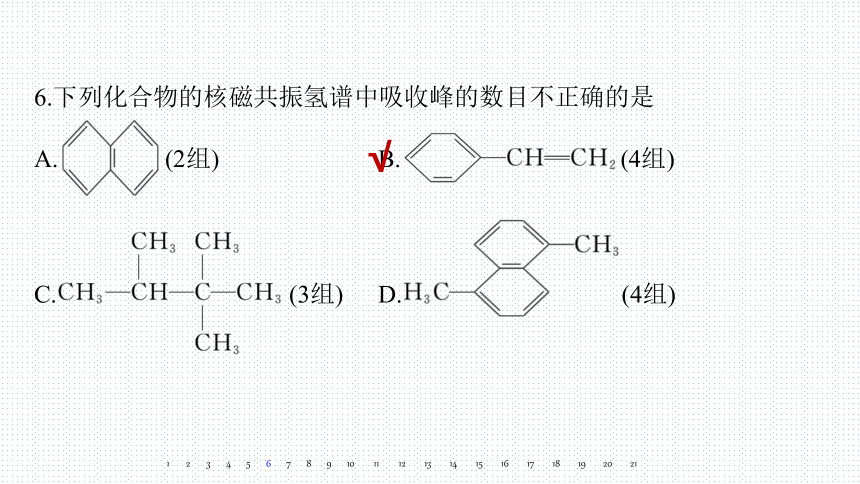
6.下列化合物的核磁共振氢谱中吸收峰的数目不正确的是
A. (2组) B. (4组)
C. (3组) D. (4组)
√
16
17
18
19
20
21
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 A项,分子中心对称,有2种不同化学环境的氢原子,吸收峰有2组,正确;
B项,有5种不同化学环境的氢原子,吸收峰有5组,不正确;
C项,有3种不同化学环境的氢原子,吸收峰有3组,正确;
D项,该分子按中心点旋转180°后重叠,有4种不同化学环境的氢原子,吸收峰有4组,正确。
16
17
18
19
20
21
7.下列分离或除杂方法不正确的是
A.利用密度与水大小的差异,用水分离苯和溴苯
B.利用沸点差异,用蒸馏法分离苯和溴苯
C.用降温结晶法除去硝酸钾中的氯化钠杂质
D.用饱和NaHCO3溶液除去CO2中混有的少量HCl气体
解析 苯和溴苯互溶且难溶于水,需根据沸点不同采用蒸馏法分离,A项错误、B项正确;
根据硝酸钾和氯化钠的溶解度不同,可采用降温结晶法除去硝酸钾中的氯化钠杂质,C项正确;
HCl能与NaHCO3反应生成CO2,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
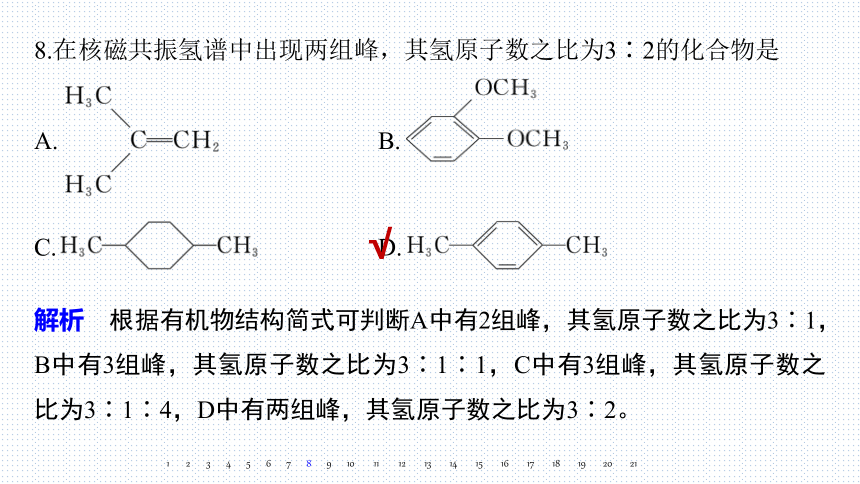
8.在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是
A. B.
C. D.
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 根据有机物结构简式可判断A中有2组峰,其氢原子数之比为3∶1,B中有3组峰,其氢原子数之比为3∶1∶1,C中有3组峰,其氢原子数之比为3∶1∶4,D中有两组峰,其氢原子数之比为3∶2。
9.下列说法正确的是
A.C3H7Cl有3种同分异构体
B.相对分子质量相同、结构不同的两种化合物互为同分异构体
C.同分异构体之间的转化是化学变化
D. 和 属于碳架异构
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 C3H7Cl有2种同分异构体,即(CH3)2CHCl和CH3CH2CH2Cl,选项A错误;
相对分子质量相同,但分子式不一定相同,故相对分子质量相同、结构不同的两种化合物不一定互为同分异构体,选项B错误;
同分异构体为不同的物质,故它们之间的转化是化学变化,选项C正确;
和 为同一物质,不互为同分异构
体,选项D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
10.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
选项 A B C D
被提纯物质 乙醇(水) 乙醇(乙酸) 乙烷(乙烯) 溴苯(溴)
除杂试剂 生石灰 氢氧化钠溶液 酸性高锰酸钾溶液 KI溶液
分离方法 蒸馏 分液 洗气 分液
√
解析 生石灰与水反应,消耗了乙醇中混有的水,蒸馏可得到乙醇,A项正确;
乙醇易溶于水,利用分液的方法不能将乙醇与盐溶液分离开,B项错误;
酸性高锰酸钾溶液可将乙烯氧化为二氧化碳,引入了新的杂质,C项错误;
溴可将KI氧化为碘单质,而碘易溶于溴苯,引入了新的杂质,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
11.下列物质中既属于芳香族化合物又属于醇的是
A. B.
C. D.CH3CH2OH
解析 含有苯环属于芳香族化合物,且羟基与苯环侧链碳原子相连属于醇,A正确;
环己基与羟基直接相连得到的是醇,环己基是烃基,B错误;
苯环与羟基直接相连得到的是酚不是醇,C错误;
分子式中不含苯环,不属于芳香族化合物,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
12.根据下表中烃的分子式排列规律,判断空格中的烃的同分异构体数目为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
A.2 B.3 C.4 D.5
解析 从表格分析,碳原子数依次增加,物质类型为烷烃、烯烃,则第五个物质是碳原子数为5的烷烃,即C5H12,有3种同分异构体。答案选B。
1 2 3 4 5 6 7 8
CH4 C2H4 C3H8 C4H8 C6H12 C7H16 C8H16
√
13.某有机物结构如图所示,它的结构最多有
A.108种 B.72种
C.56种 D.32种
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 —C5H11是戊烷去掉一个H之后形成的戊基,共8种;—C3H5Br2根据碳架异构和Br位置异构共9种,因此总共8×9=72种,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.二甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
16
17
18
19
20
21
√
解析 乙醇中含有—OH,可与金属钠或金属钾反应生成氢气,可鉴别,A正确;
质谱法可测定有机物的相对分子质量,由于分子式相同,相对分子质量相同,利用质谱法不能鉴别,B错误;
二甲醚和乙醇中分别含有C—O—C和—OH,官能团不同,可用红外光谱法鉴别,C正确;
二者含有的氢原子的种类和性质不同,可用核磁共振氢谱鉴别,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
15.下列化学用语正确的是
A.过氧化氢的电子式:
B.异戊烷的结构简式:
C.正丁烷的结构简式:CH3(CH2)2CH3
D.己烷的分子式:C6H16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
18
19
20
21
解析 过氧化氢是共价化合物,其电子式: ,故A错误;
每个碳原子有四条共价键,所以异戊烷的结构简式: ,故B错误;
正丁烷的结构简式:CH3(CH2)2CH3,故C正确;
己烷属于饱和烷烃,所以分子式为C6H14,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
16.C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是
A.2个甲基,能生成4种一氯代物
B.4个甲基,能生成1种一氯代物
C.3个甲基,能生成5种一氯代物
D.4个甲基,能生成4种一氯代物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 含2个甲基,为CH3CH2CH2CH2CH2CH3,有3种氢原子,则有3种一氯代物,故A错误;
含4个甲基,有 和 两种结构,
前一种结构有2种一氯代物,后一种结构,有3种一氯代物,故B、D错误;
含3个甲基,有 和
两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故C正确。
二、非选择题(本题包括5小题,共52分)
17.(12分)现有六种有机物,请回答下列问题:
A. B.
C. D.
E. F.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
A. B.
(1)A物质中含有的官能团名称为__________、_______。
解析 根据A的结构简式可知,分子中含有的官能团名称是碳碳双键、羟基。
碳碳双键
羟基
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
(2)B的分子式为_________。
解析 根据B的结构简式可知B的分子式为C9H12O。
C9H12O
D.
(3)D的一氯代物最多有______种。
解析 根据同一个碳原子上的氢原子是等效的,其次同一个碳原子所连接的所有甲基上的氢原子是等效的,再就是具有对称性结构的(类似于平面镜成像中物体和像的关系)可知,D分子中氢原子为4类,因此D的一氯代物最多有4种。
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
(4)上述化合物中互为同分异构体的是________(填字母,下同);互为同系物的是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
A. B.
C. D.
E. F.
A和C
B和F
解析 分子式相同,而结构不同的化合物互为同分异构体,则上述化合物中互为同分异构体的是A和C;结构相似,分子组成相差若干个CH2原子团的有机物互为同系物,则互为同系物的是B和F(因为二者均属于酚类)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
18.(8分)一般来说,对一种未知有机物结构的测定主要包括以下几个方面:
①确定相对分子质量;
②测定元素组成(种类和比例);
③研究该有机物的各种性质;
④确定结构。
(1)相对分子质量的确定一般利用质谱法、蒸气密度法等。某有机物A的质谱图显示其相对分子质量最大是72。组成元素的测定常采用元素分析仪,也可采用燃烧法。称取3.6 g A,在足量氧气中充分燃烧,生成物通过浓硫酸后,浓硫酸的质量增加5.4 g,剩余气体通过碱石灰,碱石灰的质量增加11 g,则A的分子式为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
C5H12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 燃烧后产物通过浓硫酸,浓硫酸增重5.4 g,即燃烧生成的水为5.4 g,物质的量为0.3 mol,说明A中有H,物质的量为0.6 mol;通过碱石灰,增重11 g,碱石灰吸收的为CO2,则燃烧生成的CO2物质的量为0.25 mol,说明A中有C,物质的量为0.25 mol。
(2)核磁共振谱常用氢谱或碳谱,它主要测定分子中具有不同特点的H或C
的种类与比例。如对于有机物 ,其碳谱有四个峰,峰高比为2∶1∶1∶1;氢谱有四个峰,峰高比为1∶2∶3∶6。有机物A的碳谱有两个峰,峰高比为4∶1,氢谱有一个峰。试写出有机物A的结
构简式:______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 有机物A的碳谱有两个峰,峰高比为4∶1,说明A中有2种碳原子,
氢谱有一个峰,说明只有1种氢原子,所以A的结构简式为 。
(3)A的一氯代物有_____种,二氯代物有______种。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
1
2
解析 A分子中的氢原子都是等效氢,所以只有1种一氯代物。如果分子中的2个氢原子被氯原子代替,可以是同一个碳原子上的2个氢原子被氯原子取代,也可以是不同碳原子上的氢原子被氯原子取代,所以二氯代物有2种。
19.(12分)实验室制备苯甲醇和苯甲酸的化学原理是
+KOH―→ +
+HCl―→ +KCl
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是__________,乙醚溶液中所溶解的主要成分是______。
萃取、分液
苯甲醇
解析 由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作Ⅱ为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸。据上述分析,操作Ⅰ为萃取、分液;乙醚溶液中溶解的主要成分为苯甲醇。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
(2)操作Ⅱ的名称是______,产品甲是________。
蒸馏
苯甲醇
解析 乙醚溶液中含苯甲醇,操作Ⅱ为蒸馏,得到产品甲为苯甲醇。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
(3)操作Ⅲ的名称是______,产品乙是________。
过滤
苯甲酸
解析 水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是___(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________
_______________,收集产品甲的适宜温度为________。
b
冷凝管、酒精灯、
解析 蒸馏时,温度计的水银球应在支管口处,则温度计水银球的放置位置为b;蒸馏实验中需要的玻璃仪器有:蒸馏烧瓶、温度计、冷凝管、牛角管(尾接管)、酒精灯、锥形瓶,所以还缺少的玻璃仪器为冷凝管、酒精灯、锥形瓶、牛角管;通过蒸馏分离出的是乙醚,根据乙醚的沸点可知控制蒸气的温度为34.8 ℃。
锥形瓶、牛角管
34.8 ℃
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
20.(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。
发生的反应如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 117.2 0.810 9 微溶
正丁醛 75.7 0.801 7 微溶
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~
77 ℃馏分,产量2.0 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液滴加到浓硫酸中,说明理由______________________。
不能,易造成液体飞溅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 由于浓硫酸的密度大,且溶于水放热,所以实验中不能将Na2Cr2O7溶液滴加到浓硫酸中,否则容易导致液体飞溅。
(2)加入沸石的作用是__________。若加热后发现未加沸石,应采取的正确方法是__________。
防止暴沸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 加入沸石的作用是防止暴沸,若加热后发现未加沸石,应采取的正确方法是冷却后补加。
冷却后补加
(3)题述装置图中,B仪器的名称是___________,D仪器的名称是____________。
分液漏斗
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管。
直形冷凝管
(4)分液漏斗使用前必须进行的操作是____(填字母)。
a.润湿 b.干燥 c.检漏 d.标定
c
解析 分液漏斗使用前必须进行检漏。
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在_____(填“上”或“下”)层。
下
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 正丁醛的密度为0.801 7 g·cm-3,小于水的密度,则水层在下层。
(6)反应温度应保持在90~95 ℃,其原因是__________________________
____________________________。
既可保证正丁醛及时蒸出,
解析 根据各物质的沸点可知,反应温度应保持在90~95 ℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化。
又可尽量避免其被进一步氧化
21.(8分)有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是____,则C的分子式是________。
90
C3H6O3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 有机物质谱图中,最右边的峰表示有机物的相对分子质量,因此该有机物的相对分子质量为90。浓H2SO4吸水,所以生成的水是5.4 g,即0.3 mol;碱石灰吸收CO2,则CO2是13.2 g,即0.3 mol。所以9.0 g C中
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
羧基
解析 C能与NaHCO3溶液发生反应,则C中含有官能团羧基。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结
构简式是______________。
解析 根据氢原子的种类及个数之比可知,C的结构简式为 。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
2.24
解析 C中含有1个羟基和1个羧基,所以0.1 mol C与足量Na反应能生成0.1 mol H2,标准状况下的体积是2.24 L。
章末检测试卷(一)
(时间:90分钟 满分:100分)
2023年人教版高中化学选择性必修3 ★★
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.中国《诗词大会》不仅弘扬了中国传统文化,还蕴含了许多化学知识,下列诗词与蒸馏原理有关的是
A.日照香炉生紫烟,遥看瀑布挂前川
B.千淘万漉虽辛苦,吹尽狂沙始到金
C.折戟沉沙铁未销,自将磨洗认前朝
D.千锤万凿出深山,烈火焚烧若等闲
解析 A项,由于瀑布飞泻,水汽蒸腾而上,在丽日照耀下,仿佛香炉峰冉冉升起了紫烟,“烟”实际上是水产生的雾气,与蒸馏原理有关。
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
2.下列有机物中,属于烃的衍生物且含有两种官能团的是
A.CH3Cl B.CH3CH2OH
C.CH2==CHBr D.CH2==CH2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
解析 A、B属于烃的衍生物但只有一种官能团,
C中CH2==CHBr中含有碳碳双键和碳溴键,
D属于烃类物质。
3.具有解热镇痛及消炎作用的药物“芬必得”主要成分的结构简式为
,下列关于“芬必得” 主要成分
的叙述错误的是
A.该物质的分子式为C13H18O2 B.该物质属于芳香烃
C.该物质属于羧酸类有机物 D.该物质可以发生取代反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 通过观察“芬必得”的结构简式可知,分子中含有羧基,不属于芳香烃,B项错误。
4.如图是立方烷的球棍模型,下列有关说法不正确的是
A.它的一氯代物只有一种
B.它的二氯代物有两种
C.它的核磁共振氢谱图上只有一种峰
D.它与苯乙烯(C6H5—CH==CH2)互为同分异构体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 立方烷分子中仅有1种等效氢原子,因此它的一氯代物只有一种,且核磁共振氢谱图上只有一个峰,A、C项正确;
立方烷和苯乙烯的分子式均为C8H8,二者互为同分异构体,D项正确;
立方烷分子中的碳原子形成正方体结构,其二氯代物的两个氯原子可分别在正方体的棱、面对角线、体对角线上,共3种,B项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
5.随着科学技术的发展,人们可以利用很多先进的方法和手段来测定有机物的组成和结构。下列说法正确的是
A.李比希元素分析仪可以测定有机物的结构简式
B.质谱仪能根据最小的碎片离子确定有机物的相对分子质量
C.红外光谱分析能测出各种化学键和官能团
D.对有机物CH3CH(OH)CH3进行核磁共振分析,能得到4个峰,且峰面积
之比为1∶1∶3∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 李比希最早提出测定有机化合物中碳、氢元素质量分数的方法,A错误;
质谱仪测定的最大质荷比为相对分子质量,则利用质谱仪可以测定有机物的相对分子质量,B错误;
有机物CH3CH(OH)CH3有3种等效氢原子,核磁共振分析有3个峰,且峰面积之比为1∶1∶6,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.下列化合物的核磁共振氢谱中吸收峰的数目不正确的是
A. (2组) B. (4组)
C. (3组) D. (4组)
√
16
17
18
19
20
21
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 A项,分子中心对称,有2种不同化学环境的氢原子,吸收峰有2组,正确;
B项,有5种不同化学环境的氢原子,吸收峰有5组,不正确;
C项,有3种不同化学环境的氢原子,吸收峰有3组,正确;
D项,该分子按中心点旋转180°后重叠,有4种不同化学环境的氢原子,吸收峰有4组,正确。
16
17
18
19
20
21
7.下列分离或除杂方法不正确的是
A.利用密度与水大小的差异,用水分离苯和溴苯
B.利用沸点差异,用蒸馏法分离苯和溴苯
C.用降温结晶法除去硝酸钾中的氯化钠杂质
D.用饱和NaHCO3溶液除去CO2中混有的少量HCl气体
解析 苯和溴苯互溶且难溶于水,需根据沸点不同采用蒸馏法分离,A项错误、B项正确;
根据硝酸钾和氯化钠的溶解度不同,可采用降温结晶法除去硝酸钾中的氯化钠杂质,C项正确;
HCl能与NaHCO3反应生成CO2,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
8.在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是
A. B.
C. D.
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 根据有机物结构简式可判断A中有2组峰,其氢原子数之比为3∶1,B中有3组峰,其氢原子数之比为3∶1∶1,C中有3组峰,其氢原子数之比为3∶1∶4,D中有两组峰,其氢原子数之比为3∶2。
9.下列说法正确的是
A.C3H7Cl有3种同分异构体
B.相对分子质量相同、结构不同的两种化合物互为同分异构体
C.同分异构体之间的转化是化学变化
D. 和 属于碳架异构
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 C3H7Cl有2种同分异构体,即(CH3)2CHCl和CH3CH2CH2Cl,选项A错误;
相对分子质量相同,但分子式不一定相同,故相对分子质量相同、结构不同的两种化合物不一定互为同分异构体,选项B错误;
同分异构体为不同的物质,故它们之间的转化是化学变化,选项C正确;
和 为同一物质,不互为同分异构
体,选项D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
10.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
选项 A B C D
被提纯物质 乙醇(水) 乙醇(乙酸) 乙烷(乙烯) 溴苯(溴)
除杂试剂 生石灰 氢氧化钠溶液 酸性高锰酸钾溶液 KI溶液
分离方法 蒸馏 分液 洗气 分液
√
解析 生石灰与水反应,消耗了乙醇中混有的水,蒸馏可得到乙醇,A项正确;
乙醇易溶于水,利用分液的方法不能将乙醇与盐溶液分离开,B项错误;
酸性高锰酸钾溶液可将乙烯氧化为二氧化碳,引入了新的杂质,C项错误;
溴可将KI氧化为碘单质,而碘易溶于溴苯,引入了新的杂质,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
11.下列物质中既属于芳香族化合物又属于醇的是
A. B.
C. D.CH3CH2OH
解析 含有苯环属于芳香族化合物,且羟基与苯环侧链碳原子相连属于醇,A正确;
环己基与羟基直接相连得到的是醇,环己基是烃基,B错误;
苯环与羟基直接相连得到的是酚不是醇,C错误;
分子式中不含苯环,不属于芳香族化合物,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
12.根据下表中烃的分子式排列规律,判断空格中的烃的同分异构体数目为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
A.2 B.3 C.4 D.5
解析 从表格分析,碳原子数依次增加,物质类型为烷烃、烯烃,则第五个物质是碳原子数为5的烷烃,即C5H12,有3种同分异构体。答案选B。
1 2 3 4 5 6 7 8
CH4 C2H4 C3H8 C4H8 C6H12 C7H16 C8H16
√
13.某有机物结构如图所示,它的结构最多有
A.108种 B.72种
C.56种 D.32种
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 —C5H11是戊烷去掉一个H之后形成的戊基,共8种;—C3H5Br2根据碳架异构和Br位置异构共9种,因此总共8×9=72种,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.二甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
16
17
18
19
20
21
√
解析 乙醇中含有—OH,可与金属钠或金属钾反应生成氢气,可鉴别,A正确;
质谱法可测定有机物的相对分子质量,由于分子式相同,相对分子质量相同,利用质谱法不能鉴别,B错误;
二甲醚和乙醇中分别含有C—O—C和—OH,官能团不同,可用红外光谱法鉴别,C正确;
二者含有的氢原子的种类和性质不同,可用核磁共振氢谱鉴别,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
15.下列化学用语正确的是
A.过氧化氢的电子式:
B.异戊烷的结构简式:
C.正丁烷的结构简式:CH3(CH2)2CH3
D.己烷的分子式:C6H16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
18
19
20
21
解析 过氧化氢是共价化合物,其电子式: ,故A错误;
每个碳原子有四条共价键,所以异戊烷的结构简式: ,故B错误;
正丁烷的结构简式:CH3(CH2)2CH3,故C正确;
己烷属于饱和烷烃,所以分子式为C6H14,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
16.C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是
A.2个甲基,能生成4种一氯代物
B.4个甲基,能生成1种一氯代物
C.3个甲基,能生成5种一氯代物
D.4个甲基,能生成4种一氯代物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
解析 含2个甲基,为CH3CH2CH2CH2CH2CH3,有3种氢原子,则有3种一氯代物,故A错误;
含4个甲基,有 和 两种结构,
前一种结构有2种一氯代物,后一种结构,有3种一氯代物,故B、D错误;
含3个甲基,有 和
两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故C正确。
二、非选择题(本题包括5小题,共52分)
17.(12分)现有六种有机物,请回答下列问题:
A. B.
C. D.
E. F.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
A. B.
(1)A物质中含有的官能团名称为__________、_______。
解析 根据A的结构简式可知,分子中含有的官能团名称是碳碳双键、羟基。
碳碳双键
羟基
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
(2)B的分子式为_________。
解析 根据B的结构简式可知B的分子式为C9H12O。
C9H12O
D.
(3)D的一氯代物最多有______种。
解析 根据同一个碳原子上的氢原子是等效的,其次同一个碳原子所连接的所有甲基上的氢原子是等效的,再就是具有对称性结构的(类似于平面镜成像中物体和像的关系)可知,D分子中氢原子为4类,因此D的一氯代物最多有4种。
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
(4)上述化合物中互为同分异构体的是________(填字母,下同);互为同系物的是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
A. B.
C. D.
E. F.
A和C
B和F
解析 分子式相同,而结构不同的化合物互为同分异构体,则上述化合物中互为同分异构体的是A和C;结构相似,分子组成相差若干个CH2原子团的有机物互为同系物,则互为同系物的是B和F(因为二者均属于酚类)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
18.(8分)一般来说,对一种未知有机物结构的测定主要包括以下几个方面:
①确定相对分子质量;
②测定元素组成(种类和比例);
③研究该有机物的各种性质;
④确定结构。
(1)相对分子质量的确定一般利用质谱法、蒸气密度法等。某有机物A的质谱图显示其相对分子质量最大是72。组成元素的测定常采用元素分析仪,也可采用燃烧法。称取3.6 g A,在足量氧气中充分燃烧,生成物通过浓硫酸后,浓硫酸的质量增加5.4 g,剩余气体通过碱石灰,碱石灰的质量增加11 g,则A的分子式为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
C5H12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 燃烧后产物通过浓硫酸,浓硫酸增重5.4 g,即燃烧生成的水为5.4 g,物质的量为0.3 mol,说明A中有H,物质的量为0.6 mol;通过碱石灰,增重11 g,碱石灰吸收的为CO2,则燃烧生成的CO2物质的量为0.25 mol,说明A中有C,物质的量为0.25 mol。
(2)核磁共振谱常用氢谱或碳谱,它主要测定分子中具有不同特点的H或C
的种类与比例。如对于有机物 ,其碳谱有四个峰,峰高比为2∶1∶1∶1;氢谱有四个峰,峰高比为1∶2∶3∶6。有机物A的碳谱有两个峰,峰高比为4∶1,氢谱有一个峰。试写出有机物A的结
构简式:______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 有机物A的碳谱有两个峰,峰高比为4∶1,说明A中有2种碳原子,
氢谱有一个峰,说明只有1种氢原子,所以A的结构简式为 。
(3)A的一氯代物有_____种,二氯代物有______种。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
1
2
解析 A分子中的氢原子都是等效氢,所以只有1种一氯代物。如果分子中的2个氢原子被氯原子代替,可以是同一个碳原子上的2个氢原子被氯原子取代,也可以是不同碳原子上的氢原子被氯原子取代,所以二氯代物有2种。
19.(12分)实验室制备苯甲醇和苯甲酸的化学原理是
+KOH―→ +
+HCl―→ +KCl
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是__________,乙醚溶液中所溶解的主要成分是______。
萃取、分液
苯甲醇
解析 由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作Ⅱ为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸。据上述分析,操作Ⅰ为萃取、分液;乙醚溶液中溶解的主要成分为苯甲醇。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
(2)操作Ⅱ的名称是______,产品甲是________。
蒸馏
苯甲醇
解析 乙醚溶液中含苯甲醇,操作Ⅱ为蒸馏,得到产品甲为苯甲醇。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
(3)操作Ⅲ的名称是______,产品乙是________。
过滤
苯甲酸
解析 水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是___(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________
_______________,收集产品甲的适宜温度为________。
b
冷凝管、酒精灯、
解析 蒸馏时,温度计的水银球应在支管口处,则温度计水银球的放置位置为b;蒸馏实验中需要的玻璃仪器有:蒸馏烧瓶、温度计、冷凝管、牛角管(尾接管)、酒精灯、锥形瓶,所以还缺少的玻璃仪器为冷凝管、酒精灯、锥形瓶、牛角管;通过蒸馏分离出的是乙醚,根据乙醚的沸点可知控制蒸气的温度为34.8 ℃。
锥形瓶、牛角管
34.8 ℃
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
20.(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。
发生的反应如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 117.2 0.810 9 微溶
正丁醛 75.7 0.801 7 微溶
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~
77 ℃馏分,产量2.0 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液滴加到浓硫酸中,说明理由______________________。
不能,易造成液体飞溅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 由于浓硫酸的密度大,且溶于水放热,所以实验中不能将Na2Cr2O7溶液滴加到浓硫酸中,否则容易导致液体飞溅。
(2)加入沸石的作用是__________。若加热后发现未加沸石,应采取的正确方法是__________。
防止暴沸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 加入沸石的作用是防止暴沸,若加热后发现未加沸石,应采取的正确方法是冷却后补加。
冷却后补加
(3)题述装置图中,B仪器的名称是___________,D仪器的名称是____________。
分液漏斗
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管。
直形冷凝管
(4)分液漏斗使用前必须进行的操作是____(填字母)。
a.润湿 b.干燥 c.检漏 d.标定
c
解析 分液漏斗使用前必须进行检漏。
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在_____(填“上”或“下”)层。
下
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 正丁醛的密度为0.801 7 g·cm-3,小于水的密度,则水层在下层。
(6)反应温度应保持在90~95 ℃,其原因是__________________________
____________________________。
既可保证正丁醛及时蒸出,
解析 根据各物质的沸点可知,反应温度应保持在90~95 ℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化。
又可尽量避免其被进一步氧化
21.(8分)有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是____,则C的分子式是________。
90
C3H6O3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
解析 有机物质谱图中,最右边的峰表示有机物的相对分子质量,因此该有机物的相对分子质量为90。浓H2SO4吸水,所以生成的水是5.4 g,即0.3 mol;碱石灰吸收CO2,则CO2是13.2 g,即0.3 mol。所以9.0 g C中
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
羧基
解析 C能与NaHCO3溶液发生反应,则C中含有官能团羧基。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结
构简式是______________。
解析 根据氢原子的种类及个数之比可知,C的结构简式为 。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
19
20
21
17
2.24
解析 C中含有1个羟基和1个羧基,所以0.1 mol C与足量Na反应能生成0.1 mol H2,标准状况下的体积是2.24 L。
