第三章 晶体结构与性质 测试(含解析) 高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章 晶体结构与性质 测试(含解析) 高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 405.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-10 09:55:18 | ||
图片预览




文档简介
第三章《晶体结构与性质》测试
一、单选题
1.下列说法正确的是
A.晶体溶于水时,离子键被破坏,共价键不受影响
B.易分解是因为分子间作用力弱
C.晶体中既有离子键又含有极性共价键
D.和的分子结构中,每个原子最外层都具有8电子稳定结构
2.某物质的化学式为,其水溶液不导电,加入溶液也不产生沉淀,以强碱处理并没有放出,则关于此化合物的说法正确的是
A.该配合物中心原子的配位数为4
B.该配合物的配体只有
C.和分子均与形成配位键
D.该配合物可能是平面正方形结构
3.下列说法不正确的是( )
A.NH5的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物
B.Na2O是离子晶体,溶于水生成NaOH的过程中既有离子键的断裂又有共价键的形成
C.某物质固态时不导电但溶于水能导电,则该物质中一定含有离子键
D.石英是由硅原子和氧原子构成的原子晶体,每个原子的最外层都具有8电子稳定结构
4.下列说法正确的是( )
A.在含4 mol Si—O键的二氧化硅晶体中,氧原子的数目为4NA
B.金刚石晶体中,碳原子数与C—C键数之比为1∶2
C.30 g二氧化硅晶体中含有0.5NA个二氧化硅分子
D.晶体硅、晶体氖均是由相应原子直接构成的原子晶体
5.实验室用检验的离子方程式为。下列有关说法正确的是
A.中铁离子的配位数为 B.含键
C.碳元素电负性强于氮元素的 D.再失去1个电子比更难
6.能用键能解释,且结论正确的是
A.熔点:金刚石>晶体硅 B.分子稳定性:H2O>HF
C.水中的溶解度:SO2>CO2 D.状态:常温时,Cl2是气态,Br2为液态
7.卤族元素随核电荷数的增加,下列叙述正确的是
A.单质的颜色逐渐变浅 B.氢卤酸的酸性逐渐增强
C.单质的熔点逐渐降低 D.单质的氧化性逐渐增强
8.下面说法错误的是
A.金属键由强到弱:
B.熔点由高到低:
C.硬度由大到小:金刚石>晶体硅>碳化硅
D.晶格能由大到小:
9.下列物质中有氧离子存在的是
A.CaO B.H2O C.KClO3 D.KOH
10.有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的核外电子总数等于Q原子的最外层电子数;Q原子的L电子层的p能级上只有一对成对电子;T原子有1个3p空轨道。下列叙述错误的是
A.元素Y和Q可形成化合物Y2Q3
B.气态氢化物的稳定性:Q>T>Z
C.X和Q结合生成的化合物晶体类型为分子晶体
D.T和Z的最高价氧化物均为酸性氧化物
11.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末和另一种化合物。该成果发表在《科学》杂志上。同学们对此有下列一些“理解”,你认为错误的是
A.金刚石中C原子与C-C键个数比为1:2
B.另一种化合物的化学式为NaCl,晶体中Na+的配位数为8
C.该反应涉及的四种物质分别属于四种不同的晶体类型
D.CCl4的熔点低于金属钠的熔点
12.下列不能形成配位键的组合是
A.、 B.、 C.、H+ D.、
二、填空题
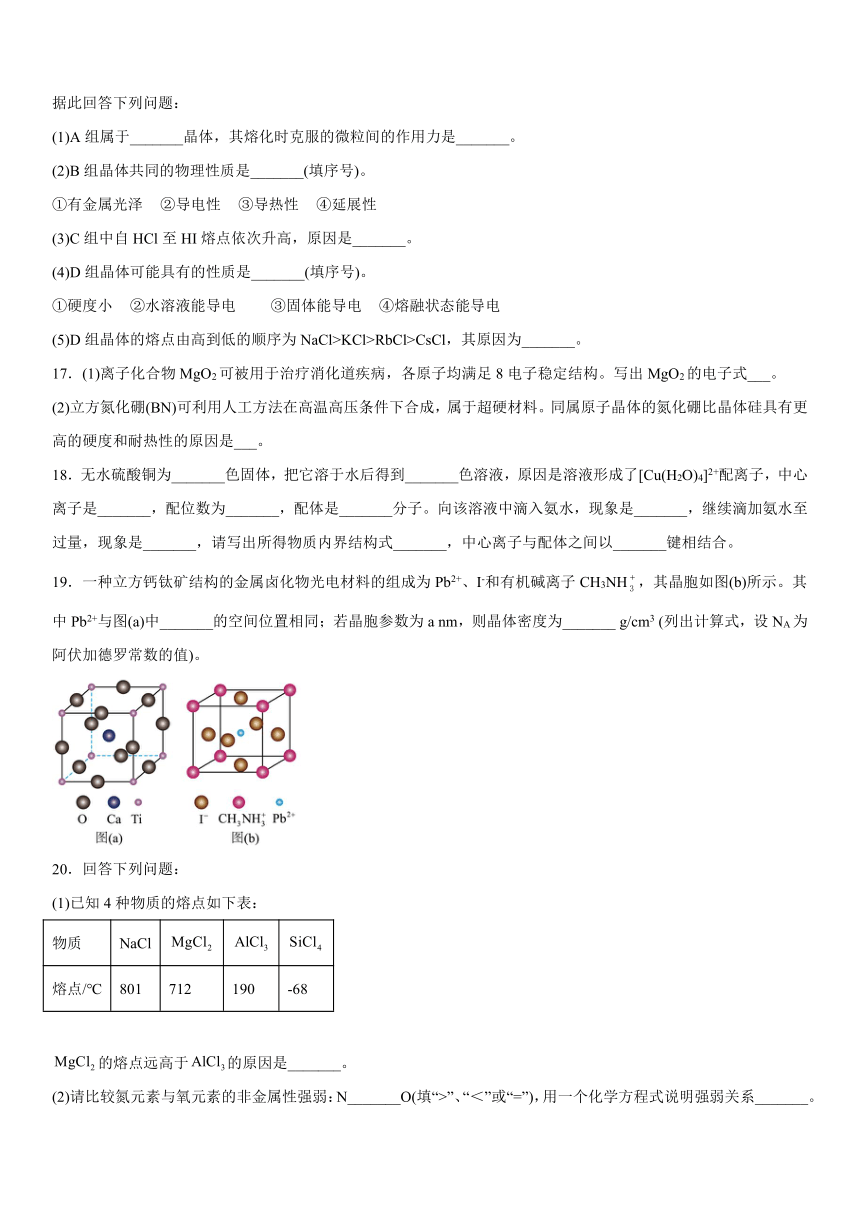
13.一种立方钙钛矿结构的金属卤化物光电材料的组成为、和有机碱离子,其晶胞如图(b)所示。其中与图(a)中_______的空间位置相同,有机碱中,N原子的杂化轨道类型是_______;若晶胞参数为anm,则晶体密度为_______(列出计算式,设为阿伏加德罗常数的值)。
14.(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3_______,
CoCl3·5NH3_______,
CoCl3·4NH3(绿色和紫色):_______。
②上述配合物中,中心离子的配位数都是_______。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供_______,SCN-提供_______,二者通过配位键结合。
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。含该离子的配合物的化学式是_______。
③若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_______。
15.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
16.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃
硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃
硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃
二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
17.(1)离子化合物MgO2可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出MgO2的电子式___。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是___。
18.无水硫酸铜为_______色固体,把它溶于水后得到_______色溶液,原因是溶液形成了[Cu(H2O)4]2+配离子,中心离子是_______,配位数为_______,配体是_______分子。向该溶液中滴入氨水,现象是_______,继续滴加氨水至过量,现象是_______,请写出所得物质内界结构式_______,中心离子与配体之间以_______键相结合。
19.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
20.回答下列问题:
(1)已知4种物质的熔点如下表:
物质 NaCl
熔点/℃ 801 712 190 -68
的熔点远高于的原因是_______。
(2)请比较氮元素与氧元素的非金属性强弱:N_______O(填“>”、“<”或“=”),用一个化学方程式说明强弱关系_______。
参考答案:
1.C
【详解】A.晶体溶于水时,电离出氢离子钠离子和硫酸根离子,离子键被破坏,部分共价键被破坏,A错误;
B.易分解是因为共价键作用力弱,B错误;
C.晶体中有离子键,氢氧根中含有极性共价键,C正确;
D.中的H原子,最外层为2电子稳定结构,D错误;
答案选C。
2.C
【详解】A.加入溶液反应也不产生沉淀,可知无游离的,以强碱处理并没有放出,可知无游离的氨分子,两者均与中心铂离子形成配位键,所以该物质的配位化学式为故配位数为6,故A错误;
B.根据题意可知该配合物为,配体有和,故B错误;
C.该配合物为,和分子均与中心铂离子形成配位键,故C正确;
D.Pt与6个配体成键,该配合物应是8面体结构,故D错误;
故答案为C。
3.C
【详解】A.NH5为离子化合物,分子中存在NH4+和H-,所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,含有离子键,N-H键属于共价键,选项A正确;
B.Na2O是离子晶体,溶于水生成NaOH的过程中,Na2O中离子键断裂,生成NaOH时有共价键的形成,选项B正确;
C.某物质固态时不导电但溶于水能导电,则该物质中不一定含有离子键,如氯化铝为共价化合物不含离子键,选项C不正确;
D.石英是由硅原子和氧原子构成的原子晶体,每个硅原子形成4个共价键,每个氧原子形成两个共价键,每个原子的最外层都具有8电子稳定结构,选项D正确;
答案选C。
4.B
【详解】A.在含4 mol Si-O键的二氧化硅晶体中,含Si原子是1mol,由于O原子与2个Si原子形成Si-O共价键,所以在含4 mol Si-O键的二氧化硅晶体中,含氧原子的数目为2NA,A错误;
B.在金刚石晶体中,碳原子与相邻的4个C原子形成4个C-C键,每个C-C键为形成共价键的2个C所共有,所以C原子数与C-C键数之比为1∶2,B正确;
C.二氧化硅晶体属于原子晶体,无二氧化硅分子,C错误;
D.晶体硅是由相应原子直接构成的原子晶体,而晶体氖则属于分子晶体,构成微粒是分子,1个Ne原子就是1个分子,D错误;
故合理选项是B。
5.B
【详解】A.中铁离子的配位数为6,A错误;
B.1个CN一含1个σ键,1个CN一与Fe3+形成1个配位键,配位键也是σ键,所以含键,B正确;
C.碳和氮位于同一周期,氮在右侧,所以碳元素电负性弱于氮元素的电负性,C错误;
D.Mn2+外围电子排布式为3d5,由Mn2+变为Mn3+,3d能级由较稳定的3d半充满状态变为不稳定的3d4状态,需要吸收的能量多,Fe2+外围电子排布式为3d6,Fe2+变为Fe3+,3d能级由较不稳定的3d6状态变为较稳定的3d5半充满状态,需要吸收的能量少。所以Mn2+再失去1个电子比Fe2+再失去一个电子困难。D错误;
故选B。
6.A
【详解】A.原子晶体中原子形成的共价键越强,晶体的熔点越高,金刚石和晶体硅都是原子晶体,碳碳键的键长小于硅硅键、键能大于硅硅键,则金刚石中的碳碳键强于晶体硅中的硅硅键,熔点高于晶体硅,能用键能解释,故A正确;
B.F的电负性大且原子半径小,则H-F键比O-H键键能更大,故分子稳定性:H2O<HF,故B错误;
C.二氧化硫和水是极性分子,二氧化碳是非极性分子,由相似相溶原理可知,二氧化硫在水中的溶解度大于二氧化碳,不能用键能解释,故C错误;
D.Cl2、Br2形成的晶体都是分子晶体,二者组成结构相似,相对分子质量越大,范德华力越大,熔沸点越高,则常温时,Cl2是气态,Br2为液态,但由于范德华力很弱,二者的沸点都比较低,不能用键能解释,故D错误;
故选A。
7.B
【详解】A.卤族元素由上到下,单质的颜色逐渐加深,故A错误;
B.卤族元素由上到下,核电荷数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减小,H-X键的键能逐渐减小,HX电离出H+越来越容易,故氢卤酸的酸性依次增强,故B正确;
C.卤族元素单质都是分子晶体,组成结构相似,相对分子质量越大,范德华力越强,熔沸点越高,所以卤族元素单质的熔点随着核电荷数的增加逐渐升高,故C错误;
D.卤族元素非金属性随核电荷数增大而减弱,其单质的氧化性随核电荷数增大逐渐减弱,故D错误;
答案选B。
8.C
【详解】A.形成金属键的金属阳离子的半径越小,所带电荷数越多,金属键越强,则金属键由强到弱:,A正确;
B.四种化合物形成的晶体均是分子晶体,相对分子质量越大,分子间作用力越强,熔点越高,则熔点由高到低:,B正确;
C.共价晶体中形成共价键的原子半径越小,共价键越强,硬度越大,则硬度由大到小:金刚石>碳化硅>晶体硅,C错误;
D.离子晶体中形成离子键的离子半径越小,所带电荷数越多,晶格能越大,则晶格能由大到小:,D正确;
答案选C。
9.A
【详解】A.CaO中含有离子键,为离子化合物,含有氧离子和钙离子,A正确;
B.H2O中存在O的共价键,是共价化合物,不存在氧离子,B错误;
C.KClO3中存在钾离子和氯酸根离子,有离子键,不存在氧离子,C错误;
D.KOH中存在钾离子和氢氧根离子,有离子键,不存在氧离子,D错误;
故选A。
10.B
【分析】由X原子M层上有2个未成对电子且无空轨道可知,X为S元素;Y原子的特征电子构型为3d64s2,则Y为Fe元素;Q原子的L电子层的p能级上只有一对成对电子,则Q是O元素;由Z原子的核外电子总数等于O原子的最外层电子数可知,Z为C元素;由T原子有1个3p空轨道可知,T是Si元素。
【详解】A.Fe元素和O元素能形成化合物Fe2O3,A项正确;
B.元素的非金属性越强,气态氢化物的稳定性越强,非金属性:Q>Z>T,则气态氢化物的稳定性:Q>Z>T,B项错误;
C.硫元素和氧元素结合生成的化合物可以是二氧化硫或三氧化硫,二氧化硫和三氧化硫都是共价化合物,形成的晶体为分子晶体,C项正确;
D.Si元素和C元素的最高价氧化物二氧化硅和二氧化碳均为酸性氧化物,D项正确;
答案选B。
11.B
【详解】A.每个碳原子形成四个C-C键,每个碳碳键由两个碳原子共用,C-C键数,所以金刚石晶体中碳原子个数与C-C键数之比1:2,故A正确;
B.根据原子守恒推出另一化合物是NaCl,根据氯化钠的晶胞结构知Na+和Cl-的配位数均为6,故B错误;
C.CCl4和Na反应生成NaCl和金刚石,CCl4属于分子晶体,Na属于金属晶体,NaCl属于离子晶体和金刚石属于原子晶体(或共价晶体),故C正确;
D.CCl4是分子晶体,常温下是液态,金属钠是金属晶体,常温下是固态,故D正确;
故选B。
12.C
【详解】A. 有空轨道,中的氮原子上有孤对电子,故二者可以形成配位键,A项不符合题意;
B. 中B原子有空轨道,中的氮原子上有孤对电子,故二者可以形成配位键,B项不符合题意;
C. 、两种离子均没有孤对电子,故二者不能形成配位键,C项符合题意;
D. 有空轨道,提供孤对电子,故二者可以形成配位键,D项不符合题意;
故选C。
13. Ti4+ sp3
【详解】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;中,氮原子形成4个单键,其中有1个是配位键,N原子采取杂化;根据均摊法,1个晶胞中含有的个数为,的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
14. [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl 6 空轨道 孤电子对 [Fe(SCN)]Cl2 FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
【详解】(1) ①由题意知,四种络合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。
②1mol CoCl3·6NH3只生成3mol氯化银,则有3mol氯离子为外界离子,钴的配位数为6;
1mol CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)都只生成1mol氯化银,则有1mol氯离子为外界离子,钴的配位数为6。
(2)①Fe3+与SCN-反应生成的配合物中, Fe3+提供空轨道, SCN-提供孤对电子。
②Fe3+与SCN-以个数比1 : 1配合所得离子为[Fe ( SCN)]2+ ,故FeCl3与KSCN在水溶液中反应生成[Fe ( SCN ) ]Cl2与KCl。
③国Fe3+与SCN-以个数比1 : 5配合所得高子为[Fe (SCN) 5]2-,故FeCl3与KSCN在水溶液中反应生成K2[Fe (SCN)5]2-与KCI,所以反应方程式为: FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl。
15. 分子晶体 苯胺分子之间存在氢键
【详解】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
16.(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
【解析】(1)
A组熔点很高,为原子晶体,构成微粒是原子,原子晶体是由原子通过共价键形成的,熔化时克服的是共价键;
(2)
B组为金属晶体,根据金属晶体的特征可知,B组金属晶体具有①②③④四条共性;
(3)
HF的分子之间除存在范德华力外,分子之间还含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常;
(4)
D组属于离子晶体,离子晶体的构成微粒是阴、阳离子,离子之间通过离子键结合,离子键是一种比较强的相互作用,具有一定的硬度;一般能够溶于水,在水分子作用下电离产生自由移动的离子,因而能够导电;在固体时离子之间通过离子键结合,不能自由移动,因此固态时不能导电;在熔融状态时断裂离子键,产生自由移动的离子,因此在熔融状态下也可以导电,故②④两个性质符合;
(5)
D组属于离子晶体,其熔点与离子键键能有关。离子半径越小,离子之间作用力越强,离子键的键能越大,晶格能越大,物质的熔沸点就越高。由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
17. B—N的键长比Si—Si的键长短(或B—N的键能较大)
【详解】(1) MgO2中为原子团,中O原子间是单键,故答案为:;
(2) 氮化硼和晶体硅都是原子晶体,原子晶体的硬度和耐热性由键能大小决定,故答案为:B—N的键长比Si—Si的键长短(或B—N的键能较大)。
18. 白 蓝 Cu2+ 4 H2O 有蓝色沉淀生成 沉淀溶解,溶液变成深蓝色 [Cu(NH3)4]2+ 配位键
【详解】无水硫酸铜固体为白色;把它溶于水后形成了[Cu(H2O)4]2+配离子,溶液呈蓝色;[Cu(H2O)4]2+配离子的中心离子是Cu2+,配位数为4,配体是H2O分子。向溶液中滴入氨水,有氢氧化铜沉淀生成,故现象是:有蓝色沉淀生成;继续滴加氨水至过量,氢氧化铜与氨水反应生成[Cu(NH3)4]SO4,现象是:沉淀溶解,得到深蓝色溶液;[Cu(NH3)4]SO4的内界结构式为:[Cu(NH3)4]2+,中心离子与配体之间以配位键结合。
19. Ti4+
【详解】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
20.(1)、分别为离子晶体、分子晶体,前者熔融需要克服离子键,后者克服分子间作用力,所以的熔点远高于
(2) < 或
【解析】(1)
一般熔点高低顺序是原子晶体>离子晶体>分子晶体,根据表中数据,氯化镁为离子晶体,熔融时破坏离子键,氯化铝为分子晶体,熔融是破坏分子间作用力,因此氯化镁的熔点高于氯化铝的熔点,答案为氯化镁、氯化铝分别为离子晶体、分子晶体,前者熔融需要克服离子键,后者克服分子间作用力,因此氯化镁熔点远高于氯化铝;
(2)
同周期从左向右非金属性增强(稀有气体除外),因此氧元素的非金属性强于氮元素,利用氧化剂的氧化性强于氧化产物的氧化性,可以用或进行比较;答案为<;或。
一、单选题
1.下列说法正确的是
A.晶体溶于水时,离子键被破坏,共价键不受影响
B.易分解是因为分子间作用力弱
C.晶体中既有离子键又含有极性共价键
D.和的分子结构中,每个原子最外层都具有8电子稳定结构
2.某物质的化学式为,其水溶液不导电,加入溶液也不产生沉淀,以强碱处理并没有放出,则关于此化合物的说法正确的是
A.该配合物中心原子的配位数为4
B.该配合物的配体只有
C.和分子均与形成配位键
D.该配合物可能是平面正方形结构
3.下列说法不正确的是( )
A.NH5的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物
B.Na2O是离子晶体,溶于水生成NaOH的过程中既有离子键的断裂又有共价键的形成
C.某物质固态时不导电但溶于水能导电,则该物质中一定含有离子键
D.石英是由硅原子和氧原子构成的原子晶体,每个原子的最外层都具有8电子稳定结构
4.下列说法正确的是( )
A.在含4 mol Si—O键的二氧化硅晶体中,氧原子的数目为4NA
B.金刚石晶体中,碳原子数与C—C键数之比为1∶2
C.30 g二氧化硅晶体中含有0.5NA个二氧化硅分子
D.晶体硅、晶体氖均是由相应原子直接构成的原子晶体
5.实验室用检验的离子方程式为。下列有关说法正确的是
A.中铁离子的配位数为 B.含键
C.碳元素电负性强于氮元素的 D.再失去1个电子比更难
6.能用键能解释,且结论正确的是
A.熔点:金刚石>晶体硅 B.分子稳定性:H2O>HF
C.水中的溶解度:SO2>CO2 D.状态:常温时,Cl2是气态,Br2为液态
7.卤族元素随核电荷数的增加,下列叙述正确的是
A.单质的颜色逐渐变浅 B.氢卤酸的酸性逐渐增强
C.单质的熔点逐渐降低 D.单质的氧化性逐渐增强
8.下面说法错误的是
A.金属键由强到弱:
B.熔点由高到低:
C.硬度由大到小:金刚石>晶体硅>碳化硅
D.晶格能由大到小:
9.下列物质中有氧离子存在的是
A.CaO B.H2O C.KClO3 D.KOH
10.有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的核外电子总数等于Q原子的最外层电子数;Q原子的L电子层的p能级上只有一对成对电子;T原子有1个3p空轨道。下列叙述错误的是
A.元素Y和Q可形成化合物Y2Q3
B.气态氢化物的稳定性:Q>T>Z
C.X和Q结合生成的化合物晶体类型为分子晶体
D.T和Z的最高价氧化物均为酸性氧化物
11.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末和另一种化合物。该成果发表在《科学》杂志上。同学们对此有下列一些“理解”,你认为错误的是
A.金刚石中C原子与C-C键个数比为1:2
B.另一种化合物的化学式为NaCl,晶体中Na+的配位数为8
C.该反应涉及的四种物质分别属于四种不同的晶体类型
D.CCl4的熔点低于金属钠的熔点
12.下列不能形成配位键的组合是
A.、 B.、 C.、H+ D.、
二、填空题
13.一种立方钙钛矿结构的金属卤化物光电材料的组成为、和有机碱离子,其晶胞如图(b)所示。其中与图(a)中_______的空间位置相同,有机碱中,N原子的杂化轨道类型是_______;若晶胞参数为anm,则晶体密度为_______(列出计算式,设为阿伏加德罗常数的值)。
14.(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3_______,
CoCl3·5NH3_______,
CoCl3·4NH3(绿色和紫色):_______。
②上述配合物中,中心离子的配位数都是_______。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供_______,SCN-提供_______,二者通过配位键结合。
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。含该离子的配合物的化学式是_______。
③若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_______。
15.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
16.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃
硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃
硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃
二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
17.(1)离子化合物MgO2可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出MgO2的电子式___。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是___。
18.无水硫酸铜为_______色固体,把它溶于水后得到_______色溶液,原因是溶液形成了[Cu(H2O)4]2+配离子,中心离子是_______,配位数为_______,配体是_______分子。向该溶液中滴入氨水,现象是_______,继续滴加氨水至过量,现象是_______,请写出所得物质内界结构式_______,中心离子与配体之间以_______键相结合。
19.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
20.回答下列问题:
(1)已知4种物质的熔点如下表:
物质 NaCl
熔点/℃ 801 712 190 -68
的熔点远高于的原因是_______。
(2)请比较氮元素与氧元素的非金属性强弱:N_______O(填“>”、“<”或“=”),用一个化学方程式说明强弱关系_______。
参考答案:
1.C
【详解】A.晶体溶于水时,电离出氢离子钠离子和硫酸根离子,离子键被破坏,部分共价键被破坏,A错误;
B.易分解是因为共价键作用力弱,B错误;
C.晶体中有离子键,氢氧根中含有极性共价键,C正确;
D.中的H原子,最外层为2电子稳定结构,D错误;
答案选C。
2.C
【详解】A.加入溶液反应也不产生沉淀,可知无游离的,以强碱处理并没有放出,可知无游离的氨分子,两者均与中心铂离子形成配位键,所以该物质的配位化学式为故配位数为6,故A错误;
B.根据题意可知该配合物为,配体有和,故B错误;
C.该配合物为,和分子均与中心铂离子形成配位键,故C正确;
D.Pt与6个配体成键,该配合物应是8面体结构,故D错误;
故答案为C。
3.C
【详解】A.NH5为离子化合物,分子中存在NH4+和H-,所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,含有离子键,N-H键属于共价键,选项A正确;
B.Na2O是离子晶体,溶于水生成NaOH的过程中,Na2O中离子键断裂,生成NaOH时有共价键的形成,选项B正确;
C.某物质固态时不导电但溶于水能导电,则该物质中不一定含有离子键,如氯化铝为共价化合物不含离子键,选项C不正确;
D.石英是由硅原子和氧原子构成的原子晶体,每个硅原子形成4个共价键,每个氧原子形成两个共价键,每个原子的最外层都具有8电子稳定结构,选项D正确;
答案选C。
4.B
【详解】A.在含4 mol Si-O键的二氧化硅晶体中,含Si原子是1mol,由于O原子与2个Si原子形成Si-O共价键,所以在含4 mol Si-O键的二氧化硅晶体中,含氧原子的数目为2NA,A错误;
B.在金刚石晶体中,碳原子与相邻的4个C原子形成4个C-C键,每个C-C键为形成共价键的2个C所共有,所以C原子数与C-C键数之比为1∶2,B正确;
C.二氧化硅晶体属于原子晶体,无二氧化硅分子,C错误;
D.晶体硅是由相应原子直接构成的原子晶体,而晶体氖则属于分子晶体,构成微粒是分子,1个Ne原子就是1个分子,D错误;
故合理选项是B。
5.B
【详解】A.中铁离子的配位数为6,A错误;
B.1个CN一含1个σ键,1个CN一与Fe3+形成1个配位键,配位键也是σ键,所以含键,B正确;
C.碳和氮位于同一周期,氮在右侧,所以碳元素电负性弱于氮元素的电负性,C错误;
D.Mn2+外围电子排布式为3d5,由Mn2+变为Mn3+,3d能级由较稳定的3d半充满状态变为不稳定的3d4状态,需要吸收的能量多,Fe2+外围电子排布式为3d6,Fe2+变为Fe3+,3d能级由较不稳定的3d6状态变为较稳定的3d5半充满状态,需要吸收的能量少。所以Mn2+再失去1个电子比Fe2+再失去一个电子困难。D错误;
故选B。
6.A
【详解】A.原子晶体中原子形成的共价键越强,晶体的熔点越高,金刚石和晶体硅都是原子晶体,碳碳键的键长小于硅硅键、键能大于硅硅键,则金刚石中的碳碳键强于晶体硅中的硅硅键,熔点高于晶体硅,能用键能解释,故A正确;
B.F的电负性大且原子半径小,则H-F键比O-H键键能更大,故分子稳定性:H2O<HF,故B错误;
C.二氧化硫和水是极性分子,二氧化碳是非极性分子,由相似相溶原理可知,二氧化硫在水中的溶解度大于二氧化碳,不能用键能解释,故C错误;
D.Cl2、Br2形成的晶体都是分子晶体,二者组成结构相似,相对分子质量越大,范德华力越大,熔沸点越高,则常温时,Cl2是气态,Br2为液态,但由于范德华力很弱,二者的沸点都比较低,不能用键能解释,故D错误;
故选A。
7.B
【详解】A.卤族元素由上到下,单质的颜色逐渐加深,故A错误;
B.卤族元素由上到下,核电荷数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减小,H-X键的键能逐渐减小,HX电离出H+越来越容易,故氢卤酸的酸性依次增强,故B正确;
C.卤族元素单质都是分子晶体,组成结构相似,相对分子质量越大,范德华力越强,熔沸点越高,所以卤族元素单质的熔点随着核电荷数的增加逐渐升高,故C错误;
D.卤族元素非金属性随核电荷数增大而减弱,其单质的氧化性随核电荷数增大逐渐减弱,故D错误;
答案选B。
8.C
【详解】A.形成金属键的金属阳离子的半径越小,所带电荷数越多,金属键越强,则金属键由强到弱:,A正确;
B.四种化合物形成的晶体均是分子晶体,相对分子质量越大,分子间作用力越强,熔点越高,则熔点由高到低:,B正确;
C.共价晶体中形成共价键的原子半径越小,共价键越强,硬度越大,则硬度由大到小:金刚石>碳化硅>晶体硅,C错误;
D.离子晶体中形成离子键的离子半径越小,所带电荷数越多,晶格能越大,则晶格能由大到小:,D正确;
答案选C。
9.A
【详解】A.CaO中含有离子键,为离子化合物,含有氧离子和钙离子,A正确;
B.H2O中存在O的共价键,是共价化合物,不存在氧离子,B错误;
C.KClO3中存在钾离子和氯酸根离子,有离子键,不存在氧离子,C错误;
D.KOH中存在钾离子和氢氧根离子,有离子键,不存在氧离子,D错误;
故选A。
10.B
【分析】由X原子M层上有2个未成对电子且无空轨道可知,X为S元素;Y原子的特征电子构型为3d64s2,则Y为Fe元素;Q原子的L电子层的p能级上只有一对成对电子,则Q是O元素;由Z原子的核外电子总数等于O原子的最外层电子数可知,Z为C元素;由T原子有1个3p空轨道可知,T是Si元素。
【详解】A.Fe元素和O元素能形成化合物Fe2O3,A项正确;
B.元素的非金属性越强,气态氢化物的稳定性越强,非金属性:Q>Z>T,则气态氢化物的稳定性:Q>Z>T,B项错误;
C.硫元素和氧元素结合生成的化合物可以是二氧化硫或三氧化硫,二氧化硫和三氧化硫都是共价化合物,形成的晶体为分子晶体,C项正确;
D.Si元素和C元素的最高价氧化物二氧化硅和二氧化碳均为酸性氧化物,D项正确;
答案选B。
11.B
【详解】A.每个碳原子形成四个C-C键,每个碳碳键由两个碳原子共用,C-C键数,所以金刚石晶体中碳原子个数与C-C键数之比1:2,故A正确;
B.根据原子守恒推出另一化合物是NaCl,根据氯化钠的晶胞结构知Na+和Cl-的配位数均为6,故B错误;
C.CCl4和Na反应生成NaCl和金刚石,CCl4属于分子晶体,Na属于金属晶体,NaCl属于离子晶体和金刚石属于原子晶体(或共价晶体),故C正确;
D.CCl4是分子晶体,常温下是液态,金属钠是金属晶体,常温下是固态,故D正确;
故选B。
12.C
【详解】A. 有空轨道,中的氮原子上有孤对电子,故二者可以形成配位键,A项不符合题意;
B. 中B原子有空轨道,中的氮原子上有孤对电子,故二者可以形成配位键,B项不符合题意;
C. 、两种离子均没有孤对电子,故二者不能形成配位键,C项符合题意;
D. 有空轨道,提供孤对电子,故二者可以形成配位键,D项不符合题意;
故选C。
13. Ti4+ sp3
【详解】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;中,氮原子形成4个单键,其中有1个是配位键,N原子采取杂化;根据均摊法,1个晶胞中含有的个数为,的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
14. [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl 6 空轨道 孤电子对 [Fe(SCN)]Cl2 FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
【详解】(1) ①由题意知,四种络合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。
②1mol CoCl3·6NH3只生成3mol氯化银,则有3mol氯离子为外界离子,钴的配位数为6;
1mol CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)都只生成1mol氯化银,则有1mol氯离子为外界离子,钴的配位数为6。
(2)①Fe3+与SCN-反应生成的配合物中, Fe3+提供空轨道, SCN-提供孤对电子。
②Fe3+与SCN-以个数比1 : 1配合所得离子为[Fe ( SCN)]2+ ,故FeCl3与KSCN在水溶液中反应生成[Fe ( SCN ) ]Cl2与KCl。
③国Fe3+与SCN-以个数比1 : 5配合所得高子为[Fe (SCN) 5]2-,故FeCl3与KSCN在水溶液中反应生成K2[Fe (SCN)5]2-与KCI,所以反应方程式为: FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl。
15. 分子晶体 苯胺分子之间存在氢键
【详解】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
16.(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
【解析】(1)
A组熔点很高,为原子晶体,构成微粒是原子,原子晶体是由原子通过共价键形成的,熔化时克服的是共价键;
(2)
B组为金属晶体,根据金属晶体的特征可知,B组金属晶体具有①②③④四条共性;
(3)
HF的分子之间除存在范德华力外,分子之间还含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常;
(4)
D组属于离子晶体,离子晶体的构成微粒是阴、阳离子,离子之间通过离子键结合,离子键是一种比较强的相互作用,具有一定的硬度;一般能够溶于水,在水分子作用下电离产生自由移动的离子,因而能够导电;在固体时离子之间通过离子键结合,不能自由移动,因此固态时不能导电;在熔融状态时断裂离子键,产生自由移动的离子,因此在熔融状态下也可以导电,故②④两个性质符合;
(5)
D组属于离子晶体,其熔点与离子键键能有关。离子半径越小,离子之间作用力越强,离子键的键能越大,晶格能越大,物质的熔沸点就越高。由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
17. B—N的键长比Si—Si的键长短(或B—N的键能较大)
【详解】(1) MgO2中为原子团,中O原子间是单键,故答案为:;
(2) 氮化硼和晶体硅都是原子晶体,原子晶体的硬度和耐热性由键能大小决定,故答案为:B—N的键长比Si—Si的键长短(或B—N的键能较大)。
18. 白 蓝 Cu2+ 4 H2O 有蓝色沉淀生成 沉淀溶解,溶液变成深蓝色 [Cu(NH3)4]2+ 配位键
【详解】无水硫酸铜固体为白色;把它溶于水后形成了[Cu(H2O)4]2+配离子,溶液呈蓝色;[Cu(H2O)4]2+配离子的中心离子是Cu2+,配位数为4,配体是H2O分子。向溶液中滴入氨水,有氢氧化铜沉淀生成,故现象是:有蓝色沉淀生成;继续滴加氨水至过量,氢氧化铜与氨水反应生成[Cu(NH3)4]SO4,现象是:沉淀溶解,得到深蓝色溶液;[Cu(NH3)4]SO4的内界结构式为:[Cu(NH3)4]2+,中心离子与配体之间以配位键结合。
19. Ti4+
【详解】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
20.(1)、分别为离子晶体、分子晶体,前者熔融需要克服离子键,后者克服分子间作用力,所以的熔点远高于
(2) < 或
【解析】(1)
一般熔点高低顺序是原子晶体>离子晶体>分子晶体,根据表中数据,氯化镁为离子晶体,熔融时破坏离子键,氯化铝为分子晶体,熔融是破坏分子间作用力,因此氯化镁的熔点高于氯化铝的熔点,答案为氯化镁、氯化铝分别为离子晶体、分子晶体,前者熔融需要克服离子键,后者克服分子间作用力,因此氯化镁熔点远高于氯化铝;
(2)
同周期从左向右非金属性增强(稀有气体除外),因此氧元素的非金属性强于氮元素,利用氧化剂的氧化性强于氧化产物的氧化性,可以用或进行比较;答案为<;或。
