第六章 化学反应与能量 训练题(含答案) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章 化学反应与能量 训练题(含答案) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 918.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-10 09:58:17 | ||
图片预览




文档简介
第六章 化学反应与能量 训练题2022—2023学年下学期高一化学人教(2019)必修第二册
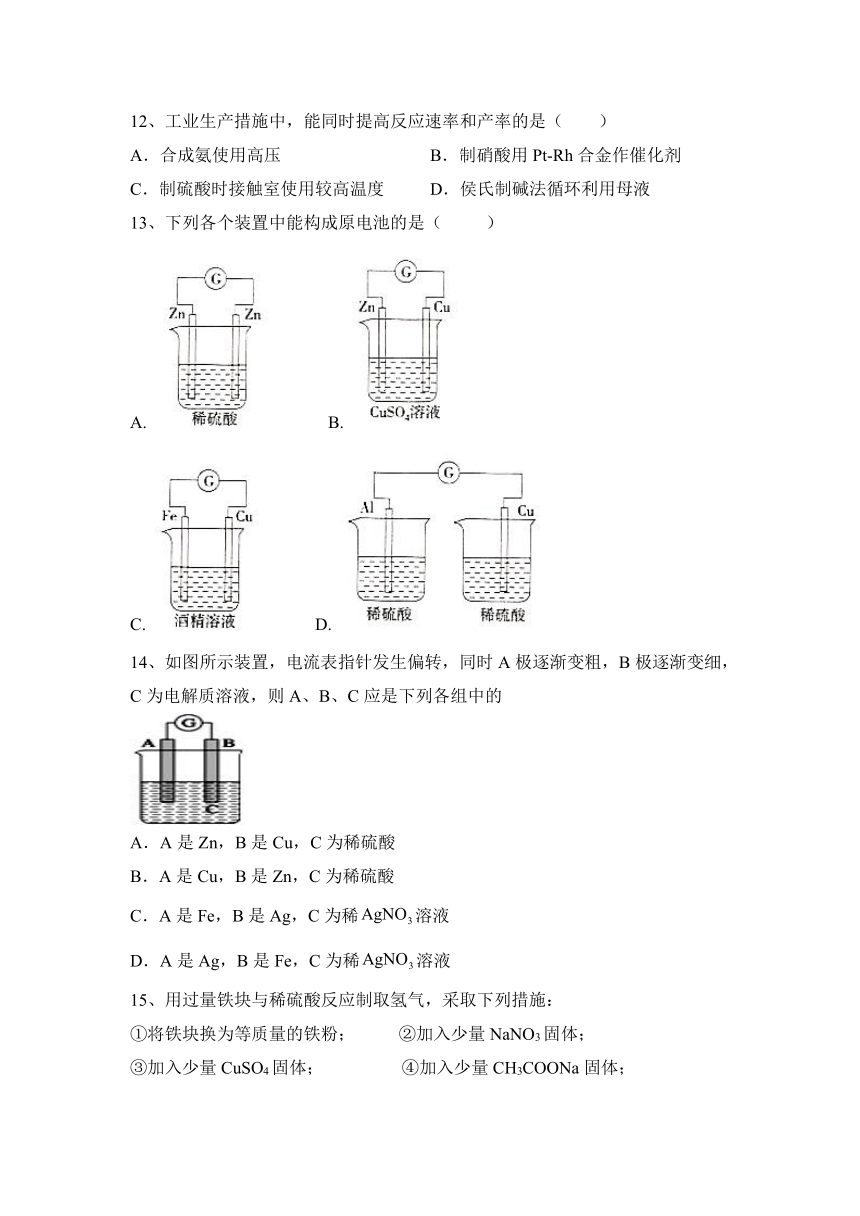
一、选择题。
1、某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
选项 正极 负极 电解质溶液
A Cu Zn HCl
B Zn Cu CuSO4
C Cu Zn CuSO4
D Cu Zn ZnCl2
2、将铁粉和硫粉混合后加热,待反应一发生立即停止加热,反应仍可持续进行,直至反应完全,生成新物质硫化亚铁。该现象说明了( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的能量高于铁粉和硫粉的总能量
3、下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成
4、下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作时,电能转化成化学能
D.氢氧燃料电池是一种具有应用前景的绿色电源
5、下列能量的转化过程中,由化学能转化为电能的是( )
A B C D
太阳能集热 燃气燃烧 风力发电 手机电池工作
A.A B.B C.C D.D
6、实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
7、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的物质的量浓度减少了0.395 mol·L-1
D.反应的化学方程式为X+Y===Z
8、在恒容密闭容器中发生反应:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),下列说法中不正确的是 ( )
A.将块状Fe2O3改为粉末,反应速率增大
B.升高温度,反应速率增大
C.增加CO,反应速率增大
D.充入N2使压强增大,反应速率增大
9、在一密闭容器中进行反应:2SO2(g)+O2(g) ===2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1
10、如图为锌、铜水果电池装置示意图,下列说法正确的是( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
11、质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是
A. B.
C. D.
12、工业生产措施中,能同时提高反应速率和产率的是( )
A.合成氨使用高压 B.制硝酸用Pt-Rh合金作催化剂
C.制硫酸时接触室使用较高温度 D.侯氏制碱法循环利用母液
13、下列各个装置中能构成原电池的是( )
A. B.
C. D.
14、如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
15、用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉; ②加入少量NaNO3固体;
③加入少量CuSO4固体; ④加入少量CH3COONa固体;
⑤加热; ⑥将稀硫酸换成98%硫酸。
其中可以加快氢气的生成速率的措施是( )
A.①③④ B.①③⑤ C.②④⑤ D.②⑤⑥
16、如图所示,两电极一为碳棒,一为铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
17、下列变化符合如图示的是( )
①冰雪融化②CaCO3分解制二氧化碳③铝与盐酸的反应④Na2O2与水反应⑤硝酸铵溶于水⑥Ba(OH)2·8H2O和NH4Cl的反应
A.②⑥ B.①②⑤⑥ C.②③ D.③④
18、在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③ B.③和⑤ C.④和⑤ D.②和④
二、非选择题。(4题)
19、某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极A 溶液B 操作及现象
Ⅰ Fe pH=2的H2SO4 连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ Cu pH=2的H2SO4 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 溶液B 操作及现象
Ⅲ 经煮沸的pH=2的 H2SO4 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ pH=2的H2SO4 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ pH=12的NaOH 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
20、某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为:__。
(2)反应开始至2min,以气体Z表示的平均反应速率为:___。
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__。
(4)2min时,X气体的体积分数为__,此时v正(X)和v逆(Y)关系比是:___。
21、某可逆反应在某体积为5 L的密闭容器中进行,在0~3分钟各物质的量的变化情况如下图所示(A,B,C均为气体)。
(1)该反应的化学方程式为_______________________________。
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是________(填字母)。
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2∶1∶2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化
22、高锰酸钾是锰的重要化合物和常用的氧化剂.请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是 (填字母代号).
a.浓硝酸 b.氯水 c.烧碱溶液
(2)KMnO4稀溶液是一种常用的消毒剂.下列物质与其消毒机理不同的是 (填字母代号).
a.84消毒液(主要成分是NaClO) b.75%酒精
c.臭氧 d.双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式: .
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体.
①若实验室要制备纯净的CO2,从下列给出的试剂中最好选择 (填字母代号).
a.石灰石 b.浓盐酸 c.稀硫酸 d.纯碱
②与上述所选试剂对应的气体发生装置是 (填字母代号).
第六章 化学反应与能量 训练题2022—2023学年下学期高一化学人教(2019)必修第二册
一、选择题。
1、某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
选项 正极 负极 电解质溶液
A Cu Zn HCl
B Zn Cu CuSO4
C Cu Zn CuSO4
D Cu Zn ZnCl2
【答案】C。
2、将铁粉和硫粉混合后加热,待反应一发生立即停止加热,反应仍可持续进行,直至反应完全,生成新物质硫化亚铁。该现象说明了( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的能量高于铁粉和硫粉的总能量
【答案】B
3、下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成
【答案】B。
4、下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作时,电能转化成化学能
D.氢氧燃料电池是一种具有应用前景的绿色电源
【答案】C
5、下列能量的转化过程中,由化学能转化为电能的是( )
A B C D
太阳能集热 燃气燃烧 风力发电 手机电池工作
A.A B.B C.C D.D
【答案】D
6、实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
【答案】B
7、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的物质的量浓度减少了0.395 mol·L-1
D.反应的化学方程式为X+Y===Z
【答案】C
8、在恒容密闭容器中发生反应:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),下列说法中不正确的是 ( )
A.将块状Fe2O3改为粉末,反应速率增大
B.升高温度,反应速率增大
C.增加CO,反应速率增大
D.充入N2使压强增大,反应速率增大
【答案】D
9、在一密闭容器中进行反应:2SO2(g)+O2(g) ===2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1
【答案】B
10、如图为锌、铜水果电池装置示意图,下列说法正确的是( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
【答案】D
11、质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是
A. B.
C. D.
【答案】A
12、工业生产措施中,能同时提高反应速率和产率的是( )
A.合成氨使用高压 B.制硝酸用Pt-Rh合金作催化剂
C.制硫酸时接触室使用较高温度 D.侯氏制碱法循环利用母液
【答案】A
13、下列各个装置中能构成原电池的是( )
A. B.
C. D.
【答案】B
14、如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
【答案】D
15、用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉; ②加入少量NaNO3固体;
③加入少量CuSO4固体; ④加入少量CH3COONa固体;
⑤加热; ⑥将稀硫酸换成98%硫酸。
其中可以加快氢气的生成速率的措施是( )
A.①③④ B.①③⑤ C.②④⑤ D.②⑤⑥
【答案】B
16、如图所示,两电极一为碳棒,一为铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
【答案】C
17、下列变化符合如图示的是( )
①冰雪融化②CaCO3分解制二氧化碳③铝与盐酸的反应④Na2O2与水反应⑤硝酸铵溶于水⑥Ba(OH)2·8H2O和NH4Cl的反应
A.②⑥ B.①②⑤⑥ C.②③ D.③④
【答案】A
18、在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③ B.③和⑤ C.④和⑤ D.②和④
【答案】B
二、非选择题。(4题)
19、某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极A 溶液B 操作及现象
Ⅰ Fe pH=2的H2SO4 连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ Cu pH=2的H2SO4 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 溶液B 操作及现象
Ⅲ 经煮沸的pH=2的 H2SO4 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ pH=2的H2SO4 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ pH=12的NaOH 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
【答案】2H+ + 2e-=H2↑ 在金属活动性顺序中,Cu在H后,Cu不能置换出H2 O2 + 4H+ + 4e-=2H2O O2浓度越大,其氧化性越强,使电压值增大 溶液的酸碱性 排除溶液中的Na+(或SO42-)对实验的可能干扰;
20、某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为:__。
(2)反应开始至2min,以气体Z表示的平均反应速率为:___。
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__。
(4)2min时,X气体的体积分数为__,此时v正(X)和v逆(Y)关系比是:___。
【答案】 7∶5 39% 1∶1
21、某可逆反应在某体积为5 L的密闭容器中进行,在0~3分钟各物质的量的变化情况如下图所示(A,B,C均为气体)。
(1)该反应的化学方程式为_______________________________。
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是________(填字母)。
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2∶1∶2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化
【答案】(1)2A+B2C (2)C
22、高锰酸钾是锰的重要化合物和常用的氧化剂.请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是 (填字母代号).
a.浓硝酸 b.氯水 c.烧碱溶液
(2)KMnO4稀溶液是一种常用的消毒剂.下列物质与其消毒机理不同的是 (填字母代号).
a.84消毒液(主要成分是NaClO) b.75%酒精
c.臭氧 d.双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式: .
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体.
①若实验室要制备纯净的CO2,从下列给出的试剂中最好选择 (填字母代号).
a.石灰石 b.浓盐酸 c.稀硫酸 d.纯碱
②与上述所选试剂对应的气体发生装置是 (填字母代号).
【答案】c;b;2H2O22H2O+O2↑;cd;c
一、选择题。
1、某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
选项 正极 负极 电解质溶液
A Cu Zn HCl
B Zn Cu CuSO4
C Cu Zn CuSO4
D Cu Zn ZnCl2
2、将铁粉和硫粉混合后加热,待反应一发生立即停止加热,反应仍可持续进行,直至反应完全,生成新物质硫化亚铁。该现象说明了( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的能量高于铁粉和硫粉的总能量
3、下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成
4、下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作时,电能转化成化学能
D.氢氧燃料电池是一种具有应用前景的绿色电源
5、下列能量的转化过程中,由化学能转化为电能的是( )
A B C D
太阳能集热 燃气燃烧 风力发电 手机电池工作
A.A B.B C.C D.D
6、实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
7、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的物质的量浓度减少了0.395 mol·L-1
D.反应的化学方程式为X+Y===Z
8、在恒容密闭容器中发生反应:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),下列说法中不正确的是 ( )
A.将块状Fe2O3改为粉末,反应速率增大
B.升高温度,反应速率增大
C.增加CO,反应速率增大
D.充入N2使压强增大,反应速率增大
9、在一密闭容器中进行反应:2SO2(g)+O2(g) ===2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1
10、如图为锌、铜水果电池装置示意图,下列说法正确的是( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
11、质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是
A. B.
C. D.
12、工业生产措施中,能同时提高反应速率和产率的是( )
A.合成氨使用高压 B.制硝酸用Pt-Rh合金作催化剂
C.制硫酸时接触室使用较高温度 D.侯氏制碱法循环利用母液
13、下列各个装置中能构成原电池的是( )
A. B.
C. D.
14、如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
15、用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉; ②加入少量NaNO3固体;
③加入少量CuSO4固体; ④加入少量CH3COONa固体;
⑤加热; ⑥将稀硫酸换成98%硫酸。
其中可以加快氢气的生成速率的措施是( )
A.①③④ B.①③⑤ C.②④⑤ D.②⑤⑥
16、如图所示,两电极一为碳棒,一为铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
17、下列变化符合如图示的是( )
①冰雪融化②CaCO3分解制二氧化碳③铝与盐酸的反应④Na2O2与水反应⑤硝酸铵溶于水⑥Ba(OH)2·8H2O和NH4Cl的反应
A.②⑥ B.①②⑤⑥ C.②③ D.③④
18、在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③ B.③和⑤ C.④和⑤ D.②和④
二、非选择题。(4题)
19、某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极A 溶液B 操作及现象
Ⅰ Fe pH=2的H2SO4 连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ Cu pH=2的H2SO4 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 溶液B 操作及现象
Ⅲ 经煮沸的pH=2的 H2SO4 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ pH=2的H2SO4 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ pH=12的NaOH 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
20、某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为:__。
(2)反应开始至2min,以气体Z表示的平均反应速率为:___。
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__。
(4)2min时,X气体的体积分数为__,此时v正(X)和v逆(Y)关系比是:___。
21、某可逆反应在某体积为5 L的密闭容器中进行,在0~3分钟各物质的量的变化情况如下图所示(A,B,C均为气体)。
(1)该反应的化学方程式为_______________________________。
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是________(填字母)。
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2∶1∶2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化
22、高锰酸钾是锰的重要化合物和常用的氧化剂.请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是 (填字母代号).
a.浓硝酸 b.氯水 c.烧碱溶液
(2)KMnO4稀溶液是一种常用的消毒剂.下列物质与其消毒机理不同的是 (填字母代号).
a.84消毒液(主要成分是NaClO) b.75%酒精
c.臭氧 d.双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式: .
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体.
①若实验室要制备纯净的CO2,从下列给出的试剂中最好选择 (填字母代号).
a.石灰石 b.浓盐酸 c.稀硫酸 d.纯碱
②与上述所选试剂对应的气体发生装置是 (填字母代号).
第六章 化学反应与能量 训练题2022—2023学年下学期高一化学人教(2019)必修第二册
一、选择题。
1、某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
选项 正极 负极 电解质溶液
A Cu Zn HCl
B Zn Cu CuSO4
C Cu Zn CuSO4
D Cu Zn ZnCl2
【答案】C。
2、将铁粉和硫粉混合后加热,待反应一发生立即停止加热,反应仍可持续进行,直至反应完全,生成新物质硫化亚铁。该现象说明了( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的能量高于铁粉和硫粉的总能量
【答案】B
3、下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成
【答案】B。
4、下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作时,电能转化成化学能
D.氢氧燃料电池是一种具有应用前景的绿色电源
【答案】C
5、下列能量的转化过程中,由化学能转化为电能的是( )
A B C D
太阳能集热 燃气燃烧 风力发电 手机电池工作
A.A B.B C.C D.D
【答案】D
6、实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
【答案】B
7、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的物质的量浓度减少了0.395 mol·L-1
D.反应的化学方程式为X+Y===Z
【答案】C
8、在恒容密闭容器中发生反应:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),下列说法中不正确的是 ( )
A.将块状Fe2O3改为粉末,反应速率增大
B.升高温度,反应速率增大
C.增加CO,反应速率增大
D.充入N2使压强增大,反应速率增大
【答案】D
9、在一密闭容器中进行反应:2SO2(g)+O2(g) ===2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1
【答案】B
10、如图为锌、铜水果电池装置示意图,下列说法正确的是( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
【答案】D
11、质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是
A. B.
C. D.
【答案】A
12、工业生产措施中,能同时提高反应速率和产率的是( )
A.合成氨使用高压 B.制硝酸用Pt-Rh合金作催化剂
C.制硫酸时接触室使用较高温度 D.侯氏制碱法循环利用母液
【答案】A
13、下列各个装置中能构成原电池的是( )
A. B.
C. D.
【答案】B
14、如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
【答案】D
15、用过量铁块与稀硫酸反应制取氢气,采取下列措施:
①将铁块换为等质量的铁粉; ②加入少量NaNO3固体;
③加入少量CuSO4固体; ④加入少量CH3COONa固体;
⑤加热; ⑥将稀硫酸换成98%硫酸。
其中可以加快氢气的生成速率的措施是( )
A.①③④ B.①③⑤ C.②④⑤ D.②⑤⑥
【答案】B
16、如图所示,两电极一为碳棒,一为铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
【答案】C
17、下列变化符合如图示的是( )
①冰雪融化②CaCO3分解制二氧化碳③铝与盐酸的反应④Na2O2与水反应⑤硝酸铵溶于水⑥Ba(OH)2·8H2O和NH4Cl的反应
A.②⑥ B.①②⑤⑥ C.②③ D.③④
【答案】A
18、在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③ B.③和⑤ C.④和⑤ D.②和④
【答案】B
二、非选择题。(4题)
19、某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极A 溶液B 操作及现象
Ⅰ Fe pH=2的H2SO4 连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ Cu pH=2的H2SO4 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 溶液B 操作及现象
Ⅲ 经煮沸的pH=2的 H2SO4 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ pH=2的H2SO4 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ pH=12的NaOH 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
【答案】2H+ + 2e-=H2↑ 在金属活动性顺序中,Cu在H后,Cu不能置换出H2 O2 + 4H+ + 4e-=2H2O O2浓度越大,其氧化性越强,使电压值增大 溶液的酸碱性 排除溶液中的Na+(或SO42-)对实验的可能干扰;
20、某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为:__。
(2)反应开始至2min,以气体Z表示的平均反应速率为:___。
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=__。
(4)2min时,X气体的体积分数为__,此时v正(X)和v逆(Y)关系比是:___。
【答案】 7∶5 39% 1∶1
21、某可逆反应在某体积为5 L的密闭容器中进行,在0~3分钟各物质的量的变化情况如下图所示(A,B,C均为气体)。
(1)该反应的化学方程式为_______________________________。
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是________(填字母)。
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2∶1∶2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化
【答案】(1)2A+B2C (2)C
22、高锰酸钾是锰的重要化合物和常用的氧化剂.请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是 (填字母代号).
a.浓硝酸 b.氯水 c.烧碱溶液
(2)KMnO4稀溶液是一种常用的消毒剂.下列物质与其消毒机理不同的是 (填字母代号).
a.84消毒液(主要成分是NaClO) b.75%酒精
c.臭氧 d.双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式: .
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体.
①若实验室要制备纯净的CO2,从下列给出的试剂中最好选择 (填字母代号).
a.石灰石 b.浓盐酸 c.稀硫酸 d.纯碱
②与上述所选试剂对应的气体发生装置是 (填字母代号).
【答案】c;b;2H2O22H2O+O2↑;cd;c
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
