第六章第一节 第三课时 化学电源 课件(共17张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章第一节 第三课时 化学电源 课件(共17张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-10 10:13:56 | ||
图片预览



文档简介
(共17张PPT)
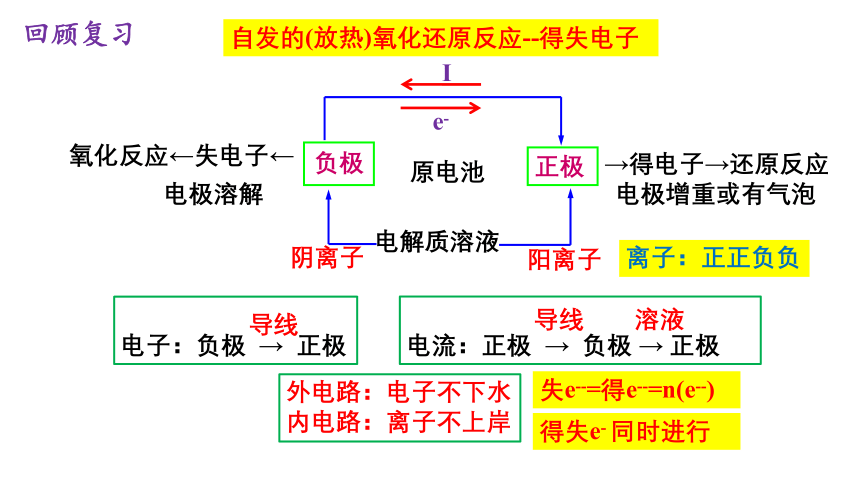
发展中的化学电源
原电池
电解质溶液
阴离子
阳离子
负极
正极
氧化反应←失电子←
电极增重或有气泡
电极溶解
I
e-
离子:正正负负
→得电子→还原反应
自发的(放热)氧化还原反应--得失电子
外电路:电子不下水
内电路:离子不上岸
失e--=得e--=n(e--)
电子:负极 → 正极
导线
电流:正极 → 负极 → 正极
导线
溶液
得失e- 同时进行
回顾复习
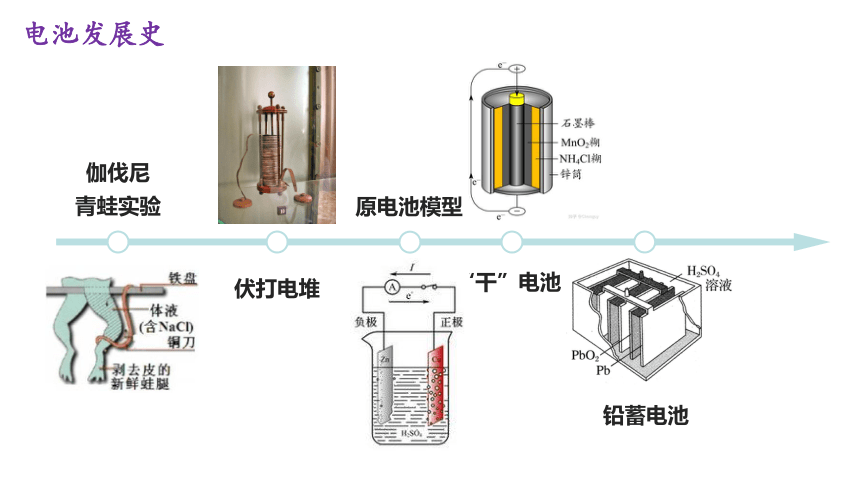
伏打电堆
原电池模型
“干”电池
伽伐尼
青蛙实验
铅蓄电池
电池发展史
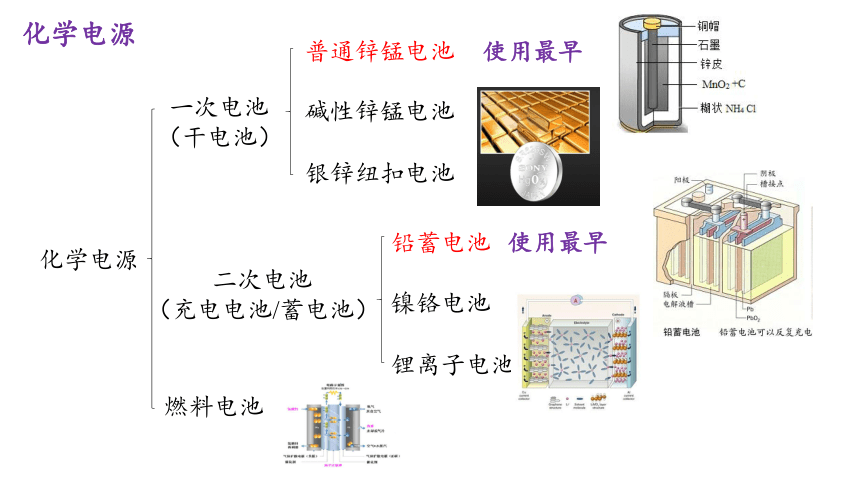
化学电源
一次电池
(干电池)
二次电池
(充电电池/蓄电池)
普通锌锰电池
碱性锌锰电池
银锌纽扣电池
铅蓄电池
镍铬电池
锂离子电池
燃料电池
使用最早
使用最早
化学电源
一、干电池(一次电池)
1、普通锌锰电池
Zn+2NH4+ ==Zn2++2NH3↑+H2↑
电解质溶液:
负极 :
Zn--2e--=Zn2+
正极 :
2NH4++2e-- =2NH3↑+H2↑
Zn+2NH4Cl ==ZnCl2+2NH3↑+H2↑
总反应:
NH4Cl溶液
消耗65gZn,标况下产生气体 L, molCl--移向 极,石墨棒质量 ,正极PH ,负极PH ,溶液PH .
67.2
2
负
不变
增大
不变
增大
正极PH看正极;负极PH看正极;溶液PH看总反应
1.总反应改成离子方程式;判断正负,负↑正↓;
2.负极(注意产物)
3.正极=总--负极
(Zn)
(C)
放电后不可充电,氧还反应不可逆
缺点:腐蚀,泄露
改进:更换电解质溶液→KOH
Zn+2MnO2+2H2O=Zn(OH)2+2 MnOOH
2.碱性锌锰电池
电解质溶液:
负极 :
Zn--2e--=Zn2+
正极 :
总反应:
KOH溶液
(Zn)
(C)
Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH
Zn--2e--+2OH---=Zn(OH)2
2MnO2+2e--+2H2O=2MnOOH+2OH---
MnO2 =MnOOH
①正极pH ,负极pH ,溶液pH ;电解质溶液密度 ,浓度 。
②转移0.2mol电子, gZn被 ; molK+移向 极, molOH--移向 极;电流由 极流向 极。
13
氧化
0.2
正
0.2
负
增大
减小
增大
增大
增大
氢氧化氧锰
消耗H2O
+e--
+H2O
+OH---
正
负
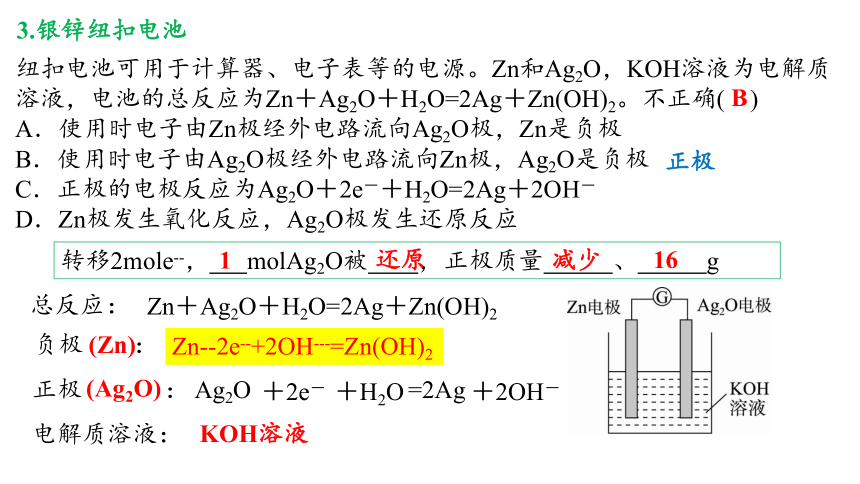
3.银锌纽扣电池
纽扣电池可用于计算器、电子表等的电源。Zn和Ag2O,KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O=2Ag+Zn(OH)2。不正确( )
A.使用时电子由Zn极经外电路流向Ag2O极,Zn是负极
B.使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极
C.正极的电极反应为Ag2O+2e-+H2O=2Ag+2OH-
D.Zn极发生氧化反应,Ag2O极发生还原反应
Zn+Ag2O+H2O=2Ag+Zn(OH)2
电解质溶液:
负极 :
正极 :
总反应:
KOH溶液
(Zn)
(Ag2O)
Zn--2e--+2OH---=Zn(OH)2
Ag2O =2Ag
正极
转移2mole--, molAg2O被 ,正极质量 、 g
1
还原
减少
16
B
+2e-
+H2O
+2OH-
二.充电电池(二次电池)
化学能 电能
放电(工作)
充电
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
电解质溶液:
负极 :
正极 :
放电总反应:
(Pb)
(PbO2)
PbO2+Pb+4H++2SO42-- = 2PbSO4+2H2O
Pb =PbSO4
--2e--
+SO42--
PbO2 =PbSO4
转移电子2mol,消耗 molH2SO4,负极质量 、 g,正极质量 、
g; molH+移向 极, molSO42--移向 极;工作时电解质的浓度 ,密度 ;放电正极pH ,负极pH ,溶液pH ;
H2SO4溶液
+4H+
+2e--
+SO42--
+2H2O
2
2e--
增大
96
增大
1molSO4
1molSO2
2
64
正
1
负
减小
减小
不变
增大
增大
1.铅蓄电池
不是可逆反应(条件不同)
+4
+2
0
2.镍镉电池
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
电解质溶液:
负极 :
正极 :
放电总反应:
(Cd)
(NiOOH)
Cd =Cd(OH)2
NiOOH ==Ni(OH)2
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
KOH溶液
放电正极pH ,负极pH ,溶液pH .
减小
增大
增大
--2e--
+2OH---
+e--
+OH---
+H2O
消耗水
3.锂电池
锂电池比热能最高、非水电解质溶液、电池<100%能量转化
锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
负极 :
正极 :
放电总反应:
(Li)
(MnO2)
Li-e-=Li+
MnO2 =LiMnO2
Li+MnO2=LiMnO2
+Li+
+e-
电流方向是由____极流向____极;电子由 极流向 极;(填字母)是否可用水代替电池中的混合有机溶剂?__,原因__________________________。
b
a
b
a
否
Li是活泼金属,能与水反应
+
---
三.燃料电池:
一种连续地将燃料与氧化剂(常为O2)的化学能直接转化为电能的化学电池。
1高效、环保
2.转化率高,但<100%
3.两电极可为同种材料
电极不参与反应,只起导电作用
4.燃料不能储存
质子交换膜
- +
O2
H2/ CH4 / CH3OH
负极 正极
O2------(正) --化合价降低--得电子----还原反应-----阳离子移向
燃料---(负) --化合价升高--失电子----氧化反应-----阴离子移向
①总反应:
燃烧方程(不写燃烧条件,没有燃烧现象)
②正极(O2):
酸性:
O2+4H++4e- = 2H2O
碱性/中性:
O2+4e--+2 H2O = 4OH--
O2--4e---
酸性 碱性
C
N
③负极(燃料):
CO2
CO32--
N2
(一)原理
负极=总反应--正极,无O2
[注意:必要时乘系数;移项,除e-外前面不可为”-”]
无OH--
无H+
正极pH ;负极pH ;
溶液pH ;消耗1molH2转移电子 。
1.H2酸性:
总反应:
2H2+O2=2H2O
正极:
O2+4H++4e-- =2H2O
负极:
H2--2e-- =2H+
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗2molO2转移电子 。
增大
减小
增大
8NA
2.H2碱性:
总反应:
2H2+O2=2H2O
正极:
负极:
H2--2e--+2OH-- =2H2O
电解质:
稀NaOH
增大
减小
减小
2NA
O2+4e--+2 H2O =4OH--
(二)书写
燃料电池pH变化 正极 负极 溶液
酸性溶液
碱性溶液
pH增大
pH减小
酸性pH增大
碱性pH减小
对应减弱
正增负减
对应减弱
正极pH ;负极pH ;
溶液pH ;3molCH4消耗 molO2
若电池能量转化率为80%,则转移电子 mol
3.CH4酸性:
总反应:
CH4+ O2=CO2+ H2O
正极:
O2+4H++4e-- = 2H2O
负极:
CH4 =CO2
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗2molCH4转移电子 。
增大
减小
增大
16NA
4.CH4碱性:
总反应:
正极:
负极:
电解质:
稀NaOH
增大
减小
减小
6
O2+4e--+2 H2O= 4OH--
2
2
--8e--
+8H+
+2H2O
C+4 H+1 O减2,N变N2不变化
CH4+ O2 + OH- =CO32--+ H2O
2
3
2
CH4 = CO32-
-8e--
+10OH--
+7H2O
19.2
CxHyOz ~ (x+y/4-z/2) O2
3
正极pH ;负极pH ;溶液pH ;1molCH3OH参与反应,消耗 molO2
5.CH3OH酸性:
总反应:
CH3OH+ O2=CO2+ H2O
正极:
O2+4H++4e-- =2H2O
负极:
CH3OH =CO2
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗1molCH3OH转移电子 。
增大
减小
增大
6NA
6.CH3OH碱性:
总反应:
正极:
负极:
电解质:
稀NaOH
O2+4e--+2 H2O = 4OH--
3/2
2
--6e--
+6H+
+H2O
C+4 H+1 O减2, N变N2不变化
CH3OH+ O2 + = CO32-- + H2O
3/2
2OH--
CH3OH =CO32--
--6e--
+8OH--
+6H2O
1.5
2CH3OH +3O2=2CO2+4H2O
2CH3OH+3O2+4OH--=2CO32--+6H2O
CxHyOz ~ (x+y/4-z/2) O2
增大
减小
减小
N2H4 =N2
7.N2H4酸性:
总反应:
正极:
O2+4H++4e-- = 2H2O
负极:
N2H4 =N2
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗0.5molN2H4转移电子 。
增大
减小
增大
2NA
8.N2H4碱性:
总反应:
正极:
负极:
电解质:
稀NaOH
O2+4e--+2 H2O = 4OH--
- 4e--
+ 4H+
C+4 H+1 O减2 N变N2不变化
- 4e--
+4OH--
+4H2O
N2H4 +O2=N2+ H2O
2
N2H4 +O2=N2+ H2O
2
正极pH ;负极pH ;
溶液pH ;1molN2H4消
耗 molO2.
增大
减小
减小
1
1.2molO2转移电子数 。
2.1molCH3OH参与反应,消耗 molO2,转移 mole--
3.1molCH4参与反应,消耗 molO2,转移 mole--
4.1molC3H8参与反应,消耗 molO2,转移 mole--
5.1molC2H5OH参与反应,消耗 molO2,转移 mole--
6.1molN2H4参与反应, molH+移向正极,消耗 molO2
7.1molCH4反应生成CO,转移 mole--
燃料电池电子计算
8NA
1.5
2
5
3
4mole--
4
1
CxHyOz ~ (x+y/4-z/2) O2
C+4 H+1 O减2 N变N2不变化
6
8
20
12
6
发展中的化学电源
原电池
电解质溶液
阴离子
阳离子
负极
正极
氧化反应←失电子←
电极增重或有气泡
电极溶解
I
e-
离子:正正负负
→得电子→还原反应
自发的(放热)氧化还原反应--得失电子
外电路:电子不下水
内电路:离子不上岸
失e--=得e--=n(e--)
电子:负极 → 正极
导线
电流:正极 → 负极 → 正极
导线
溶液
得失e- 同时进行
回顾复习
伏打电堆
原电池模型
“干”电池
伽伐尼
青蛙实验
铅蓄电池
电池发展史
化学电源
一次电池
(干电池)
二次电池
(充电电池/蓄电池)
普通锌锰电池
碱性锌锰电池
银锌纽扣电池
铅蓄电池
镍铬电池
锂离子电池
燃料电池
使用最早
使用最早
化学电源
一、干电池(一次电池)
1、普通锌锰电池
Zn+2NH4+ ==Zn2++2NH3↑+H2↑
电解质溶液:
负极 :
Zn--2e--=Zn2+
正极 :
2NH4++2e-- =2NH3↑+H2↑
Zn+2NH4Cl ==ZnCl2+2NH3↑+H2↑
总反应:
NH4Cl溶液
消耗65gZn,标况下产生气体 L, molCl--移向 极,石墨棒质量 ,正极PH ,负极PH ,溶液PH .
67.2
2
负
不变
增大
不变
增大
正极PH看正极;负极PH看正极;溶液PH看总反应
1.总反应改成离子方程式;判断正负,负↑正↓;
2.负极(注意产物)
3.正极=总--负极
(Zn)
(C)
放电后不可充电,氧还反应不可逆
缺点:腐蚀,泄露
改进:更换电解质溶液→KOH
Zn+2MnO2+2H2O=Zn(OH)2+2 MnOOH
2.碱性锌锰电池
电解质溶液:
负极 :
Zn--2e--=Zn2+
正极 :
总反应:
KOH溶液
(Zn)
(C)
Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH
Zn--2e--+2OH---=Zn(OH)2
2MnO2+2e--+2H2O=2MnOOH+2OH---
MnO2 =MnOOH
①正极pH ,负极pH ,溶液pH ;电解质溶液密度 ,浓度 。
②转移0.2mol电子, gZn被 ; molK+移向 极, molOH--移向 极;电流由 极流向 极。
13
氧化
0.2
正
0.2
负
增大
减小
增大
增大
增大
氢氧化氧锰
消耗H2O
+e--
+H2O
+OH---
正
负
3.银锌纽扣电池
纽扣电池可用于计算器、电子表等的电源。Zn和Ag2O,KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O=2Ag+Zn(OH)2。不正确( )
A.使用时电子由Zn极经外电路流向Ag2O极,Zn是负极
B.使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极
C.正极的电极反应为Ag2O+2e-+H2O=2Ag+2OH-
D.Zn极发生氧化反应,Ag2O极发生还原反应
Zn+Ag2O+H2O=2Ag+Zn(OH)2
电解质溶液:
负极 :
正极 :
总反应:
KOH溶液
(Zn)
(Ag2O)
Zn--2e--+2OH---=Zn(OH)2
Ag2O =2Ag
正极
转移2mole--, molAg2O被 ,正极质量 、 g
1
还原
减少
16
B
+2e-
+H2O
+2OH-
二.充电电池(二次电池)
化学能 电能
放电(工作)
充电
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
电解质溶液:
负极 :
正极 :
放电总反应:
(Pb)
(PbO2)
PbO2+Pb+4H++2SO42-- = 2PbSO4+2H2O
Pb =PbSO4
--2e--
+SO42--
PbO2 =PbSO4
转移电子2mol,消耗 molH2SO4,负极质量 、 g,正极质量 、
g; molH+移向 极, molSO42--移向 极;工作时电解质的浓度 ,密度 ;放电正极pH ,负极pH ,溶液pH ;
H2SO4溶液
+4H+
+2e--
+SO42--
+2H2O
2
2e--
增大
96
增大
1molSO4
1molSO2
2
64
正
1
负
减小
减小
不变
增大
增大
1.铅蓄电池
不是可逆反应(条件不同)
+4
+2
0
2.镍镉电池
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
电解质溶液:
负极 :
正极 :
放电总反应:
(Cd)
(NiOOH)
Cd =Cd(OH)2
NiOOH ==Ni(OH)2
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
KOH溶液
放电正极pH ,负极pH ,溶液pH .
减小
增大
增大
--2e--
+2OH---
+e--
+OH---
+H2O
消耗水
3.锂电池
锂电池比热能最高、非水电解质溶液、电池<100%能量转化
锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
负极 :
正极 :
放电总反应:
(Li)
(MnO2)
Li-e-=Li+
MnO2 =LiMnO2
Li+MnO2=LiMnO2
+Li+
+e-
电流方向是由____极流向____极;电子由 极流向 极;(填字母)是否可用水代替电池中的混合有机溶剂?__,原因__________________________。
b
a
b
a
否
Li是活泼金属,能与水反应
+
---
三.燃料电池:
一种连续地将燃料与氧化剂(常为O2)的化学能直接转化为电能的化学电池。
1高效、环保
2.转化率高,但<100%
3.两电极可为同种材料
电极不参与反应,只起导电作用
4.燃料不能储存
质子交换膜
- +
O2
H2/ CH4 / CH3OH
负极 正极
O2------(正) --化合价降低--得电子----还原反应-----阳离子移向
燃料---(负) --化合价升高--失电子----氧化反应-----阴离子移向
①总反应:
燃烧方程(不写燃烧条件,没有燃烧现象)
②正极(O2):
酸性:
O2+4H++4e- = 2H2O
碱性/中性:
O2+4e--+2 H2O = 4OH--
O2--4e---
酸性 碱性
C
N
③负极(燃料):
CO2
CO32--
N2
(一)原理
负极=总反应--正极,无O2
[注意:必要时乘系数;移项,除e-外前面不可为”-”]
无OH--
无H+
正极pH ;负极pH ;
溶液pH ;消耗1molH2转移电子 。
1.H2酸性:
总反应:
2H2+O2=2H2O
正极:
O2+4H++4e-- =2H2O
负极:
H2--2e-- =2H+
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗2molO2转移电子 。
增大
减小
增大
8NA
2.H2碱性:
总反应:
2H2+O2=2H2O
正极:
负极:
H2--2e--+2OH-- =2H2O
电解质:
稀NaOH
增大
减小
减小
2NA
O2+4e--+2 H2O =4OH--
(二)书写
燃料电池pH变化 正极 负极 溶液
酸性溶液
碱性溶液
pH增大
pH减小
酸性pH增大
碱性pH减小
对应减弱
正增负减
对应减弱
正极pH ;负极pH ;
溶液pH ;3molCH4消耗 molO2
若电池能量转化率为80%,则转移电子 mol
3.CH4酸性:
总反应:
CH4+ O2=CO2+ H2O
正极:
O2+4H++4e-- = 2H2O
负极:
CH4 =CO2
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗2molCH4转移电子 。
增大
减小
增大
16NA
4.CH4碱性:
总反应:
正极:
负极:
电解质:
稀NaOH
增大
减小
减小
6
O2+4e--+2 H2O= 4OH--
2
2
--8e--
+8H+
+2H2O
C+4 H+1 O减2,N变N2不变化
CH4+ O2 + OH- =CO32--+ H2O
2
3
2
CH4 = CO32-
-8e--
+10OH--
+7H2O
19.2
CxHyOz ~ (x+y/4-z/2) O2
3
正极pH ;负极pH ;溶液pH ;1molCH3OH参与反应,消耗 molO2
5.CH3OH酸性:
总反应:
CH3OH+ O2=CO2+ H2O
正极:
O2+4H++4e-- =2H2O
负极:
CH3OH =CO2
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗1molCH3OH转移电子 。
增大
减小
增大
6NA
6.CH3OH碱性:
总反应:
正极:
负极:
电解质:
稀NaOH
O2+4e--+2 H2O = 4OH--
3/2
2
--6e--
+6H+
+H2O
C+4 H+1 O减2, N变N2不变化
CH3OH+ O2 + = CO32-- + H2O
3/2
2OH--
CH3OH =CO32--
--6e--
+8OH--
+6H2O
1.5
2CH3OH +3O2=2CO2+4H2O
2CH3OH+3O2+4OH--=2CO32--+6H2O
CxHyOz ~ (x+y/4-z/2) O2
增大
减小
减小
N2H4 =N2
7.N2H4酸性:
总反应:
正极:
O2+4H++4e-- = 2H2O
负极:
N2H4 =N2
电解质:
稀HCl
正极pH ;负极pH ;
溶液pH ;消耗0.5molN2H4转移电子 。
增大
减小
增大
2NA
8.N2H4碱性:
总反应:
正极:
负极:
电解质:
稀NaOH
O2+4e--+2 H2O = 4OH--
- 4e--
+ 4H+
C+4 H+1 O减2 N变N2不变化
- 4e--
+4OH--
+4H2O
N2H4 +O2=N2+ H2O
2
N2H4 +O2=N2+ H2O
2
正极pH ;负极pH ;
溶液pH ;1molN2H4消
耗 molO2.
增大
减小
减小
1
1.2molO2转移电子数 。
2.1molCH3OH参与反应,消耗 molO2,转移 mole--
3.1molCH4参与反应,消耗 molO2,转移 mole--
4.1molC3H8参与反应,消耗 molO2,转移 mole--
5.1molC2H5OH参与反应,消耗 molO2,转移 mole--
6.1molN2H4参与反应, molH+移向正极,消耗 molO2
7.1molCH4反应生成CO,转移 mole--
燃料电池电子计算
8NA
1.5
2
5
3
4mole--
4
1
CxHyOz ~ (x+y/4-z/2) O2
C+4 H+1 O减2 N变N2不变化
6
8
20
12
6
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
