人教版九年级化学下册第九单元课题2《溶解度》课件(共56张PPT)
文档属性
| 名称 | 人教版九年级化学下册第九单元课题2《溶解度》课件(共56张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-10 09:04:49 | ||
图片预览






文档简介
(共56张PPT)
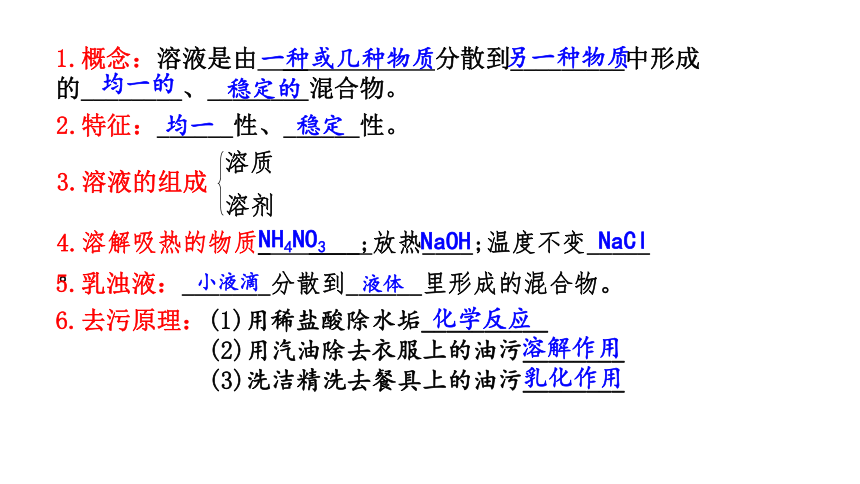
1.概念:溶液是由 __ 分散到_________中形成的________、________混合物。
2.特征:______性、______性。
3.溶液的组成
溶质
溶剂
4.溶解吸热的物质_ ____;放热____;温度不变_____。
5.乳浊液:_______分散到______里形成的混合物。
6.去污原理:(1)用稀盐酸除水垢__________
(2)用汽油除去衣服上的油污________
(3)洗洁精洗去餐具上的油污________
一种或几种物质
另一种物质
均一的
稳定的
均一
稳定
NH4NO3
NaOH
NaCl
化学反应
溶解作用
乳化作用
液体
小液滴
1、下列物质与水混合,充分振荡可得到溶液的是( )
A.泥沙 B.奶粉 C.蔗糖 D.植物油
2、配制下列溶液时,所用的溶质是液体的是( )
A.0.9%的生理盐水 B.75%的消毒酒精
C.医用葡萄糖溶液 D.蔗糖溶液
3、下列溶液中溶质的判断,正确的是( )
A.澄清石灰水:CaO B.碘酒:C2H5OH
C.氯化铁溶液:FeCl3 D.硫酸铜溶液:铜
4、下列洗涤或除污过程利用乳化原理的是( )
A.用汽油除去衣服上的油污
B.用酒精除去衣服上的碘
C.洗洁精洗去餐具上的油污
D.用稀盐酸清洗石灰水试剂瓶内壁的白色固体(CaCO3)
练习
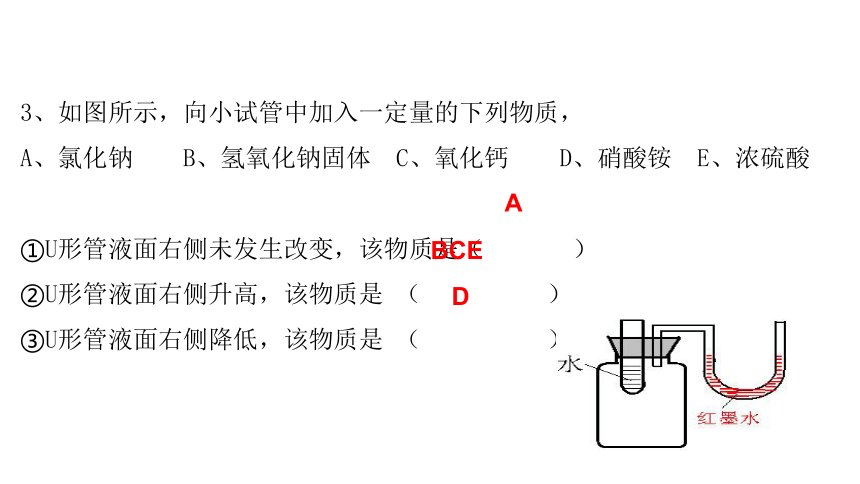
3、如图所示,向小试管中加入一定量的下列物质,
A、氯化钠 B、氢氧化钠固体 C、氧化钙 D、硝酸铵 E、浓硫酸
①U形管液面右侧未发生改变,该物质是( )
②U形管液面右侧升高,该物质是 ( )
③U形管液面右侧降低,该物质是 ( )
A
BCE
D
课题2 溶解度
饱和溶液与不饱和溶液
一、饱和溶液、不饱和溶液(P34)
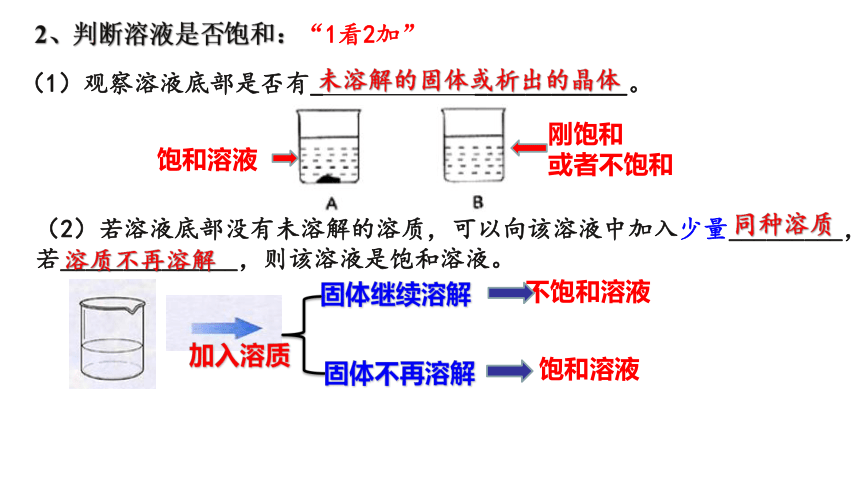
2、判断溶液是否饱和:“1看2加”
(1)观察溶液底部是否有_ ____________。
(2)若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
未溶解的固体或析出的晶体
同种溶质
溶质不再溶解
加入溶质
固体继续溶解
固体不再溶解
不饱和溶液
饱和溶液
饱和溶液
刚饱和
或者不饱和
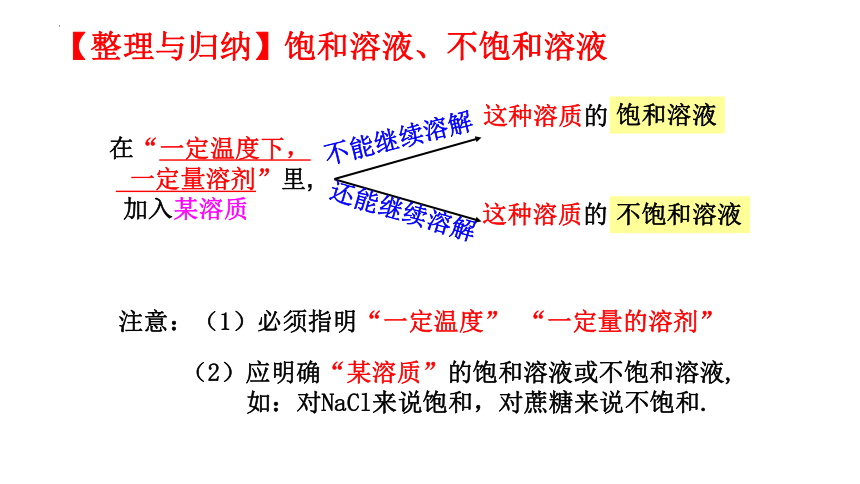
【整理与归纳】饱和溶液、不饱和溶液
不能继续溶解
饱和溶液
还能继续溶解
不饱和溶液
注意:(1)必须指明“一定温度” “一定量的溶剂”
(2)应明确“某溶质”的饱和溶液或不饱和溶液,
如:对NaCl来说饱和,对蔗糖来说不饱和.
这种溶质的
这种溶质的
在“一定温度下,
一定量溶剂”里,
加入某溶质
固体全部溶解
用玻璃棒蘸少量溶液,在酒精灯上加热
固体全部溶解
有固体剩余
不饱和溶液
饱和溶液
不饱和溶液
饱和溶液
有固体析出
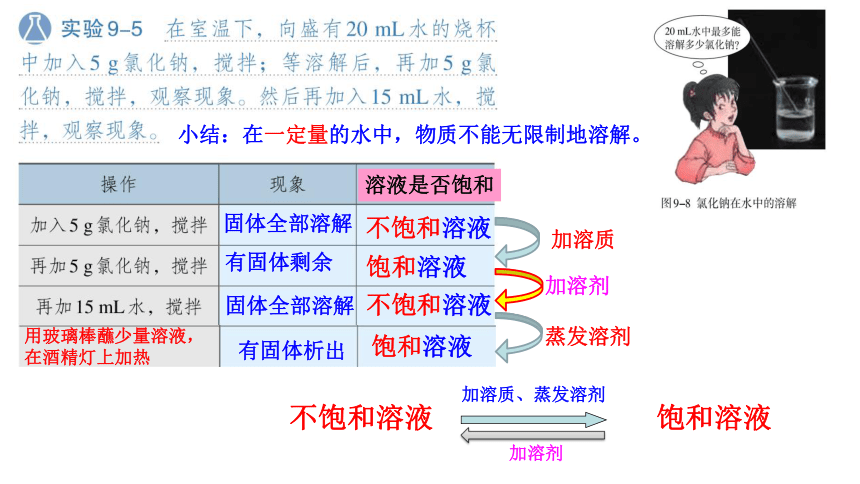
小结:在一定量的水中,物质不能无限制地溶解。
不饱和溶液 饱和溶液
加溶质、蒸发溶剂
加溶剂
溶液是否饱和
加溶质
加溶剂
蒸发溶剂
固体全部溶解
有固体剩余
有固体析出来
剩余固体全部溶解
固体全部溶解
不饱和溶液
饱和溶液
不饱和溶液
不饱和溶液
饱和溶液
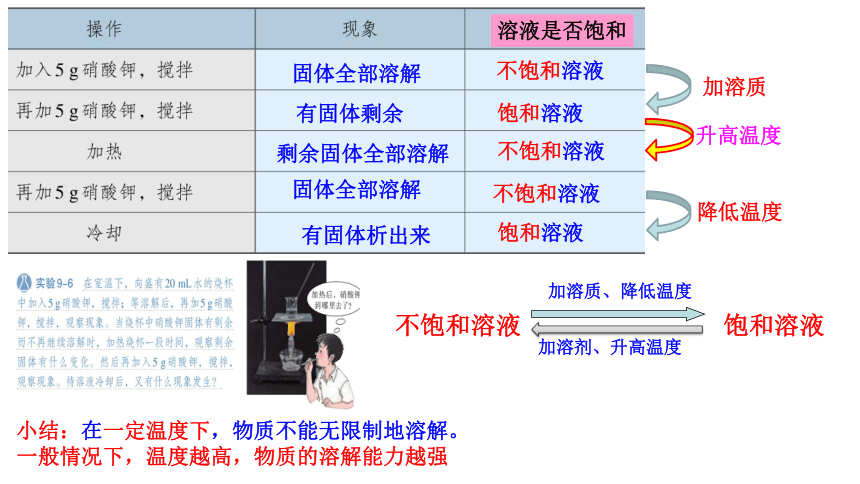
小结:在一定温度下,物质不能无限制地溶解。
一般情况下,温度越高,物质的溶解能力越强
不饱和溶液 饱和溶液
加溶质、降低温度
加溶剂、升高温度
溶液是否饱和
加溶质
升高温度
降低温度
1.饱和溶液与不饱和溶液
(1)饱和溶液:
(2)不饱和溶液:
(“一定温度”、“一定量溶剂”、“某溶质”)
2.饱和溶液的判断:“1看2加”
复习
练1:A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)_____________中盛的一定是饱和溶液;
(2)_____________中盛的可能是饱和溶液;
(3)_____________中盛的一定是不饱和溶液;
A B C D
2、已知在20℃时,50g水中溶解18gNaCl恰好成为饱和溶液。
①在20 ℃,若在50g水中加入15gNaCl得到的溶液是 溶液(填“饱和”或“不饱和”,下同);
②再加3gNaCl,得到的是 溶液;
③继续再加3gNaCl,得到的是 溶液,溶质的质量是 g,溶剂的质量是 g ,溶液的质量是 g。
不饱和
饱和
饱和
18
50
68
3、在一定温度下,向饱和的NaCl溶液中(用“不变”“增加”或“减少”填空)
(1)加入少量NaCl后,溶液的质量 。
(2)若向其中加入少量水,则溶质的质量 ,溶液的质量 。
(3)若温度不变,蒸发掉少量水,则溶质的质量 ,溶液的质量 。
不变
不变
增加
减少
减少
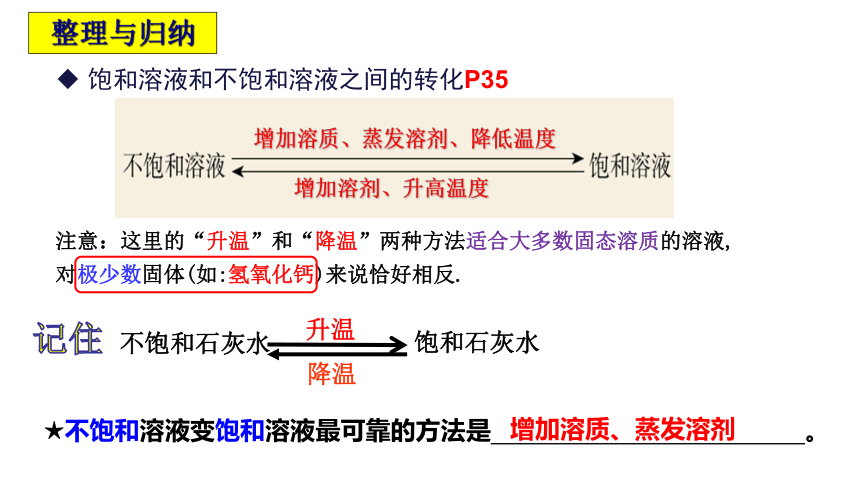
饱和溶液和不饱和溶液之间的转化P35
整理与归纳
增加溶剂、升高温度
增加溶质、蒸发溶剂、降低温度
注意:这里的“升温”和“降温”两种方法适合大多数固态溶质的溶液,对极少数固体(如:氢氧化钙)来说恰好相反.
记住
不饱和石灰水
饱和石灰水
降温
升温
★不饱和溶液变饱和溶液最可靠的方法是 。
增加溶质、蒸发溶剂
1、要使固体物质的不饱和溶液变为饱和溶液,最简单最可靠的方法是( )
A.增大压强 B.升高温度 C.降低温度 D.增加溶质
2、200C时,将接近的饱和硝酸钾溶液变为饱和溶液,可采取的方法是( )
A.升温 B.加入硝酸钾
C.加入水 D.加入硝酸钾饱和溶液
D
B
3、不饱和溶液与饱和溶液的转化关系及结晶的方法:P35
整理与归纳
蒸发结晶
冷却结晶/降温结晶
又叫冷却饱和溶液
蒸发结晶
冷却热饱和溶液
降温结晶
(1)结晶定义:溶液中的溶质以 的形式析出的过程,叫做结晶。
晶体
(2)结晶的方法
注意:析出晶体后的溶液叫做母液,母液是____溶液。
饱和
3.结晶的方法
①蒸发结晶
适用于溶解能力受温度影响较小的物质,如氯化钠。
硫酸铜晶体
二.结晶
②冷却热饱和溶液结晶
冷却结晶(降温结晶)
适用于溶解能力随温度的下降明显下降的物质,如硝酸钾、硫酸铜等。
蒸发结晶
(1)定义:溶液中的溶质以 的形式析出的过程叫做结晶。(抄在P34后面)
晶体
4、结晶
夏天晒盐NaCl
海水晒盐的原理,属于 结晶
海水
贮水池
粗盐
母液
氯化钠
多种化
工产品
蒸发
人们利用以上原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
蒸发池
结晶池
固、液分离用 操作方法
粗盐属于 物
母液是氯化钠的 溶液
经风吹日晒使水分蒸发
达到饱和才会结晶
饱和
混合
过滤
常识了解:浓溶液与稀溶液
在同量的溶液中,含溶质较多的溶液——浓溶液;
含溶质较少的溶液——稀溶液
不同的溶质:饱和溶液不一定是浓溶液,
不饱和溶液不一定是稀溶液。
相同温度,相同溶质:饱和溶液一定比不饱和溶液浓。
1.饱和溶液与不饱和溶液
(1)饱和溶液:
(2)不饱和溶液:
4.结晶:
3.转化:
不饱和
增加溶剂、升高温度
饱和溶液
增加溶质、降低温度、蒸发溶剂
饱和溶液
降温结晶(冷却结晶)
蒸发结晶
结晶
(“一定温度”、“一定量溶剂”、“某溶质”。)
2.饱和溶液的判断:“1看2加”
课堂小结
1.一定温度下,向100g硝酸钾的饱和溶液中加入10g硝酸钾,则溶液的质量是( )
A.100g B.110g C.90g D.无法确定
2.某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是( )
A.溶质质量减少 B.溶液质量增大
C.固体质量不变 D.溶质质量增加
3.在一定温度下,某物质的饱和溶液一定是( )
A.很浓的溶液 B.很稀的溶液
C.不能继续溶解该物质的溶液 D.不能溶解任何物质的溶液
巩固练习
课题2 溶解度
固体溶解度
如何比较物质的
溶解性大小呢?
指一种物质在另一种物质里的溶解能力(溶解程度)。
了解: 溶解性
应在相同的温度下
不行
下列能否说明KNO3比NaCl的溶解能力好呢?
应在相同的溶剂量中
不行
应达到饱和状态
不行
①相同的温度
②相同的溶剂量
③相同的状态(达到饱和)
【归纳】比较不同物质的溶解能力,应该控制的条件有:
一定温度下,在一定量的溶剂里溶质的溶解的质量是有一定限度的,这个限度是形成饱和溶液时能溶解的质量。
化学上用溶解度来表示这种溶解的限度。
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
四要素
条件:一定温度
标准:100克溶剂(未说明的情况下通常指水)
状态:饱和状态(最大值)
单位:质量(克)
固体物质的溶解度
二
1.固体物质溶解度(通常用S表示)
注意:描述物质的溶解度时一定要包含上面四要素,否则将无意义。
P36
(1)判断下列说法是否正确,并指明错误原因。
①把20克某物质溶解在100克水里恰好制成饱和溶液,这种物质的溶解度就是20克。
②20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。
③20℃时10克氯化钠可溶解在100克水里,故20℃时氯化钠的溶解度是10克。
④20℃时36克食盐溶解在100克水中恰好饱和,故20℃时食盐的溶解度是36。
一定温度
标准:100g溶剂
状态:饱和
单位:g
×
×
×
×
课堂练习(一)
20℃时,氯化钠的溶解度为36g ,从这句话我们可以知道以下信息:
温度 溶质的质量 溶剂的质量 溶液的质量 溶液的状态
20℃
36g
100g
136g
3、固体溶解度的含义
【理解】20℃时,氯化钠的溶解度是36g,这句话含义是什么?
或: 20℃时,100g水中最多能溶解氯化钠的质量为36g;
在20℃时,100g水中溶了36g的氯化钠就达到饱和状态。
注意:100g是溶剂水,而不是指溶液
影响溶解度的因素:外因温度、内因溶质溶剂的性质
饱和溶液
练习1:20℃时,KCl的溶解度是34g 。
①20℃时,40g KCl放在100g水中,充分溶解后,所得溶液的质量为 g
②20℃时,20g KCl放在50g水中,充分溶解后,所得溶液的质量为 g
134
67
练习2: 25℃时,50g水中最多溶解5g X物质,25℃时,100g水中最多溶解10gY物质,则X和Y的溶解度相比 。
X=Y
4、溶解度与溶解性的关系
【了解】理解了溶解度的概念,那你了解平时所说的“易溶”“难溶”与溶解度的关系吗?
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 溶物质。
难
3、20℃时氯化钠的溶解度是36g,则氯化钠是 溶物质
易
1. 20℃时,氯化钠溶解度是36g, 20℃时,
①在50g水中,加入10g氯化钠固体,充分搅动,得氯化钠溶液 的质量为 g。
②在50g水中,加入40g氯化钠固体,充分搅动,得氯化钠溶液 的质量为 g。
2.硝酸铵在 10 ℃时的溶解度为 140 g,这说明:
① 在 10℃时,将 140 g硝酸铵溶解在 g水中,就可以得到 g硝酸铵 溶液(填“饱和”或 “不饱和”)。
②在10℃时,50g水中最多溶解 g硝酸铵。
60
100
240
饱和
70
68
课堂练习
1.20℃时,KClO3的溶解度为7.4g,它表示( )
A.20℃时,100g KClO3饱和溶液中含KClO37.4g
B.20℃时,KClO3在水中溶解7.4g,溶液达到饱和状态
C.100g水最多溶解7.4g KClO3
D.20℃时,100g水溶解7.4g KClO3时,溶液达到饱和状态
2.10℃时,KNO3的溶解度为20 g,则此温度下KNO3饱和溶液中质量比关系正确是( )
A.溶液:溶质=4:1
B. 溶液:溶质=5:1
C.溶质:溶剂=1:5
D. 溶液:溶剂=5:4
D
C
巩固练习
3.在一定温度下,向饱和的NaCl溶液中(用“不变”“增加”或“减少”填空)
(1)加入少量NaCl后,溶液的质量 。
(2)若向其中加入少量水,则溶质的质量 ,溶液的质量 。
(3)若温度不变,蒸发掉少量水,则溶质的质量 ,溶液的质量 。
不变
不变
增加
减少
减少
课题2 溶解度
溶解度曲线
以温度为横坐标,以溶解度为纵坐标,形象地表示出物质的溶解度随温度变化情况的曲线。
.
.
.
.
.
硝酸钾
.
.
.
.
(以硝酸钾为例)
一、溶解度的表示方法:
(1)列表法:
(2)溶解度曲线
讨论:
固体物质溶解度受温度变化影响情况:
①大多数固体物质溶解度随温度升高而增大,例如 硝酸钾等。 (曲线陡)
②少数固体物质溶解度受温度影响不大,例如食盐。 (曲线平缓);
③极少数固体物质溶解度随温度升高反而减小,例如熟石灰。 (曲线向下)。
二、 不同的物质溶解度受温度的影响是不同的 P38
曲线越陡,溶解度受温度影响越大
三、根据溶解度曲线,判断从溶液中得到结晶或提纯物质的方法:
(1)多数固体物质的溶解度随温度升高而增大,
如 ;结晶方法选择 。
(2)少数固体物质的溶解度受温度变化的影响很小,
如 ;结晶方法选择 。
(3)极少数固体物质的溶解度随温度升高而减小,
如 。结晶方法选择 。
硝酸钾
降温结晶或冷却结晶
氯化钠
蒸发结晶
氢氧化钙
升温结晶
蒸发结晶
冷却结晶/降温结晶
又叫冷却饱和溶液
四、溶解度曲线:点的意义
四、溶解度曲线:点的意义
分别判断A.B. C.D点分别属于什么溶液?
A点 B点 D点
溶液是否饱和
不饱和溶液
饱和溶液
饱和溶液
降温到10℃,会有什么实验现象?
(4)判断溶液的状态(是否饱和)
练:在80℃时,将110g硝酸钾加入到100g水中,充分溶解后,形成的溶液为该温度下硝酸钾的________溶液。若降温到20℃,析出晶体的质量为 g。
不饱和
110-30=80
饱和溶液与不饱和溶液的判断
(1)t1℃时将35 g甲加入到100 g水中,充分溶解后得到的溶液是________(填“饱和”或“不饱和”,下同)溶液。
(2)t2℃时将20 g乙加入到50 g水中,充分溶解后得到的溶液是________溶液。
(3)将t2℃时丙的饱和溶液升温至t3℃,得到的是________溶液。
饱和
不饱和
饱和
【归纳与整理】溶解度曲线的规律与结晶方法
①甲、A物质的溶解度随温度升高而增大
②乙、B物质的溶解度受温度影响不大
③丙、C物质的溶解度随温度升高而减小
降温结晶(冷却结晶)
恒温蒸发结晶
升温结晶
曲线下方的点:不饱和溶液
曲线上方的点:饱和溶液,且有物质剩余
曲线上任一点都是饱和溶液
判断溶液的状态(是否饱和)
【归纳与整理】
【归纳与整理】溶解度曲线的点
(1)曲线上任意一点的含义表示:
如:点A: 。
点B: 。
点C: 。
(2)交点的含义表示:
如:点D: 。
点E: 。
(3)比较物质的溶解度大小
①在5℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为: 。
②在50℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为: 。
在30℃时,甲的溶解度为30g
在50℃时,乙的溶解度为40g
在30℃时,丙的溶解度为10g
在12℃时,甲、丙物质的溶解度相等
在40℃时,甲、乙物质的溶解度相等
乙﹥丙﹥甲
甲﹥乙﹥丙
1.下列是A、B、C三种物质溶解度曲线,请回答:
(1)如图,A点表示 。
(2)B点表示 ;
(3)80℃时,a的溶解度___ b的溶解度(填“>”“<”或“=”)
(4)C点对于a物质是_________溶液,
对于b物质是_________溶液。
在80℃时,a的溶解度为85g
在60 ℃时,a,b两物质的溶解度相等为52g
>
不饱和
饱和
A
.C
B
课堂练习
2.下图是两种固体物质的溶解度曲线
(1)t2℃时,A物质溶解度是 ;
(2)在 ℃时,A、B两种物质溶解度相等;
(3)t2℃时,A溶解度 B溶解度;
(填“大于”、“等于” 、“小于”)
(4)将t1℃升温至t2℃时,析出晶体的是 ;
(5)将接近饱和的A溶液变成饱和溶液的方法有 。
50克
t1
大于
B
加溶质/蒸发溶剂/降低温度
3:下列是A、B、C三种物质溶解度曲线,请回答:
(1)50℃时,乙物质的140g饱和溶液降温到10℃析出 g乙。
(2)将50 ℃时,等质量的甲、乙、丙饱和溶液降温至20℃时,析出晶体最多的 物质,无晶体析出的 物质。
(3)除去甲中混有少量乙的方法是 。
(填“蒸发结晶”或“降温结晶”)
9
甲
丙
降温结晶
课本40页练习
生活中气体溶解在水中的例子
水中溶有氧气鱼能在水中生存
可乐中溶有二氧化碳
【讨论】P38
1.打开汽水盖时,汽水会自动喷出来,
这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,常常会打嗝。
这说明气体的溶解度还与什么有关?
温度:
温度升高,气体的溶解度减小。
压强:
压强减小,气体的溶解度减小。
(二)气体的溶解度
1、定义:某气体的______为101kPa和________时,在________里达到_________时所溶解的________。
一定温度
饱和状态
1体积水
气体体积
压强
阅读资料
联系生活
1.天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
温度升高,气体的溶解度减小
2.做蒸蛋时用凉白开和自来水和蛋液的成品不同。
1.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳,溶解度随温度的升高而增大的是( )
A.①② B.③④ C.①③④ D.只有①
2.生活中的下列现象,不能说明气体的溶解度随温度的升高而减小的是( )
A.烧开水时,水沸腾前有气泡冒出
B.喝下冰镇汽水后,感觉到有气体冲到鼻腔
C.打开啤酒瓶盖时,有大量的泡沫溢出
D.夏季午后池塘里的鱼常跃出水面
★4.t3℃时,相同质量的A、B、C三种物质溶于水形成饱和溶液,所需水的质量由少到多的顺序为________。
A<B<C
分别描述硫酸镁的溶解度曲线的规律
混合物
适量水
加热
KNO3热饱和溶液
降温
结晶
过滤
滤纸上:KNO3固体
滤液中:
大部分NaCl 少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
C→B:
减小
B→A:
B→C:
A→C:
A、B、C三点溶质质量分数由大到小:
A>B=C
判断下列变化中溶质质量分数的改变:
不变
增大
不变
结合溶解度曲线求溶质质量分数
1.概念:溶液是由 __ 分散到_________中形成的________、________混合物。
2.特征:______性、______性。
3.溶液的组成
溶质
溶剂
4.溶解吸热的物质_ ____;放热____;温度不变_____。
5.乳浊液:_______分散到______里形成的混合物。
6.去污原理:(1)用稀盐酸除水垢__________
(2)用汽油除去衣服上的油污________
(3)洗洁精洗去餐具上的油污________
一种或几种物质
另一种物质
均一的
稳定的
均一
稳定
NH4NO3
NaOH
NaCl
化学反应
溶解作用
乳化作用
液体
小液滴
1、下列物质与水混合,充分振荡可得到溶液的是( )
A.泥沙 B.奶粉 C.蔗糖 D.植物油
2、配制下列溶液时,所用的溶质是液体的是( )
A.0.9%的生理盐水 B.75%的消毒酒精
C.医用葡萄糖溶液 D.蔗糖溶液
3、下列溶液中溶质的判断,正确的是( )
A.澄清石灰水:CaO B.碘酒:C2H5OH
C.氯化铁溶液:FeCl3 D.硫酸铜溶液:铜
4、下列洗涤或除污过程利用乳化原理的是( )
A.用汽油除去衣服上的油污
B.用酒精除去衣服上的碘
C.洗洁精洗去餐具上的油污
D.用稀盐酸清洗石灰水试剂瓶内壁的白色固体(CaCO3)
练习
3、如图所示,向小试管中加入一定量的下列物质,
A、氯化钠 B、氢氧化钠固体 C、氧化钙 D、硝酸铵 E、浓硫酸
①U形管液面右侧未发生改变,该物质是( )
②U形管液面右侧升高,该物质是 ( )
③U形管液面右侧降低,该物质是 ( )
A
BCE
D
课题2 溶解度
饱和溶液与不饱和溶液
一、饱和溶液、不饱和溶液(P34)
2、判断溶液是否饱和:“1看2加”
(1)观察溶液底部是否有_ ____________。
(2)若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
未溶解的固体或析出的晶体
同种溶质
溶质不再溶解
加入溶质
固体继续溶解
固体不再溶解
不饱和溶液
饱和溶液
饱和溶液
刚饱和
或者不饱和
【整理与归纳】饱和溶液、不饱和溶液
不能继续溶解
饱和溶液
还能继续溶解
不饱和溶液
注意:(1)必须指明“一定温度” “一定量的溶剂”
(2)应明确“某溶质”的饱和溶液或不饱和溶液,
如:对NaCl来说饱和,对蔗糖来说不饱和.
这种溶质的
这种溶质的
在“一定温度下,
一定量溶剂”里,
加入某溶质
固体全部溶解
用玻璃棒蘸少量溶液,在酒精灯上加热
固体全部溶解
有固体剩余
不饱和溶液
饱和溶液
不饱和溶液
饱和溶液
有固体析出
小结:在一定量的水中,物质不能无限制地溶解。
不饱和溶液 饱和溶液
加溶质、蒸发溶剂
加溶剂
溶液是否饱和
加溶质
加溶剂
蒸发溶剂
固体全部溶解
有固体剩余
有固体析出来
剩余固体全部溶解
固体全部溶解
不饱和溶液
饱和溶液
不饱和溶液
不饱和溶液
饱和溶液
小结:在一定温度下,物质不能无限制地溶解。
一般情况下,温度越高,物质的溶解能力越强
不饱和溶液 饱和溶液
加溶质、降低温度
加溶剂、升高温度
溶液是否饱和
加溶质
升高温度
降低温度
1.饱和溶液与不饱和溶液
(1)饱和溶液:
(2)不饱和溶液:
(“一定温度”、“一定量溶剂”、“某溶质”)
2.饱和溶液的判断:“1看2加”
复习
练1:A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)_____________中盛的一定是饱和溶液;
(2)_____________中盛的可能是饱和溶液;
(3)_____________中盛的一定是不饱和溶液;
A B C D
2、已知在20℃时,50g水中溶解18gNaCl恰好成为饱和溶液。
①在20 ℃,若在50g水中加入15gNaCl得到的溶液是 溶液(填“饱和”或“不饱和”,下同);
②再加3gNaCl,得到的是 溶液;
③继续再加3gNaCl,得到的是 溶液,溶质的质量是 g,溶剂的质量是 g ,溶液的质量是 g。
不饱和
饱和
饱和
18
50
68
3、在一定温度下,向饱和的NaCl溶液中(用“不变”“增加”或“减少”填空)
(1)加入少量NaCl后,溶液的质量 。
(2)若向其中加入少量水,则溶质的质量 ,溶液的质量 。
(3)若温度不变,蒸发掉少量水,则溶质的质量 ,溶液的质量 。
不变
不变
增加
减少
减少
饱和溶液和不饱和溶液之间的转化P35
整理与归纳
增加溶剂、升高温度
增加溶质、蒸发溶剂、降低温度
注意:这里的“升温”和“降温”两种方法适合大多数固态溶质的溶液,对极少数固体(如:氢氧化钙)来说恰好相反.
记住
不饱和石灰水
饱和石灰水
降温
升温
★不饱和溶液变饱和溶液最可靠的方法是 。
增加溶质、蒸发溶剂
1、要使固体物质的不饱和溶液变为饱和溶液,最简单最可靠的方法是( )
A.增大压强 B.升高温度 C.降低温度 D.增加溶质
2、200C时,将接近的饱和硝酸钾溶液变为饱和溶液,可采取的方法是( )
A.升温 B.加入硝酸钾
C.加入水 D.加入硝酸钾饱和溶液
D
B
3、不饱和溶液与饱和溶液的转化关系及结晶的方法:P35
整理与归纳
蒸发结晶
冷却结晶/降温结晶
又叫冷却饱和溶液
蒸发结晶
冷却热饱和溶液
降温结晶
(1)结晶定义:溶液中的溶质以 的形式析出的过程,叫做结晶。
晶体
(2)结晶的方法
注意:析出晶体后的溶液叫做母液,母液是____溶液。
饱和
3.结晶的方法
①蒸发结晶
适用于溶解能力受温度影响较小的物质,如氯化钠。
硫酸铜晶体
二.结晶
②冷却热饱和溶液结晶
冷却结晶(降温结晶)
适用于溶解能力随温度的下降明显下降的物质,如硝酸钾、硫酸铜等。
蒸发结晶
(1)定义:溶液中的溶质以 的形式析出的过程叫做结晶。(抄在P34后面)
晶体
4、结晶
夏天晒盐NaCl
海水晒盐的原理,属于 结晶
海水
贮水池
粗盐
母液
氯化钠
多种化
工产品
蒸发
人们利用以上原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
蒸发池
结晶池
固、液分离用 操作方法
粗盐属于 物
母液是氯化钠的 溶液
经风吹日晒使水分蒸发
达到饱和才会结晶
饱和
混合
过滤
常识了解:浓溶液与稀溶液
在同量的溶液中,含溶质较多的溶液——浓溶液;
含溶质较少的溶液——稀溶液
不同的溶质:饱和溶液不一定是浓溶液,
不饱和溶液不一定是稀溶液。
相同温度,相同溶质:饱和溶液一定比不饱和溶液浓。
1.饱和溶液与不饱和溶液
(1)饱和溶液:
(2)不饱和溶液:
4.结晶:
3.转化:
不饱和
增加溶剂、升高温度
饱和溶液
增加溶质、降低温度、蒸发溶剂
饱和溶液
降温结晶(冷却结晶)
蒸发结晶
结晶
(“一定温度”、“一定量溶剂”、“某溶质”。)
2.饱和溶液的判断:“1看2加”
课堂小结
1.一定温度下,向100g硝酸钾的饱和溶液中加入10g硝酸钾,则溶液的质量是( )
A.100g B.110g C.90g D.无法确定
2.某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是( )
A.溶质质量减少 B.溶液质量增大
C.固体质量不变 D.溶质质量增加
3.在一定温度下,某物质的饱和溶液一定是( )
A.很浓的溶液 B.很稀的溶液
C.不能继续溶解该物质的溶液 D.不能溶解任何物质的溶液
巩固练习
课题2 溶解度
固体溶解度
如何比较物质的
溶解性大小呢?
指一种物质在另一种物质里的溶解能力(溶解程度)。
了解: 溶解性
应在相同的温度下
不行
下列能否说明KNO3比NaCl的溶解能力好呢?
应在相同的溶剂量中
不行
应达到饱和状态
不行
①相同的温度
②相同的溶剂量
③相同的状态(达到饱和)
【归纳】比较不同物质的溶解能力,应该控制的条件有:
一定温度下,在一定量的溶剂里溶质的溶解的质量是有一定限度的,这个限度是形成饱和溶液时能溶解的质量。
化学上用溶解度来表示这种溶解的限度。
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
四要素
条件:一定温度
标准:100克溶剂(未说明的情况下通常指水)
状态:饱和状态(最大值)
单位:质量(克)
固体物质的溶解度
二
1.固体物质溶解度(通常用S表示)
注意:描述物质的溶解度时一定要包含上面四要素,否则将无意义。
P36
(1)判断下列说法是否正确,并指明错误原因。
①把20克某物质溶解在100克水里恰好制成饱和溶液,这种物质的溶解度就是20克。
②20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。
③20℃时10克氯化钠可溶解在100克水里,故20℃时氯化钠的溶解度是10克。
④20℃时36克食盐溶解在100克水中恰好饱和,故20℃时食盐的溶解度是36。
一定温度
标准:100g溶剂
状态:饱和
单位:g
×
×
×
×
课堂练习(一)
20℃时,氯化钠的溶解度为36g ,从这句话我们可以知道以下信息:
温度 溶质的质量 溶剂的质量 溶液的质量 溶液的状态
20℃
36g
100g
136g
3、固体溶解度的含义
【理解】20℃时,氯化钠的溶解度是36g,这句话含义是什么?
或: 20℃时,100g水中最多能溶解氯化钠的质量为36g;
在20℃时,100g水中溶了36g的氯化钠就达到饱和状态。
注意:100g是溶剂水,而不是指溶液
影响溶解度的因素:外因温度、内因溶质溶剂的性质
饱和溶液
练习1:20℃时,KCl的溶解度是34g 。
①20℃时,40g KCl放在100g水中,充分溶解后,所得溶液的质量为 g
②20℃时,20g KCl放在50g水中,充分溶解后,所得溶液的质量为 g
134
67
练习2: 25℃时,50g水中最多溶解5g X物质,25℃时,100g水中最多溶解10gY物质,则X和Y的溶解度相比 。
X=Y
4、溶解度与溶解性的关系
【了解】理解了溶解度的概念,那你了解平时所说的“易溶”“难溶”与溶解度的关系吗?
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 溶物质。
难
3、20℃时氯化钠的溶解度是36g,则氯化钠是 溶物质
易
1. 20℃时,氯化钠溶解度是36g, 20℃时,
①在50g水中,加入10g氯化钠固体,充分搅动,得氯化钠溶液 的质量为 g。
②在50g水中,加入40g氯化钠固体,充分搅动,得氯化钠溶液 的质量为 g。
2.硝酸铵在 10 ℃时的溶解度为 140 g,这说明:
① 在 10℃时,将 140 g硝酸铵溶解在 g水中,就可以得到 g硝酸铵 溶液(填“饱和”或 “不饱和”)。
②在10℃时,50g水中最多溶解 g硝酸铵。
60
100
240
饱和
70
68
课堂练习
1.20℃时,KClO3的溶解度为7.4g,它表示( )
A.20℃时,100g KClO3饱和溶液中含KClO37.4g
B.20℃时,KClO3在水中溶解7.4g,溶液达到饱和状态
C.100g水最多溶解7.4g KClO3
D.20℃时,100g水溶解7.4g KClO3时,溶液达到饱和状态
2.10℃时,KNO3的溶解度为20 g,则此温度下KNO3饱和溶液中质量比关系正确是( )
A.溶液:溶质=4:1
B. 溶液:溶质=5:1
C.溶质:溶剂=1:5
D. 溶液:溶剂=5:4
D
C
巩固练习
3.在一定温度下,向饱和的NaCl溶液中(用“不变”“增加”或“减少”填空)
(1)加入少量NaCl后,溶液的质量 。
(2)若向其中加入少量水,则溶质的质量 ,溶液的质量 。
(3)若温度不变,蒸发掉少量水,则溶质的质量 ,溶液的质量 。
不变
不变
增加
减少
减少
课题2 溶解度
溶解度曲线
以温度为横坐标,以溶解度为纵坐标,形象地表示出物质的溶解度随温度变化情况的曲线。
.
.
.
.
.
硝酸钾
.
.
.
.
(以硝酸钾为例)
一、溶解度的表示方法:
(1)列表法:
(2)溶解度曲线
讨论:
固体物质溶解度受温度变化影响情况:
①大多数固体物质溶解度随温度升高而增大,例如 硝酸钾等。 (曲线陡)
②少数固体物质溶解度受温度影响不大,例如食盐。 (曲线平缓);
③极少数固体物质溶解度随温度升高反而减小,例如熟石灰。 (曲线向下)。
二、 不同的物质溶解度受温度的影响是不同的 P38
曲线越陡,溶解度受温度影响越大
三、根据溶解度曲线,判断从溶液中得到结晶或提纯物质的方法:
(1)多数固体物质的溶解度随温度升高而增大,
如 ;结晶方法选择 。
(2)少数固体物质的溶解度受温度变化的影响很小,
如 ;结晶方法选择 。
(3)极少数固体物质的溶解度随温度升高而减小,
如 。结晶方法选择 。
硝酸钾
降温结晶或冷却结晶
氯化钠
蒸发结晶
氢氧化钙
升温结晶
蒸发结晶
冷却结晶/降温结晶
又叫冷却饱和溶液
四、溶解度曲线:点的意义
四、溶解度曲线:点的意义
分别判断A.B. C.D点分别属于什么溶液?
A点 B点 D点
溶液是否饱和
不饱和溶液
饱和溶液
饱和溶液
降温到10℃,会有什么实验现象?
(4)判断溶液的状态(是否饱和)
练:在80℃时,将110g硝酸钾加入到100g水中,充分溶解后,形成的溶液为该温度下硝酸钾的________溶液。若降温到20℃,析出晶体的质量为 g。
不饱和
110-30=80
饱和溶液与不饱和溶液的判断
(1)t1℃时将35 g甲加入到100 g水中,充分溶解后得到的溶液是________(填“饱和”或“不饱和”,下同)溶液。
(2)t2℃时将20 g乙加入到50 g水中,充分溶解后得到的溶液是________溶液。
(3)将t2℃时丙的饱和溶液升温至t3℃,得到的是________溶液。
饱和
不饱和
饱和
【归纳与整理】溶解度曲线的规律与结晶方法
①甲、A物质的溶解度随温度升高而增大
②乙、B物质的溶解度受温度影响不大
③丙、C物质的溶解度随温度升高而减小
降温结晶(冷却结晶)
恒温蒸发结晶
升温结晶
曲线下方的点:不饱和溶液
曲线上方的点:饱和溶液,且有物质剩余
曲线上任一点都是饱和溶液
判断溶液的状态(是否饱和)
【归纳与整理】
【归纳与整理】溶解度曲线的点
(1)曲线上任意一点的含义表示:
如:点A: 。
点B: 。
点C: 。
(2)交点的含义表示:
如:点D: 。
点E: 。
(3)比较物质的溶解度大小
①在5℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为: 。
②在50℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为: 。
在30℃时,甲的溶解度为30g
在50℃时,乙的溶解度为40g
在30℃时,丙的溶解度为10g
在12℃时,甲、丙物质的溶解度相等
在40℃时,甲、乙物质的溶解度相等
乙﹥丙﹥甲
甲﹥乙﹥丙
1.下列是A、B、C三种物质溶解度曲线,请回答:
(1)如图,A点表示 。
(2)B点表示 ;
(3)80℃时,a的溶解度___ b的溶解度(填“>”“<”或“=”)
(4)C点对于a物质是_________溶液,
对于b物质是_________溶液。
在80℃时,a的溶解度为85g
在60 ℃时,a,b两物质的溶解度相等为52g
>
不饱和
饱和
A
.C
B
课堂练习
2.下图是两种固体物质的溶解度曲线
(1)t2℃时,A物质溶解度是 ;
(2)在 ℃时,A、B两种物质溶解度相等;
(3)t2℃时,A溶解度 B溶解度;
(填“大于”、“等于” 、“小于”)
(4)将t1℃升温至t2℃时,析出晶体的是 ;
(5)将接近饱和的A溶液变成饱和溶液的方法有 。
50克
t1
大于
B
加溶质/蒸发溶剂/降低温度
3:下列是A、B、C三种物质溶解度曲线,请回答:
(1)50℃时,乙物质的140g饱和溶液降温到10℃析出 g乙。
(2)将50 ℃时,等质量的甲、乙、丙饱和溶液降温至20℃时,析出晶体最多的 物质,无晶体析出的 物质。
(3)除去甲中混有少量乙的方法是 。
(填“蒸发结晶”或“降温结晶”)
9
甲
丙
降温结晶
课本40页练习
生活中气体溶解在水中的例子
水中溶有氧气鱼能在水中生存
可乐中溶有二氧化碳
【讨论】P38
1.打开汽水盖时,汽水会自动喷出来,
这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,常常会打嗝。
这说明气体的溶解度还与什么有关?
温度:
温度升高,气体的溶解度减小。
压强:
压强减小,气体的溶解度减小。
(二)气体的溶解度
1、定义:某气体的______为101kPa和________时,在________里达到_________时所溶解的________。
一定温度
饱和状态
1体积水
气体体积
压强
阅读资料
联系生活
1.天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
温度升高,气体的溶解度减小
2.做蒸蛋时用凉白开和自来水和蛋液的成品不同。
1.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳,溶解度随温度的升高而增大的是( )
A.①② B.③④ C.①③④ D.只有①
2.生活中的下列现象,不能说明气体的溶解度随温度的升高而减小的是( )
A.烧开水时,水沸腾前有气泡冒出
B.喝下冰镇汽水后,感觉到有气体冲到鼻腔
C.打开啤酒瓶盖时,有大量的泡沫溢出
D.夏季午后池塘里的鱼常跃出水面
★4.t3℃时,相同质量的A、B、C三种物质溶于水形成饱和溶液,所需水的质量由少到多的顺序为________。
A<B<C
分别描述硫酸镁的溶解度曲线的规律
混合物
适量水
加热
KNO3热饱和溶液
降温
结晶
过滤
滤纸上:KNO3固体
滤液中:
大部分NaCl 少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
C→B:
减小
B→A:
B→C:
A→C:
A、B、C三点溶质质量分数由大到小:
A>B=C
判断下列变化中溶质质量分数的改变:
不变
增大
不变
结合溶解度曲线求溶质质量分数
同课章节目录
