浙教版科学中考复习专题训练:物质成分的实验探究【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:物质成分的实验探究【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 125.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 16:46:25 | ||
图片预览



文档简介
物质成分的实验探究
1.钙元素是一种重要的金属元素,它可组成氢化钙、氢氧化钙等多种物质。
(1)氢化钙(CaH2)固体是登山运动员常用的能源提供剂。某实验探究小组的同学通过查阅资料得知,氢化钙在常温下能与水反应生成氢氧化钙和氢气,请你写出该反应的化学方程式 。
(2)该实验探究小组将Na2CO3溶液滴加到Ca(OH)2溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
【提出问题】
滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH;
猜想二:NaOH和Ca(OH)2;
猜想三:NaOH和 ;
猜想四:NaOH、Na2CO3和Ca(OH)2。
经过讨论,大家认为猜想四不合理,原因是 。
【实验过程】
实验步骤 现象 结论
步骤Ⅰ:取滤液,向其中滴入适量Na2CO3溶液 猜想二不成立
步骤Ⅱ:另取滤液,向其中加入足量 溶液 产生气泡 猜想 成立
【拓展延伸】
在分析反应后所得物质的成分时,除考虑生成物外,还需考虑 。
2.现有一包黑色固体粉末,可能含有炭粉、CuO、Fe3O4中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(1)提出问题:该黑色固体粉末成分是什么?
(2)作出猜想:猜想一:混合固体是炭粉、CuO猜想二:混合固体是炭粉、Fe3O4
猜想三:混合固体是 猜想四:混合固体是炭粉、CuO、Fe3O4
(3)查阅资料:Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀。
(4)实验探究:取一定量的固体于试管中,加足量的盐酸,充分反应后有部分固体溶解,过滤,得到滤液A,并对滤液A的成分进行如下探究:
实验操作 实验现象 实验结论
步骤一:取一定量滤液A于试管中,加入足量的铁粉 无红色固体析出 该固体物质一定没有_________________________
步骤二:又取一定量的滤液A于试管中,加入少量的KSCN(硫氰化钾)溶液 溶液变成红色 滤液A中一定含有的物质是
步骤三:再取一定量的滤液A于试管中,加入足量的NaOH溶液 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最后面变成红褐色 滤液A中还一定含有的物质是
(5)讨论交流:
①通过以上实验,猜想 成立。
②写出Fe3O4与盐酸反应的化学方程式_______________ 。
③Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为 。
(6)拓展:请写出同种元素显不同化合价的一种盐 (写化学式)。
3.兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠、硫酸钠中的一种或两种。为此,他们对这瓶固体的成分进行了探究。
【实验验证】
实验步骤 现象 结论、分析及化学方程式
(1)取少量该样品于烧杯中,加入适量的水,溶解,得到溶液A
(2)取少量溶液A于试管中,滴入过量的稀硝酸,再滴入过量的硝酸钡溶液,充分反应后,静置 ________________________ 说明该固体中混有硫酸钠。写出证明有硫酸钠存在的化学方程式:______________________
(3)取步骤(2)中的上层清液于试管中,滴入几滴硝酸银溶液 有白色沉淀生成 说明该固体中________。实验结束所得溶液中一定含有的阳离子是________
【实验反思】步骤(2)中滴入过量稀硝酸的目的是______________________。
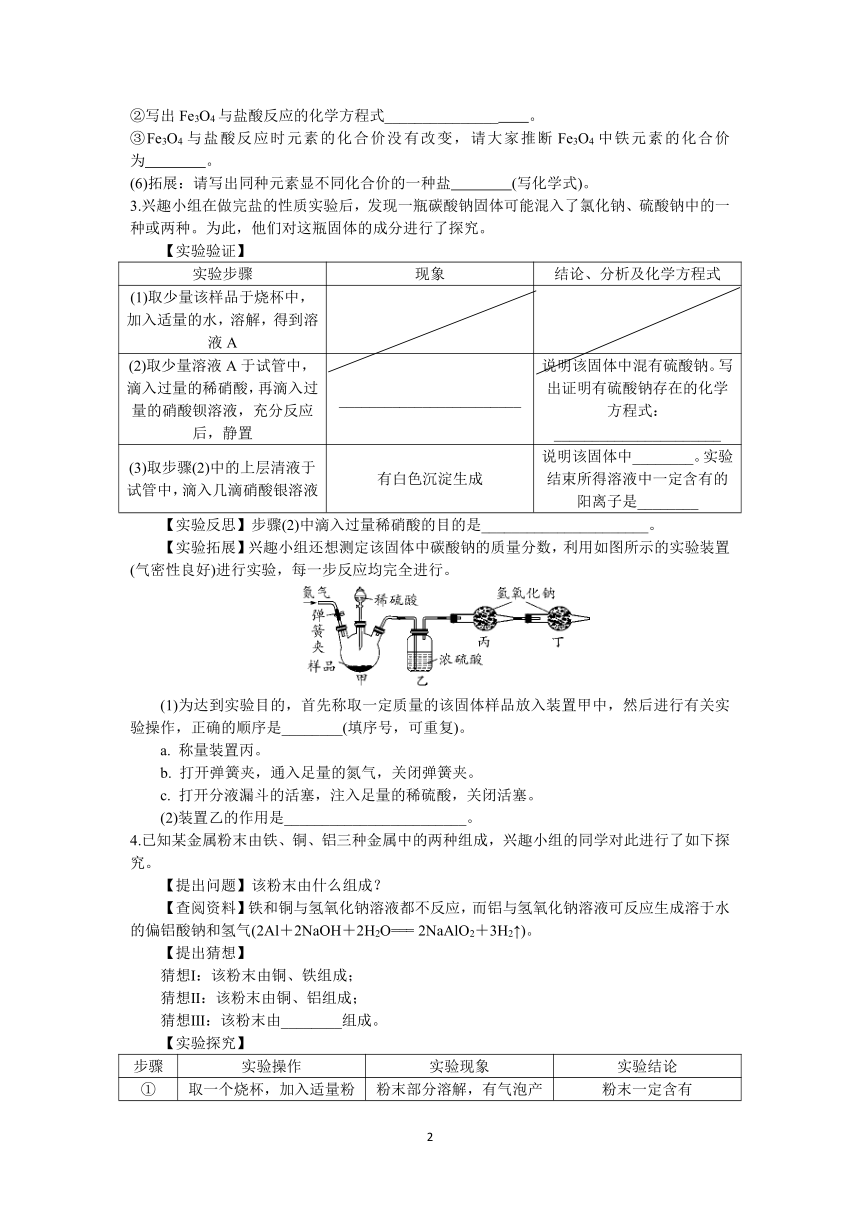
【实验拓展】兴趣小组还想测定该固体中碳酸钠的质量分数,利用如图所示的实验装置(气密性良好)进行实验,每一步反应均完全进行。
(1)为达到实验目的,首先称取一定质量的该固体样品放入装置甲中,然后进行有关实验操作,正确的顺序是________(填序号,可重复)。
a. 称量装置丙。
b. 打开弹簧夹,通入足量的氮气,关闭弹簧夹。
c. 打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞。
(2)装置乙的作用是________________________。
4.已知某金属粉末由铁、铜、铝三种金属中的两种组成,兴趣小组的同学对此进行了如下探究。
【提出问题】该粉末由什么组成?
【查阅资料】铁和铜与氢氧化钠溶液都不反应,而铝与氢氧化钠溶液可反应生成溶于水的偏铝酸钠和氢气(2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑)。
【提出猜想】
猜想Ⅰ:该粉末由铜、铁组成;
猜想Ⅱ:该粉末由铜、铝组成;
猜想Ⅲ:该粉末由________组成。
【实验探究】
步骤 实验操作 实验现象 实验结论
① 取一个烧杯,加入适量粉末样品,再加入足量的稀盐酸 粉末部分溶解,有气泡产生 粉末一定含有__________________
② 另取一个烧杯,加入适量粉末样品,再加入足量NaOH溶液 粉末部分溶解,____气泡产生 粉末一定含有铝
综合上述实验,说明猜想________成立。
【实验反思】有同学认为能用浅绿色的FeSO4溶液代替NaOH溶液完成步骤②,你认为________(填“能”或“不能”),理由是__________________________________。
【拓展应用】铝与稀盐酸反应的化学方程式是__________________________。
5.实验室有一包白色粉末,可能含有Na2SO4、Ba(NO3)2、K2CO3、KOH、CuSO4、Mg(NO3)2和KCl中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下实验探究。
【查阅资料】CaCl2溶液显中性;K2CO3和“纯碱”的化学性质极其相似;MgCO3微溶于水,不考虑为沉淀。
【实验步骤】
步骤Ⅰ:取一定量样品于烧杯中,加足量水充分溶解,有白色沉淀产生,溶液呈无色。
初步结论:原粉末中一定不含______________。
步骤Ⅱ:将步骤Ⅰ中的混合物过滤,进行下一步实验探究。
【实验探究一】
小明同学对步骤Ⅱ中过滤所得滤液设计了如下的实验探究方案:
实验步骤 实验现象 实验结论
取一定量滤液于试管中,加入足量CaCl2溶液,充分振荡后,再滴加酚酞溶液 溶液呈红色 由此确定原粉末中含有________
请说明加入足量CaCl2溶液的理由________________________________。
【猜想假设】
小红同学对步骤Ⅱ中过滤所得固体成分提出了如下猜想:
①Mg(OH)2 ②BaSO4
③BaCO3 ④Mg(OH)2、BaSO4
⑤BaSO4、BaCO3 ⑥Mg(OH)2、BaCO3
⑦Mg(OH)2、BaSO4、BaCO3
【实验探究二】
小红同学对猜想设计了如下的实验探究方案:
实验步骤 实验现象 实验结论
(1)取一定量过滤所得固体于试管中,加入足量稀HCl,充分振荡 有气泡产生,沉淀完全溶解 上述猜想____可能成立
(2)向(1)试管中,继续滴加足量的NaOH溶液 有白色沉淀产生 上述猜想____一定成立
请写出(2)中产生白色沉淀的化学方程式:____________________________。
【归纳总结】通过上述实验验证,原粉末中仍不能确定的成分是________________。
6.某化学小组对K2CO3溶液与Ca(OH)2溶液反应后所得滤液中的溶质成分产生了兴趣,请你一起参与他们的探究。
(1)提出问题:滤液中溶质的成分是什么?
(2)猜想与假设:
猜想一:KOH
猜想二:KOH和Ca(OH)2
猜想三:____________
猜想四:KOH、Ca(OH)2和K2CO3
(3)小组讨论:经过讨论,同学们认为猜想________是错误的,理由是______________________。
(4)实验探究:
实验 实验操作 实验现象 实验结论
实验一 取适量滤液于试管中,通入足量二氧化碳 无明显现象 猜想______错误
实验二 取适量滤液于试管中,滴入几滴稀盐酸 ________ 猜想一正确
(5)交流与反思:
同学们将实验结果与老师交流,老师认为实验二的结论不一定正确,理由是______________________________。经过讨论,同学们又进行了第三次实验:另取适量滤液于试管中,滴入________溶液(填化学式),观察到有白色沉淀生成,由此得出猜想三正确。
(6)拓展延伸:实验结束后欲使滤液中的溶质只含KOH,则可以加入适量的__________溶液(填化学式)。
7.NaHCO3是初中化学教材中重点介绍的一种盐,俗名________,NaHCO3溶液呈碱性。某化学兴趣小组要制取一瓶NaHCO3溶液,他们向NaOH溶液中通入了一定量的CO2,然后对反应后所得到的溶液进行探究。
【提出问题】反应后溶液中溶质的组成是什么?
【查阅资料】(1)NaHCO3不仅可以与盐酸反应,也可以与NaOH溶液反应。与NaOH溶液反应的化学方程式为:NaHCO3+NaOH=== Na2CO3+H2O。
(2)向NaOH溶液中通入少量CO2,反应的化学方程式为:CO2+2NaOH=== Na2CO3+H2O。继续通入过量CO2,反应的化学方程式为:Na2CO3+H2O+CO2=== 2NaHCO3。
【猜想与假设】猜想一:含有NaOH、Na2CO3;
猜想二:只含有____________;
猜想三:含有Na2CO3、NaHCO3;
猜想四:只含有NaHCO3。
【设计实验】
实验步骤 实验现象 解释或结论
①取少量样品于试管中,滴加几滴无色酚酞试液 溶液呈红色 证明溶液显碱性
②另取少量样品于试管中,加入足量的BaCl2溶液,反应完全后,静置过滤 加入BaCl2溶液时观察 到的现象________ 证明溶质中有Na2CO3
③向实验②所得的滤液中滴加稀盐酸 有无色无味的气体产生, 该气体能使澄清石灰水 变浑浊 证明实验②所得的滤液中有 __________
【结论与反思】
(1)有同学认为实验①观察到的现象及结论足以证明溶液中有NaOH。你是否同意?请说出理由________________________________________。
(2)写出实验③中产生气体的化学方程式__________________________。
(3)通过实验①、②、③所观察到的现象及结论,最终得出猜想____是正确的。
【拓展与提升】实验室现有一瓶NaOH溶液和足量CO2气体,要制取一瓶溶质只有Na2CO3的溶液,请完善以下实验方案,仪器可以任意选择。
实验方案:先用量筒将NaOH溶液均匀分成两等份,_______________________。
8.某化学兴趣小组的同学在实验室发现一瓶敞口放置的过氧化钠(Na2O2)固体,他们对该固体是否变质产生了兴趣,对固体成分进行了实验探究。
【查阅资料】
①在标准状况下,氧气的密度是1.429 g/L。在室温下,1 L水中能溶解约30 mL的氧气。
②过氧化钠能与二氧化碳反应:2Na2O2+2CO2=== 2Na2CO3+O2。
③过氧化钠能与水反应:2Na2O2+2H2O=== 4NaOH+O2↑。
④BaCl2溶液呈中性。
【成分猜想】固体中可能有Na2O2、NaOH和Na2CO3中的一种或几种。
【实验验证】
实验步骤 实验现象 结论或化学方程式
(1)取少量样品于试管中,加水溶解,并立即将带火星的木条伸入试管中 有气泡产生,__________ 证明固体中含有Na2O2
(2)取步骤(1)所得溶液于试管中,滴加过量的BaCl2溶液 有白色沉淀生成 证明固体中含有Na2CO3,化学方程式为________________________
(3)取步骤(2)中上层清液于试管中,滴入1~2滴酚酞溶液 溶液变红 证明固体中含有NaOH
【分析交流】经过讨论分析,同学们认为步骤(3)中的结论不合理,不能证明固体中含有NaOH,理由是________________________________________。
【继续探究】为确定固体中是否含有NaOH,取一定质量的样品,利用如图装置进行实验验证(BaCl2溶液的体积和温度变化对气体体积的影响忽略不计)。
(1)装置乙中植物油的作用是____________________________。
(2)待反应完全后,根据收集所得气体的体积,进行相关计算,得出样品中________的质量。
(3)再将烧瓶中的沉淀进行过滤、洗涤、烘干、称量,进行相关计算,得出样品中________的质量。
【实验结论】经过实验数据分析,得出固体中不但含有Na2O2和Na2CO3,还含有NaOH。证明含有NaOH的依据是__________________________________。
9.一种自加热食品包装中加热包的成分有:生石灰、活性炭、铝粉、铁粉、碳酸钠、氯化钙、硫酸镁,使用时需向加热包加水。课堂上老师分别取适量加热包中的固体样品进行图1实验:
(1)实验A中,将样品加入水里,触摸烧杯外壁发烫,其原因是__________________(用化学方程式表示)。
图1
(2)实验B中,将一定量稀盐酸加入锥形瓶中,剧烈反应,生成大量气体。学习小组同学对气体成分和锥形瓶内溶液进行探究。
Ⅰ.对气体成分进行探究
【做出假设】假设一:只有H2
假设二:只有CO2
假设三:H2和CO2
【实验验证】小明同学设计图2实验对气体成分进行探究。
图2
①当气体通过甲时,澄清石灰水变浑浊,证明假设________不成立。
②丁中出现__________________的现象时,证明假设三成立。
③乙的作用是________________。
Ⅱ.对锥形瓶内的溶液进行探究
实验后,小萍同学取少量锥形瓶内的溶液于试管中,向其中滴加NaOH溶液,开始一段时间无沉淀生成,其原因是锥形瓶内的溶液中存在______________。
【总结反思】通过以上探究,小林同学做了如下的反思归纳:
a. 加热包应密封防潮保存
b. 向用过的加热包内的固体中,加入过量稀盐酸后过滤,可以回收活性炭
c. 能与水混合放出热量的物质均可用作加热包中的发热材料
你认为其中不正确的是________(填字母)。
10.实验室存放盐溶液的柜子里,有一瓶无色溶液的标签因受到腐蚀而破损,如图所示。某兴趣小组同学对其成分进行探究。
【提出问题】这瓶是什么溶液呢?
【猜想与假设】经了解得知,这瓶无色溶液可能是碳酸钾、硫酸钾、氯化钾、硝酸钾中的某一种溶液。
【推理分析】小组同学为了确定该溶液的成分,他们进行了以下分析:
(1)甲同学根据物质的组成元素认为一定不可能是________溶液。
(2)乙同学认为也不可能是硝酸钾溶液,他的依据是___________________________________________。
【设计实验】为了确定该溶液究竟是剩余两种溶液中的哪一种,丙同学设计了如下实验:
实验操作 实验现象 实验结论
取少量该溶液于试管中,逐滴加入氯化钡溶液 产生白色沉淀 该溶液一定是碳酸钾溶液
【实验反思】
(1)丁同学认为丙的结论不合理,理由是_________________________。
(2)在丙同学实验的基础上,丁同学继续进行实验,实验方案如下:
实验操作 实验现象 实验结论
取丙同学实验所得的白色沉淀于试管中,滴加适量的________,振荡 ________,沉淀溶解 该溶液是碳酸钾溶液。反应的化学方程式是__________________
(3)为防止标签受到腐蚀,倾倒液体时应注意:_____________________。
11.实验室有一瓶标签受到腐蚀的蓝色溶液,其标签如图所示,化学兴趣小组的同学在老师的指导下对该溶液的溶质进行了探究。
【提出问题】该蓝色溶液的溶质是什么?
【作出猜想】同学们依据标签上的内容和溶液颜色猜测:该蓝色溶液的溶质可能是硫酸铜、硝酸铜、氯化铜中的某一种。
【设计实验】为了确定该溶质的成分,小明设计了如下实验。
实验步骤 实验现象 实验结论
(1)取少量该溶液于试管中,向其中滴加________溶液 无明显现象 该溶质不是硫酸铜
(2)取少量该溶液于试管中,向其中滴加硝酸酸化的硝酸银溶液 __________ 该溶质是氯化铜
写出步骤(2)中发生反应的化学方程式____________________________。
【拓展探究】小组同学取少许样品,进行金属和盐溶液的实验:将镁片放入氯化铜溶液中,观察到的现象为__________________________,同时有气泡产生,他们对此进行了进一步探究。
(1)取少量样品测定溶液的pH,测得pH<7,即氯化铜溶液显________性。
(2)同学们对产生的气体进行了猜想,你认为可能是________。
A. Cl2 B. O2 C. H2
【反思应用】盐溶液不一定显中性,请再举出一例说明________________________。
参考答案
1.(1)CaH2+2H2O=== Ca(OH)2+2H2↑ (2)【猜想与假设】猜想三:Na2CO3 Na2CO3和Ca(OH)2不能共存[或Na2CO3和Ca(OH)2能够反应等] 【实验过程】无明显现象(或无白色沉淀产生) 稀盐酸(或稀硫酸等)
2. (2)CuO、Fe3O4 (4)CuO(或氧化铜) FeCl3(或氯化铁) FeCl2(或氯化亚铁) (5)①二 ②Fe3O4+8HCl=== 2FeCl3+FeCl2+4H2O ③+2、+3 (6)NH4NO3(合理即可)
3. 【实验验证】(2)先有气泡产生,后产生白色沉淀 Na2SO4 +Ba(NO3)2=== 2NaNO3+BaSO4↓ (3)含有氯化钠 Na+、H+、Ba2+ 【实验反思】排除其他离子对硫酸根离子检验的干扰 【实验拓展】(1)bacba
(2)除去二氧化碳中的水蒸气(或干燥CO2)
4 【提出猜想】铁、铝 【实验探究】①铜(或Cu) ②有 Ⅱ 【实验反思】能 若溶液颜色褪去,则证明粉末中含有铝 【拓展应用】2Al+6HCl=== 2AlCl3+3H2↑
5. 【实验步骤】CuSO4 【实验探究一】KOH 因K2CO3溶液显碱性也能使酚酞溶液变红,需排除其干扰(合理即可) 【实验探究二】(1)③⑥ (2)⑥ 2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓ 【归纳总结】KCl
6. (2)KOH和K2CO3 (3)四 Ca(OH)2与K2CO3不能共存 (4)二 无明显现象 (5)滴入的稀盐酸的量不足(合理即可) BaCl2(合理即可) (6)Ca(OH)2(合理即可)
7. 小苏打 【猜想与假设】Na2CO3 【设计实验】②有白色沉淀产生 ③NaHCO3 【结论与反思】(1)不同意;碳酸钠溶液和碳酸氢钠溶液都呈碱性 (2)NaHCO3+HCl=== NaCl+H2O+CO2↑ (3)三 【拓展与提升】将一份氢氧化钠溶液倒入到盛有二氧化碳的集气瓶中,另一份倒入烧杯中,充分反应后将混合溶液倒入另一份氢氧化钠溶液中,搅拌混合,即可得到碳酸钠溶液
8. 【实验验证】(1)带火星的木条复燃 (2)Na2CO3+ BaCl2=== BaCO3 ↓+2NaCl 【分析交流】样品中的Na2O2与水反应也生成氢氧化钠 【继续探究】(1)防止氧气溶解在水中,减小实验误差(2)过氧化钠(或Na2O2) (3)碳酸钠(或Na2CO3) 【实验结论】样品的质量大于过氧化钠和碳酸钠的质量总和
9. (1)CaO+H2O=== Ca(OH)2 (2)Ⅰ.①一 ②黑色粉末变为红色 ③吸收CO2(或除去CO2) Ⅱ.盐酸(或HCl或氯化氢) 【总结反思】c
10. 【推理分析】(1)氯化钾(或KCl) (2)硝酸钾化学式中K右下角的数字不是2(合理即可) 【实验反思】(1)硫酸钾也能和氯化钡溶液反应生成白色沉淀 (2)稀盐酸(或稀硝酸) 产生大量气泡 BaCO3+2HCl=== BaCl2+H2O+CO2↑[或BaCO3+2HNO3=== Ba(NO3)2+H2O+CO2↑,与上一空对应] (3)标签朝向手心
11. 【设计实验】(1)氯化钡(或可溶性钡盐,化学式也可)(2)产生白色沉淀 2AgNO3+CuCl2=== 2AgCl↓+Cu(NO3)2 【拓展探究】镁片表面有红色物质析出,溶液颜色变浅 (1)酸 (2)C 【反思应用】碳酸钠属于盐,但其溶液显碱性(合理即可)
(
1
)
1.钙元素是一种重要的金属元素,它可组成氢化钙、氢氧化钙等多种物质。
(1)氢化钙(CaH2)固体是登山运动员常用的能源提供剂。某实验探究小组的同学通过查阅资料得知,氢化钙在常温下能与水反应生成氢氧化钙和氢气,请你写出该反应的化学方程式 。
(2)该实验探究小组将Na2CO3溶液滴加到Ca(OH)2溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
【提出问题】
滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH;
猜想二:NaOH和Ca(OH)2;
猜想三:NaOH和 ;
猜想四:NaOH、Na2CO3和Ca(OH)2。
经过讨论,大家认为猜想四不合理,原因是 。
【实验过程】
实验步骤 现象 结论
步骤Ⅰ:取滤液,向其中滴入适量Na2CO3溶液 猜想二不成立
步骤Ⅱ:另取滤液,向其中加入足量 溶液 产生气泡 猜想 成立
【拓展延伸】
在分析反应后所得物质的成分时,除考虑生成物外,还需考虑 。
2.现有一包黑色固体粉末,可能含有炭粉、CuO、Fe3O4中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(1)提出问题:该黑色固体粉末成分是什么?
(2)作出猜想:猜想一:混合固体是炭粉、CuO猜想二:混合固体是炭粉、Fe3O4
猜想三:混合固体是 猜想四:混合固体是炭粉、CuO、Fe3O4
(3)查阅资料:Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀。
(4)实验探究:取一定量的固体于试管中,加足量的盐酸,充分反应后有部分固体溶解,过滤,得到滤液A,并对滤液A的成分进行如下探究:
实验操作 实验现象 实验结论
步骤一:取一定量滤液A于试管中,加入足量的铁粉 无红色固体析出 该固体物质一定没有_________________________
步骤二:又取一定量的滤液A于试管中,加入少量的KSCN(硫氰化钾)溶液 溶液变成红色 滤液A中一定含有的物质是
步骤三:再取一定量的滤液A于试管中,加入足量的NaOH溶液 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最后面变成红褐色 滤液A中还一定含有的物质是
(5)讨论交流:
①通过以上实验,猜想 成立。
②写出Fe3O4与盐酸反应的化学方程式_______________ 。
③Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为 。
(6)拓展:请写出同种元素显不同化合价的一种盐 (写化学式)。
3.兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠、硫酸钠中的一种或两种。为此,他们对这瓶固体的成分进行了探究。
【实验验证】
实验步骤 现象 结论、分析及化学方程式
(1)取少量该样品于烧杯中,加入适量的水,溶解,得到溶液A
(2)取少量溶液A于试管中,滴入过量的稀硝酸,再滴入过量的硝酸钡溶液,充分反应后,静置 ________________________ 说明该固体中混有硫酸钠。写出证明有硫酸钠存在的化学方程式:______________________
(3)取步骤(2)中的上层清液于试管中,滴入几滴硝酸银溶液 有白色沉淀生成 说明该固体中________。实验结束所得溶液中一定含有的阳离子是________
【实验反思】步骤(2)中滴入过量稀硝酸的目的是______________________。
【实验拓展】兴趣小组还想测定该固体中碳酸钠的质量分数,利用如图所示的实验装置(气密性良好)进行实验,每一步反应均完全进行。
(1)为达到实验目的,首先称取一定质量的该固体样品放入装置甲中,然后进行有关实验操作,正确的顺序是________(填序号,可重复)。
a. 称量装置丙。
b. 打开弹簧夹,通入足量的氮气,关闭弹簧夹。
c. 打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞。
(2)装置乙的作用是________________________。
4.已知某金属粉末由铁、铜、铝三种金属中的两种组成,兴趣小组的同学对此进行了如下探究。
【提出问题】该粉末由什么组成?
【查阅资料】铁和铜与氢氧化钠溶液都不反应,而铝与氢氧化钠溶液可反应生成溶于水的偏铝酸钠和氢气(2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑)。
【提出猜想】
猜想Ⅰ:该粉末由铜、铁组成;
猜想Ⅱ:该粉末由铜、铝组成;
猜想Ⅲ:该粉末由________组成。
【实验探究】
步骤 实验操作 实验现象 实验结论
① 取一个烧杯,加入适量粉末样品,再加入足量的稀盐酸 粉末部分溶解,有气泡产生 粉末一定含有__________________
② 另取一个烧杯,加入适量粉末样品,再加入足量NaOH溶液 粉末部分溶解,____气泡产生 粉末一定含有铝
综合上述实验,说明猜想________成立。
【实验反思】有同学认为能用浅绿色的FeSO4溶液代替NaOH溶液完成步骤②,你认为________(填“能”或“不能”),理由是__________________________________。
【拓展应用】铝与稀盐酸反应的化学方程式是__________________________。
5.实验室有一包白色粉末,可能含有Na2SO4、Ba(NO3)2、K2CO3、KOH、CuSO4、Mg(NO3)2和KCl中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下实验探究。
【查阅资料】CaCl2溶液显中性;K2CO3和“纯碱”的化学性质极其相似;MgCO3微溶于水,不考虑为沉淀。
【实验步骤】
步骤Ⅰ:取一定量样品于烧杯中,加足量水充分溶解,有白色沉淀产生,溶液呈无色。
初步结论:原粉末中一定不含______________。
步骤Ⅱ:将步骤Ⅰ中的混合物过滤,进行下一步实验探究。
【实验探究一】
小明同学对步骤Ⅱ中过滤所得滤液设计了如下的实验探究方案:
实验步骤 实验现象 实验结论
取一定量滤液于试管中,加入足量CaCl2溶液,充分振荡后,再滴加酚酞溶液 溶液呈红色 由此确定原粉末中含有________
请说明加入足量CaCl2溶液的理由________________________________。
【猜想假设】
小红同学对步骤Ⅱ中过滤所得固体成分提出了如下猜想:
①Mg(OH)2 ②BaSO4
③BaCO3 ④Mg(OH)2、BaSO4
⑤BaSO4、BaCO3 ⑥Mg(OH)2、BaCO3
⑦Mg(OH)2、BaSO4、BaCO3
【实验探究二】
小红同学对猜想设计了如下的实验探究方案:
实验步骤 实验现象 实验结论
(1)取一定量过滤所得固体于试管中,加入足量稀HCl,充分振荡 有气泡产生,沉淀完全溶解 上述猜想____可能成立
(2)向(1)试管中,继续滴加足量的NaOH溶液 有白色沉淀产生 上述猜想____一定成立
请写出(2)中产生白色沉淀的化学方程式:____________________________。
【归纳总结】通过上述实验验证,原粉末中仍不能确定的成分是________________。
6.某化学小组对K2CO3溶液与Ca(OH)2溶液反应后所得滤液中的溶质成分产生了兴趣,请你一起参与他们的探究。
(1)提出问题:滤液中溶质的成分是什么?
(2)猜想与假设:
猜想一:KOH
猜想二:KOH和Ca(OH)2
猜想三:____________
猜想四:KOH、Ca(OH)2和K2CO3
(3)小组讨论:经过讨论,同学们认为猜想________是错误的,理由是______________________。
(4)实验探究:
实验 实验操作 实验现象 实验结论
实验一 取适量滤液于试管中,通入足量二氧化碳 无明显现象 猜想______错误
实验二 取适量滤液于试管中,滴入几滴稀盐酸 ________ 猜想一正确
(5)交流与反思:
同学们将实验结果与老师交流,老师认为实验二的结论不一定正确,理由是______________________________。经过讨论,同学们又进行了第三次实验:另取适量滤液于试管中,滴入________溶液(填化学式),观察到有白色沉淀生成,由此得出猜想三正确。
(6)拓展延伸:实验结束后欲使滤液中的溶质只含KOH,则可以加入适量的__________溶液(填化学式)。
7.NaHCO3是初中化学教材中重点介绍的一种盐,俗名________,NaHCO3溶液呈碱性。某化学兴趣小组要制取一瓶NaHCO3溶液,他们向NaOH溶液中通入了一定量的CO2,然后对反应后所得到的溶液进行探究。
【提出问题】反应后溶液中溶质的组成是什么?
【查阅资料】(1)NaHCO3不仅可以与盐酸反应,也可以与NaOH溶液反应。与NaOH溶液反应的化学方程式为:NaHCO3+NaOH=== Na2CO3+H2O。
(2)向NaOH溶液中通入少量CO2,反应的化学方程式为:CO2+2NaOH=== Na2CO3+H2O。继续通入过量CO2,反应的化学方程式为:Na2CO3+H2O+CO2=== 2NaHCO3。
【猜想与假设】猜想一:含有NaOH、Na2CO3;
猜想二:只含有____________;
猜想三:含有Na2CO3、NaHCO3;
猜想四:只含有NaHCO3。
【设计实验】
实验步骤 实验现象 解释或结论
①取少量样品于试管中,滴加几滴无色酚酞试液 溶液呈红色 证明溶液显碱性
②另取少量样品于试管中,加入足量的BaCl2溶液,反应完全后,静置过滤 加入BaCl2溶液时观察 到的现象________ 证明溶质中有Na2CO3
③向实验②所得的滤液中滴加稀盐酸 有无色无味的气体产生, 该气体能使澄清石灰水 变浑浊 证明实验②所得的滤液中有 __________
【结论与反思】
(1)有同学认为实验①观察到的现象及结论足以证明溶液中有NaOH。你是否同意?请说出理由________________________________________。
(2)写出实验③中产生气体的化学方程式__________________________。
(3)通过实验①、②、③所观察到的现象及结论,最终得出猜想____是正确的。
【拓展与提升】实验室现有一瓶NaOH溶液和足量CO2气体,要制取一瓶溶质只有Na2CO3的溶液,请完善以下实验方案,仪器可以任意选择。
实验方案:先用量筒将NaOH溶液均匀分成两等份,_______________________。
8.某化学兴趣小组的同学在实验室发现一瓶敞口放置的过氧化钠(Na2O2)固体,他们对该固体是否变质产生了兴趣,对固体成分进行了实验探究。
【查阅资料】
①在标准状况下,氧气的密度是1.429 g/L。在室温下,1 L水中能溶解约30 mL的氧气。
②过氧化钠能与二氧化碳反应:2Na2O2+2CO2=== 2Na2CO3+O2。
③过氧化钠能与水反应:2Na2O2+2H2O=== 4NaOH+O2↑。
④BaCl2溶液呈中性。
【成分猜想】固体中可能有Na2O2、NaOH和Na2CO3中的一种或几种。
【实验验证】
实验步骤 实验现象 结论或化学方程式
(1)取少量样品于试管中,加水溶解,并立即将带火星的木条伸入试管中 有气泡产生,__________ 证明固体中含有Na2O2
(2)取步骤(1)所得溶液于试管中,滴加过量的BaCl2溶液 有白色沉淀生成 证明固体中含有Na2CO3,化学方程式为________________________
(3)取步骤(2)中上层清液于试管中,滴入1~2滴酚酞溶液 溶液变红 证明固体中含有NaOH
【分析交流】经过讨论分析,同学们认为步骤(3)中的结论不合理,不能证明固体中含有NaOH,理由是________________________________________。
【继续探究】为确定固体中是否含有NaOH,取一定质量的样品,利用如图装置进行实验验证(BaCl2溶液的体积和温度变化对气体体积的影响忽略不计)。
(1)装置乙中植物油的作用是____________________________。
(2)待反应完全后,根据收集所得气体的体积,进行相关计算,得出样品中________的质量。
(3)再将烧瓶中的沉淀进行过滤、洗涤、烘干、称量,进行相关计算,得出样品中________的质量。
【实验结论】经过实验数据分析,得出固体中不但含有Na2O2和Na2CO3,还含有NaOH。证明含有NaOH的依据是__________________________________。
9.一种自加热食品包装中加热包的成分有:生石灰、活性炭、铝粉、铁粉、碳酸钠、氯化钙、硫酸镁,使用时需向加热包加水。课堂上老师分别取适量加热包中的固体样品进行图1实验:
(1)实验A中,将样品加入水里,触摸烧杯外壁发烫,其原因是__________________(用化学方程式表示)。
图1
(2)实验B中,将一定量稀盐酸加入锥形瓶中,剧烈反应,生成大量气体。学习小组同学对气体成分和锥形瓶内溶液进行探究。
Ⅰ.对气体成分进行探究
【做出假设】假设一:只有H2
假设二:只有CO2
假设三:H2和CO2
【实验验证】小明同学设计图2实验对气体成分进行探究。
图2
①当气体通过甲时,澄清石灰水变浑浊,证明假设________不成立。
②丁中出现__________________的现象时,证明假设三成立。
③乙的作用是________________。
Ⅱ.对锥形瓶内的溶液进行探究
实验后,小萍同学取少量锥形瓶内的溶液于试管中,向其中滴加NaOH溶液,开始一段时间无沉淀生成,其原因是锥形瓶内的溶液中存在______________。
【总结反思】通过以上探究,小林同学做了如下的反思归纳:
a. 加热包应密封防潮保存
b. 向用过的加热包内的固体中,加入过量稀盐酸后过滤,可以回收活性炭
c. 能与水混合放出热量的物质均可用作加热包中的发热材料
你认为其中不正确的是________(填字母)。
10.实验室存放盐溶液的柜子里,有一瓶无色溶液的标签因受到腐蚀而破损,如图所示。某兴趣小组同学对其成分进行探究。
【提出问题】这瓶是什么溶液呢?
【猜想与假设】经了解得知,这瓶无色溶液可能是碳酸钾、硫酸钾、氯化钾、硝酸钾中的某一种溶液。
【推理分析】小组同学为了确定该溶液的成分,他们进行了以下分析:
(1)甲同学根据物质的组成元素认为一定不可能是________溶液。
(2)乙同学认为也不可能是硝酸钾溶液,他的依据是___________________________________________。
【设计实验】为了确定该溶液究竟是剩余两种溶液中的哪一种,丙同学设计了如下实验:
实验操作 实验现象 实验结论
取少量该溶液于试管中,逐滴加入氯化钡溶液 产生白色沉淀 该溶液一定是碳酸钾溶液
【实验反思】
(1)丁同学认为丙的结论不合理,理由是_________________________。
(2)在丙同学实验的基础上,丁同学继续进行实验,实验方案如下:
实验操作 实验现象 实验结论
取丙同学实验所得的白色沉淀于试管中,滴加适量的________,振荡 ________,沉淀溶解 该溶液是碳酸钾溶液。反应的化学方程式是__________________
(3)为防止标签受到腐蚀,倾倒液体时应注意:_____________________。
11.实验室有一瓶标签受到腐蚀的蓝色溶液,其标签如图所示,化学兴趣小组的同学在老师的指导下对该溶液的溶质进行了探究。
【提出问题】该蓝色溶液的溶质是什么?
【作出猜想】同学们依据标签上的内容和溶液颜色猜测:该蓝色溶液的溶质可能是硫酸铜、硝酸铜、氯化铜中的某一种。
【设计实验】为了确定该溶质的成分,小明设计了如下实验。
实验步骤 实验现象 实验结论
(1)取少量该溶液于试管中,向其中滴加________溶液 无明显现象 该溶质不是硫酸铜
(2)取少量该溶液于试管中,向其中滴加硝酸酸化的硝酸银溶液 __________ 该溶质是氯化铜
写出步骤(2)中发生反应的化学方程式____________________________。
【拓展探究】小组同学取少许样品,进行金属和盐溶液的实验:将镁片放入氯化铜溶液中,观察到的现象为__________________________,同时有气泡产生,他们对此进行了进一步探究。
(1)取少量样品测定溶液的pH,测得pH<7,即氯化铜溶液显________性。
(2)同学们对产生的气体进行了猜想,你认为可能是________。
A. Cl2 B. O2 C. H2
【反思应用】盐溶液不一定显中性,请再举出一例说明________________________。
参考答案
1.(1)CaH2+2H2O=== Ca(OH)2+2H2↑ (2)【猜想与假设】猜想三:Na2CO3 Na2CO3和Ca(OH)2不能共存[或Na2CO3和Ca(OH)2能够反应等] 【实验过程】无明显现象(或无白色沉淀产生) 稀盐酸(或稀硫酸等)
2. (2)CuO、Fe3O4 (4)CuO(或氧化铜) FeCl3(或氯化铁) FeCl2(或氯化亚铁) (5)①二 ②Fe3O4+8HCl=== 2FeCl3+FeCl2+4H2O ③+2、+3 (6)NH4NO3(合理即可)
3. 【实验验证】(2)先有气泡产生,后产生白色沉淀 Na2SO4 +Ba(NO3)2=== 2NaNO3+BaSO4↓ (3)含有氯化钠 Na+、H+、Ba2+ 【实验反思】排除其他离子对硫酸根离子检验的干扰 【实验拓展】(1)bacba
(2)除去二氧化碳中的水蒸气(或干燥CO2)
4 【提出猜想】铁、铝 【实验探究】①铜(或Cu) ②有 Ⅱ 【实验反思】能 若溶液颜色褪去,则证明粉末中含有铝 【拓展应用】2Al+6HCl=== 2AlCl3+3H2↑
5. 【实验步骤】CuSO4 【实验探究一】KOH 因K2CO3溶液显碱性也能使酚酞溶液变红,需排除其干扰(合理即可) 【实验探究二】(1)③⑥ (2)⑥ 2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓ 【归纳总结】KCl
6. (2)KOH和K2CO3 (3)四 Ca(OH)2与K2CO3不能共存 (4)二 无明显现象 (5)滴入的稀盐酸的量不足(合理即可) BaCl2(合理即可) (6)Ca(OH)2(合理即可)
7. 小苏打 【猜想与假设】Na2CO3 【设计实验】②有白色沉淀产生 ③NaHCO3 【结论与反思】(1)不同意;碳酸钠溶液和碳酸氢钠溶液都呈碱性 (2)NaHCO3+HCl=== NaCl+H2O+CO2↑ (3)三 【拓展与提升】将一份氢氧化钠溶液倒入到盛有二氧化碳的集气瓶中,另一份倒入烧杯中,充分反应后将混合溶液倒入另一份氢氧化钠溶液中,搅拌混合,即可得到碳酸钠溶液
8. 【实验验证】(1)带火星的木条复燃 (2)Na2CO3+ BaCl2=== BaCO3 ↓+2NaCl 【分析交流】样品中的Na2O2与水反应也生成氢氧化钠 【继续探究】(1)防止氧气溶解在水中,减小实验误差(2)过氧化钠(或Na2O2) (3)碳酸钠(或Na2CO3) 【实验结论】样品的质量大于过氧化钠和碳酸钠的质量总和
9. (1)CaO+H2O=== Ca(OH)2 (2)Ⅰ.①一 ②黑色粉末变为红色 ③吸收CO2(或除去CO2) Ⅱ.盐酸(或HCl或氯化氢) 【总结反思】c
10. 【推理分析】(1)氯化钾(或KCl) (2)硝酸钾化学式中K右下角的数字不是2(合理即可) 【实验反思】(1)硫酸钾也能和氯化钡溶液反应生成白色沉淀 (2)稀盐酸(或稀硝酸) 产生大量气泡 BaCO3+2HCl=== BaCl2+H2O+CO2↑[或BaCO3+2HNO3=== Ba(NO3)2+H2O+CO2↑,与上一空对应] (3)标签朝向手心
11. 【设计实验】(1)氯化钡(或可溶性钡盐,化学式也可)(2)产生白色沉淀 2AgNO3+CuCl2=== 2AgCl↓+Cu(NO3)2 【拓展探究】镁片表面有红色物质析出,溶液颜色变浅 (1)酸 (2)C 【反思应用】碳酸钠属于盐,但其溶液显碱性(合理即可)
(
1
)
