浙教版科学中考复习专题训练:异常现象的实验探究【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:异常现象的实验探究【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 199.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 16:49:10 | ||
图片预览




文档简介
异常、无明显现象的实验探究
1.某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
【提出问题】澄清石灰水为什么没有变浑浊?
【查阅资料】
(1)CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2。
(2)AgCl不溶于稀硝酸。
【提出猜想】
Ⅰ. 石灰水已完全变质Ⅱ. Ⅲ. CO2中混有HCl
【实验方案】
兴趣小组用原药品继续制取CO2,并进行探究。制备CO2的化学方程式为 。
步骤 实验操作 实验现象 结论及化学方程式
(1) 取少量澄清石灰水于试管中,加入 溶液 产生白色沉淀 猜想Ⅰ不成立
(2) 将少量气体通入盛有澄清石灰水的试管中 猜想Ⅱ不成立
(3) 将气体通入盛有 溶液的试管中,再加稀硝酸 猜想Ⅲ成立反应方程式为______
【实验结论】
制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
【交流讨论】
若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和 。
【拓展思考】
回忆课本中收集呼出气体的操作后,同学们尝试用排水法收集一瓶CO2,倒入澄清石灰水后,石灰水变浑浊。你认为该实验成功的原因是 (写一点)。
2.小杨往NaOH溶液中滴加稀硫酸,溶液无明显变化,他和小组同学以“酸与碱能否发生反应”为课题进行了科学探究,请回答下列问题。
【实验一】(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由____色变为无色,该反应的化学方程式为______________________。
(2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到__________________________现象,证明了滴加的稀硫酸过量。
【实验二】按照“证明反应后NaOH消失了”这个角度,同学们又设计了实验二,利用NaOH溶液、CuSO4溶液、稀盐酸同样证明了酸和碱能发生反应,其中试剂丙是______________。
【拓展延伸】CO2通入NaOH溶液中也无明显现象,CO2与NaOH溶液能否发生化学反应呢?小组同学对此继续探究。
【查阅资料】常温下NaOH、Na2CO3在水、乙醇中的溶解性如下表所示:
溶质 溶解性 溶剂 氢氧化钠 碳酸钠
水 极易溶 易溶
乙醇 易溶 微溶
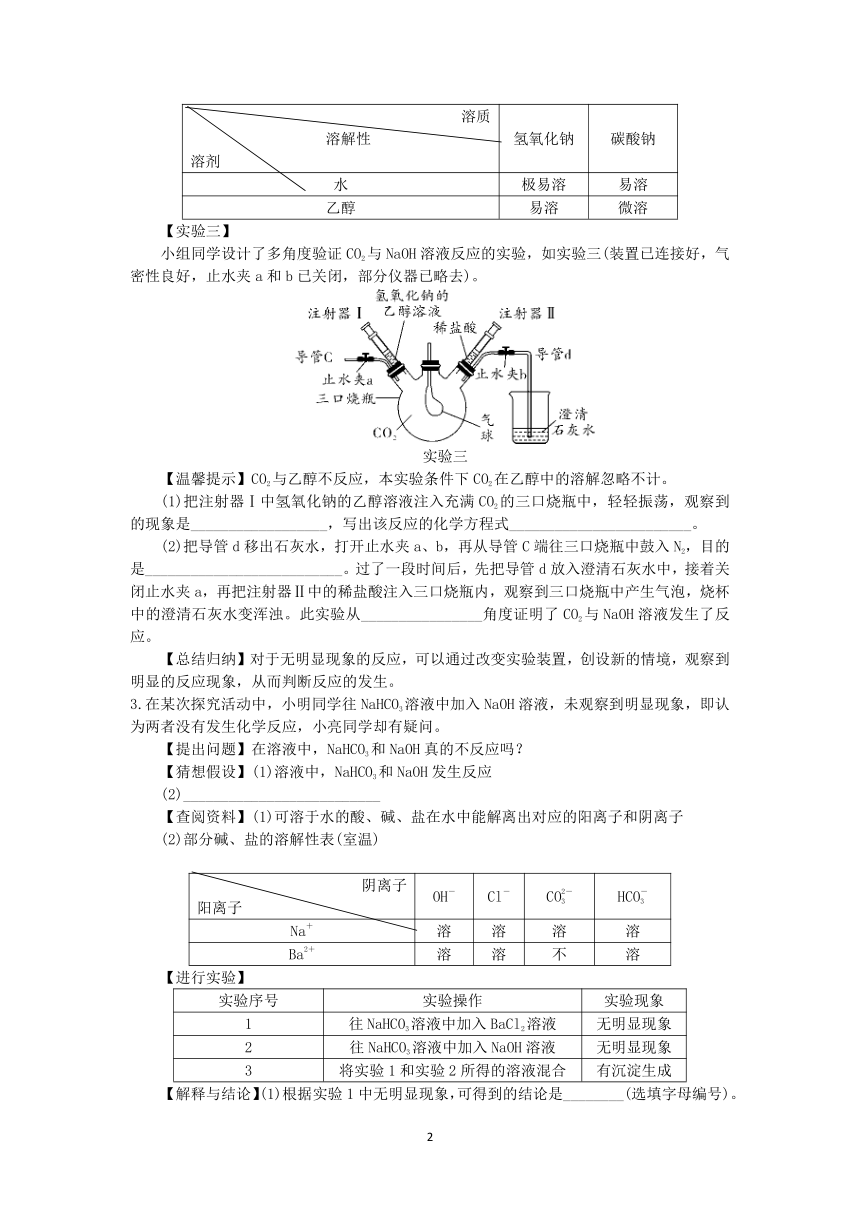
【实验三】
小组同学设计了多角度验证CO2与NaOH溶液反应的实验,如实验三(装置已连接好,气密性良好,止水夹a和b已关闭,部分仪器已略去)。
实验三
【温馨提示】CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
(1)把注射器Ⅰ中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是__________________,写出该反应的化学方程式________________________。
(2)把导管d移出石灰水,打开止水夹a、b,再从导管C端往三口烧瓶中鼓入N2,目的是__________________________。过了一段时间后,先把导管d放入澄清石灰水中,接着关闭止水夹a,再把注射器Ⅱ中的稀盐酸注入三口烧瓶内,观察到三口烧瓶中产生气泡,烧杯中的澄清石灰水变浑浊。此实验从________________角度证明了CO2与NaOH溶液发生了反应。
【总结归纳】对于无明显现象的反应,可以通过改变实验装置,创设新的情境,观察到明显的反应现象,从而判断反应的发生。
3.在某次探究活动中,小明同学往NaHCO3溶液中加入NaOH溶液,未观察到明显现象,即认为两者没有发生化学反应,小亮同学却有疑问。
【提出问题】在溶液中,NaHCO3和NaOH真的不反应吗?
【猜想假设】(1)溶液中,NaHCO3和NaOH发生反应
(2)__________________________
【查阅资料】(1)可溶于水的酸、碱、盐在水中能解离出对应的阳离子和阴离子
(2)部分碱、盐的溶解性表(室温)
阴离子 阳离子 OH- Cl- CO HCO
Na+ 溶 溶 溶 溶
Ba2+ 溶 溶 不 溶
【进行实验】
实验序号 实验操作 实验现象
1 往NaHCO3溶液中加入BaCl2溶液 无明显现象
2 往NaHCO3溶液中加入NaOH溶液 无明显现象
3 将实验1和实验2所得的溶液混合 有沉淀生成
【解释与结论】(1)根据实验1中无明显现象,可得到的结论是________(选填字母编号)。
A. 混合溶液中没有NaCl
B. 混合溶液中没有Ba(HCO3)2
C. 混合溶液中没有NaHCO3
D. 混合溶液中的阴、阳离子不能形成不溶物
(2)实验3中生成的沉淀为________(填化学式),该沉淀中的阴离子只能来源于实验________(选填“1”或“2”)所得到的溶液,则实验________(选填“1”或“2”)必定发生了化学反应,写出该反应的化学方程式____________________________。
(3)依据上述实验及分析,猜想________成立。
【总结反思】两种溶液混合,未观察到明显现象,而化学反应________(选填字母编号)。
A. 一定没发生 B. 一定发生了C. 不一定没发生
4.某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
【提出问题】澄清石灰水为什么没有变浑浊?
【查阅资料】(1)CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2。
(2)AgCl不溶于稀硝酸。
【提出猜想】Ⅰ. 石灰水已完全变质
Ⅱ. __________________
Ⅲ. CO2中混有HCl
【实验方案】兴趣小组用原药品继续制取CO2,并进行探究。制备CO2的化学方程式为____________________________。
步骤 实验操作 实验现象 结论及化学方程式
(1) 取少量澄清石灰水于试管中,加入________溶液 产生白色沉淀 猜想Ⅰ不成立
(2) 将少量气体通入盛有澄清石灰水的试管中 ________ ________ 猜想Ⅱ不成立
(3) 将气体通入盛有________溶液的试管中,再加稀硝酸 ________ ________ 猜想Ⅲ成立。反应方程式为__________________
【实验结论】制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
【交流讨论】若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和________。
【拓展思考】回忆课本中收集呼出气体的操作后,同学们尝试用排水法收集一瓶CO2,倒入澄清石灰水后,石灰水变浑浊。你认为该实验成功的原因是____________________________(写一点)。
5.化学兴趣小组做酸和碱的中和反应时,往NaOH溶液中滴入几滴酚酞溶液,发现溶液刚变红瞬间又褪成无色。讨论并猜想。
图1
猜想一:可能是酚酞溶液变质
猜想二:可能与NaOH溶液的浓度有关
猜想三:可能是酚酞溶液在滴入过程中被O2氧化
……
(1)甲同学认为猜想一是不对的。其理由是________________________________。
(2)取3 mL不同浓度的NaOH溶液,分别滴入3滴酚酞溶液,观察现象。得到NaOH溶液的浓度与酚酞溶液褪色时间关系如图2所示。
图2
①根据图2所示,NaOH溶液溶质的质量分数________,酚酞溶液由红色褪为无色的时间越短。
②做酸和碱的中和反应时,滴加酚酞溶液的目的是____________________。
若用做实验的NaOH溶液溶质的质量分数为4%,完成该实验的操作时间应控制在________之内。
(3)请设计实验,验证猜想三是否正确。
实验操作 实验现象 实验结论
5.5 min酚酞溶液褪色 酚酞溶液先变红后褪色与O2______(选填“有关”或“无关”)
(4)探究酸碱中和反应时,逐滴加入稀盐酸的过程,并不断搅拌的目的是________________,写出该反应的化学方程式________________________。
6.兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究Ⅰ:反应产生的气体是什么?
【作出猜想】小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有__________三种元素,作出如下猜想:
①氢气;②二氧化碳;③氢气和二氧化碳。
【实验1】取适量镁条、100 mL Na2CO3溶液于反应装置A中,按图1所示方案进行实验。B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
(1)反应装置A应选用图2中的________(填写序号)。
(2)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是:__________________________________。
探究Ⅱ:快速产生气体的原因是什么?
【查阅资料】镁与水缓慢反应生成氢气;Na2CO3溶液显碱性,其溶液中除Na+、CO外,还有OH-。
【作出猜想】可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是CO而不是Na+、OH-促进了镁与水的反应。
第2题图3
(1)G中实验的作用是__________________。
(2)试剂X是____________。
探究Ⅲ:反应产生的白色沉淀中是否含有MgCO3
【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO3。试剂Y及实验现象为__________________________;该反应的化学方程式为_______________________。
反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。
7.科学探究很奇妙!在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有5%过氧化氢的溶液中,发现立即有大量气泡产生。硫酸铜溶液中有三种粒子(H2O、SO、Cu2+),小明想知道硫酸铜溶液中的哪种粒子能使双氧水分解的速率加快。请你和小明一起通过下图所示的三个实验完成这次探究活动,并回答有关问题。
你认为最不可能的是哪一种粒子?_________________________________
______________;理由是________________________________。
(2)要证明另外两种粒子能否加快双氧水分解的速率,还需要进行实验②和③:在实验②中加入稀硫酸后,无明显变化,说明__________不起催化作用;在实验③中加入__________________后,会观察到大量气泡,证明起催化作用的是______。
(3)检验实验产生的气体的方法是_________________________________________。
(4)小明如果要确定硫酸铜是催化剂,还需通过实验确认它在化学反应前后_______________________________________。
8.某学习小组同学用图1实验装置来探究鸡蛋壳里
图1
含有CO(以CaCO3的形式存在)的可能性,请你一起参与学习探究。
【讨论交流】同学们讨论后一致认为若鸡蛋壳里含有CO,实验时广口瓶中一定会产生气泡,玻璃片上石灰水会变浑浊,据此写出有气泡生成的化学方程式:____________________。
【进行实验】小明和小红在各自的实验中均看到广口瓶中产生气泡,小明还看到玻璃片上石灰水变浑浊,而小红却未看到。他们很是好奇,于是进一步进行探究。
【提出问题】小红的实验中,玻璃片上石灰水为什么不变浑浊呢?
【做出猜想】小红猜想:可能鸡蛋壳中含有铁等较活泼金属,而不含CO;
小明猜想:可能小红实验所用盐酸中溶质质量分数过大,挥发出HCl气体。
依据所学化学知识和生活常识,你认为________的猜想是不合理的。
【实验验证】小红分别取适量等体积的自己实验中所用的盐酸a和小明实验中所用的盐酸b于2支试管中,试管内各盛有同一鸡蛋壳的碎片,塞上带导管的橡胶塞,并分别将导管伸入AgNO3溶液中,实验过程如图2所示:
图2
实验中,甲、乙两试管内均有气泡产生,同时甲试管中有白色沉淀生成而乙中没有,白色沉淀的化学式是_______。
【实验结论】上述实验说明盐酸a中溶质的质量分数一定________(填“大于”或“小于”)盐酸b中溶质的质量分数,同时也说明了鸡蛋壳中含有CO的可能性。
【反思应用】(1)实验室制备CO2时,最好选择____(填“浓”或“稀”)盐酸。
(2)实验中发现,与相同溶质质量分数的盐酸反应时,鸡蛋壳碎片比大块鸡蛋壳更剧烈,说明增大反应物______________可以加快反应速率。
9.如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据如图实验,请你与甲、乙同学一起完成下列探究:
探究环节 甲同学的探究 乙同学的探究
提出问题 A3溶液为什么不变红? B3溶液中溶质成分是什么?(酚酞不计)
做出猜想 实验过程中,酚酞变质了 猜想一:NaCl猜想二:NaCl、HCl
实验验证 (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想________(填“成立”或“不成立”)。 (2)你认为,在常温下A2溶液测出的pH应________(填“>”、“=”或“<”)7。 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为____________。据此,你认为乙同学的猜想______(填“一”或“二”)成立。
交流反思 (1)甲、乙同学的实验中,反应均涉及到的化学方程式是_______________。 (2)A3溶液未变红,你认为原因是A2溶液中__________较多,加入的NaOH溶液未将其完全中和。 (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。
10.兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究Ⅰ:反应产生的气体是什么?
【作出猜想】小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有________________三种元素,作出如下猜想:
①氢气; ②二氧化碳; ③氢气和二氧化碳。
【实验1】取适量镁条、100 mL Na2CO3溶液于反应装置A中,按图1所示方案进行实验。B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
(1)反应装置A应选用图2中的____(填写序号)。
(2)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是:____________________________________________。
探究Ⅱ:快速产生气体的原因是什么?
【查阅资料】镁与水缓慢反应生成氢气;Na2CO3溶液显碱性,其溶液中除Na+、CO外,还有OH-。
【作出猜想】可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是CO而不是Na+、OH-促进了镁与水的反应。
图3
(1)G中实验的作用是__________________。
(2)试剂X是________________。
探究Ⅲ:反应产生的白色沉淀中是否含有MgCO3
【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO3。试剂Y及实验现象为________________________________________________;该反应的化学方程式为_________________________________________。
【反思交流】有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。
参考答案
1.【提出猜想】Ⅱ. CO2过量
【实验方案】CaCO3+2HCl=== CaCl2+H2O+CO2↑ (1)Na2CO3 (2)无明显现象 (3)AgNO3 产生白色沉淀且沉淀不溶解 AgNO3+HCl=== AgCl↓+HNO3
【交流讨论】浓硫酸
【拓展思考】排水过程中除掉了HCl(或排水法能收集到CO2等合理即可)
2. 【实验一】(1)红 H2SO4+2NaOH=== Na2SO4 + 2H2O (2)过一会儿溶液才变成红色 【实验二】硫酸铜溶液(或CuSO4溶液) 【实验三】(1)三口烧瓶中有白色沉淀出现,气球逐渐膨胀 2NaOH + CO2=== Na2CO3 ↓+ H2O (2)排尽三口烧瓶中的二氧化碳 有新物质生成(合理即可)
3.【猜想假设】(2)溶液中,NaHCO3和NaOH不发生反应 【解释与结论】(1)D (2)BaCO3 2 2 NaHCO3+NaOH=== Na2CO3+H2O (3)(1) 【总结反思】C
4.【提出猜想】Ⅱ.CO2过量【实验方案】CaCO3+2HCl=== CaCl2+H2O+CO2↑(1)Na2CO3(或可溶性碳酸盐等合理即可) (2)无明显现象 (3)AgNO3 产生白色沉淀 AgNO3+HCl=== AgCl↓+HNO3 【交流讨论】浓硫酸(或浓H2SO4) 【拓展思考】排水过程中除掉了HCl(合理即可)
5. (1)如果酚酞溶液已经变质,遇到氢氧化钠溶液不会有先变红的现象 (2)①越大 ②便于观察反应的发生和反应终点 3.5 min (3)取3 mL 3%的氢氧化钠溶液于试管中,加热煮沸后,在液面上方加入植物油,然后在冷却到室温的下方溶液中滴加酚酞溶液,轻轻振荡 无关 (4)使反应充分进行(或加快反应速率) HCl + NaOH === NaCl +H2O
【解析】(1)如果酚酞溶液已经变质,那么遇到氢氧化钠溶液就不会有先变红的现象,刚滴入酚酞时变红色说明酚酞没变质。(2)①由图中数据可得氢氧化钠溶液的溶质质量分数越大,酚酞溶液由红色褪为无色的时间越短;②氢氧化钠和盐酸反应没有明显现象,加入酚酞溶液通过溶液颜色的变化可以判断反应的发生和反应终点;通过图2可得溶质质量分数为4%时,褪色时间约为3.5 min,因此应该把实验的操作时间控制在3.5 min之内。(3)取3 mL 3%的氢氧化钠溶液于试管中,加热煮沸后,在液面上方加入植物油,然后在冷却到室温的下方溶液中滴加酚酞溶液,轻轻振荡,观察到酚酞溶液呈红色,直到5.5 min时溶液才褪色,说明酚酞溶液先变红后褪色与氧气无关。(4)不断搅拌可以加快反应速率或使反应充分进行,反应的化学方程式为HCl+NaOH=== NaCl+H2O。
6. 探究Ⅰ:【作出猜想】碳、氢、氧(或C、H、O) 【实验1】(1)D (2)在B和C装置之间增加干燥装置(合理即可) 探究Ⅱ:【实验2】(1)作对比实验 (2)氢氧化钠溶液(或NaOH溶液) 探究Ⅲ:【实验3】试剂Y是稀盐酸(或稀硫酸);现象为有气泡产生(合理即可) MgCO3+2HCl === MgCl2+H2O+CO2↑(或MgCO3+H2SO4=== MgSO4+H2O+CO2↑,与上空对应)
【解析】探究Ⅰ:【作出猜想】根据题干信息是将镁条放入碳酸钠溶液中产生气体,再结合猜想中的三种气体,可知应填写碳、氢、氧。【实验1】(1)镁和碳酸钠溶液反应不需要加热,且取用的碳酸钠溶液为100 mL,因此应选择锥形瓶做反应容器,故反应装置A应选用图2中的D。(2)当气体通过B装置时,气体中会携带少量的水蒸气,从而对气体燃烧是否有水生成的判断产生干扰,因此需在B和C装置之间增加干燥装置。探究Ⅱ:【实验2】(1)根据【查阅资料】可知镁和水缓慢反应生成氢气,因此G中实验的作用是作对比实验,排除H和I实验中所加试剂中的水对实验的干扰。(2)根据题中结论可知Na+和OH-不能促进镁和水的反应,因此试剂X应能提供钠离子和氢氧根离子,则X是氢氧化钠溶液。探究Ⅲ:【实验3】检验固体中含有碳酸盐,可以加入稀酸,如稀盐酸或稀硫酸,可观察到有气泡产生;该反应是碳酸镁和稀酸反应生成对应的镁盐、水和二氧化碳,据此写出反应的化学方程式。
7. (1)H2O 5%的过氧化氢溶液中含有水 (2)SO
氯化铜溶液(或硝酸铜溶液) Cu2+ (3)将带火星的木条伸入试管中,若木条复燃,说明产生的气体是氧气
(4)质量和化学性质都没改变
8. 【讨论交流】CaCO3+2HCl=== CaCl2+CO2↑+H2O
【做出猜想】小红 【实验验证】AgCl 【实验结论】大于
【反思应用】(1)稀 (2)接触面积
9.
探究环节 甲同学的探究 乙同学的探究
实验验证 (1)不成立
(2)< 浅绿色
二
交流反思 (1)NaOH+HCl=== NaCl+H2O
(2)盐酸(或HCl或氯化氢)
10. 探究Ⅰ:【作出猜想】碳、氢、氧(或C、H、O)
【实验1】(1)D (2)在B和C装置之间增加干燥装置(合理即可)
探究Ⅱ:【实验2】(1)对比(合理即可) (2)氢氧化钠溶液(或NaOH溶液)
探究Ⅲ:【实验3】试剂Y是稀盐酸(或稀硫酸);有气泡产生(合理即可) MgCO3+2HCl === MgCl2+H2O+CO2↑(或MgCO3+H2SO4=== MgSO4+H2O+CO2↑,与上空对应)
(
1
)
1.某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
【提出问题】澄清石灰水为什么没有变浑浊?
【查阅资料】
(1)CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2。
(2)AgCl不溶于稀硝酸。
【提出猜想】
Ⅰ. 石灰水已完全变质Ⅱ. Ⅲ. CO2中混有HCl
【实验方案】
兴趣小组用原药品继续制取CO2,并进行探究。制备CO2的化学方程式为 。
步骤 实验操作 实验现象 结论及化学方程式
(1) 取少量澄清石灰水于试管中,加入 溶液 产生白色沉淀 猜想Ⅰ不成立
(2) 将少量气体通入盛有澄清石灰水的试管中 猜想Ⅱ不成立
(3) 将气体通入盛有 溶液的试管中,再加稀硝酸 猜想Ⅲ成立反应方程式为______
【实验结论】
制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
【交流讨论】
若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和 。
【拓展思考】
回忆课本中收集呼出气体的操作后,同学们尝试用排水法收集一瓶CO2,倒入澄清石灰水后,石灰水变浑浊。你认为该实验成功的原因是 (写一点)。
2.小杨往NaOH溶液中滴加稀硫酸,溶液无明显变化,他和小组同学以“酸与碱能否发生反应”为课题进行了科学探究,请回答下列问题。
【实验一】(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由____色变为无色,该反应的化学方程式为______________________。
(2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到__________________________现象,证明了滴加的稀硫酸过量。
【实验二】按照“证明反应后NaOH消失了”这个角度,同学们又设计了实验二,利用NaOH溶液、CuSO4溶液、稀盐酸同样证明了酸和碱能发生反应,其中试剂丙是______________。
【拓展延伸】CO2通入NaOH溶液中也无明显现象,CO2与NaOH溶液能否发生化学反应呢?小组同学对此继续探究。
【查阅资料】常温下NaOH、Na2CO3在水、乙醇中的溶解性如下表所示:
溶质 溶解性 溶剂 氢氧化钠 碳酸钠
水 极易溶 易溶
乙醇 易溶 微溶
【实验三】
小组同学设计了多角度验证CO2与NaOH溶液反应的实验,如实验三(装置已连接好,气密性良好,止水夹a和b已关闭,部分仪器已略去)。
实验三
【温馨提示】CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
(1)把注射器Ⅰ中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是__________________,写出该反应的化学方程式________________________。
(2)把导管d移出石灰水,打开止水夹a、b,再从导管C端往三口烧瓶中鼓入N2,目的是__________________________。过了一段时间后,先把导管d放入澄清石灰水中,接着关闭止水夹a,再把注射器Ⅱ中的稀盐酸注入三口烧瓶内,观察到三口烧瓶中产生气泡,烧杯中的澄清石灰水变浑浊。此实验从________________角度证明了CO2与NaOH溶液发生了反应。
【总结归纳】对于无明显现象的反应,可以通过改变实验装置,创设新的情境,观察到明显的反应现象,从而判断反应的发生。
3.在某次探究活动中,小明同学往NaHCO3溶液中加入NaOH溶液,未观察到明显现象,即认为两者没有发生化学反应,小亮同学却有疑问。
【提出问题】在溶液中,NaHCO3和NaOH真的不反应吗?
【猜想假设】(1)溶液中,NaHCO3和NaOH发生反应
(2)__________________________
【查阅资料】(1)可溶于水的酸、碱、盐在水中能解离出对应的阳离子和阴离子
(2)部分碱、盐的溶解性表(室温)
阴离子 阳离子 OH- Cl- CO HCO
Na+ 溶 溶 溶 溶
Ba2+ 溶 溶 不 溶
【进行实验】
实验序号 实验操作 实验现象
1 往NaHCO3溶液中加入BaCl2溶液 无明显现象
2 往NaHCO3溶液中加入NaOH溶液 无明显现象
3 将实验1和实验2所得的溶液混合 有沉淀生成
【解释与结论】(1)根据实验1中无明显现象,可得到的结论是________(选填字母编号)。
A. 混合溶液中没有NaCl
B. 混合溶液中没有Ba(HCO3)2
C. 混合溶液中没有NaHCO3
D. 混合溶液中的阴、阳离子不能形成不溶物
(2)实验3中生成的沉淀为________(填化学式),该沉淀中的阴离子只能来源于实验________(选填“1”或“2”)所得到的溶液,则实验________(选填“1”或“2”)必定发生了化学反应,写出该反应的化学方程式____________________________。
(3)依据上述实验及分析,猜想________成立。
【总结反思】两种溶液混合,未观察到明显现象,而化学反应________(选填字母编号)。
A. 一定没发生 B. 一定发生了C. 不一定没发生
4.某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
【提出问题】澄清石灰水为什么没有变浑浊?
【查阅资料】(1)CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2。
(2)AgCl不溶于稀硝酸。
【提出猜想】Ⅰ. 石灰水已完全变质
Ⅱ. __________________
Ⅲ. CO2中混有HCl
【实验方案】兴趣小组用原药品继续制取CO2,并进行探究。制备CO2的化学方程式为____________________________。
步骤 实验操作 实验现象 结论及化学方程式
(1) 取少量澄清石灰水于试管中,加入________溶液 产生白色沉淀 猜想Ⅰ不成立
(2) 将少量气体通入盛有澄清石灰水的试管中 ________ ________ 猜想Ⅱ不成立
(3) 将气体通入盛有________溶液的试管中,再加稀硝酸 ________ ________ 猜想Ⅲ成立。反应方程式为__________________
【实验结论】制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
【交流讨论】若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和________。
【拓展思考】回忆课本中收集呼出气体的操作后,同学们尝试用排水法收集一瓶CO2,倒入澄清石灰水后,石灰水变浑浊。你认为该实验成功的原因是____________________________(写一点)。
5.化学兴趣小组做酸和碱的中和反应时,往NaOH溶液中滴入几滴酚酞溶液,发现溶液刚变红瞬间又褪成无色。讨论并猜想。
图1
猜想一:可能是酚酞溶液变质
猜想二:可能与NaOH溶液的浓度有关
猜想三:可能是酚酞溶液在滴入过程中被O2氧化
……
(1)甲同学认为猜想一是不对的。其理由是________________________________。
(2)取3 mL不同浓度的NaOH溶液,分别滴入3滴酚酞溶液,观察现象。得到NaOH溶液的浓度与酚酞溶液褪色时间关系如图2所示。
图2
①根据图2所示,NaOH溶液溶质的质量分数________,酚酞溶液由红色褪为无色的时间越短。
②做酸和碱的中和反应时,滴加酚酞溶液的目的是____________________。
若用做实验的NaOH溶液溶质的质量分数为4%,完成该实验的操作时间应控制在________之内。
(3)请设计实验,验证猜想三是否正确。
实验操作 实验现象 实验结论
5.5 min酚酞溶液褪色 酚酞溶液先变红后褪色与O2______(选填“有关”或“无关”)
(4)探究酸碱中和反应时,逐滴加入稀盐酸的过程,并不断搅拌的目的是________________,写出该反应的化学方程式________________________。
6.兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究Ⅰ:反应产生的气体是什么?
【作出猜想】小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有__________三种元素,作出如下猜想:
①氢气;②二氧化碳;③氢气和二氧化碳。
【实验1】取适量镁条、100 mL Na2CO3溶液于反应装置A中,按图1所示方案进行实验。B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
(1)反应装置A应选用图2中的________(填写序号)。
(2)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是:__________________________________。
探究Ⅱ:快速产生气体的原因是什么?
【查阅资料】镁与水缓慢反应生成氢气;Na2CO3溶液显碱性,其溶液中除Na+、CO外,还有OH-。
【作出猜想】可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是CO而不是Na+、OH-促进了镁与水的反应。
第2题图3
(1)G中实验的作用是__________________。
(2)试剂X是____________。
探究Ⅲ:反应产生的白色沉淀中是否含有MgCO3
【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO3。试剂Y及实验现象为__________________________;该反应的化学方程式为_______________________。
反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。
7.科学探究很奇妙!在一次实验中,小明不小心把硫酸铜溶液滴加到了盛有5%过氧化氢的溶液中,发现立即有大量气泡产生。硫酸铜溶液中有三种粒子(H2O、SO、Cu2+),小明想知道硫酸铜溶液中的哪种粒子能使双氧水分解的速率加快。请你和小明一起通过下图所示的三个实验完成这次探究活动,并回答有关问题。
你认为最不可能的是哪一种粒子?_________________________________
______________;理由是________________________________。
(2)要证明另外两种粒子能否加快双氧水分解的速率,还需要进行实验②和③:在实验②中加入稀硫酸后,无明显变化,说明__________不起催化作用;在实验③中加入__________________后,会观察到大量气泡,证明起催化作用的是______。
(3)检验实验产生的气体的方法是_________________________________________。
(4)小明如果要确定硫酸铜是催化剂,还需通过实验确认它在化学反应前后_______________________________________。
8.某学习小组同学用图1实验装置来探究鸡蛋壳里
图1
含有CO(以CaCO3的形式存在)的可能性,请你一起参与学习探究。
【讨论交流】同学们讨论后一致认为若鸡蛋壳里含有CO,实验时广口瓶中一定会产生气泡,玻璃片上石灰水会变浑浊,据此写出有气泡生成的化学方程式:____________________。
【进行实验】小明和小红在各自的实验中均看到广口瓶中产生气泡,小明还看到玻璃片上石灰水变浑浊,而小红却未看到。他们很是好奇,于是进一步进行探究。
【提出问题】小红的实验中,玻璃片上石灰水为什么不变浑浊呢?
【做出猜想】小红猜想:可能鸡蛋壳中含有铁等较活泼金属,而不含CO;
小明猜想:可能小红实验所用盐酸中溶质质量分数过大,挥发出HCl气体。
依据所学化学知识和生活常识,你认为________的猜想是不合理的。
【实验验证】小红分别取适量等体积的自己实验中所用的盐酸a和小明实验中所用的盐酸b于2支试管中,试管内各盛有同一鸡蛋壳的碎片,塞上带导管的橡胶塞,并分别将导管伸入AgNO3溶液中,实验过程如图2所示:
图2
实验中,甲、乙两试管内均有气泡产生,同时甲试管中有白色沉淀生成而乙中没有,白色沉淀的化学式是_______。
【实验结论】上述实验说明盐酸a中溶质的质量分数一定________(填“大于”或“小于”)盐酸b中溶质的质量分数,同时也说明了鸡蛋壳中含有CO的可能性。
【反思应用】(1)实验室制备CO2时,最好选择____(填“浓”或“稀”)盐酸。
(2)实验中发现,与相同溶质质量分数的盐酸反应时,鸡蛋壳碎片比大块鸡蛋壳更剧烈,说明增大反应物______________可以加快反应速率。
9.如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据如图实验,请你与甲、乙同学一起完成下列探究:
探究环节 甲同学的探究 乙同学的探究
提出问题 A3溶液为什么不变红? B3溶液中溶质成分是什么?(酚酞不计)
做出猜想 实验过程中,酚酞变质了 猜想一:NaCl猜想二:NaCl、HCl
实验验证 (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想________(填“成立”或“不成立”)。 (2)你认为,在常温下A2溶液测出的pH应________(填“>”、“=”或“<”)7。 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为____________。据此,你认为乙同学的猜想______(填“一”或“二”)成立。
交流反思 (1)甲、乙同学的实验中,反应均涉及到的化学方程式是_______________。 (2)A3溶液未变红,你认为原因是A2溶液中__________较多,加入的NaOH溶液未将其完全中和。 (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。
10.兴趣小组在课外实验中意外发现:将镁条放入Na2CO3溶液中,快速产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究Ⅰ:反应产生的气体是什么?
【作出猜想】小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有________________三种元素,作出如下猜想:
①氢气; ②二氧化碳; ③氢气和二氧化碳。
【实验1】取适量镁条、100 mL Na2CO3溶液于反应装置A中,按图1所示方案进行实验。B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
(1)反应装置A应选用图2中的____(填写序号)。
(2)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是:____________________________________________。
探究Ⅱ:快速产生气体的原因是什么?
【查阅资料】镁与水缓慢反应生成氢气;Na2CO3溶液显碱性,其溶液中除Na+、CO外,还有OH-。
【作出猜想】可能是Na2CO3溶液中的某一种离子促进了镁与水的反应。
【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是CO而不是Na+、OH-促进了镁与水的反应。
图3
(1)G中实验的作用是__________________。
(2)试剂X是________________。
探究Ⅲ:反应产生的白色沉淀中是否含有MgCO3
【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO3。试剂Y及实验现象为________________________________________________;该反应的化学方程式为_________________________________________。
【反思交流】有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。
参考答案
1.【提出猜想】Ⅱ. CO2过量
【实验方案】CaCO3+2HCl=== CaCl2+H2O+CO2↑ (1)Na2CO3 (2)无明显现象 (3)AgNO3 产生白色沉淀且沉淀不溶解 AgNO3+HCl=== AgCl↓+HNO3
【交流讨论】浓硫酸
【拓展思考】排水过程中除掉了HCl(或排水法能收集到CO2等合理即可)
2. 【实验一】(1)红 H2SO4+2NaOH=== Na2SO4 + 2H2O (2)过一会儿溶液才变成红色 【实验二】硫酸铜溶液(或CuSO4溶液) 【实验三】(1)三口烧瓶中有白色沉淀出现,气球逐渐膨胀 2NaOH + CO2=== Na2CO3 ↓+ H2O (2)排尽三口烧瓶中的二氧化碳 有新物质生成(合理即可)
3.【猜想假设】(2)溶液中,NaHCO3和NaOH不发生反应 【解释与结论】(1)D (2)BaCO3 2 2 NaHCO3+NaOH=== Na2CO3+H2O (3)(1) 【总结反思】C
4.【提出猜想】Ⅱ.CO2过量【实验方案】CaCO3+2HCl=== CaCl2+H2O+CO2↑(1)Na2CO3(或可溶性碳酸盐等合理即可) (2)无明显现象 (3)AgNO3 产生白色沉淀 AgNO3+HCl=== AgCl↓+HNO3 【交流讨论】浓硫酸(或浓H2SO4) 【拓展思考】排水过程中除掉了HCl(合理即可)
5. (1)如果酚酞溶液已经变质,遇到氢氧化钠溶液不会有先变红的现象 (2)①越大 ②便于观察反应的发生和反应终点 3.5 min (3)取3 mL 3%的氢氧化钠溶液于试管中,加热煮沸后,在液面上方加入植物油,然后在冷却到室温的下方溶液中滴加酚酞溶液,轻轻振荡 无关 (4)使反应充分进行(或加快反应速率) HCl + NaOH === NaCl +H2O
【解析】(1)如果酚酞溶液已经变质,那么遇到氢氧化钠溶液就不会有先变红的现象,刚滴入酚酞时变红色说明酚酞没变质。(2)①由图中数据可得氢氧化钠溶液的溶质质量分数越大,酚酞溶液由红色褪为无色的时间越短;②氢氧化钠和盐酸反应没有明显现象,加入酚酞溶液通过溶液颜色的变化可以判断反应的发生和反应终点;通过图2可得溶质质量分数为4%时,褪色时间约为3.5 min,因此应该把实验的操作时间控制在3.5 min之内。(3)取3 mL 3%的氢氧化钠溶液于试管中,加热煮沸后,在液面上方加入植物油,然后在冷却到室温的下方溶液中滴加酚酞溶液,轻轻振荡,观察到酚酞溶液呈红色,直到5.5 min时溶液才褪色,说明酚酞溶液先变红后褪色与氧气无关。(4)不断搅拌可以加快反应速率或使反应充分进行,反应的化学方程式为HCl+NaOH=== NaCl+H2O。
6. 探究Ⅰ:【作出猜想】碳、氢、氧(或C、H、O) 【实验1】(1)D (2)在B和C装置之间增加干燥装置(合理即可) 探究Ⅱ:【实验2】(1)作对比实验 (2)氢氧化钠溶液(或NaOH溶液) 探究Ⅲ:【实验3】试剂Y是稀盐酸(或稀硫酸);现象为有气泡产生(合理即可) MgCO3+2HCl === MgCl2+H2O+CO2↑(或MgCO3+H2SO4=== MgSO4+H2O+CO2↑,与上空对应)
【解析】探究Ⅰ:【作出猜想】根据题干信息是将镁条放入碳酸钠溶液中产生气体,再结合猜想中的三种气体,可知应填写碳、氢、氧。【实验1】(1)镁和碳酸钠溶液反应不需要加热,且取用的碳酸钠溶液为100 mL,因此应选择锥形瓶做反应容器,故反应装置A应选用图2中的D。(2)当气体通过B装置时,气体中会携带少量的水蒸气,从而对气体燃烧是否有水生成的判断产生干扰,因此需在B和C装置之间增加干燥装置。探究Ⅱ:【实验2】(1)根据【查阅资料】可知镁和水缓慢反应生成氢气,因此G中实验的作用是作对比实验,排除H和I实验中所加试剂中的水对实验的干扰。(2)根据题中结论可知Na+和OH-不能促进镁和水的反应,因此试剂X应能提供钠离子和氢氧根离子,则X是氢氧化钠溶液。探究Ⅲ:【实验3】检验固体中含有碳酸盐,可以加入稀酸,如稀盐酸或稀硫酸,可观察到有气泡产生;该反应是碳酸镁和稀酸反应生成对应的镁盐、水和二氧化碳,据此写出反应的化学方程式。
7. (1)H2O 5%的过氧化氢溶液中含有水 (2)SO
氯化铜溶液(或硝酸铜溶液) Cu2+ (3)将带火星的木条伸入试管中,若木条复燃,说明产生的气体是氧气
(4)质量和化学性质都没改变
8. 【讨论交流】CaCO3+2HCl=== CaCl2+CO2↑+H2O
【做出猜想】小红 【实验验证】AgCl 【实验结论】大于
【反思应用】(1)稀 (2)接触面积
9.
探究环节 甲同学的探究 乙同学的探究
实验验证 (1)不成立
(2)< 浅绿色
二
交流反思 (1)NaOH+HCl=== NaCl+H2O
(2)盐酸(或HCl或氯化氢)
10. 探究Ⅰ:【作出猜想】碳、氢、氧(或C、H、O)
【实验1】(1)D (2)在B和C装置之间增加干燥装置(合理即可)
探究Ⅱ:【实验2】(1)对比(合理即可) (2)氢氧化钠溶液(或NaOH溶液)
探究Ⅲ:【实验3】试剂Y是稀盐酸(或稀硫酸);有气泡产生(合理即可) MgCO3+2HCl === MgCl2+H2O+CO2↑(或MgCO3+H2SO4=== MgSO4+H2O+CO2↑,与上空对应)
(
1
)
