浙教版科学中考复习专题训练:表格型化学计算【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:表格型化学计算【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 31.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 16:51:46 | ||
图片预览



文档简介
表格型化学计算
1.文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5 g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),发生反应的化学方程式为2HCl+Zn=== ZnCl2+H2↑,记录所加锌粉质量与产生氢气的质量如下表所示:
次数 1 2 3 4
锌粉质量/g 5 5 5 5
氢气质量/g 0.15 0.15 0.1 0
请帮文文计算稀盐酸的溶质质量分数。
2.为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20 g固体混合物置于烧杯中,将100 g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 ① ② ③ ④
加入稀硫酸的质量/g 25 25 25 25
剩余固体的质量/g 16 a 10 10
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为________。
(2)上表中,a的值为________,实验③所得溶液中的溶质是__________________(填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
3.某课外活动小组为测定某不纯锌粒中含锌的质量分数,取来了一些锌粒样品,并取稀硫酸800 g,平均分成4份,将四份不同质量的样品加入到四份稀硫酸中,进行实验(杂质不与稀硫酸反应),结果如下:
实验 1 2 3 4
加入样品的质量/g 6.5 13 19.5 26
生成H2的质量/g 0.16 0.32 0.40 m
(1)上表中m 的数值是________;
(2)试计算这种锌粒样品中锌的质量分数(写出计算过程)。
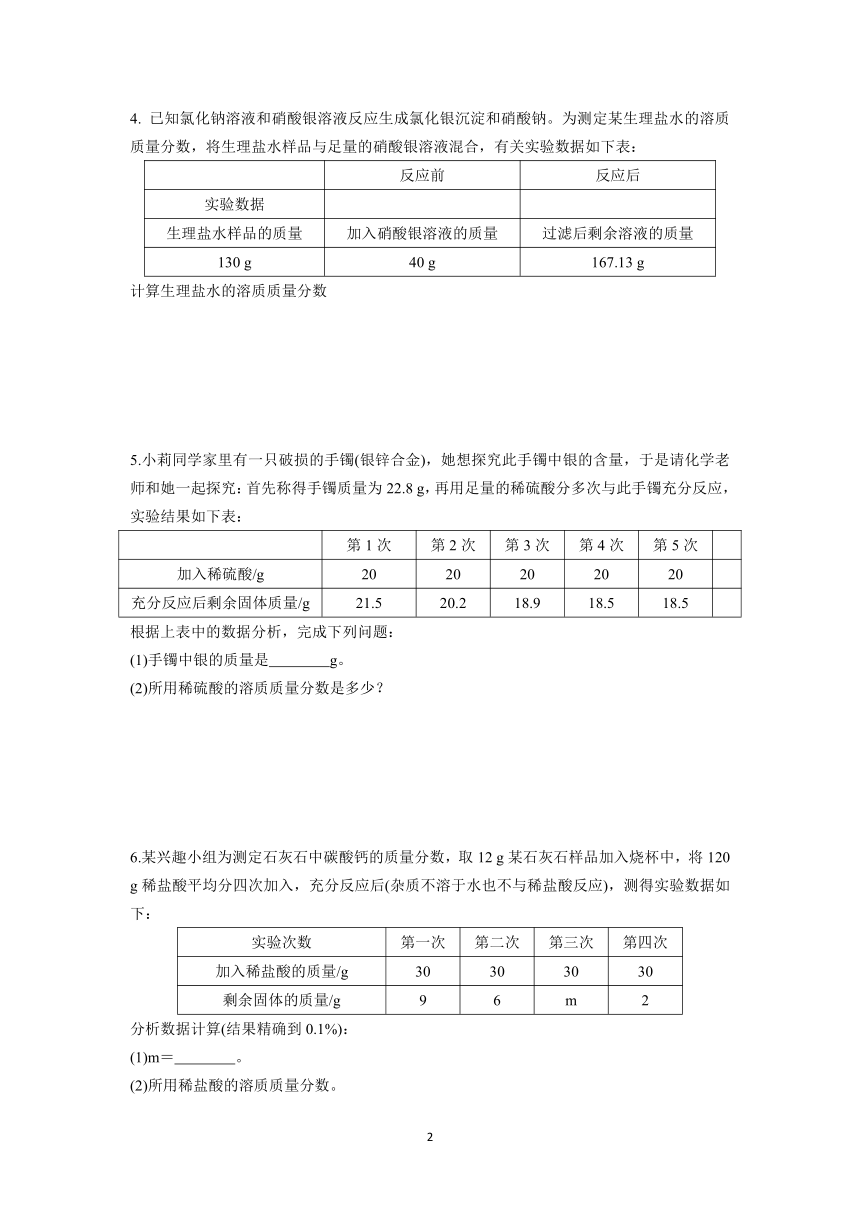
4. 已知氯化钠溶液和硝酸银溶液反应生成氯化银沉淀和硝酸钠。为测定某生理盐水的溶质质量分数,将生理盐水样品与足量的硝酸银溶液混合,有关实验数据如下表:
反应前 反应后
实验数据
生理盐水样品的质量 加入硝酸银溶液的质量 过滤后剩余溶液的质量
130 g 40 g 167.13 g
计算生理盐水的溶质质量分数
5.小莉同学家里有一只破损的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究:首先称得手镯质量为22.8 g,再用足量的稀硫酸分多次与此手镯充分反应,实验结果如下表:
第1次 第2次 第3次 第4次 第5次
加入稀硫酸/g 20 20 20 20 20
充分反应后剩余固体质量/g 21.5 20.2 18.9 18.5 18.5
根据上表中的数据分析,完成下列问题:
(1)手镯中银的质量是 g。
(2)所用稀硫酸的溶质质量分数是多少?
6.某兴趣小组为测定石灰石中碳酸钙的质量分数,取12 g某石灰石样品加入烧杯中,将120 g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数 第一次 第二次 第三次 第四次
加入稀盐酸的质量/g 30 30 30 30
剩余固体的质量/g 9 6 m 2
分析数据计算(结果精确到0.1%):
(1)m= 。
(2)所用稀盐酸的溶质质量分数。
7.碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如下表所示:
烧杯编号 ① ② ③
稀盐酸质量/g 100 200 300
固体混合物质量/g 100 100 100
反应后烧杯中物质的质量/g 195.6 291.2 391.2
试求:
(1)烧杯②中产生CO2的质量为 g。
(2)原固体混合物中SrCO3的质量分数(计算结果精确到0.1%)。
(提示:SrCO3+2HCl=== SrCl2+CO2↑+H2O,Sr的相对原子质量为88)
8.将氯化钠和氯化铁的固体混合物40 g完全溶于101.4 g水中形成溶液,再将100 g一定溶质质量分数的氢氧化钠溶液分5次加入到该溶液中,充分反应后,测得的实验数据如下表所示:
实验次数 1 2 3 4 5
加入氢氧化钠溶液质量/g 20 20 20 20 20
共生成沉淀的质量/g 5.35 10.7 m 21.4 21.4
求:(1)表中m的值为 。
(2)原混合物中氯化铁的质量 。
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(写出计算过程)
9.有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20 g,和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤、干燥后称得其质量为13.5 g。该样品中铜的质量分数为________。
(2)再取三份不同质量的样品,分别加入到三份100 g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
实验序号 ① ② ③
样品的质量/g 10 20 30
生成气体的质量/g 0.1 0.2 0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
10.徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰石样品,把40 g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 剩余固体的质量
第一次加入10 g 3.0 g
第二次加入10 g 2.0 g
第三次加入10 g 1.0 g
第四次加入10 g 0.6 g
请计算:
(1)4.0 g石灰石样品中碳酸钙的质量是______g。
(2)10 g稀盐酸能与________g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
11.某校化学活动小组的同学们欲测定海水中氯化镁的含量,甲、乙、丙三位同学分别进行实验,实验数据列入下表,其中只有一位同学取用的海水样品与所加入的氢氧化钠溶液恰好完全反应。
甲 乙 丙
所取海水样品的质量/g 100 100 150
加入NaOH溶液的质量/g 20 10 10
反应后所得沉淀物的质量/g 0.29 0.29 0.29
观察分析表中数据,回答下列问题:
(1)两溶液恰好完全反应的是________实验。(填“甲”或“乙”或“丙”)
(2)计算海水样品中MgCl2的质量分数。
12.有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200 g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 40 40 40 40 40
生成气体的总质量/g 0.16 m 0.48 0.5 0.5
(1)表中m的值为________。
(2)所用稀盐酸的溶质质量分数为多少?
参考答案
1. 解:稀盐酸中的溶质完全反应后产生的氢气质量为0.15 g+0.15 g+0.1 g=0.4 g
设稀盐酸的溶质质量为x
Zn+2HCl=== ZnCl2+H2↑
73 2
x 0.4 g
=x=14.6 g
该稀盐酸的溶质质量分数为×100%=8%
答:稀盐酸的溶质质量分数为8%。
2. (1)50% (2)12 CuSO4和H2SO4
(3)前两次实验稀硫酸完全反应,而后两次实验稀硫酸都有剩余,所以可利用前两次反应的质量计算稀硫酸的质量分数。其中25 g稀硫酸反应消耗掉的氧化铜的质量为4 g。
解:设25 g稀硫酸中溶质的质量为x
CuO+H2SO4=== CuSO4+H2O
80 98
4 g x
=
x=4.9 g
则所用稀硫酸中溶质的质量分数为×100%=19.6 %
答:该实验所用稀硫酸中溶质的质量分数为19.6%。
3. (1)0.40
(2)解:设13 g锌粒样品中Zn的质量为x
Zn+H2SO4=== ZnSO4+H2↑
65 2
x 0.32 g
=
x=10.4 g
这种锌粒样品中锌的质量分数为×100%=80%
答:这种锌粒样品中锌的质量分数为80%。
4.解:设130 g生理盐水中氯化钠的质量为x
NaCl+AgNO3=== AgCl↓+NaNO3
58.5 143.5
x(130+40-167.13) g
= x=1.17 g
该生理盐水的溶质质量分数为 ×100%=0.9%
5.(1)18.5
(2)解:第一次反应中消耗金属锌的质量为22.8 g-21.5 g=1.3 g
设第一次反应中消耗稀硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
65 98
1.3 g x
= x=1.96 g
所用稀硫酸的溶质质量分数为×100%=9.8%
答:所用稀硫酸的溶质质量分数为9.8%。
6.(1)3
(2)解:分析可知30 g稀盐酸恰好能与石灰石中的3g碳酸钙完全反应。
设第一次参与反应的HCl质量为x
CaCO3+2HCl=== CaCl2+H2O+CO2↑
100 73
3 g x
= x=2.19 g
所用盐酸的溶质质量分数为×100%=7.3%
答:所用稀盐酸的溶质质量分数为7.3%。
7.(1)8.8
(2)解:设100 g固体混合物中SrCO3的质量为x
SrCO3+2HCl=== SrCl2+CO2↑+H2O
148 44
x8.8 g
= x=29.6 g
混合物中SrCO3的质量分数为×100%=29.6%
答:原固体混合物中SrCO3的质量分数为29.6%。
8.(1)16.05
(2)32.5 g
(3)解:设恰好完全反应时生成氯化钠的质量为x
FeCl3+3NaOH=== Fe(OH)3↓+3NaCl
107 175.5
21.4 gx
= x=35.1 g
恰好完全反应时所得溶液的溶质质量分数为×100%=21.3%
答:恰好完全反应时,所得溶液的溶质质量分数为21.3%。
9. (1)67.5% (2)12.25%
10. (1)3.4 (2)1.0 (3)7.3%
11. (1)乙 (2)0.475%
12. (1)0.32 (2)14.6%
(
1
)
1.文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5 g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),发生反应的化学方程式为2HCl+Zn=== ZnCl2+H2↑,记录所加锌粉质量与产生氢气的质量如下表所示:
次数 1 2 3 4
锌粉质量/g 5 5 5 5
氢气质量/g 0.15 0.15 0.1 0
请帮文文计算稀盐酸的溶质质量分数。
2.为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20 g固体混合物置于烧杯中,将100 g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 ① ② ③ ④
加入稀硫酸的质量/g 25 25 25 25
剩余固体的质量/g 16 a 10 10
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为________。
(2)上表中,a的值为________,实验③所得溶液中的溶质是__________________(填化学式)。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
3.某课外活动小组为测定某不纯锌粒中含锌的质量分数,取来了一些锌粒样品,并取稀硫酸800 g,平均分成4份,将四份不同质量的样品加入到四份稀硫酸中,进行实验(杂质不与稀硫酸反应),结果如下:
实验 1 2 3 4
加入样品的质量/g 6.5 13 19.5 26
生成H2的质量/g 0.16 0.32 0.40 m
(1)上表中m 的数值是________;
(2)试计算这种锌粒样品中锌的质量分数(写出计算过程)。
4. 已知氯化钠溶液和硝酸银溶液反应生成氯化银沉淀和硝酸钠。为测定某生理盐水的溶质质量分数,将生理盐水样品与足量的硝酸银溶液混合,有关实验数据如下表:
反应前 反应后
实验数据
生理盐水样品的质量 加入硝酸银溶液的质量 过滤后剩余溶液的质量
130 g 40 g 167.13 g
计算生理盐水的溶质质量分数
5.小莉同学家里有一只破损的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究:首先称得手镯质量为22.8 g,再用足量的稀硫酸分多次与此手镯充分反应,实验结果如下表:
第1次 第2次 第3次 第4次 第5次
加入稀硫酸/g 20 20 20 20 20
充分反应后剩余固体质量/g 21.5 20.2 18.9 18.5 18.5
根据上表中的数据分析,完成下列问题:
(1)手镯中银的质量是 g。
(2)所用稀硫酸的溶质质量分数是多少?
6.某兴趣小组为测定石灰石中碳酸钙的质量分数,取12 g某石灰石样品加入烧杯中,将120 g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数 第一次 第二次 第三次 第四次
加入稀盐酸的质量/g 30 30 30 30
剩余固体的质量/g 9 6 m 2
分析数据计算(结果精确到0.1%):
(1)m= 。
(2)所用稀盐酸的溶质质量分数。
7.碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如下表所示:
烧杯编号 ① ② ③
稀盐酸质量/g 100 200 300
固体混合物质量/g 100 100 100
反应后烧杯中物质的质量/g 195.6 291.2 391.2
试求:
(1)烧杯②中产生CO2的质量为 g。
(2)原固体混合物中SrCO3的质量分数(计算结果精确到0.1%)。
(提示:SrCO3+2HCl=== SrCl2+CO2↑+H2O,Sr的相对原子质量为88)
8.将氯化钠和氯化铁的固体混合物40 g完全溶于101.4 g水中形成溶液,再将100 g一定溶质质量分数的氢氧化钠溶液分5次加入到该溶液中,充分反应后,测得的实验数据如下表所示:
实验次数 1 2 3 4 5
加入氢氧化钠溶液质量/g 20 20 20 20 20
共生成沉淀的质量/g 5.35 10.7 m 21.4 21.4
求:(1)表中m的值为 。
(2)原混合物中氯化铁的质量 。
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(写出计算过程)
9.有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20 g,和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤、干燥后称得其质量为13.5 g。该样品中铜的质量分数为________。
(2)再取三份不同质量的样品,分别加入到三份100 g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
实验序号 ① ② ③
样品的质量/g 10 20 30
生成气体的质量/g 0.1 0.2 0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
10.徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰石样品,把40 g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 剩余固体的质量
第一次加入10 g 3.0 g
第二次加入10 g 2.0 g
第三次加入10 g 1.0 g
第四次加入10 g 0.6 g
请计算:
(1)4.0 g石灰石样品中碳酸钙的质量是______g。
(2)10 g稀盐酸能与________g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
11.某校化学活动小组的同学们欲测定海水中氯化镁的含量,甲、乙、丙三位同学分别进行实验,实验数据列入下表,其中只有一位同学取用的海水样品与所加入的氢氧化钠溶液恰好完全反应。
甲 乙 丙
所取海水样品的质量/g 100 100 150
加入NaOH溶液的质量/g 20 10 10
反应后所得沉淀物的质量/g 0.29 0.29 0.29
观察分析表中数据,回答下列问题:
(1)两溶液恰好完全反应的是________实验。(填“甲”或“乙”或“丙”)
(2)计算海水样品中MgCl2的质量分数。
12.有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200 g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 40 40 40 40 40
生成气体的总质量/g 0.16 m 0.48 0.5 0.5
(1)表中m的值为________。
(2)所用稀盐酸的溶质质量分数为多少?
参考答案
1. 解:稀盐酸中的溶质完全反应后产生的氢气质量为0.15 g+0.15 g+0.1 g=0.4 g
设稀盐酸的溶质质量为x
Zn+2HCl=== ZnCl2+H2↑
73 2
x 0.4 g
=x=14.6 g
该稀盐酸的溶质质量分数为×100%=8%
答:稀盐酸的溶质质量分数为8%。
2. (1)50% (2)12 CuSO4和H2SO4
(3)前两次实验稀硫酸完全反应,而后两次实验稀硫酸都有剩余,所以可利用前两次反应的质量计算稀硫酸的质量分数。其中25 g稀硫酸反应消耗掉的氧化铜的质量为4 g。
解:设25 g稀硫酸中溶质的质量为x
CuO+H2SO4=== CuSO4+H2O
80 98
4 g x
=
x=4.9 g
则所用稀硫酸中溶质的质量分数为×100%=19.6 %
答:该实验所用稀硫酸中溶质的质量分数为19.6%。
3. (1)0.40
(2)解:设13 g锌粒样品中Zn的质量为x
Zn+H2SO4=== ZnSO4+H2↑
65 2
x 0.32 g
=
x=10.4 g
这种锌粒样品中锌的质量分数为×100%=80%
答:这种锌粒样品中锌的质量分数为80%。
4.解:设130 g生理盐水中氯化钠的质量为x
NaCl+AgNO3=== AgCl↓+NaNO3
58.5 143.5
x(130+40-167.13) g
= x=1.17 g
该生理盐水的溶质质量分数为 ×100%=0.9%
5.(1)18.5
(2)解:第一次反应中消耗金属锌的质量为22.8 g-21.5 g=1.3 g
设第一次反应中消耗稀硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
65 98
1.3 g x
= x=1.96 g
所用稀硫酸的溶质质量分数为×100%=9.8%
答:所用稀硫酸的溶质质量分数为9.8%。
6.(1)3
(2)解:分析可知30 g稀盐酸恰好能与石灰石中的3g碳酸钙完全反应。
设第一次参与反应的HCl质量为x
CaCO3+2HCl=== CaCl2+H2O+CO2↑
100 73
3 g x
= x=2.19 g
所用盐酸的溶质质量分数为×100%=7.3%
答:所用稀盐酸的溶质质量分数为7.3%。
7.(1)8.8
(2)解:设100 g固体混合物中SrCO3的质量为x
SrCO3+2HCl=== SrCl2+CO2↑+H2O
148 44
x8.8 g
= x=29.6 g
混合物中SrCO3的质量分数为×100%=29.6%
答:原固体混合物中SrCO3的质量分数为29.6%。
8.(1)16.05
(2)32.5 g
(3)解:设恰好完全反应时生成氯化钠的质量为x
FeCl3+3NaOH=== Fe(OH)3↓+3NaCl
107 175.5
21.4 gx
= x=35.1 g
恰好完全反应时所得溶液的溶质质量分数为×100%=21.3%
答:恰好完全反应时,所得溶液的溶质质量分数为21.3%。
9. (1)67.5% (2)12.25%
10. (1)3.4 (2)1.0 (3)7.3%
11. (1)乙 (2)0.475%
12. (1)0.32 (2)14.6%
(
1
)
