浙教版科学中考复习专题训练:实验操作型化学计算【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:实验操作型化学计算【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 60.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 16:55:42 | ||
图片预览


文档简介
实验操作型化学计算
1.食醋中醋酸(CH3COOH)的质量分数,按国家标准应≥3.50%,某兴趣小组为测定某品牌食醋的醋酸含量,进行如图所示的实验。
(反应方程式Na2CO3+2CH3COOH=== 2CH3COONa+CO2↑+H2O,其他物质不参与反应)
(1)反应后生成CO2的质量为________ g。
(2)求100 g该市售食醋中的醋酸质量,并说明该食醋是否符合国家标准。
2.请你仔细分析如图所示的实验过程和提供的数据,并进行计算。
(反应的化学方程式为Fe+2HCl=== FeCl2+H2↑)
(1)生成氢气________ g;
(2)反应后所得溶液中溶质的质量分数是多少?(写出计算过程,精确到0.1%)。
3.兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6 g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160 g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合如图计算:
(1)该合金样品中铁的质量分数。(计算结果精确至0.1%)
(2)所得固体的质量a为多少克?
(3)向不饱和滤液中加入多少克水,能得到5%的硫酸亚铁溶液,用于缺铁花卉的营养液。[(2)(3)中计算结果精确至0.1 g]
4.根据如图所示的实验过程和提供的数据进行计算:
(1)原混合物中NaCl的质量(要求写出计算过程)。
(2)AgNO3溶液溶质质量分数(精确到0.1%)。
5.厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。
计算:该食用碱中碳酸钠的质量分数是多少?(计算结果精确至0.1%)
6. 某兴趣小组的同学在实验室发现一瓶久置过氧化氢溶液,溶质质量分数标明为10%。为探究该瓶过氧化氢溶液的实际溶质质量分数,进行如下实验:取34.0 g过氧化氢溶液放入盛有2 g二氧化锰固体的烧杯中,静置至质量不再改变,测得相关实验数据如图:
(1)二氧化锰的作用是________。
(2)过氧化氢溶液中溶质的质量分数是多少?
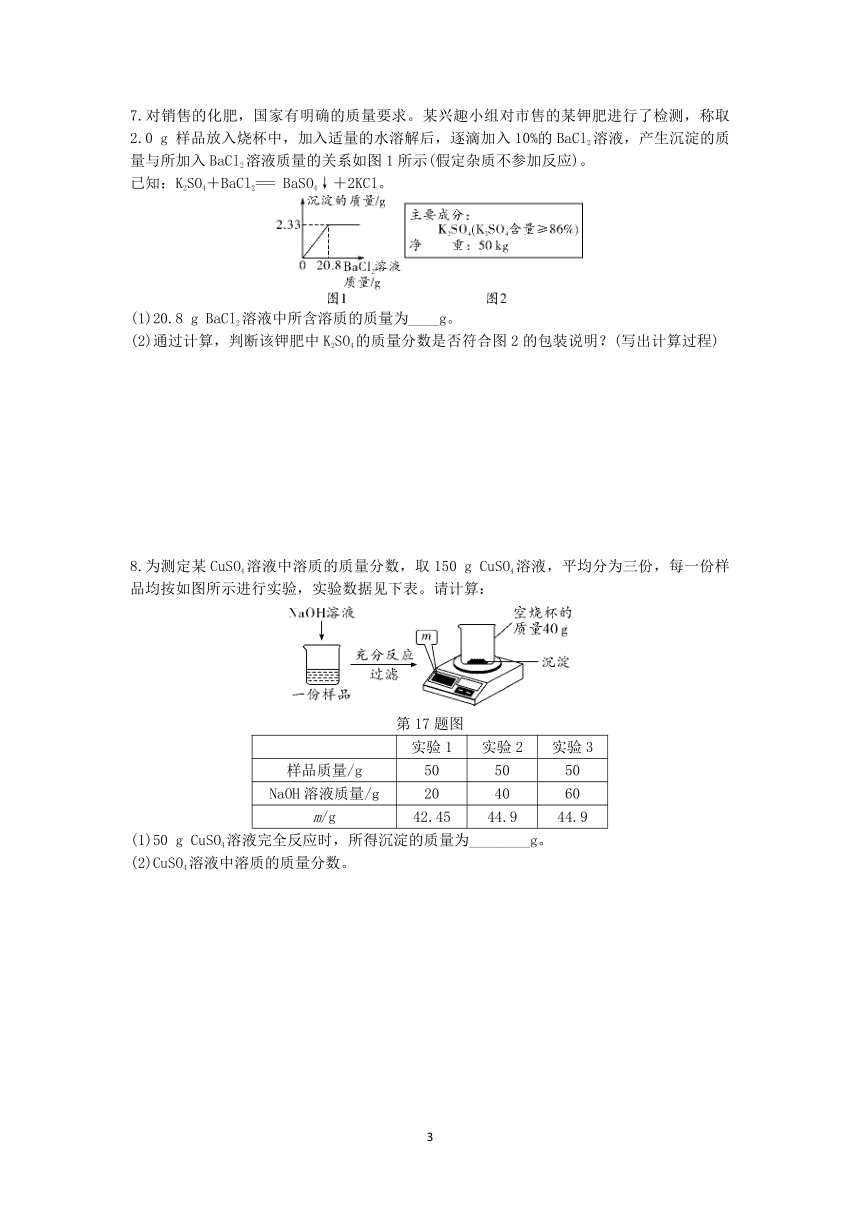
7.对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0 g 样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2=== BaSO4↓+2KCl。
(1)20.8 g BaCl2溶液中所含溶质的质量为____g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明?(写出计算过程)
8.为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
第17题图
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 42.45 44.9 44.9
(1)50 g CuSO4溶液完全反应时,所得沉淀的质量为________g。
(2)CuSO4溶液中溶质的质量分数。
9.某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下:
请回答下列问题:
(1)滤液可作化肥使用,你认为它属于________肥。
(2)该同学制得氧气的质量________g。
(3)计算滤液中溶质质量分数(写出计算过程)。
10.另取一定量CuSO4溶液,完成下列实验。利用数据,计算无色溶液的溶质质量分数。(写出计算过程,滴入的酚酞溶液质量忽略不计。)
参考答案
1. (1)1.65
(2)解:设100 g该市售食醋中醋酸的质量为x
Na2CO3+2CH3COOH=== 2CH3COONa+CO2↑+H2O
120 44
x 1.65 g
=x=4.5 g
×100%=4.5% 该食醋符合国家标准
答:100 g该市售食醋中的醋酸质量为4.5 g,质量分数为4.5%,该食醋符合国家标准。
2. (1)0.4
(2)解:设反应后生成氯化亚铁的质量为x
Fe + 2HCl=== FeCl2 + H2↑
56 127
11.2 g x
= x=25.4 g
反应后所得溶液中溶质的质量分数为×100%=12.7%
答:反应后所得溶液中溶质的质量分数是12.7%。
【解析】(1)设反应后生成氢气的质量为y
Fe + 2HCl=== FeCl2 + H2↑
56 2
11.2 g y
=y=0.4 g
3.解:设样品中铁的质量为x,生成铜的质量为y,生成硫酸亚铁的质量为z
Fe+CuSO4=== FeSO4+Cu
56 160 152 64
x 160 g×10% yz
= x=5.6 g
= y=6.4 g
= z=15.2 g
(1)样品中含铁的质量分数=×100%≈93.3%
(2)a=6.4 g+(6 g-5.6 g)=6.8 g
(3)设要得到5%的硫酸亚铁溶液,需要向不饱和滤液中加入水的质量为m
×100%=5%
m=144.8 g
答:(1)合金样品中铁的质量分数约为93.3%;(2)所得固体的质量a为6.8 g;(3)向不饱和溶液中加入144.8 g水能得到5%的硫酸亚铁溶液。
4.(1)解:设原混合物中NaCl的质量为x,参加反应的硝酸银的质量为y
NaCl+AgNO3 === AgCl↓+NaNO3
58.5 170 143.5
x y 28.7 g
= x=11.7 g
= y=34 g
(2)加入硝酸银溶液的质量为170 g+28.7 g-28.7 g-50 g=120 g
AgNO3溶液的溶质质量分数为×100%≈28.3%
答:(1)原混合物中NaCl的质量为11.7 g;(2)AgNO3溶液的溶质质量分数约为28.3%。
5.88.3%
6. (1)加快反应速率 (2)5%
7. (1)2.08 (2)符合包装说明
8. (1)4.9 (2)16%
9. (1)钾(或K) (2)4.8 (3)14.9%
10. 2.84%
(
1
)
1.食醋中醋酸(CH3COOH)的质量分数,按国家标准应≥3.50%,某兴趣小组为测定某品牌食醋的醋酸含量,进行如图所示的实验。
(反应方程式Na2CO3+2CH3COOH=== 2CH3COONa+CO2↑+H2O,其他物质不参与反应)
(1)反应后生成CO2的质量为________ g。
(2)求100 g该市售食醋中的醋酸质量,并说明该食醋是否符合国家标准。
2.请你仔细分析如图所示的实验过程和提供的数据,并进行计算。
(反应的化学方程式为Fe+2HCl=== FeCl2+H2↑)
(1)生成氢气________ g;
(2)反应后所得溶液中溶质的质量分数是多少?(写出计算过程,精确到0.1%)。
3.兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6 g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160 g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合如图计算:
(1)该合金样品中铁的质量分数。(计算结果精确至0.1%)
(2)所得固体的质量a为多少克?
(3)向不饱和滤液中加入多少克水,能得到5%的硫酸亚铁溶液,用于缺铁花卉的营养液。[(2)(3)中计算结果精确至0.1 g]
4.根据如图所示的实验过程和提供的数据进行计算:
(1)原混合物中NaCl的质量(要求写出计算过程)。
(2)AgNO3溶液溶质质量分数(精确到0.1%)。
5.厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。
计算:该食用碱中碳酸钠的质量分数是多少?(计算结果精确至0.1%)
6. 某兴趣小组的同学在实验室发现一瓶久置过氧化氢溶液,溶质质量分数标明为10%。为探究该瓶过氧化氢溶液的实际溶质质量分数,进行如下实验:取34.0 g过氧化氢溶液放入盛有2 g二氧化锰固体的烧杯中,静置至质量不再改变,测得相关实验数据如图:
(1)二氧化锰的作用是________。
(2)过氧化氢溶液中溶质的质量分数是多少?
7.对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0 g 样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2=== BaSO4↓+2KCl。
(1)20.8 g BaCl2溶液中所含溶质的质量为____g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明?(写出计算过程)
8.为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
第17题图
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 42.45 44.9 44.9
(1)50 g CuSO4溶液完全反应时,所得沉淀的质量为________g。
(2)CuSO4溶液中溶质的质量分数。
9.某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下:
请回答下列问题:
(1)滤液可作化肥使用,你认为它属于________肥。
(2)该同学制得氧气的质量________g。
(3)计算滤液中溶质质量分数(写出计算过程)。
10.另取一定量CuSO4溶液,完成下列实验。利用数据,计算无色溶液的溶质质量分数。(写出计算过程,滴入的酚酞溶液质量忽略不计。)
参考答案
1. (1)1.65
(2)解:设100 g该市售食醋中醋酸的质量为x
Na2CO3+2CH3COOH=== 2CH3COONa+CO2↑+H2O
120 44
x 1.65 g
=x=4.5 g
×100%=4.5% 该食醋符合国家标准
答:100 g该市售食醋中的醋酸质量为4.5 g,质量分数为4.5%,该食醋符合国家标准。
2. (1)0.4
(2)解:设反应后生成氯化亚铁的质量为x
Fe + 2HCl=== FeCl2 + H2↑
56 127
11.2 g x
= x=25.4 g
反应后所得溶液中溶质的质量分数为×100%=12.7%
答:反应后所得溶液中溶质的质量分数是12.7%。
【解析】(1)设反应后生成氢气的质量为y
Fe + 2HCl=== FeCl2 + H2↑
56 2
11.2 g y
=y=0.4 g
3.解:设样品中铁的质量为x,生成铜的质量为y,生成硫酸亚铁的质量为z
Fe+CuSO4=== FeSO4+Cu
56 160 152 64
x 160 g×10% yz
= x=5.6 g
= y=6.4 g
= z=15.2 g
(1)样品中含铁的质量分数=×100%≈93.3%
(2)a=6.4 g+(6 g-5.6 g)=6.8 g
(3)设要得到5%的硫酸亚铁溶液,需要向不饱和滤液中加入水的质量为m
×100%=5%
m=144.8 g
答:(1)合金样品中铁的质量分数约为93.3%;(2)所得固体的质量a为6.8 g;(3)向不饱和溶液中加入144.8 g水能得到5%的硫酸亚铁溶液。
4.(1)解:设原混合物中NaCl的质量为x,参加反应的硝酸银的质量为y
NaCl+AgNO3 === AgCl↓+NaNO3
58.5 170 143.5
x y 28.7 g
= x=11.7 g
= y=34 g
(2)加入硝酸银溶液的质量为170 g+28.7 g-28.7 g-50 g=120 g
AgNO3溶液的溶质质量分数为×100%≈28.3%
答:(1)原混合物中NaCl的质量为11.7 g;(2)AgNO3溶液的溶质质量分数约为28.3%。
5.88.3%
6. (1)加快反应速率 (2)5%
7. (1)2.08 (2)符合包装说明
8. (1)4.9 (2)16%
9. (1)钾(或K) (2)4.8 (3)14.9%
10. 2.84%
(
1
)
