浙教版科学中考复习专题训练:物质分离、提纯流程图分析【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:物质分离、提纯流程图分析【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 78.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 16:57:11 | ||
图片预览


文档简介
物质分离、提纯流程图分析
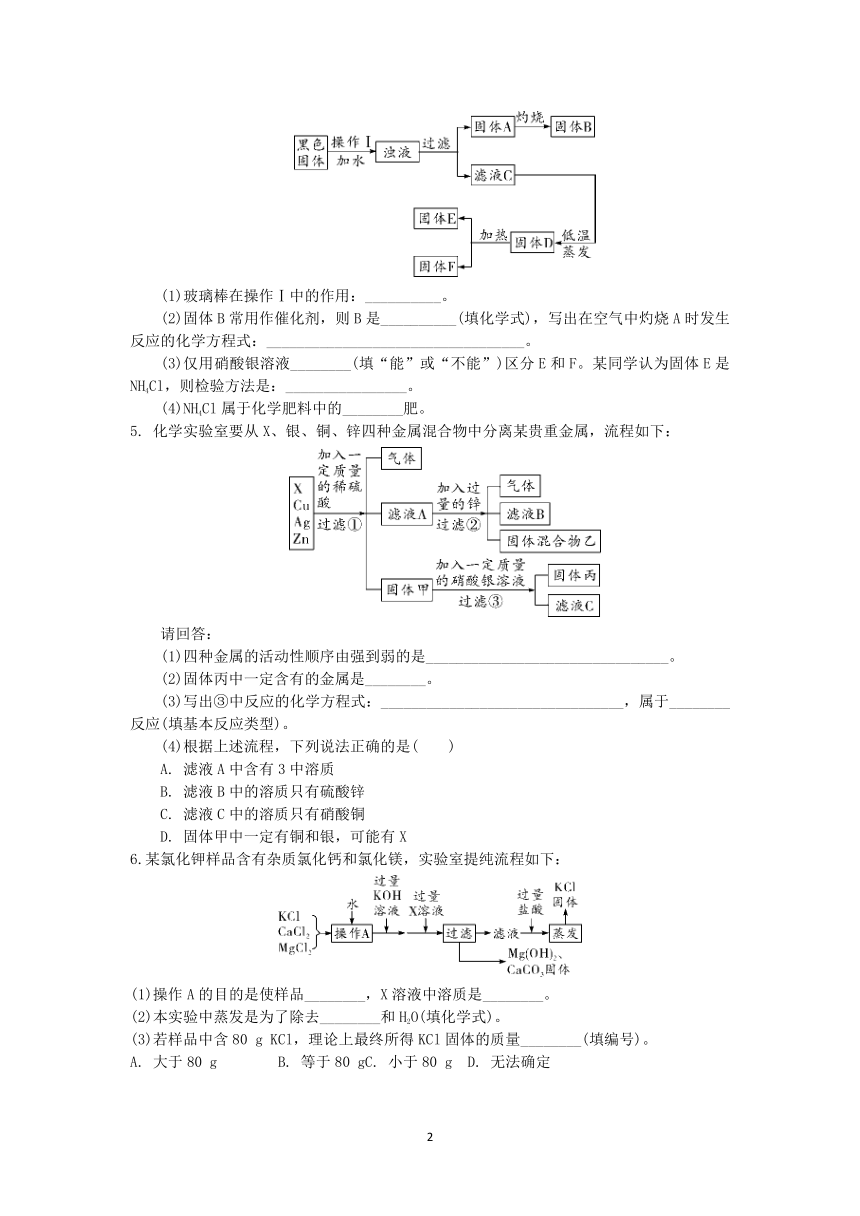
1.用氯酸钾和二氧化锰制备氧气时,二氧化锰在反应中的作用是__________。利用下列流程分离并回收充分反应后的剩余固体,请回答下列问题。
①操作m的名称是__________。操作m和操作n中都用到的玻璃仪器是____________,操作m中该仪器的作用是__________。
2. 从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
反应池Ⅰ中用硝酸不用稀硫酸的主要原因是______________________。
(2)反应池Ⅱ中加入氨水的目的是____________________________。
(3)反应池Ⅲ中生成碳酸钙的化学方程式是______________________________。
(4)过滤Ⅱ中所得滤液在农业生产中的一种用途是________________。
3.某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,分离A、B的实验操作名称是______,试剂a是________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是________(双选,填序号)。
A. NaOH溶液 B. CaCl2溶液
C. NaCl溶液 D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_________________________________________。
(4)要达到预期的目的,还需要改进的方法为___________________________。
4. 废干电池内的黑色固体含有MnO2、ZnCl2、NH4Cl、C(少量)等物质。化学小组欲通过以下流程分离并回收部分物质。据图回答相关问题:
(1)玻璃棒在操作Ⅰ中的作用:__________。
(2)固体B常用作催化剂,则B是__________(填化学式),写出在空气中灼烧A时发生反应的化学方程式:__________________________________。
(3)仅用硝酸银溶液________(填“能”或“不能”)区分E和F。某同学认为固体E是NH4Cl,则检验方法是:________________。
(4)NH4Cl属于化学肥料中的________肥。
5. 化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属,流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是________________________________。
(2)固体丙中一定含有的金属是________。
(3)写出③中反应的化学方程式:________________________________,属于________反应(填基本反应类型)。
(4)根据上述流程,下列说法正确的是( )
A. 滤液A中含有3中溶质
B. 滤液B中的溶质只有硫酸锌
C. 滤液C中的溶质只有硝酸铜
D. 固体甲中一定有铜和银,可能有X
6.某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:
(1)操作A的目的是使样品________,X溶液中溶质是________。
(2)本实验中蒸发是为了除去________和H2O(填化学式)。
(3)若样品中含80 g KCl,理论上最终所得KCl固体的质量________(填编号)。
A. 大于80 g B. 等于80 gC. 小于80 g D. 无法确定
7.某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)试剂a是____________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是________(双选,填序号)。
A. NaOH溶液 B. CaCl2溶液C. NaCl溶液 D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_____________________________________________。
(4)要达到预期的目的,还需要改进的方法为_____________________________________。
8. 为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下:
请根据以上流程图中的信息,回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是___________________________________________。
(2)步骤④中加过量碳酸钾溶液的目的是_______________________。
(3)此设计方案是否严谨?并说明理由___________________________________。
9.为了将混有硫酸钠的氯化钠提纯得到纯净的氯化钠固体,某小组设计了如下流程:
(1)操作①中玻璃棒的作用是 。
(2)操作②结束后,如何判断硫酸钠已除尽_______________________________。
(3)此方案是否严谨,并说明理由 。
10.某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
根据流程图回答:
(1)操作Ⅰ的目的是 ,加入的试剂A是 (填化学式)。
(2)写出NaOH与杂质反应的化学方程式:_______________________________。
(3)加入过量试剂B的目的是:______________________________。
11.如图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳酸钙的实验流程。请回答下列问题:
已知:①SiO2不溶于水也不溶于酸
②氨水呈碱性,与盐酸反应的化学方程式为:
NH3·H2O+HCl === NH4Cl+H2O
(1)稀盐酸不能用稀硫酸代替,原因是 。
(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)写出滤液A中加氨水生成Fe(OH)3的化学方程式________________________。
(4)滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为 。
12. 某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,试剂a是 。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是 (双选,填序号)。
A. NaOH溶液
B. CaCl2溶液
C. NaCl溶液
D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_____________ 。
(4)要达到预期的目的,还需要改进的方法为__________ 。
13.某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下。(氯化钾溶解度受温度影响较小)
(1)沉淀a是 。
(2)操作Ⅰ是 。
①冷却热饱和溶液②蒸发结晶
(3)若KCl固体样品中还含有少量杂质K2SO4,小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是 。
14.从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2。从该矿物中提取KCl的流程如图:
回答下列问题:
(1)滤渣Ⅰ的主要成分是 。
(2)Y溶液中溶质的化学式为 。
(3)向滤液Ⅱ中加入过量盐酸的目的是 。
(4)蒸发溶液得到KCl固体的过程中,要用玻璃棒不断搅拌,目的是 。
参考答案
1. (3)催化作用 ①过滤 玻璃棒 引流
2. (1) 稀硫酸与大理石的主要成分碳酸钙反应生成微溶于水的硫酸钙会覆盖在大理石表面,阻碍反应的进行 (2)调节pH,除去溶液中的铁离子(3)Ca(NO3)2+(NH4)2CO3=== CaCO3↓+2NH4NO3(4)作氮肥
3. (1)过滤 K2CO3溶液 (2)BD(3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)向滤液A中加入适量的稀盐酸(或其他合理答案)
4. (1)搅拌,加速溶解 (2)MnO2 C+O2 CO2(3)不能 取少量E加入熟石灰研磨,若有刺激性气味的气体产生,则E为NH4Cl (4)氮
5. (1)Zn、X、Cu、Ag (2)Ag (3)Cu+2AgNO3=== Cu(NO3)2+2Ag 置换 (4)AB
6. (1)充分溶解 碳酸钾(或K2CO3) (2)HCl (3)A
7. (1)K2CO3溶液 (2)BD (3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)加入过量试剂a改为加入适量试剂a(或其他合理答案)
8. (1)加热 (2)除去氯化钙和过量的氯化钡 (3)不严谨。因为没有除去过量的碳酸钾(或煮沸后的溶液中仍含有碳酸钾)
9. (1)搅拌,加速溶解 (2)取少量上层清液于试管中,滴加氯化钡溶液,若没有沉淀生成,则证明硫酸钠已除尽
(3)不严谨,因为没有除去过量的碳酸钠
10. (1)过滤除去食盐中的不溶性杂质沙土 Na2CO3 (2)2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓ (3)保证过量的NaOH和Na2CO3都被除去
11. (1)稀硫酸会和大理石中的碳酸钙反应生成微溶于水的硫酸钙覆盖在大理石表面,会阻碍反应的进行
(2)漏斗 (3)FeCl3+3NH3·H2O=== Fe(OH)3↓+3NH4Cl (4)(NH4)2CO3
12. (1)K2CO3溶液 (2)BD (3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)加入过量试剂a改为适量试剂a(合理即可)
13. (1)碳酸钙(或CaCO3) (2)② (3)硝酸钾和硝酸钡
14. (1)Mg(OH)2、BaSO4 (2)K2CO3 (3)除去溶液中过量的碳酸钾和生成的氢氧化钾 (4)防止因局部温度过高而造成液滴飞溅
(
1
)
1.用氯酸钾和二氧化锰制备氧气时,二氧化锰在反应中的作用是__________。利用下列流程分离并回收充分反应后的剩余固体,请回答下列问题。
①操作m的名称是__________。操作m和操作n中都用到的玻璃仪器是____________,操作m中该仪器的作用是__________。
2. 从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
反应池Ⅰ中用硝酸不用稀硫酸的主要原因是______________________。
(2)反应池Ⅱ中加入氨水的目的是____________________________。
(3)反应池Ⅲ中生成碳酸钙的化学方程式是______________________________。
(4)过滤Ⅱ中所得滤液在农业生产中的一种用途是________________。
3.某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,分离A、B的实验操作名称是______,试剂a是________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是________(双选,填序号)。
A. NaOH溶液 B. CaCl2溶液
C. NaCl溶液 D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_________________________________________。
(4)要达到预期的目的,还需要改进的方法为___________________________。
4. 废干电池内的黑色固体含有MnO2、ZnCl2、NH4Cl、C(少量)等物质。化学小组欲通过以下流程分离并回收部分物质。据图回答相关问题:
(1)玻璃棒在操作Ⅰ中的作用:__________。
(2)固体B常用作催化剂,则B是__________(填化学式),写出在空气中灼烧A时发生反应的化学方程式:__________________________________。
(3)仅用硝酸银溶液________(填“能”或“不能”)区分E和F。某同学认为固体E是NH4Cl,则检验方法是:________________。
(4)NH4Cl属于化学肥料中的________肥。
5. 化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属,流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是________________________________。
(2)固体丙中一定含有的金属是________。
(3)写出③中反应的化学方程式:________________________________,属于________反应(填基本反应类型)。
(4)根据上述流程,下列说法正确的是( )
A. 滤液A中含有3中溶质
B. 滤液B中的溶质只有硫酸锌
C. 滤液C中的溶质只有硝酸铜
D. 固体甲中一定有铜和银,可能有X
6.某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:
(1)操作A的目的是使样品________,X溶液中溶质是________。
(2)本实验中蒸发是为了除去________和H2O(填化学式)。
(3)若样品中含80 g KCl,理论上最终所得KCl固体的质量________(填编号)。
A. 大于80 g B. 等于80 gC. 小于80 g D. 无法确定
7.某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)试剂a是____________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是________(双选,填序号)。
A. NaOH溶液 B. CaCl2溶液C. NaCl溶液 D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_____________________________________________。
(4)要达到预期的目的,还需要改进的方法为_____________________________________。
8. 为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下:
请根据以上流程图中的信息,回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是___________________________________________。
(2)步骤④中加过量碳酸钾溶液的目的是_______________________。
(3)此设计方案是否严谨?并说明理由___________________________________。
9.为了将混有硫酸钠的氯化钠提纯得到纯净的氯化钠固体,某小组设计了如下流程:
(1)操作①中玻璃棒的作用是 。
(2)操作②结束后,如何判断硫酸钠已除尽_______________________________。
(3)此方案是否严谨,并说明理由 。
10.某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
根据流程图回答:
(1)操作Ⅰ的目的是 ,加入的试剂A是 (填化学式)。
(2)写出NaOH与杂质反应的化学方程式:_______________________________。
(3)加入过量试剂B的目的是:______________________________。
11.如图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳酸钙的实验流程。请回答下列问题:
已知:①SiO2不溶于水也不溶于酸
②氨水呈碱性,与盐酸反应的化学方程式为:
NH3·H2O+HCl === NH4Cl+H2O
(1)稀盐酸不能用稀硫酸代替,原因是 。
(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)写出滤液A中加氨水生成Fe(OH)3的化学方程式________________________。
(4)滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为 。
12. 某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,试剂a是 。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是 (双选,填序号)。
A. NaOH溶液
B. CaCl2溶液
C. NaCl溶液
D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_____________ 。
(4)要达到预期的目的,还需要改进的方法为__________ 。
13.某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下。(氯化钾溶解度受温度影响较小)
(1)沉淀a是 。
(2)操作Ⅰ是 。
①冷却热饱和溶液②蒸发结晶
(3)若KCl固体样品中还含有少量杂质K2SO4,小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是 。
14.从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2。从该矿物中提取KCl的流程如图:
回答下列问题:
(1)滤渣Ⅰ的主要成分是 。
(2)Y溶液中溶质的化学式为 。
(3)向滤液Ⅱ中加入过量盐酸的目的是 。
(4)蒸发溶液得到KCl固体的过程中,要用玻璃棒不断搅拌,目的是 。
参考答案
1. (3)催化作用 ①过滤 玻璃棒 引流
2. (1) 稀硫酸与大理石的主要成分碳酸钙反应生成微溶于水的硫酸钙会覆盖在大理石表面,阻碍反应的进行 (2)调节pH,除去溶液中的铁离子(3)Ca(NO3)2+(NH4)2CO3=== CaCO3↓+2NH4NO3(4)作氮肥
3. (1)过滤 K2CO3溶液 (2)BD(3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)向滤液A中加入适量的稀盐酸(或其他合理答案)
4. (1)搅拌,加速溶解 (2)MnO2 C+O2 CO2(3)不能 取少量E加入熟石灰研磨,若有刺激性气味的气体产生,则E为NH4Cl (4)氮
5. (1)Zn、X、Cu、Ag (2)Ag (3)Cu+2AgNO3=== Cu(NO3)2+2Ag 置换 (4)AB
6. (1)充分溶解 碳酸钾(或K2CO3) (2)HCl (3)A
7. (1)K2CO3溶液 (2)BD (3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)加入过量试剂a改为加入适量试剂a(或其他合理答案)
8. (1)加热 (2)除去氯化钙和过量的氯化钡 (3)不严谨。因为没有除去过量的碳酸钾(或煮沸后的溶液中仍含有碳酸钾)
9. (1)搅拌,加速溶解 (2)取少量上层清液于试管中,滴加氯化钡溶液,若没有沉淀生成,则证明硫酸钠已除尽
(3)不严谨,因为没有除去过量的碳酸钠
10. (1)过滤除去食盐中的不溶性杂质沙土 Na2CO3 (2)2NaOH+MgCl2=== 2NaCl+Mg(OH)2↓ (3)保证过量的NaOH和Na2CO3都被除去
11. (1)稀硫酸会和大理石中的碳酸钙反应生成微溶于水的硫酸钙覆盖在大理石表面,会阻碍反应的进行
(2)漏斗 (3)FeCl3+3NH3·H2O=== Fe(OH)3↓+3NH4Cl (4)(NH4)2CO3
12. (1)K2CO3溶液 (2)BD (3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)加入过量试剂a改为适量试剂a(合理即可)
13. (1)碳酸钙(或CaCO3) (2)② (3)硝酸钾和硝酸钡
14. (1)Mg(OH)2、BaSO4 (2)K2CO3 (3)除去溶液中过量的碳酸钾和生成的氢氧化钾 (4)防止因局部温度过高而造成液滴飞溅
(
1
)
