浙教版科学中考复习专题训练:有关控制变量法的探究【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:有关控制变量法的探究【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 316.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-11 17:00:15 | ||
图片预览



文档简介
有关控制变量法的探究
1. 小海同学在学习了燃烧与燃料的有关知识后,观察到家庭用的燃煤通常加工成蜂窝状,这样会燃烧的更充分。由此她联想到细铁丝在空气中不能燃烧但在氧气中能剧烈燃烧。于是引发了思考:哪些因素能影响可燃物燃烧的剧烈程度呢?她作出了两种猜想并进行了实验探究。
(1)她提出的两种猜想是:
①________________________________;
②__________________________________。
(2)请你选择其中一种猜想,设计实验方案探究影响可燃物燃烧剧烈程度的因素(简要的写出实验步骤、现象和结论)_______________________________________________________。
2.某化学兴趣小组为了探究氢气的实验室制法,进行了一系列实验探索。
(1)小组用锌与稀盐酸反应制取氢气,该反应的化学方程式为___________________。
(2)为了加快锌与稀盐酸的反应速率,老师提示可向反应物中加入少量硫酸铜固体。为了弄明白速率加快的原因,小组同学提出了以下猜想。
猜想一:起促进作用的是硫酸根离子
猜想二:起促进作用的是铜离子
猜想三:生成物质起到促进作用
为了验证上述猜想是否正确。
①小明将硫酸铜换成硫酸钠,发现反应速率几乎没有变化,小明得出猜想________不正确。
②小明提出将硫酸铜换成氯化铜进一步验证猜想,小刘认为不需要替换试剂,只需通过观察加入硫酸铜固体后的现象就可以验证,该反应的现象为__________________,发生反应的化学方程式为___________________。此反应发生后反应速率加快依然较明显,小刘得出猜想________正确。
(3)小王觉得用稀硫酸比用稀盐酸制取的氢气更纯净,原因是_____________。
3.小敏研究影响锌与盐酸反应快慢的因素。
序号 盐酸溶液浓度 2分钟内产生氢气的体积
1 5% 10mL
2 15% 28mL
甲乙
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的______管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过____________________来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与________有关。
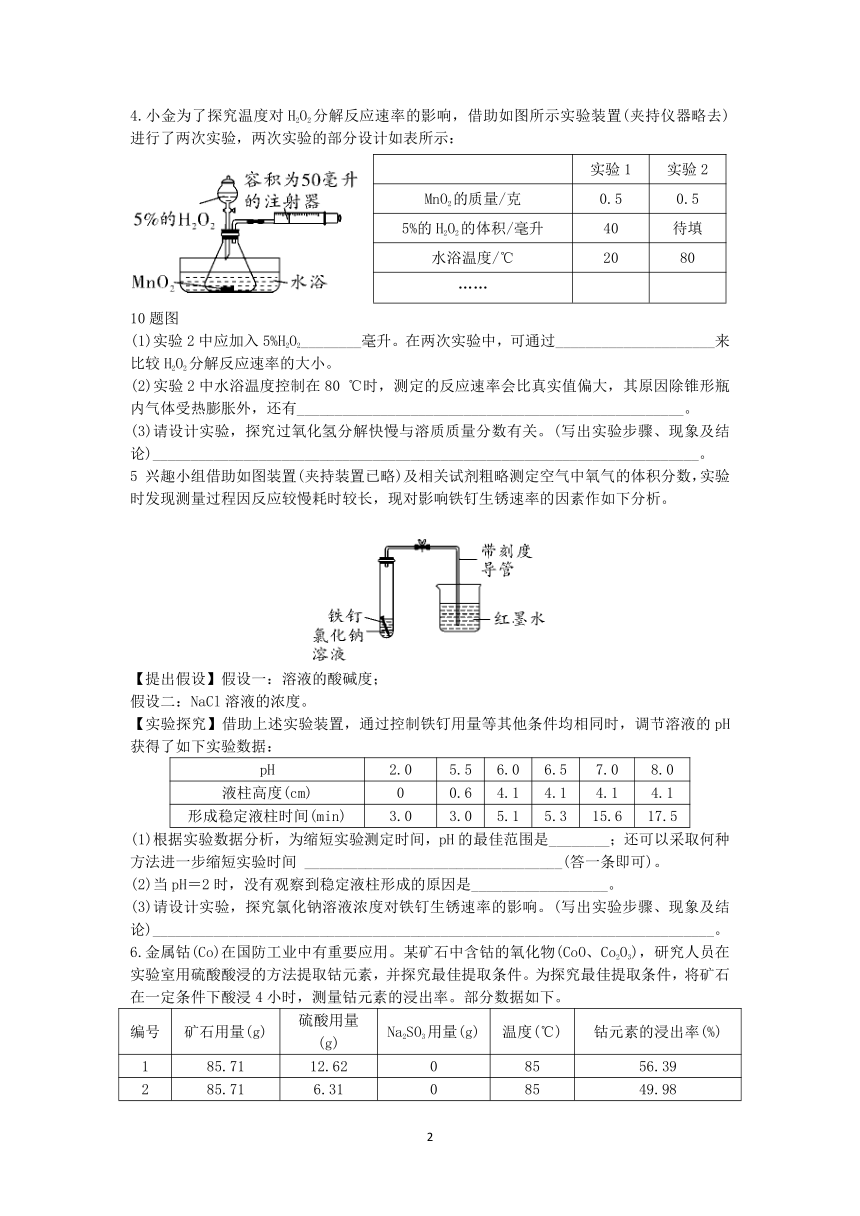
4.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持仪器略去)进行了两次实验,两次实验的部分设计如表所示:
实验1 实验2
MnO2的质量/克 0.5 0.5
5%的H2O2的体积/毫升 40 待填
水浴温度/℃ 20 80
……
第10题图
(1)实验2中应加入5%H2O2________毫升。在两次实验中,可通过_____________________来比较H2O2分解反应速率的大小。
(2)实验2中水浴温度控制在80 ℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有___________________________________________________。
(3)请设计实验,探究过氧化氢分解快慢与溶质质量分数有关。(写出实验步骤、现象及结论)________________________________________________________________________。
5 兴趣小组借助如图装置(夹持装置已略)及相关试剂粗略测定空气中氧气的体积分数,实验时发现测量过程因反应较慢耗时较长,现对影响铁钉生锈速率的因素作如下分析。
【提出假设】假设一:溶液的酸碱度;
假设二:NaCl溶液的浓度。
【实验探究】借助上述实验装置,通过控制铁钉用量等其他条件均相同时,调节溶液的pH获得了如下实验数据:
pH 2.0 5.5 6.0 6.5 7.0 8.0
液柱高度(cm) 0 0.6 4.1 4.1 4.1 4.1
形成稳定液柱时间(min) 3.0 3.0 5.1 5.3 15.6 17.5
(1)根据实验数据分析,为缩短实验测定时间,pH的最佳范围是________;还可以采取何种方法进一步缩短实验时间 __________________________________(答一条即可)。
(2)当pH=2时,没有观察到稳定液柱形成的原因是__________________。
(3)请设计实验,探究氯化钠溶液浓度对铁钉生锈速率的影响。(写出实验步骤、现象及结论)__________________________________________________________________________。
6.金属钴(Co)在国防工业中有重要应用。某矿石中含钴的氧化物(CoO、Co2O3),研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率。部分数据如下。
编号 矿石用量(g) 硫酸用量(g) Na2SO3用量(g) 温度(℃) 钴元素的浸出率(%)
1 85.71 12.62 0 85 56.39
2 85.71 6.31 0 85 49.98
3 85.71 6.31 0 65 43.33
4 85.71 6.31 0.43 65 73.95
5 85.71 6.31 0.86 65 74.77
(1)本实验研究了那些因素对钴元素浸出率的影响?______________________________。
(2)根据上表数据,其他条件不变,温度升高,钴元素的浸出率________。
(3)工业生产中采用实验________(填编号)的提取条件更合理。
7.碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2=== 2K2CO3+2I2
乙:4KI+O2+2H2O === 4KOH+2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
【实验过程】
【实验1】取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)石灰水变浑浊的原因是____________________(用化学方程式表示)。
(2)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____________________________________________。
【实验2】按图1所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
(3)据此现象,可得出的结论是________________。
图1 图2
【实验3】
按图2所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。
化学小组据此改进实验,很快观察到固体泛黄的现象。
(4)简述化学小组改进实验的具体措施:_________________________。
【实验结论】
(5)根据上述实验,化学小组得出结论:碘化钾固体泛黄变质是碘化钾与___共同作用的结果。
8.《天工开物》中记载的“倭铅”即是金属锌,说明我国炼锌在明代就出现。
探究一 用锌制取氢气
甲同学拟用如图实验装置完成制取氢气和测量生成气体体积实验:
(1)写出锌与稀硫酸反应的化学方程式________________________。
(2)装置连接顺序是:A→____→____→D(填字母)。
探究二 硫酸铜对氢气生成速率的影响
乙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为此展开探究。
【设计实验】
在锥形瓶中分别放入足量的、等质量的、颗粒大小相同的锌粒,再向分液漏斗中加入由31.5%的稀硫酸、不同体积水、5%的硫酸铜溶液组成的混合液,试剂用量记录如下表:
混合液(试管编号) ① ② ③ ④ ⑤
31.5%的H2SO4溶液/mL 10 V1 10 10 10
5%的CuSO4溶液/mL 3.6 3.8 4.0 4.2 4.4
蒸馏水/mL 16.4 16.2 16.0 15.8 V2
收集70 mL水所用时间/s 21.20 20.45 19.69 20.49 21.33
(3)表中的V1=________mL,V2=________mL。
【分析与结论】
(4)表中________组反应速率最快,原混合液中H2SO4和CuSO4 溶质质量比为________(最简整数比)。(提示:31.5%的H2SO4溶液和5%的CuSO4溶液密度均为1.2 g/mL)。
探究三 锌与硫酸铜溶液反应
丙同学取打磨过的锌片按下表内容进行对比实验:
实验项目 硫酸铜溶液溶质质量分数 是否添加稀硫酸 锌表面产生的现象
① 1.6% 否 黑色物质
② 1.6% 加2滴 红色物质,有极少量的气泡
③ 8% 否 红褐色物质
④ 8% 加2滴 光亮红色物质,有少量的气泡
⑤ 16% 否 红色物质,有极少量的气泡
⑥ 16% 加2滴 光亮红色物质,有较多气泡
【分析与结论】
(5)锌与硫酸铜溶液反应要产生红色的物质,需要的条件是________________________。
(6)根据第⑤组实验判断,硫酸铜溶液可能显________(选填:“酸”、“碱”或“中”)性。
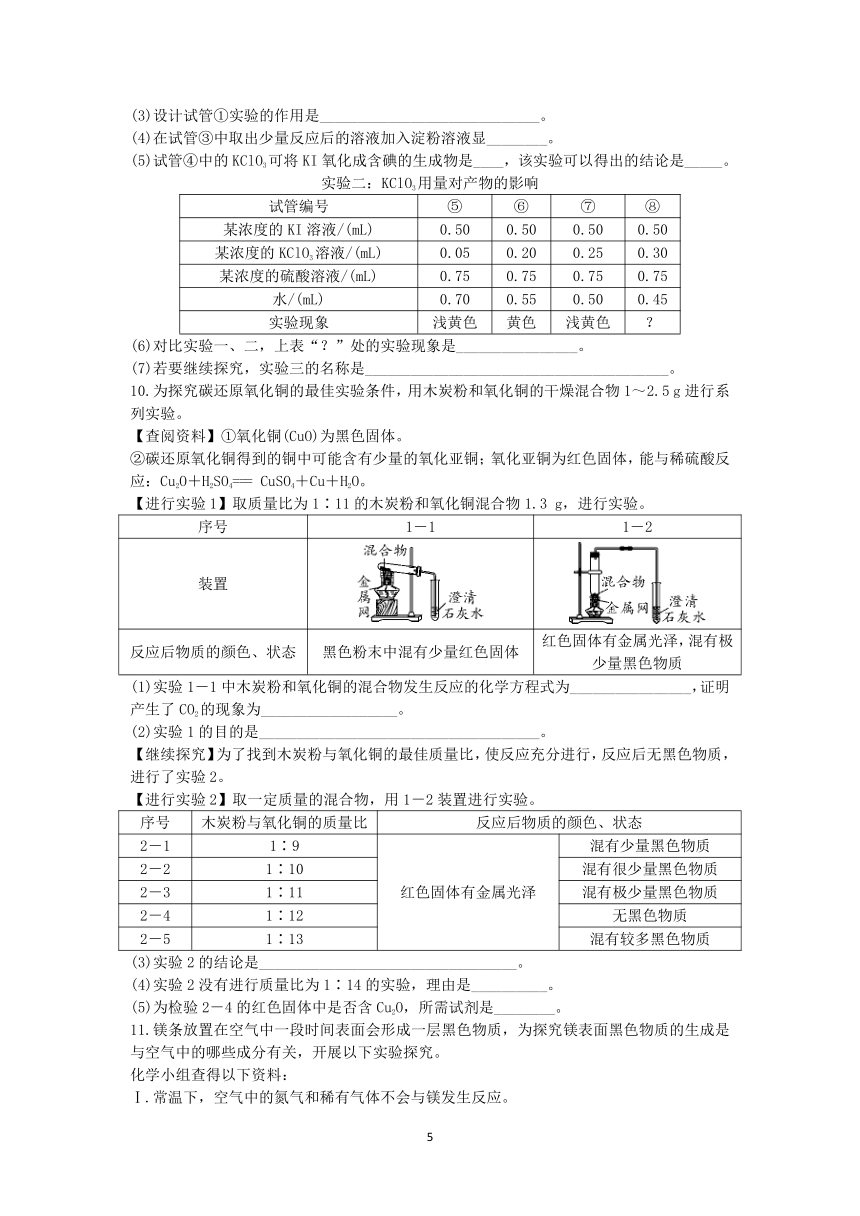
9.某实验小组设计了两组实验,探究常温下KClO3在硫酸溶液中将KI氧化生成I2或者KIO3的影响因素。
知识信息:
Ⅰ.碘单质(I2)在水中溶解度较小,水溶液呈黄色。
Ⅱ.KClO3、KI、KIO3、KCl溶液均为无色。
实验一:硫酸用量对产物的影响
试管编号 ① ② ③ ④
某浓度的KI溶液/(mL) 0.50 0.50 V1 0.50
某浓度的KClO3溶液/(mL) 0.30 V2 0.30 0.30
某浓度的硫酸溶液/(mL) 0 0.25 0.65 0.75
水/(mL) 1.20 0.95 0.55 0.45
实验现象 无色 浅黄色 黄色 无色
(1)在某浓度的硫酸中,KClO3可将KI氧化,生成I2、H2O、K2SO4和物质X,根据质量守恒定律,物质X中一定含有的元素是________。
(2)表中V1=________、V2=________。
(3)设计试管①实验的作用是_____________________________。
(4)在试管③中取出少量反应后的溶液加入淀粉溶液显________。
(5)试管④中的KClO3可将KI氧化成含碘的生成物是____,该实验可以得出的结论是_____。
实验二:KClO3用量对产物的影响
试管编号 ⑤ ⑥ ⑦ ⑧
某浓度的KI溶液/(mL) 0.50 0.50 0.50 0.50
某浓度的KClO3溶液/(mL) 0.05 0.20 0.25 0.30
某浓度的硫酸溶液/(mL) 0.75 0.75 0.75 0.75
水/(mL) 0.70 0.55 0.50 0.45
实验现象 浅黄色 黄色 浅黄色 ?
(6)对比实验一、二,上表“?”处的实验现象是________________。
(7)若要继续探究,实验三的名称是________________________________________。
10.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=== CuSO4+Cu+H2O。
【进行实验1】取质量比为1∶11的木炭粉和氧化铜混合物1.3 g,进行实验。
序号 1-1 1-2
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量黑色物质
(1)实验1-1中木炭粉和氧化铜的混合物发生反应的化学方程式为________________,证明产生了CO2的现象为__________________。
(2)实验1的目的是_____________________________________。
【继续探究】为了找到木炭粉与氧化铜的最佳质量比,使反应充分进行,反应后无黑色物质,进行了实验2。
【进行实验2】取一定质量的混合物,用1-2装置进行实验。
序号 木炭粉与氧化铜的质量比 反应后物质的颜色、状态
2-1 1∶9 红色固体有金属光泽 混有少量黑色物质
2-2 1∶10 混有很少量黑色物质
2-3 1∶11 混有极少量黑色物质
2-4 1∶12 无黑色物质
2-5 1∶13 混有较多黑色物质
(3)实验2的结论是__________________________________。
(4)实验2没有进行质量比为1∶14的实验,理由是__________。
(5)为检验2-4的红色固体中是否含Cu2O,所需试剂是________。
11.镁条放置在空气中一段时间表面会形成一层黑色物质,为探究镁表面黑色物质的生成是与空气中的哪些成分有关,开展以下实验探究。
化学小组查得以下资料:
Ⅰ.常温下,空气中的氮气和稀有气体不会与镁发生反应。
Ⅱ.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
【实验1】按图1所示装置进行实验,数日后,只观察到镁条表面变暗,没有出现黑色物质。
图1图2
(1)查阅文献获知,镁条表面变暗是镁与氧气反应的结果,该反应的化学方程式为_______。
(2)据此现象,可说明就________和________两种物质无法使镁生成黑色物质。
【实验2】按图2所示装置进行实验,数日后,只观察到镁条表面变暗,没有出现黑色物质。
(3)该实验的目的是___________________________。
【实验3】按图3所示装置进行实验,数日后,观察到镁条表面出现黑色物质。
图3
(4)得出“镁条变黑一定与水有关”的结论,依据的两个实验是______________(填实验序号)。
【实验4】化学小组认为据此现象还不足以得出最终结论,于是又补做了如下实验:
(5)将图3中的潮湿的空气换成___________进行实验,数日后,观察到镁条表面无明显变化。
(6)根据上述四个实验,化学小组得出结论:镁表面的黑色物质是镁与______________等物质共同作用的结果。
12. 暖贴发热是利用了铁粉生锈放出热量的原理,某小组同学设计并进行实验,探究铁生锈的条件及影响生锈速率的因素。
Ⅰ.探究铁生锈的条件
(1)由实验B和C得出铁生锈需要与水接触,画出实验C的实验装置图。
(2)证明铁生锈需要与氧气接触的实验现象是______________________。
Ⅱ.探究影响铁生锈速率的因素
【查阅资料】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
【猜想假设】
1.活性炭能加快铁粉生锈的速率。
2.食盐能加快铁粉生锈的速率。
【进行实验】下表是2 g铁粉、5 g水与不同质量活性炭、食盐均匀混合后,在10分钟内温度上升的实验记录。
实验编号 活性炭/g 食盐/g 温度上升值/℃
1 0 0 0.1
2 0.2 0 22.0
3 x 0.1 3.1
4 0.2 0.1 56.3
【解释与结论】
(3)表中x的值为______。
(4)对比实验1和3,得出的结论是______________________。
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快铁生锈速率”,需要对比________________________________________(填实验编号)。
【反思与评价】
(6)下列说法正确的是______。
A. 暖贴在使用前要密封保存
B. 暖贴使用后剩余物可以回收利用
C. 利用铁生锈的原理,铁粉还可用于食品保鲜
13. 鱼浮灵【主要成分是过碳酸钠(2Na2CO3·3H2O2)】是水产养殖中常见的增氧剂,溶于水后生成Na2CO3和H2O2,能迅速增加水体溶氧量,某课外小组用如图装置探究促进H2O2分解的因素。
【查阅资料】①H2O2常温下分解很慢。
②NaCl溶于水解离出Na+和Cl-。
③Na2CO3溶于水解离出Na+和CO,CO与水作用使溶液呈碱性。
实验一:探究促进H2O2分解的因素
【猜想与假设】1.Na+促进H2O2分解。
2.溶液的碱性促进H2O2分解。
【进行实验】分别进行下列3个实验(80 mL蒸馏水中加入6.7 g“鱼浮灵”,所得溶液中H2O2的浓度约为4%)。
实验 实验内容 实验结果
pH 溶解氧(mg/L)
1 ①80 mL蒸馏水 6.96 5.68
②加“鱼浮灵”6.7 g 9.89 7.97
2 ①80 mL 4%的H2O2溶液 6.01 6.44
②加少量NaCl 6.00 6.46
③再加少量Na2CO3 8.14 9.11
3 80 mL 4%的H2O2溶液中加少量NaOH溶液 9.26 10.97
【解释与结论】
(1)根据实验1的实验结果,加入“鱼浮灵”后,液体的变化是______________________。
(2)通过实验________,证明猜想1不成立。
(3)实验2-①与实验1-①对比,溶解氧的含量增大的原因是____________________。
(4)证明猜想2成立的依据是_____________。
实验二:探究溶液pH对H2O2分解的影响
【进行实验】向5个烧杯中分别加入80 mL 4%的H2O2溶液,再分别滴加NaOH溶液,测得不同pH下的溶解氧情况如下表所示。
烧杯 1 2 3 4 5
pH 8.00 8.59 9.29 10.43 11.47
溶解氧(mg/L) 6.88 9.30 13.82 17.57 13.15
(5)从表格中可得出的结论是_______________。
【反思与评价】
(6)下列物质能加快H2O2分解的是________。
A. MnO2 B. NaCl C. NaOH D. Na2CO3
14.如图,用一次性塑料水杯盛鲜榨果汁时,常用带皮柠檬片作装饰。网上传言,柠檬皮可以溶解这种水杯中的聚苯乙烯,危害人体健康,这种说法是真的吗?为了查明真相,小东用泡沫饭盒(主要成分是聚苯乙烯)和柠檬皮进行探究。
(1)探究一:柠檬皮真的能溶解聚苯乙烯吗?
进行实验:将柠檬皮研磨成酱,取一匙涂在泡沫饭盒上,2分钟后饭盒光滑的表面变得凹凸不平,5分钟后凹凸更加明显,10分钟后出现很多小孔。
结论与解释:柠檬皮中含有柠檬烯(C10H16),柠檬烯是一种(填“有机”或“无机”)________溶剂,可以溶解聚苯乙烯。
反思交流:用一次性塑料水杯喝水时,聚苯乙烯不会进入人体,放了带皮柠檬片后,聚苯乙烯会被溶解而进入人体,这说明物质的溶解性与____________有关。
一次性泡沫饭盒、一次性塑料水杯随意丢弃造成的环境问题被称为____________,果汁加工厂的大量柠檬皮被丢弃浪费,对此你有什么建议____________________________。
(2)探究二:酸性、碱性溶液对柠檬皮溶解聚苯乙烯有影响吗?
实验用品:泡沫饭盒、柠檬皮酱、食醋、纯碱溶液、食盐水、水。
查阅资料:酸性溶液、碱性溶液均不能溶解聚苯乙烯。
进行实验:
①取一匙柠檬皮酱,与2 mL水混合均匀后涂在泡沫饭盒上;
②取一匙柠檬皮酱,与2 mL (写溶质化学式)________混合均匀后涂在泡沫饭盒上;
③取一匙柠檬皮酱,与2 mL (写溶质化学式)________混合均匀后涂在泡沫饭盒上。
该实验方案中采用了对照实验的方法。请指出其中的对照实验(填实验编号):第一组对照实验________,第二组对照实验________。
5分钟后观察到三个泡沫饭盒表面的凹凸程度几乎相同,实验结论为______________。
(3)探究三:温度对柠檬皮溶解聚苯乙烯有影响吗?
请将下表填写完整(柠檬皮中的成分在实验温度下性质稳定)。
实验步骤 实验现象 实验结论
温度越高,越不利于柠檬皮酱溶解聚苯乙烯
解释实验结论:______________________________。
参考答案
1. (1)①可燃物与氧气的接触面积 ②氧气的浓度
(2)选择猜想①,实验步骤:将两组形状、质量均相同的木柴分别架空燃烧和堆积燃烧;实验现象:木柴架空燃烧比堆积燃烧更剧烈;实验结论:可燃物燃烧的剧烈程度与可燃物和氧气的接触面积有关(或选择猜想②,实验步骤:将两组形状、质量均相同的木柴分别放在空气和氧气中架空燃烧;实验现象:木柴在氧气中燃烧比在空气中燃烧更剧烈;实验结论:可燃物燃烧的剧烈程度与氧气的浓度有关)(合理即可)
2. (1)Zn+2HCl=== ZnCl2+H2↑ (2)①一 ②锌片表面有少量红色固体产生,溶液由蓝色变为无色,反应速率加快 Zn+CuSO4=== ZnSO4+Cu 三 (3)盐酸浓度过大具有挥发性,使制取的H2中含有杂质HCl而不纯,硫酸没有挥发性,可以得到纯净的氢气
3. (1)b (2)相同时间内产生氢气多少 (3)没有换用不同浓度盐酸多次实验 (4)温度
4. (1)40 相同时间内注射器活塞移动的距离(或注射器活塞移动相同距离所需要的时间) (2)温度较高,水蒸发较快,导致氧气中含有较多的水蒸气 (3)步骤:温度相同的条件下取相同质量的5%和10%的过氧化氢溶液于试管中,加入质量相等的二氧化锰,测量收集相同体积的氧气时所需要的时间。现象:收集到相同体积的氧气时,加入10%的过氧化氢溶液的试管所用的时间短。结论:过氧化氢溶液溶质质量分数越大,分解速率越快
5. (1)6.0~6.5 增加氯化钠溶液的浓度(或在较高的环境温度下实验等,合理即可) (2)pH=2时酸性较强,铁会与酸发生反应产生氢气,使装置内压强增大,不能形成液柱 (3)实验步骤:借助如图实验装置,控制其他变量相同,分别取浓度为1%、5%、10%的氯化钠溶液于试管中,观察导管内形成相同高度的液柱时所需要的时间。实验现象:浓度为10%的氯化钠溶液所需要的时间最短,浓度为1%的氯化钠溶液所需要的时间最长。实验结论:氯化钠溶液浓度越高,铁钉锈蚀越快(合理即可)
6. (1)硫酸用量、亚硫酸钠用量、温度 (2)增大 (3)4
7. (1)CO2+Ca(OH)2=== CaCO3↓+H2O (2)无法判断碳酸钾是按反应甲原理产生的,还是按反应乙原理生成的氢氧化钾吸收空气中的二氧化碳而产生的 (3)反应乙不是造成碘化钾泛黄的原因 (4)往瓶中再加入少量水 (5)氧气、水和二氧化碳(或O2、H2O和CO2)
8. (1)Zn+H2SO4=== ZnSO4+H2↑ (2)C B (3)10 15.6 (4)③ 63∶4 (5)硫酸铜溶液达到一定浓度或在一定pH溶液中(或其他合理答案) (6)酸
9. (1)氯(或Cl) (2)0.50 0.30 (3)对照实验(或探究未加酸时是否反应) (4)蓝色 (5)KIO3(或碘酸钾)
硫酸用量增大,KI被氧化的产物不同(合理即可)
(6)无色 (7)碘化钾用量对产物的影响
10. (1)C+2CuO CO2↑+2Cu 澄清石灰水变浑浊
(2)探究木炭粉与氧化铜的受热面积对其反应的影响
(3)木炭粉与氧化铜质量比为1∶12时恰好完全反应,因此木炭粉与氧化铜的反应的最佳质量比为1∶12
(4)木炭粉与氧化铜质量比为1∶13时,氧化铜已过量
(5)稀硫酸
11. (1)2Mg+O2=== 2MgO (2)氧气(或O2) 水(或H2O) (3)验证氧气和二氧化碳能否使镁生成黑色物质(或其它合理答案) (4)实验2和实验3 (5)潮湿的二氧化碳 (6)氧气(或O2)、二氧化碳(或CO2)和水(或H2O)
12. (1)
(2)A中铁钉不生锈,B中铁钉生锈 (3)0 (4)食盐能加快铁粉生锈的速率 (5)234(或1234) (6)ABC
13. (1)pH和溶解氧增大 (2)2 (3)过氧化氢常温下分解放出氧气 (4)实验2加入碳酸钠、实验3加入氢氧化钠溶液后,pH增大,溶解氧的量增加 (5)当pH在8.00~11.47之间时,随着pH的增大溶解氧的量先增加后减少 (6)ACD
【解析】(1)实验1的结果显示,加入“鱼浮灵”后,液体的pH由6.96增大到9.89,溶解氧的含量由5.68 mg/L增大到7.97 mg/L。(2)对比实验2-①和实验2-②的结果,加入少量NaCl后,液体中溶解氧没有明显的变化,说明Na+不能促进H2O2分解。(3)过氧化氢在常温下能缓慢分解放出氧气,所以实验2-①比实验1-①中溶解氧的含量增大。(4)实验2-③中加入碳酸钠和实验3中加入氢氧化钠溶液后,溶液pH明显增大,溶解氧也明显增加,且液体pH由8.14增大到9.26时,溶解氧的数值也随之增大,这说明溶液的碱性可以促进H2O2分解。(5)由表格中数据可知,在研究的pH范围内,随着pH的增大,溶解氧的含量先增加后减少。(6)根据上述实验结果,可知NaCl不能促进H2O2分解,NaOH、Na2CO3这类碱性物质能够促进H2O2分解,MnO2作为催化剂也可以加快H2O2分解。
14. (1)有机 溶剂的种类(或溶剂的性质) 白色污染
可以用柠檬皮处理一次性泡沫饭盒、一次性塑料水杯以减少白色污染(合理即可) (2)②CH3COOH (或Na2CO3) ③Na2CO3 (或CH3COOH,与前一空对应) ①②(或①③) ①③(或①②,与前一空对应) 酸性、碱性溶液对柠檬皮溶解聚苯乙烯没有影响
(3)
实验步骤 实验现象 实验结论
分别取两匙柠檬皮酱,一份加热,一份不加热,分别涂在两个泡沫饭盒上,2分钟后观察现象 涂加热柠檬皮酱的泡沫饭盒凹凸不明显,涂不加热柠檬皮酱的泡沫饭盒凹凸明显
温度越高,聚苯乙烯在柠檬烯(或柠檬皮酱)中的溶解度越小
【解析】(1)根据柠檬烯的化学式C10H16可知,柠檬烯属于有机物;根据题给信息可知聚苯乙烯难溶于水,而易溶于柠檬皮酱,说明物质的溶解性与溶剂的种类(或溶剂的性质)有关;一次性塑料水杯,一次性泡沫饭盒随意丢弃会造成的环境问题被称为白色污染;柠檬皮能够溶解一次性泡沫饭盒、一次性水杯中的聚苯乙烯,可以减少白污染,达到废物利用的目的。(2)根据实验目的可知,实验②③应分别选择一种酸性试剂和一种碱性试剂;通过对照实验①②,对照实验①③,根据5分钟后三个泡沫饭盒的表面凹凸程度几乎相同,对比说明酸性、碱性溶液对柠檬皮溶解聚苯乙烯没有影响。(3)证明温度对柠檬皮溶解聚苯乙烯有影响,需控制柠檬皮酱的量、时间等因素相同而温度不同的情况下进行实验,则实验步骤应为:分别取两匙柠檬皮酱,一份加热,一份不加热,分别涂在两个泡沫饭盒上,2分钟后观察现象,结合结论可知实验现象应为涂加热柠檬皮酱的泡沫饭盒凹凸不明显,涂不加热柠檬皮酱的泡沫饭盒凹凸明显。根据聚苯乙烯易溶于柠檬皮酱中可知,温度会影响聚苯乙烯在柠檬烯(或柠檬皮酱)中的溶解度,温度越高,聚苯乙烯在柠檬烯(或柠檬皮酱)中的溶解度越小。
(
1
)
1. 小海同学在学习了燃烧与燃料的有关知识后,观察到家庭用的燃煤通常加工成蜂窝状,这样会燃烧的更充分。由此她联想到细铁丝在空气中不能燃烧但在氧气中能剧烈燃烧。于是引发了思考:哪些因素能影响可燃物燃烧的剧烈程度呢?她作出了两种猜想并进行了实验探究。
(1)她提出的两种猜想是:
①________________________________;
②__________________________________。
(2)请你选择其中一种猜想,设计实验方案探究影响可燃物燃烧剧烈程度的因素(简要的写出实验步骤、现象和结论)_______________________________________________________。
2.某化学兴趣小组为了探究氢气的实验室制法,进行了一系列实验探索。
(1)小组用锌与稀盐酸反应制取氢气,该反应的化学方程式为___________________。
(2)为了加快锌与稀盐酸的反应速率,老师提示可向反应物中加入少量硫酸铜固体。为了弄明白速率加快的原因,小组同学提出了以下猜想。
猜想一:起促进作用的是硫酸根离子
猜想二:起促进作用的是铜离子
猜想三:生成物质起到促进作用
为了验证上述猜想是否正确。
①小明将硫酸铜换成硫酸钠,发现反应速率几乎没有变化,小明得出猜想________不正确。
②小明提出将硫酸铜换成氯化铜进一步验证猜想,小刘认为不需要替换试剂,只需通过观察加入硫酸铜固体后的现象就可以验证,该反应的现象为__________________,发生反应的化学方程式为___________________。此反应发生后反应速率加快依然较明显,小刘得出猜想________正确。
(3)小王觉得用稀硫酸比用稀盐酸制取的氢气更纯净,原因是_____________。
3.小敏研究影响锌与盐酸反应快慢的因素。
序号 盐酸溶液浓度 2分钟内产生氢气的体积
1 5% 10mL
2 15% 28mL
甲乙
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的______管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过____________________来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与________有关。
4.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持仪器略去)进行了两次实验,两次实验的部分设计如表所示:
实验1 实验2
MnO2的质量/克 0.5 0.5
5%的H2O2的体积/毫升 40 待填
水浴温度/℃ 20 80
……
第10题图
(1)实验2中应加入5%H2O2________毫升。在两次实验中,可通过_____________________来比较H2O2分解反应速率的大小。
(2)实验2中水浴温度控制在80 ℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有___________________________________________________。
(3)请设计实验,探究过氧化氢分解快慢与溶质质量分数有关。(写出实验步骤、现象及结论)________________________________________________________________________。
5 兴趣小组借助如图装置(夹持装置已略)及相关试剂粗略测定空气中氧气的体积分数,实验时发现测量过程因反应较慢耗时较长,现对影响铁钉生锈速率的因素作如下分析。
【提出假设】假设一:溶液的酸碱度;
假设二:NaCl溶液的浓度。
【实验探究】借助上述实验装置,通过控制铁钉用量等其他条件均相同时,调节溶液的pH获得了如下实验数据:
pH 2.0 5.5 6.0 6.5 7.0 8.0
液柱高度(cm) 0 0.6 4.1 4.1 4.1 4.1
形成稳定液柱时间(min) 3.0 3.0 5.1 5.3 15.6 17.5
(1)根据实验数据分析,为缩短实验测定时间,pH的最佳范围是________;还可以采取何种方法进一步缩短实验时间 __________________________________(答一条即可)。
(2)当pH=2时,没有观察到稳定液柱形成的原因是__________________。
(3)请设计实验,探究氯化钠溶液浓度对铁钉生锈速率的影响。(写出实验步骤、现象及结论)__________________________________________________________________________。
6.金属钴(Co)在国防工业中有重要应用。某矿石中含钴的氧化物(CoO、Co2O3),研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率。部分数据如下。
编号 矿石用量(g) 硫酸用量(g) Na2SO3用量(g) 温度(℃) 钴元素的浸出率(%)
1 85.71 12.62 0 85 56.39
2 85.71 6.31 0 85 49.98
3 85.71 6.31 0 65 43.33
4 85.71 6.31 0.43 65 73.95
5 85.71 6.31 0.86 65 74.77
(1)本实验研究了那些因素对钴元素浸出率的影响?______________________________。
(2)根据上表数据,其他条件不变,温度升高,钴元素的浸出率________。
(3)工业生产中采用实验________(填编号)的提取条件更合理。
7.碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2=== 2K2CO3+2I2
乙:4KI+O2+2H2O === 4KOH+2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
【实验过程】
【实验1】取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)石灰水变浑浊的原因是____________________(用化学方程式表示)。
(2)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____________________________________________。
【实验2】按图1所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
(3)据此现象,可得出的结论是________________。
图1 图2
【实验3】
按图2所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。
化学小组据此改进实验,很快观察到固体泛黄的现象。
(4)简述化学小组改进实验的具体措施:_________________________。
【实验结论】
(5)根据上述实验,化学小组得出结论:碘化钾固体泛黄变质是碘化钾与___共同作用的结果。
8.《天工开物》中记载的“倭铅”即是金属锌,说明我国炼锌在明代就出现。
探究一 用锌制取氢气
甲同学拟用如图实验装置完成制取氢气和测量生成气体体积实验:
(1)写出锌与稀硫酸反应的化学方程式________________________。
(2)装置连接顺序是:A→____→____→D(填字母)。
探究二 硫酸铜对氢气生成速率的影响
乙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为此展开探究。
【设计实验】
在锥形瓶中分别放入足量的、等质量的、颗粒大小相同的锌粒,再向分液漏斗中加入由31.5%的稀硫酸、不同体积水、5%的硫酸铜溶液组成的混合液,试剂用量记录如下表:
混合液(试管编号) ① ② ③ ④ ⑤
31.5%的H2SO4溶液/mL 10 V1 10 10 10
5%的CuSO4溶液/mL 3.6 3.8 4.0 4.2 4.4
蒸馏水/mL 16.4 16.2 16.0 15.8 V2
收集70 mL水所用时间/s 21.20 20.45 19.69 20.49 21.33
(3)表中的V1=________mL,V2=________mL。
【分析与结论】
(4)表中________组反应速率最快,原混合液中H2SO4和CuSO4 溶质质量比为________(最简整数比)。(提示:31.5%的H2SO4溶液和5%的CuSO4溶液密度均为1.2 g/mL)。
探究三 锌与硫酸铜溶液反应
丙同学取打磨过的锌片按下表内容进行对比实验:
实验项目 硫酸铜溶液溶质质量分数 是否添加稀硫酸 锌表面产生的现象
① 1.6% 否 黑色物质
② 1.6% 加2滴 红色物质,有极少量的气泡
③ 8% 否 红褐色物质
④ 8% 加2滴 光亮红色物质,有少量的气泡
⑤ 16% 否 红色物质,有极少量的气泡
⑥ 16% 加2滴 光亮红色物质,有较多气泡
【分析与结论】
(5)锌与硫酸铜溶液反应要产生红色的物质,需要的条件是________________________。
(6)根据第⑤组实验判断,硫酸铜溶液可能显________(选填:“酸”、“碱”或“中”)性。
9.某实验小组设计了两组实验,探究常温下KClO3在硫酸溶液中将KI氧化生成I2或者KIO3的影响因素。
知识信息:
Ⅰ.碘单质(I2)在水中溶解度较小,水溶液呈黄色。
Ⅱ.KClO3、KI、KIO3、KCl溶液均为无色。
实验一:硫酸用量对产物的影响
试管编号 ① ② ③ ④
某浓度的KI溶液/(mL) 0.50 0.50 V1 0.50
某浓度的KClO3溶液/(mL) 0.30 V2 0.30 0.30
某浓度的硫酸溶液/(mL) 0 0.25 0.65 0.75
水/(mL) 1.20 0.95 0.55 0.45
实验现象 无色 浅黄色 黄色 无色
(1)在某浓度的硫酸中,KClO3可将KI氧化,生成I2、H2O、K2SO4和物质X,根据质量守恒定律,物质X中一定含有的元素是________。
(2)表中V1=________、V2=________。
(3)设计试管①实验的作用是_____________________________。
(4)在试管③中取出少量反应后的溶液加入淀粉溶液显________。
(5)试管④中的KClO3可将KI氧化成含碘的生成物是____,该实验可以得出的结论是_____。
实验二:KClO3用量对产物的影响
试管编号 ⑤ ⑥ ⑦ ⑧
某浓度的KI溶液/(mL) 0.50 0.50 0.50 0.50
某浓度的KClO3溶液/(mL) 0.05 0.20 0.25 0.30
某浓度的硫酸溶液/(mL) 0.75 0.75 0.75 0.75
水/(mL) 0.70 0.55 0.50 0.45
实验现象 浅黄色 黄色 浅黄色 ?
(6)对比实验一、二,上表“?”处的实验现象是________________。
(7)若要继续探究,实验三的名称是________________________________________。
10.为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5 g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=== CuSO4+Cu+H2O。
【进行实验1】取质量比为1∶11的木炭粉和氧化铜混合物1.3 g,进行实验。
序号 1-1 1-2
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量黑色物质
(1)实验1-1中木炭粉和氧化铜的混合物发生反应的化学方程式为________________,证明产生了CO2的现象为__________________。
(2)实验1的目的是_____________________________________。
【继续探究】为了找到木炭粉与氧化铜的最佳质量比,使反应充分进行,反应后无黑色物质,进行了实验2。
【进行实验2】取一定质量的混合物,用1-2装置进行实验。
序号 木炭粉与氧化铜的质量比 反应后物质的颜色、状态
2-1 1∶9 红色固体有金属光泽 混有少量黑色物质
2-2 1∶10 混有很少量黑色物质
2-3 1∶11 混有极少量黑色物质
2-4 1∶12 无黑色物质
2-5 1∶13 混有较多黑色物质
(3)实验2的结论是__________________________________。
(4)实验2没有进行质量比为1∶14的实验,理由是__________。
(5)为检验2-4的红色固体中是否含Cu2O,所需试剂是________。
11.镁条放置在空气中一段时间表面会形成一层黑色物质,为探究镁表面黑色物质的生成是与空气中的哪些成分有关,开展以下实验探究。
化学小组查得以下资料:
Ⅰ.常温下,空气中的氮气和稀有气体不会与镁发生反应。
Ⅱ.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
【实验1】按图1所示装置进行实验,数日后,只观察到镁条表面变暗,没有出现黑色物质。
图1图2
(1)查阅文献获知,镁条表面变暗是镁与氧气反应的结果,该反应的化学方程式为_______。
(2)据此现象,可说明就________和________两种物质无法使镁生成黑色物质。
【实验2】按图2所示装置进行实验,数日后,只观察到镁条表面变暗,没有出现黑色物质。
(3)该实验的目的是___________________________。
【实验3】按图3所示装置进行实验,数日后,观察到镁条表面出现黑色物质。
图3
(4)得出“镁条变黑一定与水有关”的结论,依据的两个实验是______________(填实验序号)。
【实验4】化学小组认为据此现象还不足以得出最终结论,于是又补做了如下实验:
(5)将图3中的潮湿的空气换成___________进行实验,数日后,观察到镁条表面无明显变化。
(6)根据上述四个实验,化学小组得出结论:镁表面的黑色物质是镁与______________等物质共同作用的结果。
12. 暖贴发热是利用了铁粉生锈放出热量的原理,某小组同学设计并进行实验,探究铁生锈的条件及影响生锈速率的因素。
Ⅰ.探究铁生锈的条件
(1)由实验B和C得出铁生锈需要与水接触,画出实验C的实验装置图。
(2)证明铁生锈需要与氧气接触的实验现象是______________________。
Ⅱ.探究影响铁生锈速率的因素
【查阅资料】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
【猜想假设】
1.活性炭能加快铁粉生锈的速率。
2.食盐能加快铁粉生锈的速率。
【进行实验】下表是2 g铁粉、5 g水与不同质量活性炭、食盐均匀混合后,在10分钟内温度上升的实验记录。
实验编号 活性炭/g 食盐/g 温度上升值/℃
1 0 0 0.1
2 0.2 0 22.0
3 x 0.1 3.1
4 0.2 0.1 56.3
【解释与结论】
(3)表中x的值为______。
(4)对比实验1和3,得出的结论是______________________。
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快铁生锈速率”,需要对比________________________________________(填实验编号)。
【反思与评价】
(6)下列说法正确的是______。
A. 暖贴在使用前要密封保存
B. 暖贴使用后剩余物可以回收利用
C. 利用铁生锈的原理,铁粉还可用于食品保鲜
13. 鱼浮灵【主要成分是过碳酸钠(2Na2CO3·3H2O2)】是水产养殖中常见的增氧剂,溶于水后生成Na2CO3和H2O2,能迅速增加水体溶氧量,某课外小组用如图装置探究促进H2O2分解的因素。
【查阅资料】①H2O2常温下分解很慢。
②NaCl溶于水解离出Na+和Cl-。
③Na2CO3溶于水解离出Na+和CO,CO与水作用使溶液呈碱性。
实验一:探究促进H2O2分解的因素
【猜想与假设】1.Na+促进H2O2分解。
2.溶液的碱性促进H2O2分解。
【进行实验】分别进行下列3个实验(80 mL蒸馏水中加入6.7 g“鱼浮灵”,所得溶液中H2O2的浓度约为4%)。
实验 实验内容 实验结果
pH 溶解氧(mg/L)
1 ①80 mL蒸馏水 6.96 5.68
②加“鱼浮灵”6.7 g 9.89 7.97
2 ①80 mL 4%的H2O2溶液 6.01 6.44
②加少量NaCl 6.00 6.46
③再加少量Na2CO3 8.14 9.11
3 80 mL 4%的H2O2溶液中加少量NaOH溶液 9.26 10.97
【解释与结论】
(1)根据实验1的实验结果,加入“鱼浮灵”后,液体的变化是______________________。
(2)通过实验________,证明猜想1不成立。
(3)实验2-①与实验1-①对比,溶解氧的含量增大的原因是____________________。
(4)证明猜想2成立的依据是_____________。
实验二:探究溶液pH对H2O2分解的影响
【进行实验】向5个烧杯中分别加入80 mL 4%的H2O2溶液,再分别滴加NaOH溶液,测得不同pH下的溶解氧情况如下表所示。
烧杯 1 2 3 4 5
pH 8.00 8.59 9.29 10.43 11.47
溶解氧(mg/L) 6.88 9.30 13.82 17.57 13.15
(5)从表格中可得出的结论是_______________。
【反思与评价】
(6)下列物质能加快H2O2分解的是________。
A. MnO2 B. NaCl C. NaOH D. Na2CO3
14.如图,用一次性塑料水杯盛鲜榨果汁时,常用带皮柠檬片作装饰。网上传言,柠檬皮可以溶解这种水杯中的聚苯乙烯,危害人体健康,这种说法是真的吗?为了查明真相,小东用泡沫饭盒(主要成分是聚苯乙烯)和柠檬皮进行探究。
(1)探究一:柠檬皮真的能溶解聚苯乙烯吗?
进行实验:将柠檬皮研磨成酱,取一匙涂在泡沫饭盒上,2分钟后饭盒光滑的表面变得凹凸不平,5分钟后凹凸更加明显,10分钟后出现很多小孔。
结论与解释:柠檬皮中含有柠檬烯(C10H16),柠檬烯是一种(填“有机”或“无机”)________溶剂,可以溶解聚苯乙烯。
反思交流:用一次性塑料水杯喝水时,聚苯乙烯不会进入人体,放了带皮柠檬片后,聚苯乙烯会被溶解而进入人体,这说明物质的溶解性与____________有关。
一次性泡沫饭盒、一次性塑料水杯随意丢弃造成的环境问题被称为____________,果汁加工厂的大量柠檬皮被丢弃浪费,对此你有什么建议____________________________。
(2)探究二:酸性、碱性溶液对柠檬皮溶解聚苯乙烯有影响吗?
实验用品:泡沫饭盒、柠檬皮酱、食醋、纯碱溶液、食盐水、水。
查阅资料:酸性溶液、碱性溶液均不能溶解聚苯乙烯。
进行实验:
①取一匙柠檬皮酱,与2 mL水混合均匀后涂在泡沫饭盒上;
②取一匙柠檬皮酱,与2 mL (写溶质化学式)________混合均匀后涂在泡沫饭盒上;
③取一匙柠檬皮酱,与2 mL (写溶质化学式)________混合均匀后涂在泡沫饭盒上。
该实验方案中采用了对照实验的方法。请指出其中的对照实验(填实验编号):第一组对照实验________,第二组对照实验________。
5分钟后观察到三个泡沫饭盒表面的凹凸程度几乎相同,实验结论为______________。
(3)探究三:温度对柠檬皮溶解聚苯乙烯有影响吗?
请将下表填写完整(柠檬皮中的成分在实验温度下性质稳定)。
实验步骤 实验现象 实验结论
温度越高,越不利于柠檬皮酱溶解聚苯乙烯
解释实验结论:______________________________。
参考答案
1. (1)①可燃物与氧气的接触面积 ②氧气的浓度
(2)选择猜想①,实验步骤:将两组形状、质量均相同的木柴分别架空燃烧和堆积燃烧;实验现象:木柴架空燃烧比堆积燃烧更剧烈;实验结论:可燃物燃烧的剧烈程度与可燃物和氧气的接触面积有关(或选择猜想②,实验步骤:将两组形状、质量均相同的木柴分别放在空气和氧气中架空燃烧;实验现象:木柴在氧气中燃烧比在空气中燃烧更剧烈;实验结论:可燃物燃烧的剧烈程度与氧气的浓度有关)(合理即可)
2. (1)Zn+2HCl=== ZnCl2+H2↑ (2)①一 ②锌片表面有少量红色固体产生,溶液由蓝色变为无色,反应速率加快 Zn+CuSO4=== ZnSO4+Cu 三 (3)盐酸浓度过大具有挥发性,使制取的H2中含有杂质HCl而不纯,硫酸没有挥发性,可以得到纯净的氢气
3. (1)b (2)相同时间内产生氢气多少 (3)没有换用不同浓度盐酸多次实验 (4)温度
4. (1)40 相同时间内注射器活塞移动的距离(或注射器活塞移动相同距离所需要的时间) (2)温度较高,水蒸发较快,导致氧气中含有较多的水蒸气 (3)步骤:温度相同的条件下取相同质量的5%和10%的过氧化氢溶液于试管中,加入质量相等的二氧化锰,测量收集相同体积的氧气时所需要的时间。现象:收集到相同体积的氧气时,加入10%的过氧化氢溶液的试管所用的时间短。结论:过氧化氢溶液溶质质量分数越大,分解速率越快
5. (1)6.0~6.5 增加氯化钠溶液的浓度(或在较高的环境温度下实验等,合理即可) (2)pH=2时酸性较强,铁会与酸发生反应产生氢气,使装置内压强增大,不能形成液柱 (3)实验步骤:借助如图实验装置,控制其他变量相同,分别取浓度为1%、5%、10%的氯化钠溶液于试管中,观察导管内形成相同高度的液柱时所需要的时间。实验现象:浓度为10%的氯化钠溶液所需要的时间最短,浓度为1%的氯化钠溶液所需要的时间最长。实验结论:氯化钠溶液浓度越高,铁钉锈蚀越快(合理即可)
6. (1)硫酸用量、亚硫酸钠用量、温度 (2)增大 (3)4
7. (1)CO2+Ca(OH)2=== CaCO3↓+H2O (2)无法判断碳酸钾是按反应甲原理产生的,还是按反应乙原理生成的氢氧化钾吸收空气中的二氧化碳而产生的 (3)反应乙不是造成碘化钾泛黄的原因 (4)往瓶中再加入少量水 (5)氧气、水和二氧化碳(或O2、H2O和CO2)
8. (1)Zn+H2SO4=== ZnSO4+H2↑ (2)C B (3)10 15.6 (4)③ 63∶4 (5)硫酸铜溶液达到一定浓度或在一定pH溶液中(或其他合理答案) (6)酸
9. (1)氯(或Cl) (2)0.50 0.30 (3)对照实验(或探究未加酸时是否反应) (4)蓝色 (5)KIO3(或碘酸钾)
硫酸用量增大,KI被氧化的产物不同(合理即可)
(6)无色 (7)碘化钾用量对产物的影响
10. (1)C+2CuO CO2↑+2Cu 澄清石灰水变浑浊
(2)探究木炭粉与氧化铜的受热面积对其反应的影响
(3)木炭粉与氧化铜质量比为1∶12时恰好完全反应,因此木炭粉与氧化铜的反应的最佳质量比为1∶12
(4)木炭粉与氧化铜质量比为1∶13时,氧化铜已过量
(5)稀硫酸
11. (1)2Mg+O2=== 2MgO (2)氧气(或O2) 水(或H2O) (3)验证氧气和二氧化碳能否使镁生成黑色物质(或其它合理答案) (4)实验2和实验3 (5)潮湿的二氧化碳 (6)氧气(或O2)、二氧化碳(或CO2)和水(或H2O)
12. (1)
(2)A中铁钉不生锈,B中铁钉生锈 (3)0 (4)食盐能加快铁粉生锈的速率 (5)234(或1234) (6)ABC
13. (1)pH和溶解氧增大 (2)2 (3)过氧化氢常温下分解放出氧气 (4)实验2加入碳酸钠、实验3加入氢氧化钠溶液后,pH增大,溶解氧的量增加 (5)当pH在8.00~11.47之间时,随着pH的增大溶解氧的量先增加后减少 (6)ACD
【解析】(1)实验1的结果显示,加入“鱼浮灵”后,液体的pH由6.96增大到9.89,溶解氧的含量由5.68 mg/L增大到7.97 mg/L。(2)对比实验2-①和实验2-②的结果,加入少量NaCl后,液体中溶解氧没有明显的变化,说明Na+不能促进H2O2分解。(3)过氧化氢在常温下能缓慢分解放出氧气,所以实验2-①比实验1-①中溶解氧的含量增大。(4)实验2-③中加入碳酸钠和实验3中加入氢氧化钠溶液后,溶液pH明显增大,溶解氧也明显增加,且液体pH由8.14增大到9.26时,溶解氧的数值也随之增大,这说明溶液的碱性可以促进H2O2分解。(5)由表格中数据可知,在研究的pH范围内,随着pH的增大,溶解氧的含量先增加后减少。(6)根据上述实验结果,可知NaCl不能促进H2O2分解,NaOH、Na2CO3这类碱性物质能够促进H2O2分解,MnO2作为催化剂也可以加快H2O2分解。
14. (1)有机 溶剂的种类(或溶剂的性质) 白色污染
可以用柠檬皮处理一次性泡沫饭盒、一次性塑料水杯以减少白色污染(合理即可) (2)②CH3COOH (或Na2CO3) ③Na2CO3 (或CH3COOH,与前一空对应) ①②(或①③) ①③(或①②,与前一空对应) 酸性、碱性溶液对柠檬皮溶解聚苯乙烯没有影响
(3)
实验步骤 实验现象 实验结论
分别取两匙柠檬皮酱,一份加热,一份不加热,分别涂在两个泡沫饭盒上,2分钟后观察现象 涂加热柠檬皮酱的泡沫饭盒凹凸不明显,涂不加热柠檬皮酱的泡沫饭盒凹凸明显
温度越高,聚苯乙烯在柠檬烯(或柠檬皮酱)中的溶解度越小
【解析】(1)根据柠檬烯的化学式C10H16可知,柠檬烯属于有机物;根据题给信息可知聚苯乙烯难溶于水,而易溶于柠檬皮酱,说明物质的溶解性与溶剂的种类(或溶剂的性质)有关;一次性塑料水杯,一次性泡沫饭盒随意丢弃会造成的环境问题被称为白色污染;柠檬皮能够溶解一次性泡沫饭盒、一次性水杯中的聚苯乙烯,可以减少白污染,达到废物利用的目的。(2)根据实验目的可知,实验②③应分别选择一种酸性试剂和一种碱性试剂;通过对照实验①②,对照实验①③,根据5分钟后三个泡沫饭盒的表面凹凸程度几乎相同,对比说明酸性、碱性溶液对柠檬皮溶解聚苯乙烯没有影响。(3)证明温度对柠檬皮溶解聚苯乙烯有影响,需控制柠檬皮酱的量、时间等因素相同而温度不同的情况下进行实验,则实验步骤应为:分别取两匙柠檬皮酱,一份加热,一份不加热,分别涂在两个泡沫饭盒上,2分钟后观察现象,结合结论可知实验现象应为涂加热柠檬皮酱的泡沫饭盒凹凸不明显,涂不加热柠檬皮酱的泡沫饭盒凹凸明显。根据聚苯乙烯易溶于柠檬皮酱中可知,温度会影响聚苯乙烯在柠檬烯(或柠檬皮酱)中的溶解度,温度越高,聚苯乙烯在柠檬烯(或柠檬皮酱)中的溶解度越小。
(
1
)
