高二化学人教版(2019)选择性必修3 第二章 烃 整理与提升 教案
文档属性
| 名称 | 高二化学人教版(2019)选择性必修3 第二章 烃 整理与提升 教案 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-12 18:06:47 | ||
图片预览


文档简介
第二章 烃 整理与提升
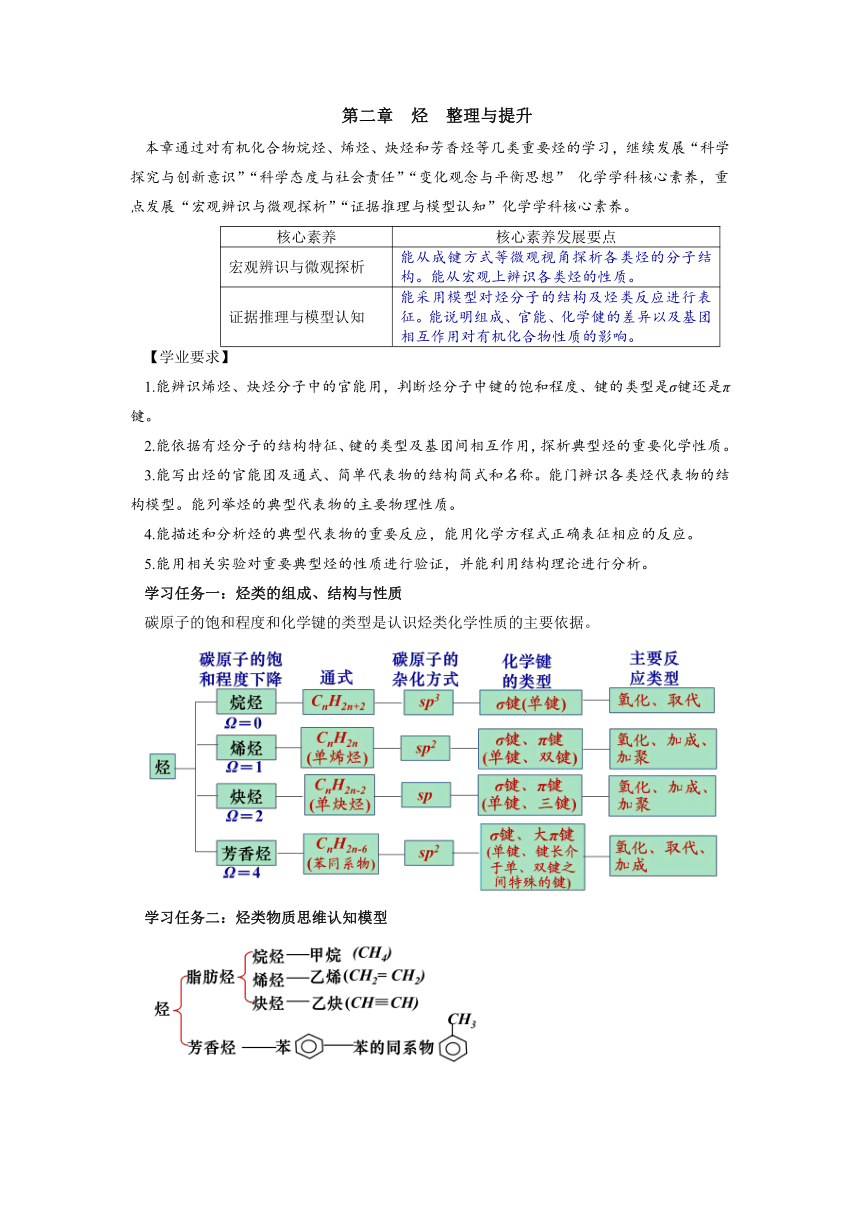
本章通过对有机化合物烷烃、烯烃、炔烃和芳香烃等几类重要烃的学习,继续发展“科学探究与创新意识”“科学态度与社会责任”“变化观念与平衡思想” 化学学科核心素养,重点发展“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
核心素养 核心素养发展要点
宏观辨识与微观探析 能从成键方式等微观视角探析各类烃的分子结构。能从宏观上辨识各类烃的性质。
证据推理与模型认知 能采用模型对烃分子的结构及烃类反应进行表征。能说明组成、官能、化学健的差异以及基团相互作用对有机化合物性质的影响。
【学业要求】
1.能辨识烯烃、炔烃分子中的官能用,判断烃分子中键的饱和程度、键的类型是σ键还是π键。
2.能依据有烃分子的结构特征、键的类型及基团间相互作用,探析典型烃的重要化学性质。
3.能写出烃的官能团及通式、简单代表物的结构简式和名称。能门辨识各类烃代表物的结构模型。能列举烃的典型代表物的主要物理性质。
4.能描述和分析烃的典型代表物的重要反应,能用化学方程式正确表征相应的反应。
5.能用相关实验对重要典型烃的性质进行验证,并能利用结构理论进行分析。
学习任务一:烃类的组成、结构与性质
碳原子的饱和程度和化学键的类型是认识烃类化学性质的主要依据。
学习任务二:烃类物质思维认知模型
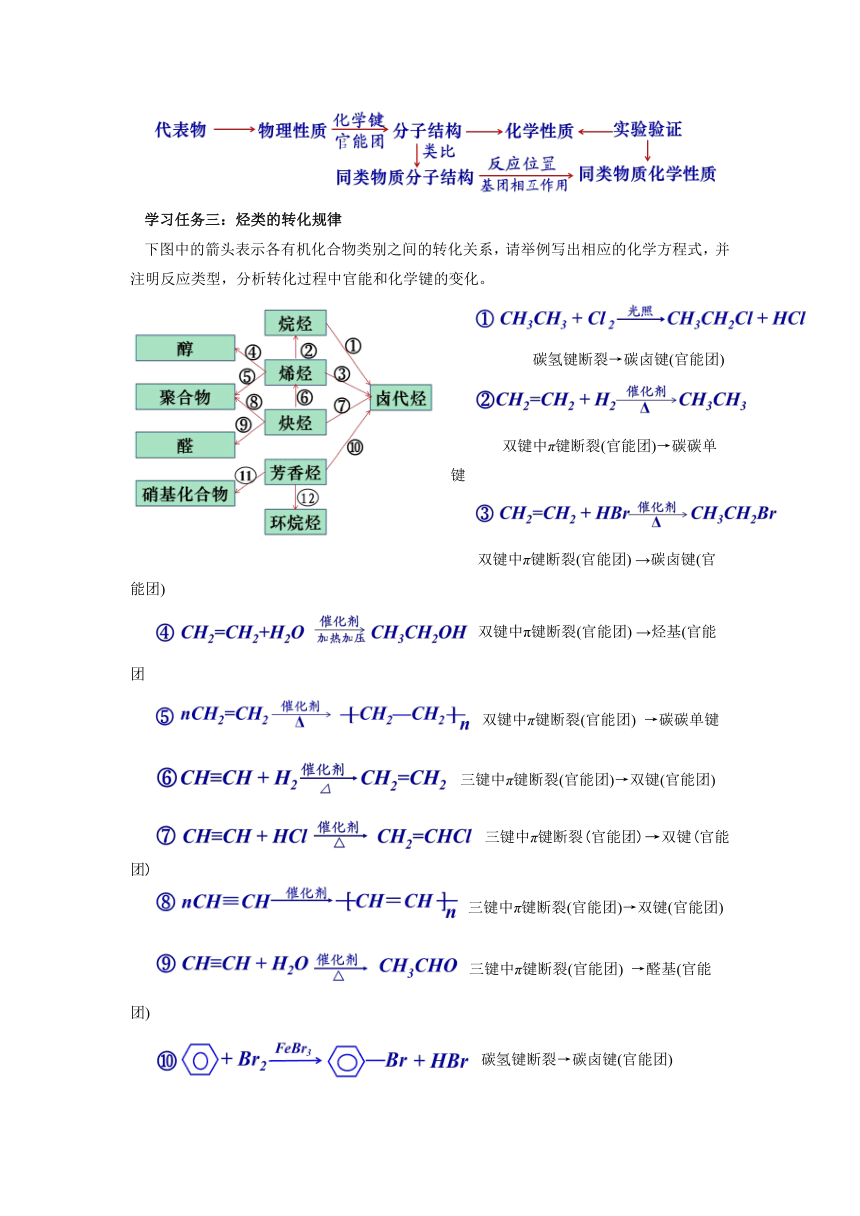
学习任务三:烃类的转化规律
下图中的箭头表示各有机化合物类别之间的转化关系,请举例写出相应的化学方程式,并注明反应类型,分析转化过程中官能和化学键的变化。
碳氢键断裂→碳卤键(官能团)
双键中π键断裂(官能团)→碳碳单键
双键中π键断裂(官能团) →碳卤键(官能团)
双键中π键断裂(官能团) →烃基(官能团
双键中π键断裂(官能团) →碳碳单键
三键中π键断裂(官能团)→双键(官能团)
三键中π键断裂(官能团)→双键(官能团)
三键中π键断裂(官能团)→双键(官能团)
三键中π键断裂(官能团) →醛基(官能团)
碳氢键断裂→碳卤键(官能团)
碳氢键断裂→硝基(官能团)
大π键断裂→碳碳单键
学习任务四、烃的燃烧规律
烃的燃烧通式:
1.等物质的量的烃完全燃烧耗氧量比较的规律:
等物质的量的任意烃(CxHy) ,完全燃烧,耗氧量取决于 ,该值越大,耗氧量越多。
例1:等物质的量的CH4、C2H4、C2H6、C3H4、C3H6完全燃烧,耗氧量最大是_____。
2.等质量的烃完全燃烧耗氧量比较的规律:
对于相同质量的任意烃,完全燃烧,耗氧量的大小取决于 的值的大小,该值越大(含H量越大),耗氧量越多。
例2:等质量的CH4、C2H4、C2H6、C3H4、C3H6完全燃烧,耗氧量最大的是_____.
3.燃烧前后气体的体积大小变化规律:
同温同压下,不同气体的体积比等于物质的量之比,物质量之比等于化学方程式计量数之比。
(1)烃完全燃烧后,若生成的水液态(温度低于100℃)
∵y>0,∴反应后的体积总是减小。
(2)烃完全燃烧后,若生成的水为气态(温度高于100℃)
① y=4时,△V=0,反应前后的体积不变;
② y>4时, △V > 0,反应后气体增大;
③ y<4时, △V < 0,反应后气体体积减小。
例3.CH4、C2H2、C2H4、C2H6、C3H4、C3H6完全燃烧,反应后温度为120℃ ,则反应后,体积不变的是_________________,体积增大的是_____________,体积减小的是______ 。
4.混合烃燃烧规律:
(1)最简式相同的烃(或有机物),无论以何种比例混合,只要混合物总质量一定,完全燃烧耗氧量为定值,产生的CO2和H2O的量总是一个定值。
例4:下列各组物质中,只要总质量一定,不论以何种比例混和,完全燃烧生成二氧化碳和水的质量也总是定值的是( )
A.C3H8和C3H6 B. C2H6和 C. C2H4 和C4H8 D. CH4 和C2H6
(2)十字交叉法解混合烃燃烧问题。
例5:一种气态烷烃和一种气态烯烃,它们分子里
的碳原子数相同。在相同状况下,将1体积这种混合
气体在氧气中充分燃烧,生成2体积的二氧化碳和2.4体积的水蒸气。则混合气中烷烃和烯烃为______________,它们的体积比为_____。
学习任务五:有机分子原子共线、面问题
1.甲烷的正四面体结构:
CH4分子为正四面体结构,根据三角形规则,其分子最多有一个C两个H共3个原子共处同一平面。
凡是C原子与其他四个原子形成共价单键时,空间结构为四面体结构
小结:结构中每出现一个饱和碳原子,则整个分子不再共面。
2.乙烯的平面结构:
乙烯分子中6个原均在同一平面内。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。
小结:结构中每出现一个碳碳双键,至少有6个原子共面。
例2:判断丙烯中最多有几个原子共面,最少有几个原子共面?
至少6个原子、至多7个原子共面。
例3:(CH 3 )2C=C(CH3 )C(CH3 )=C(CH3)2中最多有几个碳原子共面,最少有几个碳原子共面?
最少6个碳原子共面(因碳碳单键可以旋转),最多10个碳原子共面。
3.乙炔的直线结构:
乙炔分子中四个原子在同一直线上。当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其他原子共线。
小结:结构中每出现一个碳碳三键,至少有4个原子共线。
例4:乙烯基乙炔中一定有几个原子共面?
一定有8个原子在同一平面上。
4.苯的平面结构:
苯环中12个原子均在同一平面内。当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平面内。
小结:结构中每出现一个苯环,至少有12个原子共面
例5:甲苯中最多有几个原子共面,最少有几个原子共面?
最少12个原子一定共面,最多13个原子共面。
同理,萘、蒽的平面结构:
18原子共面(10C+8H) 24个原子共面(14C+10H)
例6: 中一定有几个原子共面? 共17个原子共面
5.甲醛平面结构: 共4个原子共面
小结:结构中每出现一个醛基,至少有4个原子共面
归纳:
1.简单小分子的空间构型:
①CH4分子为正四面体结构,其分子最多有3个原子共处同一平面。
②乙烯、甲醛、苯、萘、蒽分子中所有原子共平面。
③乙炔分子中所有原子共直线。
2.分子构型的判断:
①结构中每出现一个碳碳双键,至少有6个原子共面;
②结构中每出现一个碳碳三键,至少有4个原子共线;
③结构中每出现一个苯环,至少有12个原子共面
④结构中每出现一个饱和碳原子,则整个分子不再共面
注意:单键可以旋转,而双、三键不能旋转。
学习评价:
1. 在CH3-CH=CH-C≡C-CF3分子结构中,至少可以有____个原子在同一个平面,最多可以有____个原子在同一个平面.
2.在 CH3--CH=CH-C≡C-CH3 分子中,处于同一平面上的原子数最多可能是:
A.12个 B.14个 C.18个 D.20个
3.烃的结构简式为: CH3CH2CH=CH-C≡CH, 分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
A.2、3、5 B.2、3、4 C.4、6、4 D.4、3、5
4.下列有机分子中,所有的原子不可能处于同一平面的是( )
5.结构简式为的烃,下列说法正确的是( )
A.分子中至少有6个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至少有9个碳原子处于同一平面上
D.分子中至少有14个碳原子处于同一平面上
6.下列分子中的14个碳原子不可能处在同一平面上的是:
板书设计:
作业设计:
教学反思:
本章通过对有机化合物烷烃、烯烃、炔烃和芳香烃等几类重要烃的学习,继续发展“科学探究与创新意识”“科学态度与社会责任”“变化观念与平衡思想” 化学学科核心素养,重点发展“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
核心素养 核心素养发展要点
宏观辨识与微观探析 能从成键方式等微观视角探析各类烃的分子结构。能从宏观上辨识各类烃的性质。
证据推理与模型认知 能采用模型对烃分子的结构及烃类反应进行表征。能说明组成、官能、化学健的差异以及基团相互作用对有机化合物性质的影响。
【学业要求】
1.能辨识烯烃、炔烃分子中的官能用,判断烃分子中键的饱和程度、键的类型是σ键还是π键。
2.能依据有烃分子的结构特征、键的类型及基团间相互作用,探析典型烃的重要化学性质。
3.能写出烃的官能团及通式、简单代表物的结构简式和名称。能门辨识各类烃代表物的结构模型。能列举烃的典型代表物的主要物理性质。
4.能描述和分析烃的典型代表物的重要反应,能用化学方程式正确表征相应的反应。
5.能用相关实验对重要典型烃的性质进行验证,并能利用结构理论进行分析。
学习任务一:烃类的组成、结构与性质
碳原子的饱和程度和化学键的类型是认识烃类化学性质的主要依据。
学习任务二:烃类物质思维认知模型
学习任务三:烃类的转化规律
下图中的箭头表示各有机化合物类别之间的转化关系,请举例写出相应的化学方程式,并注明反应类型,分析转化过程中官能和化学键的变化。
碳氢键断裂→碳卤键(官能团)
双键中π键断裂(官能团)→碳碳单键
双键中π键断裂(官能团) →碳卤键(官能团)
双键中π键断裂(官能团) →烃基(官能团
双键中π键断裂(官能团) →碳碳单键
三键中π键断裂(官能团)→双键(官能团)
三键中π键断裂(官能团)→双键(官能团)
三键中π键断裂(官能团)→双键(官能团)
三键中π键断裂(官能团) →醛基(官能团)
碳氢键断裂→碳卤键(官能团)
碳氢键断裂→硝基(官能团)
大π键断裂→碳碳单键
学习任务四、烃的燃烧规律
烃的燃烧通式:
1.等物质的量的烃完全燃烧耗氧量比较的规律:
等物质的量的任意烃(CxHy) ,完全燃烧,耗氧量取决于 ,该值越大,耗氧量越多。
例1:等物质的量的CH4、C2H4、C2H6、C3H4、C3H6完全燃烧,耗氧量最大是_____。
2.等质量的烃完全燃烧耗氧量比较的规律:
对于相同质量的任意烃,完全燃烧,耗氧量的大小取决于 的值的大小,该值越大(含H量越大),耗氧量越多。
例2:等质量的CH4、C2H4、C2H6、C3H4、C3H6完全燃烧,耗氧量最大的是_____.
3.燃烧前后气体的体积大小变化规律:
同温同压下,不同气体的体积比等于物质的量之比,物质量之比等于化学方程式计量数之比。
(1)烃完全燃烧后,若生成的水液态(温度低于100℃)
∵y>0,∴反应后的体积总是减小。
(2)烃完全燃烧后,若生成的水为气态(温度高于100℃)
① y=4时,△V=0,反应前后的体积不变;
② y>4时, △V > 0,反应后气体增大;
③ y<4时, △V < 0,反应后气体体积减小。
例3.CH4、C2H2、C2H4、C2H6、C3H4、C3H6完全燃烧,反应后温度为120℃ ,则反应后,体积不变的是_________________,体积增大的是_____________,体积减小的是______ 。
4.混合烃燃烧规律:
(1)最简式相同的烃(或有机物),无论以何种比例混合,只要混合物总质量一定,完全燃烧耗氧量为定值,产生的CO2和H2O的量总是一个定值。
例4:下列各组物质中,只要总质量一定,不论以何种比例混和,完全燃烧生成二氧化碳和水的质量也总是定值的是( )
A.C3H8和C3H6 B. C2H6和 C. C2H4 和C4H8 D. CH4 和C2H6
(2)十字交叉法解混合烃燃烧问题。
例5:一种气态烷烃和一种气态烯烃,它们分子里
的碳原子数相同。在相同状况下,将1体积这种混合
气体在氧气中充分燃烧,生成2体积的二氧化碳和2.4体积的水蒸气。则混合气中烷烃和烯烃为______________,它们的体积比为_____。
学习任务五:有机分子原子共线、面问题
1.甲烷的正四面体结构:
CH4分子为正四面体结构,根据三角形规则,其分子最多有一个C两个H共3个原子共处同一平面。
凡是C原子与其他四个原子形成共价单键时,空间结构为四面体结构
小结:结构中每出现一个饱和碳原子,则整个分子不再共面。
2.乙烯的平面结构:
乙烯分子中6个原均在同一平面内。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。
小结:结构中每出现一个碳碳双键,至少有6个原子共面。
例2:判断丙烯中最多有几个原子共面,最少有几个原子共面?
至少6个原子、至多7个原子共面。
例3:(CH 3 )2C=C(CH3 )C(CH3 )=C(CH3)2中最多有几个碳原子共面,最少有几个碳原子共面?
最少6个碳原子共面(因碳碳单键可以旋转),最多10个碳原子共面。
3.乙炔的直线结构:
乙炔分子中四个原子在同一直线上。当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其他原子共线。
小结:结构中每出现一个碳碳三键,至少有4个原子共线。
例4:乙烯基乙炔中一定有几个原子共面?
一定有8个原子在同一平面上。
4.苯的平面结构:
苯环中12个原子均在同一平面内。当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平面内。
小结:结构中每出现一个苯环,至少有12个原子共面
例5:甲苯中最多有几个原子共面,最少有几个原子共面?
最少12个原子一定共面,最多13个原子共面。
同理,萘、蒽的平面结构:
18原子共面(10C+8H) 24个原子共面(14C+10H)
例6: 中一定有几个原子共面? 共17个原子共面
5.甲醛平面结构: 共4个原子共面
小结:结构中每出现一个醛基,至少有4个原子共面
归纳:
1.简单小分子的空间构型:
①CH4分子为正四面体结构,其分子最多有3个原子共处同一平面。
②乙烯、甲醛、苯、萘、蒽分子中所有原子共平面。
③乙炔分子中所有原子共直线。
2.分子构型的判断:
①结构中每出现一个碳碳双键,至少有6个原子共面;
②结构中每出现一个碳碳三键,至少有4个原子共线;
③结构中每出现一个苯环,至少有12个原子共面
④结构中每出现一个饱和碳原子,则整个分子不再共面
注意:单键可以旋转,而双、三键不能旋转。
学习评价:
1. 在CH3-CH=CH-C≡C-CF3分子结构中,至少可以有____个原子在同一个平面,最多可以有____个原子在同一个平面.
2.在 CH3--CH=CH-C≡C-CH3 分子中,处于同一平面上的原子数最多可能是:
A.12个 B.14个 C.18个 D.20个
3.烃的结构简式为: CH3CH2CH=CH-C≡CH, 分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
A.2、3、5 B.2、3、4 C.4、6、4 D.4、3、5
4.下列有机分子中,所有的原子不可能处于同一平面的是( )
5.结构简式为的烃,下列说法正确的是( )
A.分子中至少有6个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至少有9个碳原子处于同一平面上
D.分子中至少有14个碳原子处于同一平面上
6.下列分子中的14个碳原子不可能处在同一平面上的是:
板书设计:
作业设计:
教学反思:
