江西省吉安市吉水中学2022-2023学年高一上学期期末考试化学试题(含解析)
文档属性
| 名称 | 江西省吉安市吉水中学2022-2023学年高一上学期期末考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 899.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 09:25:12 | ||
图片预览


文档简介
吉水中学2022-2023学年高一上学期期末考试
化学试卷
一.单选题(每小题3分,共45分)
1.宏观辨识与微观探析是化学学科核心素养之一。下列实验现象对应的离子方程式正确的是
A.过量SO2通入滴有酚酞的NaOH溶液,溶液红色褪去:SO2 +OH- =HSO
B.大理石与盐酸接触,产生无色气泡:CO+2H+=CO2↑ +H2O
C.CO2 通入饱和Na2CO3溶液中出现浑浊现象:CO2 +H2O +CO= 2HCO
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体:2Fe +3Cu2+= 3Cu +2Fe3+
2.“纳米材料”(1nm=10-9m)已广泛应用于催化及军事科学中。“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中。有以下叙述:
①所得物质一定是溶液,
②能全部透过半透膜,
③有丁达尔现象,
④所得液体可以全部透过滤纸。
对所得分散系的上述叙述正确的是
A.①② B.②③ C.①④ D.③④
3.澳大利亚科学家Andrei V.Rode发现一种纯碳新材料“碳纳米泡沫”,其中每个泡沫约含有4000个碳原子,直径约为6~9 nm,在低于-183 ℃时,该泡沫具有永久磁性。下列叙述正确的是
A.“碳纳米泡沫”是一种新型的含碳化合物
B.“碳纳米泡沫”和金刚石的性质完全相同
C.把“碳纳米泡沫”分散到适当的溶剂中形成的分散系属于混合物
D.把“碳纳米泡沫”分散到适当的溶剂中,不能产生丁达尔效应
4.下列叙述正确的是
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
5.设NA为阿伏加德罗常数的值,下列说法正确的有几项
①2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA
④标准状况下等体积的SO2、SO3中含有相同数目硫原子
⑤由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
⑥含有0.5molKClO3的溶液电离出的Cl-为0.5mol
⑦相同温度不同压强下等质量的N2O和CO2含有的原子数目不同
A.1 B.2 C.3 D.4
6.实验室常用KMnO4、KClO3、H2O2为原料制取氧气,当制得相同质量的氧气,三个反应中电子转移数目之比为
A.1:1:1 B.2:2:1 C.1:3:1 D.3:1:3
7.下列各组离子能在指定溶液中大量共存的是
A.无色溶液中: B.含有的溶液中:
C.含有的溶液中: D.使石蕊变红的溶液中:
8.下列离子方程式书写正确的是
A.向Fe2O3中加入HI溶液:Fe2O3+6H+=2Fe3++H2O
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.向AgCl悬浊液中滴加过量的Na2S溶液:2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq)
D.足量澄清石灰水和少量NaHCO3溶液反应:2OH-+2HCO+Ca2+=2H2O+CO+CaCO3↓
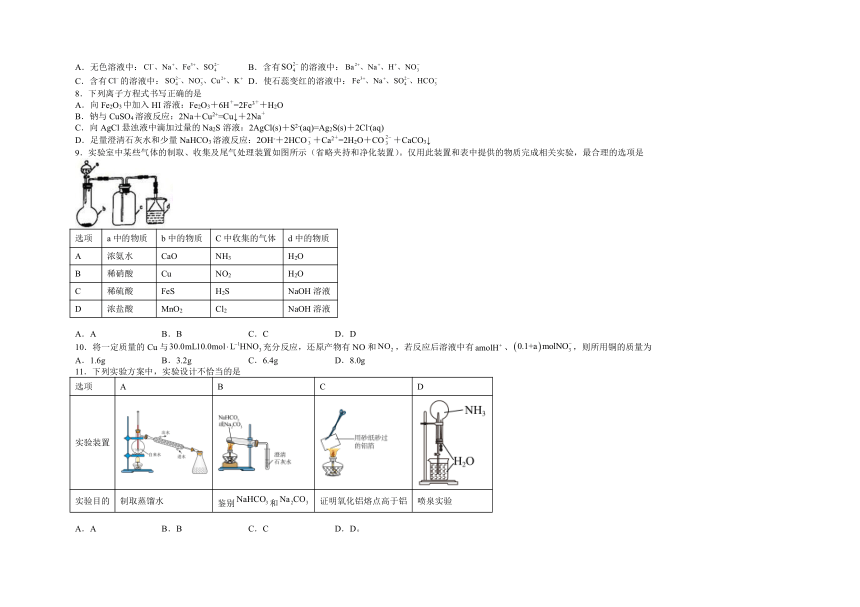
9.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项 a中的物质 b中的物质 C中收集的气体 d中的物质
A 浓氨水 CaO NH3 H2O
B 稀硝酸 Cu NO2 H2O
C 稀硫酸 FeS H2S NaOH溶液
D 浓盐酸 MnO2 Cl2 NaOH溶液
A.A B.B C.C D.D
10.将一定质量的Cu与充分反应,还原产物有NO和,若反应后溶液中有、,则所用铜的质量为
A.1.6g B.3.2g C.6.4g D.8.0g
11.下列实验方案中,实验设计不恰当的是
选项 A B C D
实验装置
实验目的 制取蒸馏水 鉴别和 证明氧化铝熔点高于铝 喷泉实验
A.A B.B C.C D.D。
12.磷化氢是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料。实验室制备的方法有:ⅰ.;ⅱ.。下列说法错误的是
A.反应ⅰ不是氧化还原反应
B.加热使其分解,能得到三种生成物
C.溶液中含有、、、四种含磷微粒
D.反应ⅱ中是还原产物
13.硫酸钙可用作建筑材料和水泥原料外,也可用作硫酸、漂白粉的生产原料。生产流程如图,下列说法正确的是
A.“高温焙烧”时产生的气体均为酸性氧化物
B.漂白粉是纯净物,其成分为Ca(ClO)2
C.“接触室”与“吸收塔”内均发生了化合反应,硫的价态均升高
D.合成甲醇的化学反应为CO+2H2CH3OH
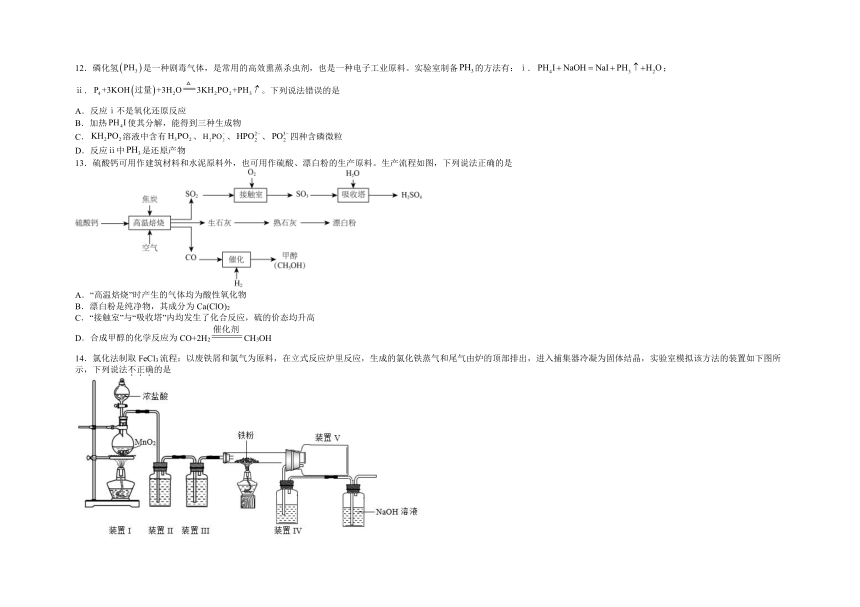
14.氯化法制取FeCl3流程:以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶,实验室模拟该方法的装置如下图所示,下列说法不正确的是
A.装置I反应的离子方程式为
B.装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl
C.装置IV洗气瓶中盛放的液体为浓盐酸
D.装置V的作用是收集FeCl3
15.向Cu、Cu2O和CuO组成的混合物中,加入的稀HNO3溶液恰好使混合物完全溶解,同时收集到2.24LNO气体(标准状况)。[已知:。]下列说法错误的是
A.发生氧化还原反应的HNO3物质的量为0.1mol
B.得到的溶液中n(Cu2+)=0.25mol
C.Cu与稀硝酸反应的离子方程式为
D.若混合物中含0.1molCu,则该混合物与足量稀硫酸充分反应,最后剩余固体12.8g
二、填空题(共50分)
16.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成1 mol X,则X的化学式为________。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4b.H3ASO4是还原产物
c.还原性:AsH3>X d.K2SO4和H2O是还原产物
(4)请将反应物的化学式和配平后的系数填入下列相应的位置中,并用“单线桥”标出电子转移的方向和数目。
17.某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 Fe3+ Fe2+ Mg2+ Al3+ Cr3+
开始沉淀时的pH 1.9 7 — — —
沉淀完全时的pH 3.2 9 11.1 8 9(>9溶解)
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaRMRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____
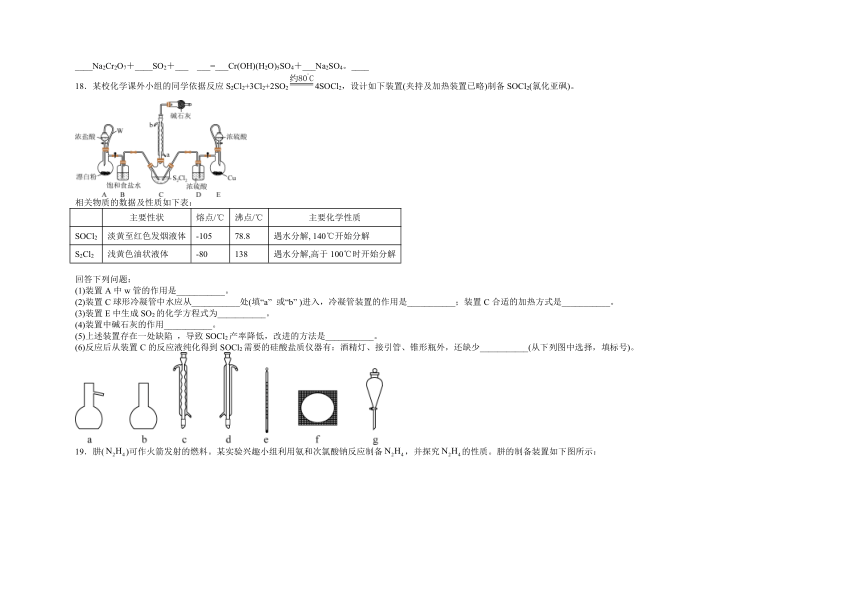
18.某校化学课外小组的同学依据反应S2Cl2+3Cl2+2SO24SOCl2,设计如下装置(夹持及加热装置已略)制备SOCl2(氯化亚砜)。
相关物质的数据及性质如下表:
主要性状 熔点/℃ 沸点/℃ 主要化学性质
SOCl2 淡黄至红色发烟液体 -105 78.8 遇水分解, 140℃开始分解
S2Cl2 浅黄色油状液体 -80 138 遇水分解,高于100℃时开始分解
回答下列问题:
(1)装置A中w管的作用是___________。
(2)装置C球形冷凝管中水应从___________处(填“a” 或“b” )进入,冷凝管装置的作用是___________;装置C合适的加热方式是___________。
(3)装置E中生成SO2的化学方程式为___________。
(4)装置中碱石灰的作用___________。
(5)上述装置存在一处缺陷 ,导致SOCl2产率降低,改进的方法是___________。
(6)反应后从装置C的反应液纯化得到SOCl2需要的硅酸盐质仪器有:酒精灯、接引管、锥形瓶外,还缺少___________(从下列图中选择,填标号)。
19.肼()可作火箭发射的燃料。某实验兴趣小组利用氨和次氯酸钠反应制备,并探究的性质。胼的制备装置如下图所示:
回答下列问题:
(1)A为实验室制氨的发生装置,反应前试管a盛装的固体为_______(填化学式),仪器b的作用是_______。
(2)装置C中发生的离子方程式为_______。B中生成肼的离子反应方程式为_______。
(3)上述装置存在一处缺陷会导致的产率降低,改进措施是_______。
(4)探究的性质。将制得的分离提纯后,进行如下实验。
【查阅资料】AgOH不稳定,易分解生成黑色的,可溶于氨水。
【提出假设】黑色固体可能是Ag、中的一种或两种。
【实验验证】设计如下方案,进行实验。
操作 现象 结论
i.取少量黑色固体于试管中,加入足量稀硝酸,振荡 黑色固体全部溶解,产生无色气体,遇空气马上变为红棕色 黑色固体中有_______
ii.取少量黑色固体于试管中,加入足量_______,振荡 黑色固体部分溶解 黑色固体中有
通过上述实验,得出肼具有的性质是_______。
(5)根据酸碱质子理论,结合质子()的物质是碱,已知胼与一水合氨类似,是一种二元弱碱,向肼溶液中加入过量硫酸生成的酸式盐的化学式为_______。
1.A
【详解】A.二氧化硫为酸性氧化物,过量的SO2与NaOH溶液反应生成酸式盐和水,溶液红色褪去,其离子方程式为SO2 +OH- =,故A正确;
B.大理石与盐酸接触,发生反应生成CaCl2、CO2和H2O,由于CaCO3难溶于水,在离子方程式中应保留化学式,其离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.CO2 通入饱和Na2CO3溶液中,二者发生反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则产生沉淀,即溶液出现浑浊,其离子方程式为CO2 +H2O +2Na++=2NaHCO3↓,故C错误;
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体,说明铁能与硫酸铜发生置换反应,即Fe与CuSO4发生反应,生成硫酸亚铁和Cu,其离子方程式为Fe+Cu2+=Fe2++Cu,故D错误;
答案为A。
2.D
【详解】①根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),“纳米材料”(1nm=10-9m),“纳米材料”(1nm=10-9m)是指研究开发直径为几纳米至几十纳米的材料,分散到液体分散剂中,对于所得分散系为胶体,故①错误;②胶体的微粒直径在1-100nm之间,将“纳米材料”分散到某液体中,所得分散系为胶体,半透膜上的小孔直径小于1nm,不能透过半透膜,故②错误;③胶体具有有丁达尔效应,光速通过此分散系时会形成一条光亮的“通路”,故③正确;④滤纸上的小孔直径大于100nm,所得液体能透过滤纸,故④正确;故选D。
3.C
【详解】A.纯碳新材料“碳纳米泡沫”是由碳元素组成的单质,错误;
B.纯碳新材料“碳纳米泡沫”是由碳元素组成的单质,其结构与金刚石不同,故其性质与金刚石不完全相同,错误;
C.“碳纳米泡沫”的直径约为6~9 nm,将其分散到适当的溶剂中可形成胶体,能产生丁达尔效应,胶体属于分散系,是一种混合物,正确;
D.“碳纳米泡沫”的直径约为6~9 nm,将其分散到适当的溶剂中可形成胶体,能产生丁达尔效应,错误;
故选C。
4.B
【详解】A项,FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl,故A错误;
B项,由于还原性I->Fe2+,所以向FeI2溶液中通入少量Cl2,Cl2首先与I-反应:Cl2+2I-=I2+2Cl-,故B正确;
C项,过量的Fe与热浓硫酸反应,首先产生SO2气体,随着反应的进行,浓硫酸的浓度逐渐变稀,后来稀硫酸与Fe反应产生H2,生成的气体不能被烧碱溶液完全吸收,故C错误;
D项,由于发生反应:SO2+Br2+2H2O=H2SO4+2HBr,欲检验溶液中的,应向溶液中加入BaCl2溶液,若加入Ba(NO3)2溶液,则不能排除的干扰,故D错误;
答案选B。
5.A
【详解】①氢气和氯气所处的状态不明确,故其物质的量无法计算,则和HCl的原子数目是否相同无法计算,故①错误;
②同温同压下,体积相同的氢气和氩气物质的量相同,则所含的分子数相等,故②正确;
③溶液体积不明确,溶液中含有的氯离子的个数无法计算,故③错误;
④标准状况下SO3是固体,气体摩尔体积不是22.4L/mol,则等体积的SO2、SO3物质的量不相等,硫原子数目不相同,故④错误;
⑤NO2与N2O4组成的4.6g混合气体,设NO2的物质的量为x,N2O4的物质的量为y,则46x+92y=4,6,所以x+2y=0.1,即NO2与N2O4组成的4.6g混合气体含氮原子物质的量为0.1mol,含N原子数0.1NA,故⑤错误;
⑥KClO3的溶液中KClO3的电离方程式为KClO3=K++,溶液中不存在Cl-,故⑥错误;
⑦N2O和CO2的摩尔质量都是44g/mol,二者质量相同,物质的量相同,都是3原子分子,含有原子总数相等,故⑦错误;
由上只有②正确,即正确的只有一项,选项A符合题意;答案为A。
6.B
【详解】KMnO4加热分解为锰酸钾、二氧化锰、氧气,氧元素化合价由-2升高为0,生成1mol氧气转移4mol电子;KClO3加热分解为氯化钾、氧气,氧元素化合价由-2升高为0,生成1mol氧气转移4mol电子;H2O2分解为水和氧气,氧元素化合价由-1升高为0,生成1mol氧气转移2mol电子;当制得相同质量的氧气,三个反应中电子转移数目之比为2:2:1,故选B。
7.C
【详解】A.含有Fe3+的溶液为黄色,与无色溶液不符,A与题意不符;
B.含有的溶液中:Ba2+与反应生成硫酸钡沉淀,B与题意不符;
C.含有Cl-的溶液中:Cu2+、K+、、Cl-、之间不反应,能大量共存,C符合题意;
D.使石蕊变红的溶液中显酸性:H+、反应生成二氧化碳和水,不能大量共存,D与题意不符;
答案为C。
8.C
【详解】A.向Fe2O3中加入HI溶液,生成的铁离子会继续氧化碘离子,正确离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,A错误;
B.钠与CuSO4溶液反应,Na与水反应生成氢氧化钠,再与CuSO4反应生成氢氧化铜沉淀:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,B错误;
C.向AgCl悬浊液中滴加过量的Na2S溶液,由于Ag2S的溶解度比AgCl小很多,会发生沉淀的转化:2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq),C正确;
D.足量澄清石灰水和少量NaHCO3溶液反应,离子方程式为:OH-+HCO+Ca2+=H2O+CaCO3↓,D错误。
故答案选C。
9.C
【详解】A.氨气的密度小于空气的密度,所以用向下排空气法收集,不是向上排空气法,导气管应“短进长出”,A错误;
B.稀硝酸与铜反应生成一氧化氮,得不到二氧化氮,且一氧化氮与水不反应,不能用水吸收,B错误;
C.稀硫酸与FeS反应生成硫化氢气体,密度大于空气,所以用向上排空气法,硫化氢有毒,可与氢氧化钠溶液反应生成氯化钠和亚硫酸钠,可以被碱液吸收,C正确;
D.浓盐酸与二氧化锰制取氯气需要加热,缺少加热仪器,不能得到氯气,D错误;
故答案选C。
10.B
【详解】Cu与充分反应,还原产物有NO和,若反应后溶液中有、,说明Cu完全反应,根据元素守恒,可得Cu(NO3)2的物质的量为,则参加反应Cu的物质的量为,质量为64g/mol×0.05mol=3.2g,故答案选B。
11.A
【详解】A.蒸馏时,需要控制的量蒸气的温度,因此,温度计的水银球应放在蒸馏烧瓶的支管口处,A错误;
B.碳酸氢钠不稳定,受热分解生成二氧化碳,遇见澄清石灰水变浑浊,所以可以鉴别,B正确;
C.铝箔受热熔化在铝外面形成一层致密的氧化铝,包在融化的铝外面,形成一个圆球似的液滴状但是并不滴落下来,证明氧化铝熔点高于铝,C正确;
D.挤入水时,氨气迅速溶于水,使瓶内的压强远远小于外界的大气压,从而形成喷泉实验,D正确;
故选A。
12.C
【详解】A.反应i.PH4I+NaOH=NaI+PH3↑+H2O,该反应中没有元素化合价的变化,不属于氧化还原反应,故A正确;
B.PH4I分解生成PH3、HI,HI也能分解生成H2、I2,所以加热PH4I使其分解,能得到PH3、H2、I2三种生成物,故B正确;
C.H3PO2是一元酸,KH2PO2是正盐,能部分发生水解反应生成H3PO2,则KH2PO2溶液中含有H3PO2、两种含磷微粒,故C错误;
D.反应ii中P4反应生成PH3,P元素的化合价降低,所以是还原产物,故D正确;
故选:C。
13.D
【分析】硫酸钙在焦炭、空气和高温条件下生成CO、SO2、CaO,SO2与氧气在加热和催化剂条件下转化为SO3,SO3和水反应生成H2SO4;CO和H2在催化剂条件下反应生成CH3OH;CaO和水反应生成氢氧化钙,氯气和石灰乳反应生成漂白粉。
【详解】A.酸性氧化物指与碱反应生成盐和水的化合物,CO不溶于水,不与碱反应,A错误;
B.漂白粉主要成分是Ca(ClO)2,还含有CaCl2等物质,因此漂白粉是混合物,B错误;
C.接触室中发生反应2SO2+O2SO3,属于化合反应,S元素化合价由+4价升高为+6价,吸收塔中发生SO3+H2O=H2SO4,属于化合反应,但是S元素的化合价没有发生变化,C错误;
D.“催化”中CO和H2合成CH3OH,方程式为CO+2H2CH3OH,D正确;
故答案为:D。
14.C
【分析】由实验装置可知,本实验用二氧化锰和浓盐酸反应制氯气,氯气经饱和食盐水和浓硫酸除杂后通入装有铁粉的硬质玻璃管中,在加热的条件下氯气和铁粉发生反应生成氯化铁蒸气,氯化铁蒸气随气流进入装置Ⅴ冷凝为固体;装置Ⅳ中装有浓硫酸,防止氯化铁发生潮解和水解;最后是尾气处理装置,防止污染空气。
【详解】A.装置I中是浓盐酸和二氧化锰共同受热制取氯气,反应的离子方程式为,A正确;
B.浓盐酸易挥发,制得的氯气含有杂质氯化氢,装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl,B正确;
C.装置IV洗气瓶的作用是防止水蒸气进入装置Ⅴ导致氯化铁发生潮解和水解,故其中应盛放浓硫酸,浓盐酸中的水蒸气可以逸出,达不到保护氯化铁的目的,C错误;
D.装置V相当于捕集器,氯化铁蒸气在此冷凝为固体,故其作用是收集FeCl3,D正确;
故选C。
15.D
【分析】HNO3的物质的量为0.6mol/L×1L=0.6mol,NO的物质的量为=0.1mol。
【详解】A.HNO3作为氧化剂,还原产物为NO,根据分析,生成NO为0.1mol,故发生还原反应的HNO3为0.1mol,A正确;
B.反应后溶液中的溶质为Cu(NO3)2,根据分析,起到酸性作用的HNO3为0.6mol-0.1mol=0.5mol,故n(Cu2+)=n(HNO3)=0.25mol,B正确;
C.Cu与稀硝酸反应生成Cu(NO3)2、NO和H2O,离子方程式为,C正确;
D.混合物与硝酸反应时,Cu和Cu2O被氧化,失去的总电子为HNO3所得电子,物质的量为0.1mol×3=0.3mol,故Cu2O转移电子的物质的量为0.3mol -0.1mol×2=0.1mol,n(Cu2O)=×0.1mol=0.05mol,根据溶液中n(Cu2+)=0.25mol,可知Cu元素共0.25mol,原混合物中n(CuO)= 0.25mol-0.05mol×2-0.1mol=0.05mol。混合物与稀硫酸反应时, Cu不与稀H2SO4反应,根据可知,生成的Cu的物质的量n’(Cu)= n(Cu2O)=0.05mol,故反应后所得的Cu的物质的量为n(Cu)+n’(Cu)=0.15mol,质量为0.15mol×64g/mol=9.6g,D错误;
故选D。
16. AsH3 Br2 ac
【分析】(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)氧化剂的氧化性最强,还原剂的还原性最强,氧化剂对应的产物叫还原产物;
(4)根据化学反应中化合价的升降情况标电子转移情况。
【详解】(1) KBrO3在反应中得到电子,所以KBrO3是氧化剂, AsH3变成了H3AsO4,所以AsH3是还原剂;
因此,本题正确答案是: AsH3;
(2)设X中溴元素的化合价为x,则0.2×(5-x)=1,所以x=0,故X为Br2;
因此,本题正确答案是: Br2;
(3)a、反应中KBrO3是氧化剂, H3AsO4,是氧化产物,氧化性为KBrO3>H3AsO4,故a正确;
b、AsH3变成了H3AsO4,砷元素化合价升高,所以H3AsO4是氧化产物,故b错误;
c、AsH3是还原剂, Br2是还原产物,所以还原性AsH3> Br2,故c正确;
d、K2SO4和H2O中的元素化合价均未变化,既不是氧化产物也不是还原产物,故d错误;
综上所述,本题正确选项ac;
(4)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-;
因此,本题正确答案是:。
17. 65.2 250 mL容量瓶、胶头滴管 沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2~3次 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+、Al3+ Ca2+、Mg2+ Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4
【分析】含铬污泥预处理后,用硫酸浸取液中金属离子主要是Cr3+,其次是 Fe2+、Fe3+、A13+、Ca2+、Mg2+,过滤除去不溶性杂质,然后加入过氧化氢氧化铬离子、亚铁离子为高价态,加入氢氧化钠溶液调节溶液pH=8使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子,得到溶液中通入二氧化硫还原得到Cr(OH)(H2O)5SO4。
【详解】(1)浓硫酸物质的量浓度为==18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,实验室中没有200 mL的容量瓶,应该选用250mL容量瓶配制,则需要浓硫酸体积为=0.0652L=65.2mL,需用到的玻璃仪器有:胶头滴管、玻璃棒、烧杯和100mL量筒、250mL容量瓶,所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需250mL容量瓶,胶头滴管,故答案为:65.2;250mL容量瓶,胶头滴管;
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次,故答案为:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次;
(3)双氧水有强氧化性,能氧化还原性的物质,加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面Fe2+有还原性,Fe2+能被双氧水氧化为高价离子,Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)依据表格数据中离子开始沉淀和完全沉淀的pH,调节pH至8,可使Al3+、Fe3+生成沉淀,故答案为:Al3+、Fe3+;
(5)因镁离子、钙离子沉淀的pH较大,可用离子交换法除去,故答案为:Ca2+、Mg2+;
(6)通SO2气体时,还原过程中铬元素化合价+6价变化为+3价,Na2Cr2O~2CrOH(H2O)5SO4~6e-,硫元素化合价变化为+6价,SO2~SO42-~2e-,根据得失电子守恒,得到电子转移总数6e-,结合原子守恒配平得到化学方程式:Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4,故答案为:Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4。
【点睛】本题的易错点为(6),要注意氧化还原反应中缺项配平的练习和应用,配平时关键是反应前后Cr元素化合价的正确标注和分析。
18. 平衡气压,使浓盐酸顺利滴下 a 冷凝回流 SOCl2 80℃热水浴 Cu +2H2SO4(浓) CuSO4 + SO2↑+ 2H2O 吸收 SO2、Cl2等气体,防止空气中的水蒸气进入装置 C 将装置 B 中饱和食盐水换成浓硫酸(或 B、C 间加装盛有浓硫酸的洗气瓶) adef
【分析】根据实验原理及实验装置分析,装置A是用浓盐酸和漂白粉制备氯气,B中的饱和食盐水目的是除去杂质HCl;E装置是用浓硫酸与铜反应制备二氧化硫气体,D中浓硫酸作用是干燥二氧化硫气体;将氯气及二氧化硫气体通入C中与S2Cl2反应制备SOCl2,冷凝管的作用为冷凝回流S2Cl2和SOCl2,连接的干燥管作用是防止空气中水分进入和剩余气体的尾气处理,据此分析解答。
【详解】(1)根据图示装置特点分析,装置A中w管的作用是平衡气压,使浓盐酸顺利滴下,故答案为:平衡气压,使浓盐酸顺利滴下;
(2)为了使冷凝水充满冷凝管,装置C球形冷凝管中水应从下端通入,即a处进入;由题干信息知SOCl2的沸点为78.8℃,且反应温度为80℃,所以冷凝管的作用是冷凝回流SOCl2;反应温度应该控制在80℃,所以适合的加热方式为80℃水浴加热;故答案为:a;冷凝回流 SOCl2;80℃水浴加热;
(3)装置E中铜和浓硫酸在加热的条件下反应生成硫酸铜、SO2和水,反应方程式为:Cu +2H2SO4(浓) CuSO4 + SO2↑+ 2H2O,故答案为:Cu +2H2SO4(浓) CuSO4 + SO2↑+ 2H2O;
(4)根据上述分析,装置中碱石灰的作用是吸收未反应的SO2、Cl2等气体,同时防止空气中的水蒸气进入装置 C,故答案为:吸收 SO2、Cl2等气体,防止空气中的水蒸气进入装置 C;
(5)已知SOCl2易水解,在氯气进入C中时未干燥,会导致SOCl2产率降低,应该增加干燥装置,故答案为:将装置 B 中饱和食盐水换成浓硫酸(或 B、C 间加装盛有浓硫酸的洗气瓶);
(6)由题干信息知,SOCl2与S2Cl2沸点不同,可以用蒸馏的方法得到纯净的SOCl2,蒸馏装置所需的玻璃仪器含有蒸馏烧瓶、冷凝管、温度计、石棉网,故答案为:adef。
19.(1) NH4Cl Ca(OH)2 导气,防止倒吸
(2) 2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 2NH3+ClO-=Cl-+N2H4+H2O
(3)在装置B、C之间加装盛有饱和食盐水的洗气瓶
(4) Ag 氨水 还原性和碱性
(5)N2H6(HSO4)2
【分析】实验室用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,装置C为生成氯气装置,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠再和氨生成肼。
【详解】(1)实验室用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,且反应为固体加热反应,则试管a中的试剂为氯化铵和氢氧化钙固体,两者反应生成氨气和氯化钙、水;氨气极易溶于水,仪器b的作用是将氨气通入装置B中,且球形部分可以防止倒吸,故答案为:NH4Cl、Ca(OH)2;导气、防止倒吸;
(2)装置C为生成氯气装置,浓盐酸和高锰酸钾反应生成氯气、氯化锰、氯化钾和水,离子方程式为: 2+16H++10Cl-=2Mn2++5Cl2↑+8H2O ;生成的氯气通入NaOH溶液中,两者反应生成氯化钠、NaClO和水,NaClO和通入的氨气反应生成肼,在此反应中,N的化合价从-3价升高到-2价,则NaClO做氧化剂,Cl的化合价从+1价低降低到-1价,根据电子守恒、电荷守恒和质量守恒配平该反应的离子方程式为:2NH3+ClO-=Cl-+N2H4+H2O;
(3)装置C反应生成氯气,浓盐酸具有挥发性,导致氯气不纯,氯化氢会和装置B中氢氧化钠溶液反应,导致肼的产率降低,改进方法是在装置B、C之间加装盛有饱和食盐水的洗气瓶,除去氯化氢气体;
(4)银和氧化银都可以和硝酸反应,其中单质银和硝酸反应的时候会生成气体一氧化氮,故加入足量硝酸后黑色固体全部溶解,产生无色气体,遇空气马上变为红棕色,可证明黑色固体中有Ag;氧化银可以溶解在氨水中,故ii加入的试剂为氨水,溶解的部分固体为氧化银;AgNO3和N2H4反应生成Ag和Ag2O,N2H4将AgNO3还原为Ag,说明肼有还原性,N2H4和AgNO3反应生成了Ag2O,说明N2H4有碱性,和AgNO3反应生成了AgOH,AgOH不稳定,分解为Ag2O;
(5)肼有碱性,肼为二元弱碱,和过量的硫酸反应,肼结合2个H+形成阳离子,生成的酸式盐为硫酸氢盐,所以生成物质的化学式为N2H6(HSO4)2。
化学试卷
一.单选题(每小题3分,共45分)
1.宏观辨识与微观探析是化学学科核心素养之一。下列实验现象对应的离子方程式正确的是
A.过量SO2通入滴有酚酞的NaOH溶液,溶液红色褪去:SO2 +OH- =HSO
B.大理石与盐酸接触,产生无色气泡:CO+2H+=CO2↑ +H2O
C.CO2 通入饱和Na2CO3溶液中出现浑浊现象:CO2 +H2O +CO= 2HCO
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体:2Fe +3Cu2+= 3Cu +2Fe3+
2.“纳米材料”(1nm=10-9m)已广泛应用于催化及军事科学中。“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中。有以下叙述:
①所得物质一定是溶液,
②能全部透过半透膜,
③有丁达尔现象,
④所得液体可以全部透过滤纸。
对所得分散系的上述叙述正确的是
A.①② B.②③ C.①④ D.③④
3.澳大利亚科学家Andrei V.Rode发现一种纯碳新材料“碳纳米泡沫”,其中每个泡沫约含有4000个碳原子,直径约为6~9 nm,在低于-183 ℃时,该泡沫具有永久磁性。下列叙述正确的是
A.“碳纳米泡沫”是一种新型的含碳化合物
B.“碳纳米泡沫”和金刚石的性质完全相同
C.把“碳纳米泡沫”分散到适当的溶剂中形成的分散系属于混合物
D.把“碳纳米泡沫”分散到适当的溶剂中,不能产生丁达尔效应
4.下列叙述正确的是
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
5.设NA为阿伏加德罗常数的值,下列说法正确的有几项
①2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA
④标准状况下等体积的SO2、SO3中含有相同数目硫原子
⑤由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
⑥含有0.5molKClO3的溶液电离出的Cl-为0.5mol
⑦相同温度不同压强下等质量的N2O和CO2含有的原子数目不同
A.1 B.2 C.3 D.4
6.实验室常用KMnO4、KClO3、H2O2为原料制取氧气,当制得相同质量的氧气,三个反应中电子转移数目之比为
A.1:1:1 B.2:2:1 C.1:3:1 D.3:1:3
7.下列各组离子能在指定溶液中大量共存的是
A.无色溶液中: B.含有的溶液中:
C.含有的溶液中: D.使石蕊变红的溶液中:
8.下列离子方程式书写正确的是
A.向Fe2O3中加入HI溶液:Fe2O3+6H+=2Fe3++H2O
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.向AgCl悬浊液中滴加过量的Na2S溶液:2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq)
D.足量澄清石灰水和少量NaHCO3溶液反应:2OH-+2HCO+Ca2+=2H2O+CO+CaCO3↓
9.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项 a中的物质 b中的物质 C中收集的气体 d中的物质
A 浓氨水 CaO NH3 H2O
B 稀硝酸 Cu NO2 H2O
C 稀硫酸 FeS H2S NaOH溶液
D 浓盐酸 MnO2 Cl2 NaOH溶液
A.A B.B C.C D.D
10.将一定质量的Cu与充分反应,还原产物有NO和,若反应后溶液中有、,则所用铜的质量为
A.1.6g B.3.2g C.6.4g D.8.0g
11.下列实验方案中,实验设计不恰当的是
选项 A B C D
实验装置
实验目的 制取蒸馏水 鉴别和 证明氧化铝熔点高于铝 喷泉实验
A.A B.B C.C D.D。
12.磷化氢是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料。实验室制备的方法有:ⅰ.;ⅱ.。下列说法错误的是
A.反应ⅰ不是氧化还原反应
B.加热使其分解,能得到三种生成物
C.溶液中含有、、、四种含磷微粒
D.反应ⅱ中是还原产物
13.硫酸钙可用作建筑材料和水泥原料外,也可用作硫酸、漂白粉的生产原料。生产流程如图,下列说法正确的是
A.“高温焙烧”时产生的气体均为酸性氧化物
B.漂白粉是纯净物,其成分为Ca(ClO)2
C.“接触室”与“吸收塔”内均发生了化合反应,硫的价态均升高
D.合成甲醇的化学反应为CO+2H2CH3OH
14.氯化法制取FeCl3流程:以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶,实验室模拟该方法的装置如下图所示,下列说法不正确的是
A.装置I反应的离子方程式为
B.装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl
C.装置IV洗气瓶中盛放的液体为浓盐酸
D.装置V的作用是收集FeCl3
15.向Cu、Cu2O和CuO组成的混合物中,加入的稀HNO3溶液恰好使混合物完全溶解,同时收集到2.24LNO气体(标准状况)。[已知:。]下列说法错误的是
A.发生氧化还原反应的HNO3物质的量为0.1mol
B.得到的溶液中n(Cu2+)=0.25mol
C.Cu与稀硝酸反应的离子方程式为
D.若混合物中含0.1molCu,则该混合物与足量稀硫酸充分反应,最后剩余固体12.8g
二、填空题(共50分)
16.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成1 mol X,则X的化学式为________。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4b.H3ASO4是还原产物
c.还原性:AsH3>X d.K2SO4和H2O是还原产物
(4)请将反应物的化学式和配平后的系数填入下列相应的位置中,并用“单线桥”标出电子转移的方向和数目。
17.某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 Fe3+ Fe2+ Mg2+ Al3+ Cr3+
开始沉淀时的pH 1.9 7 — — —
沉淀完全时的pH 3.2 9 11.1 8 9(>9溶解)
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaRMRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____
18.某校化学课外小组的同学依据反应S2Cl2+3Cl2+2SO24SOCl2,设计如下装置(夹持及加热装置已略)制备SOCl2(氯化亚砜)。
相关物质的数据及性质如下表:
主要性状 熔点/℃ 沸点/℃ 主要化学性质
SOCl2 淡黄至红色发烟液体 -105 78.8 遇水分解, 140℃开始分解
S2Cl2 浅黄色油状液体 -80 138 遇水分解,高于100℃时开始分解
回答下列问题:
(1)装置A中w管的作用是___________。
(2)装置C球形冷凝管中水应从___________处(填“a” 或“b” )进入,冷凝管装置的作用是___________;装置C合适的加热方式是___________。
(3)装置E中生成SO2的化学方程式为___________。
(4)装置中碱石灰的作用___________。
(5)上述装置存在一处缺陷 ,导致SOCl2产率降低,改进的方法是___________。
(6)反应后从装置C的反应液纯化得到SOCl2需要的硅酸盐质仪器有:酒精灯、接引管、锥形瓶外,还缺少___________(从下列图中选择,填标号)。
19.肼()可作火箭发射的燃料。某实验兴趣小组利用氨和次氯酸钠反应制备,并探究的性质。胼的制备装置如下图所示:
回答下列问题:
(1)A为实验室制氨的发生装置,反应前试管a盛装的固体为_______(填化学式),仪器b的作用是_______。
(2)装置C中发生的离子方程式为_______。B中生成肼的离子反应方程式为_______。
(3)上述装置存在一处缺陷会导致的产率降低,改进措施是_______。
(4)探究的性质。将制得的分离提纯后,进行如下实验。
【查阅资料】AgOH不稳定,易分解生成黑色的,可溶于氨水。
【提出假设】黑色固体可能是Ag、中的一种或两种。
【实验验证】设计如下方案,进行实验。
操作 现象 结论
i.取少量黑色固体于试管中,加入足量稀硝酸,振荡 黑色固体全部溶解,产生无色气体,遇空气马上变为红棕色 黑色固体中有_______
ii.取少量黑色固体于试管中,加入足量_______,振荡 黑色固体部分溶解 黑色固体中有
通过上述实验,得出肼具有的性质是_______。
(5)根据酸碱质子理论,结合质子()的物质是碱,已知胼与一水合氨类似,是一种二元弱碱,向肼溶液中加入过量硫酸生成的酸式盐的化学式为_______。
1.A
【详解】A.二氧化硫为酸性氧化物,过量的SO2与NaOH溶液反应生成酸式盐和水,溶液红色褪去,其离子方程式为SO2 +OH- =,故A正确;
B.大理石与盐酸接触,发生反应生成CaCl2、CO2和H2O,由于CaCO3难溶于水,在离子方程式中应保留化学式,其离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.CO2 通入饱和Na2CO3溶液中,二者发生反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则产生沉淀,即溶液出现浑浊,其离子方程式为CO2 +H2O +2Na++=2NaHCO3↓,故C错误;
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体,说明铁能与硫酸铜发生置换反应,即Fe与CuSO4发生反应,生成硫酸亚铁和Cu,其离子方程式为Fe+Cu2+=Fe2++Cu,故D错误;
答案为A。
2.D
【详解】①根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),“纳米材料”(1nm=10-9m),“纳米材料”(1nm=10-9m)是指研究开发直径为几纳米至几十纳米的材料,分散到液体分散剂中,对于所得分散系为胶体,故①错误;②胶体的微粒直径在1-100nm之间,将“纳米材料”分散到某液体中,所得分散系为胶体,半透膜上的小孔直径小于1nm,不能透过半透膜,故②错误;③胶体具有有丁达尔效应,光速通过此分散系时会形成一条光亮的“通路”,故③正确;④滤纸上的小孔直径大于100nm,所得液体能透过滤纸,故④正确;故选D。
3.C
【详解】A.纯碳新材料“碳纳米泡沫”是由碳元素组成的单质,错误;
B.纯碳新材料“碳纳米泡沫”是由碳元素组成的单质,其结构与金刚石不同,故其性质与金刚石不完全相同,错误;
C.“碳纳米泡沫”的直径约为6~9 nm,将其分散到适当的溶剂中可形成胶体,能产生丁达尔效应,胶体属于分散系,是一种混合物,正确;
D.“碳纳米泡沫”的直径约为6~9 nm,将其分散到适当的溶剂中可形成胶体,能产生丁达尔效应,错误;
故选C。
4.B
【详解】A项,FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl,故A错误;
B项,由于还原性I->Fe2+,所以向FeI2溶液中通入少量Cl2,Cl2首先与I-反应:Cl2+2I-=I2+2Cl-,故B正确;
C项,过量的Fe与热浓硫酸反应,首先产生SO2气体,随着反应的进行,浓硫酸的浓度逐渐变稀,后来稀硫酸与Fe反应产生H2,生成的气体不能被烧碱溶液完全吸收,故C错误;
D项,由于发生反应:SO2+Br2+2H2O=H2SO4+2HBr,欲检验溶液中的,应向溶液中加入BaCl2溶液,若加入Ba(NO3)2溶液,则不能排除的干扰,故D错误;
答案选B。
5.A
【详解】①氢气和氯气所处的状态不明确,故其物质的量无法计算,则和HCl的原子数目是否相同无法计算,故①错误;
②同温同压下,体积相同的氢气和氩气物质的量相同,则所含的分子数相等,故②正确;
③溶液体积不明确,溶液中含有的氯离子的个数无法计算,故③错误;
④标准状况下SO3是固体,气体摩尔体积不是22.4L/mol,则等体积的SO2、SO3物质的量不相等,硫原子数目不相同,故④错误;
⑤NO2与N2O4组成的4.6g混合气体,设NO2的物质的量为x,N2O4的物质的量为y,则46x+92y=4,6,所以x+2y=0.1,即NO2与N2O4组成的4.6g混合气体含氮原子物质的量为0.1mol,含N原子数0.1NA,故⑤错误;
⑥KClO3的溶液中KClO3的电离方程式为KClO3=K++,溶液中不存在Cl-,故⑥错误;
⑦N2O和CO2的摩尔质量都是44g/mol,二者质量相同,物质的量相同,都是3原子分子,含有原子总数相等,故⑦错误;
由上只有②正确,即正确的只有一项,选项A符合题意;答案为A。
6.B
【详解】KMnO4加热分解为锰酸钾、二氧化锰、氧气,氧元素化合价由-2升高为0,生成1mol氧气转移4mol电子;KClO3加热分解为氯化钾、氧气,氧元素化合价由-2升高为0,生成1mol氧气转移4mol电子;H2O2分解为水和氧气,氧元素化合价由-1升高为0,生成1mol氧气转移2mol电子;当制得相同质量的氧气,三个反应中电子转移数目之比为2:2:1,故选B。
7.C
【详解】A.含有Fe3+的溶液为黄色,与无色溶液不符,A与题意不符;
B.含有的溶液中:Ba2+与反应生成硫酸钡沉淀,B与题意不符;
C.含有Cl-的溶液中:Cu2+、K+、、Cl-、之间不反应,能大量共存,C符合题意;
D.使石蕊变红的溶液中显酸性:H+、反应生成二氧化碳和水,不能大量共存,D与题意不符;
答案为C。
8.C
【详解】A.向Fe2O3中加入HI溶液,生成的铁离子会继续氧化碘离子,正确离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,A错误;
B.钠与CuSO4溶液反应,Na与水反应生成氢氧化钠,再与CuSO4反应生成氢氧化铜沉淀:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,B错误;
C.向AgCl悬浊液中滴加过量的Na2S溶液,由于Ag2S的溶解度比AgCl小很多,会发生沉淀的转化:2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq),C正确;
D.足量澄清石灰水和少量NaHCO3溶液反应,离子方程式为:OH-+HCO+Ca2+=H2O+CaCO3↓,D错误。
故答案选C。
9.C
【详解】A.氨气的密度小于空气的密度,所以用向下排空气法收集,不是向上排空气法,导气管应“短进长出”,A错误;
B.稀硝酸与铜反应生成一氧化氮,得不到二氧化氮,且一氧化氮与水不反应,不能用水吸收,B错误;
C.稀硫酸与FeS反应生成硫化氢气体,密度大于空气,所以用向上排空气法,硫化氢有毒,可与氢氧化钠溶液反应生成氯化钠和亚硫酸钠,可以被碱液吸收,C正确;
D.浓盐酸与二氧化锰制取氯气需要加热,缺少加热仪器,不能得到氯气,D错误;
故答案选C。
10.B
【详解】Cu与充分反应,还原产物有NO和,若反应后溶液中有、,说明Cu完全反应,根据元素守恒,可得Cu(NO3)2的物质的量为,则参加反应Cu的物质的量为,质量为64g/mol×0.05mol=3.2g,故答案选B。
11.A
【详解】A.蒸馏时,需要控制的量蒸气的温度,因此,温度计的水银球应放在蒸馏烧瓶的支管口处,A错误;
B.碳酸氢钠不稳定,受热分解生成二氧化碳,遇见澄清石灰水变浑浊,所以可以鉴别,B正确;
C.铝箔受热熔化在铝外面形成一层致密的氧化铝,包在融化的铝外面,形成一个圆球似的液滴状但是并不滴落下来,证明氧化铝熔点高于铝,C正确;
D.挤入水时,氨气迅速溶于水,使瓶内的压强远远小于外界的大气压,从而形成喷泉实验,D正确;
故选A。
12.C
【详解】A.反应i.PH4I+NaOH=NaI+PH3↑+H2O,该反应中没有元素化合价的变化,不属于氧化还原反应,故A正确;
B.PH4I分解生成PH3、HI,HI也能分解生成H2、I2,所以加热PH4I使其分解,能得到PH3、H2、I2三种生成物,故B正确;
C.H3PO2是一元酸,KH2PO2是正盐,能部分发生水解反应生成H3PO2,则KH2PO2溶液中含有H3PO2、两种含磷微粒,故C错误;
D.反应ii中P4反应生成PH3,P元素的化合价降低,所以是还原产物,故D正确;
故选:C。
13.D
【分析】硫酸钙在焦炭、空气和高温条件下生成CO、SO2、CaO,SO2与氧气在加热和催化剂条件下转化为SO3,SO3和水反应生成H2SO4;CO和H2在催化剂条件下反应生成CH3OH;CaO和水反应生成氢氧化钙,氯气和石灰乳反应生成漂白粉。
【详解】A.酸性氧化物指与碱反应生成盐和水的化合物,CO不溶于水,不与碱反应,A错误;
B.漂白粉主要成分是Ca(ClO)2,还含有CaCl2等物质,因此漂白粉是混合物,B错误;
C.接触室中发生反应2SO2+O2SO3,属于化合反应,S元素化合价由+4价升高为+6价,吸收塔中发生SO3+H2O=H2SO4,属于化合反应,但是S元素的化合价没有发生变化,C错误;
D.“催化”中CO和H2合成CH3OH,方程式为CO+2H2CH3OH,D正确;
故答案为:D。
14.C
【分析】由实验装置可知,本实验用二氧化锰和浓盐酸反应制氯气,氯气经饱和食盐水和浓硫酸除杂后通入装有铁粉的硬质玻璃管中,在加热的条件下氯气和铁粉发生反应生成氯化铁蒸气,氯化铁蒸气随气流进入装置Ⅴ冷凝为固体;装置Ⅳ中装有浓硫酸,防止氯化铁发生潮解和水解;最后是尾气处理装置,防止污染空气。
【详解】A.装置I中是浓盐酸和二氧化锰共同受热制取氯气,反应的离子方程式为,A正确;
B.浓盐酸易挥发,制得的氯气含有杂质氯化氢,装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl,B正确;
C.装置IV洗气瓶的作用是防止水蒸气进入装置Ⅴ导致氯化铁发生潮解和水解,故其中应盛放浓硫酸,浓盐酸中的水蒸气可以逸出,达不到保护氯化铁的目的,C错误;
D.装置V相当于捕集器,氯化铁蒸气在此冷凝为固体,故其作用是收集FeCl3,D正确;
故选C。
15.D
【分析】HNO3的物质的量为0.6mol/L×1L=0.6mol,NO的物质的量为=0.1mol。
【详解】A.HNO3作为氧化剂,还原产物为NO,根据分析,生成NO为0.1mol,故发生还原反应的HNO3为0.1mol,A正确;
B.反应后溶液中的溶质为Cu(NO3)2,根据分析,起到酸性作用的HNO3为0.6mol-0.1mol=0.5mol,故n(Cu2+)=n(HNO3)=0.25mol,B正确;
C.Cu与稀硝酸反应生成Cu(NO3)2、NO和H2O,离子方程式为,C正确;
D.混合物与硝酸反应时,Cu和Cu2O被氧化,失去的总电子为HNO3所得电子,物质的量为0.1mol×3=0.3mol,故Cu2O转移电子的物质的量为0.3mol -0.1mol×2=0.1mol,n(Cu2O)=×0.1mol=0.05mol,根据溶液中n(Cu2+)=0.25mol,可知Cu元素共0.25mol,原混合物中n(CuO)= 0.25mol-0.05mol×2-0.1mol=0.05mol。混合物与稀硫酸反应时, Cu不与稀H2SO4反应,根据可知,生成的Cu的物质的量n’(Cu)= n(Cu2O)=0.05mol,故反应后所得的Cu的物质的量为n(Cu)+n’(Cu)=0.15mol,质量为0.15mol×64g/mol=9.6g,D错误;
故选D。
16. AsH3 Br2 ac
【分析】(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)氧化剂的氧化性最强,还原剂的还原性最强,氧化剂对应的产物叫还原产物;
(4)根据化学反应中化合价的升降情况标电子转移情况。
【详解】(1) KBrO3在反应中得到电子,所以KBrO3是氧化剂, AsH3变成了H3AsO4,所以AsH3是还原剂;
因此,本题正确答案是: AsH3;
(2)设X中溴元素的化合价为x,则0.2×(5-x)=1,所以x=0,故X为Br2;
因此,本题正确答案是: Br2;
(3)a、反应中KBrO3是氧化剂, H3AsO4,是氧化产物,氧化性为KBrO3>H3AsO4,故a正确;
b、AsH3变成了H3AsO4,砷元素化合价升高,所以H3AsO4是氧化产物,故b错误;
c、AsH3是还原剂, Br2是还原产物,所以还原性AsH3> Br2,故c正确;
d、K2SO4和H2O中的元素化合价均未变化,既不是氧化产物也不是还原产物,故d错误;
综上所述,本题正确选项ac;
(4)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-;
因此,本题正确答案是:。
17. 65.2 250 mL容量瓶、胶头滴管 沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2~3次 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+、Al3+ Ca2+、Mg2+ Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4
【分析】含铬污泥预处理后,用硫酸浸取液中金属离子主要是Cr3+,其次是 Fe2+、Fe3+、A13+、Ca2+、Mg2+,过滤除去不溶性杂质,然后加入过氧化氢氧化铬离子、亚铁离子为高价态,加入氢氧化钠溶液调节溶液pH=8使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子,得到溶液中通入二氧化硫还原得到Cr(OH)(H2O)5SO4。
【详解】(1)浓硫酸物质的量浓度为==18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,实验室中没有200 mL的容量瓶,应该选用250mL容量瓶配制,则需要浓硫酸体积为=0.0652L=65.2mL,需用到的玻璃仪器有:胶头滴管、玻璃棒、烧杯和100mL量筒、250mL容量瓶,所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需250mL容量瓶,胶头滴管,故答案为:65.2;250mL容量瓶,胶头滴管;
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次,故答案为:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次;
(3)双氧水有强氧化性,能氧化还原性的物质,加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面Fe2+有还原性,Fe2+能被双氧水氧化为高价离子,Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)依据表格数据中离子开始沉淀和完全沉淀的pH,调节pH至8,可使Al3+、Fe3+生成沉淀,故答案为:Al3+、Fe3+;
(5)因镁离子、钙离子沉淀的pH较大,可用离子交换法除去,故答案为:Ca2+、Mg2+;
(6)通SO2气体时,还原过程中铬元素化合价+6价变化为+3价,Na2Cr2O~2CrOH(H2O)5SO4~6e-,硫元素化合价变化为+6价,SO2~SO42-~2e-,根据得失电子守恒,得到电子转移总数6e-,结合原子守恒配平得到化学方程式:Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4,故答案为:Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4。
【点睛】本题的易错点为(6),要注意氧化还原反应中缺项配平的练习和应用,配平时关键是反应前后Cr元素化合价的正确标注和分析。
18. 平衡气压,使浓盐酸顺利滴下 a 冷凝回流 SOCl2 80℃热水浴 Cu +2H2SO4(浓) CuSO4 + SO2↑+ 2H2O 吸收 SO2、Cl2等气体,防止空气中的水蒸气进入装置 C 将装置 B 中饱和食盐水换成浓硫酸(或 B、C 间加装盛有浓硫酸的洗气瓶) adef
【分析】根据实验原理及实验装置分析,装置A是用浓盐酸和漂白粉制备氯气,B中的饱和食盐水目的是除去杂质HCl;E装置是用浓硫酸与铜反应制备二氧化硫气体,D中浓硫酸作用是干燥二氧化硫气体;将氯气及二氧化硫气体通入C中与S2Cl2反应制备SOCl2,冷凝管的作用为冷凝回流S2Cl2和SOCl2,连接的干燥管作用是防止空气中水分进入和剩余气体的尾气处理,据此分析解答。
【详解】(1)根据图示装置特点分析,装置A中w管的作用是平衡气压,使浓盐酸顺利滴下,故答案为:平衡气压,使浓盐酸顺利滴下;
(2)为了使冷凝水充满冷凝管,装置C球形冷凝管中水应从下端通入,即a处进入;由题干信息知SOCl2的沸点为78.8℃,且反应温度为80℃,所以冷凝管的作用是冷凝回流SOCl2;反应温度应该控制在80℃,所以适合的加热方式为80℃水浴加热;故答案为:a;冷凝回流 SOCl2;80℃水浴加热;
(3)装置E中铜和浓硫酸在加热的条件下反应生成硫酸铜、SO2和水,反应方程式为:Cu +2H2SO4(浓) CuSO4 + SO2↑+ 2H2O,故答案为:Cu +2H2SO4(浓) CuSO4 + SO2↑+ 2H2O;
(4)根据上述分析,装置中碱石灰的作用是吸收未反应的SO2、Cl2等气体,同时防止空气中的水蒸气进入装置 C,故答案为:吸收 SO2、Cl2等气体,防止空气中的水蒸气进入装置 C;
(5)已知SOCl2易水解,在氯气进入C中时未干燥,会导致SOCl2产率降低,应该增加干燥装置,故答案为:将装置 B 中饱和食盐水换成浓硫酸(或 B、C 间加装盛有浓硫酸的洗气瓶);
(6)由题干信息知,SOCl2与S2Cl2沸点不同,可以用蒸馏的方法得到纯净的SOCl2,蒸馏装置所需的玻璃仪器含有蒸馏烧瓶、冷凝管、温度计、石棉网,故答案为:adef。
19.(1) NH4Cl Ca(OH)2 导气,防止倒吸
(2) 2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 2NH3+ClO-=Cl-+N2H4+H2O
(3)在装置B、C之间加装盛有饱和食盐水的洗气瓶
(4) Ag 氨水 还原性和碱性
(5)N2H6(HSO4)2
【分析】实验室用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,装置C为生成氯气装置,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠再和氨生成肼。
【详解】(1)实验室用氨和次氯酸钠反应制备肼,装置A为生成氨气的装置,且反应为固体加热反应,则试管a中的试剂为氯化铵和氢氧化钙固体,两者反应生成氨气和氯化钙、水;氨气极易溶于水,仪器b的作用是将氨气通入装置B中,且球形部分可以防止倒吸,故答案为:NH4Cl、Ca(OH)2;导气、防止倒吸;
(2)装置C为生成氯气装置,浓盐酸和高锰酸钾反应生成氯气、氯化锰、氯化钾和水,离子方程式为: 2+16H++10Cl-=2Mn2++5Cl2↑+8H2O ;生成的氯气通入NaOH溶液中,两者反应生成氯化钠、NaClO和水,NaClO和通入的氨气反应生成肼,在此反应中,N的化合价从-3价升高到-2价,则NaClO做氧化剂,Cl的化合价从+1价低降低到-1价,根据电子守恒、电荷守恒和质量守恒配平该反应的离子方程式为:2NH3+ClO-=Cl-+N2H4+H2O;
(3)装置C反应生成氯气,浓盐酸具有挥发性,导致氯气不纯,氯化氢会和装置B中氢氧化钠溶液反应,导致肼的产率降低,改进方法是在装置B、C之间加装盛有饱和食盐水的洗气瓶,除去氯化氢气体;
(4)银和氧化银都可以和硝酸反应,其中单质银和硝酸反应的时候会生成气体一氧化氮,故加入足量硝酸后黑色固体全部溶解,产生无色气体,遇空气马上变为红棕色,可证明黑色固体中有Ag;氧化银可以溶解在氨水中,故ii加入的试剂为氨水,溶解的部分固体为氧化银;AgNO3和N2H4反应生成Ag和Ag2O,N2H4将AgNO3还原为Ag,说明肼有还原性,N2H4和AgNO3反应生成了Ag2O,说明N2H4有碱性,和AgNO3反应生成了AgOH,AgOH不稳定,分解为Ag2O;
(5)肼有碱性,肼为二元弱碱,和过量的硫酸反应,肼结合2个H+形成阳离子,生成的酸式盐为硫酸氢盐,所以生成物质的化学式为N2H6(HSO4)2。
同课章节目录
