化学人教版(2019)选择性必修2 2.3.1.共价键的极性 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.1.共价键的极性 课件(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 533.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-12 20:40:15 | ||
图片预览








文档简介
(共20张PPT)
第二章:分子结构与性质
第三节:分子结构与物质性质
第一课时:共价键的极性
课标分解
【学习重难点】
重点:1、能理解共价键的极性与分子极性的关系。
2、会判断极性分子和非极性分子。
难点:1、能解释共价键的极性对化学性质的影响。
2、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
课堂导入
如何判断共价键是极性共价键还是非极性共价键?
第二章:分子结构与性质 第二节:分子结构与物质性质
什么是极性、其本质是什么?
一、极性的解释。
HCl
HCl
+
-
电子转移或者共用电子对的偏移,导致电子分布不均,出现正极和负极。
电子云分布不均,正负电荷中心不重合。
第二章:分子结构与性质 第二节:分子结构与物质性质
二、极性与非键极性共价键的判断。
非键极性共价键
分类
键极性共价键
成键原子:
共用电子对:
成键原子:
共用电子对:
同种非金属原子
不发生偏移
不同种非金属原子
发生偏移
第二章:分子结构与性质 第二节:分子结构与物质性质
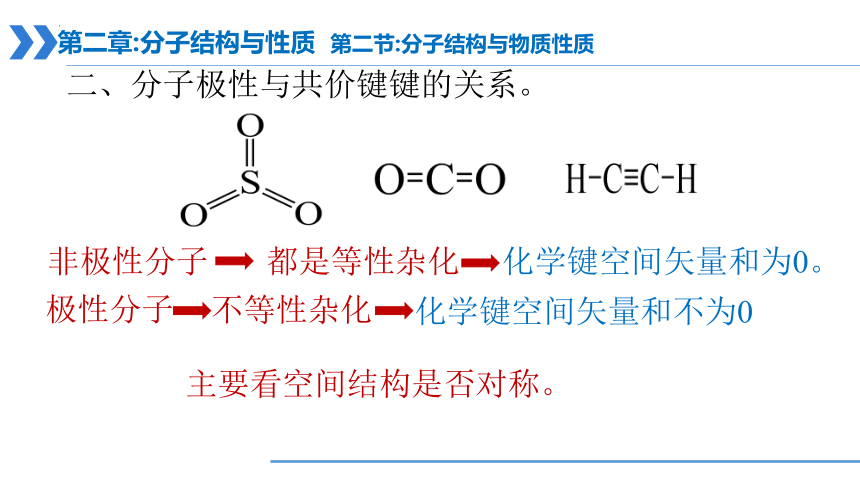
二、分子极性与共价键键的关系。
非极性分子:
分类
极性分子:
只含非极性共价键的分子。
含极性共价键的分子。
含有极性共价键的分子一定是极性分子吗?
第二章:分子结构与性质 第二节:分子结构与物质性质
二、分子极性与共价键键的关系。
都是等性杂化
化学键空间矢量和为0。
极性分子
非极性分子
不等性杂化
第二章:分子结构与性质 第二节:分子结构与物质性质
化学键空间矢量和不为0
主要看空间结构是否对称。
【课堂练习】
CH4
CO2
SO2
SO3
NH3
BCl3
CCl4
PCl5
H2O
HCl
极性分子
非极性分子
非极性分子
非极性分子
极性分子
极性分子
非极性分子
非极性分子
非极性分子
极性分子
思考
共价键的极性对物质的性质有什么影响呢?
第二章:分子结构与性质 第二节:分子结构与物质性质
主要看空间结构是否对称、矢量和是否为零。
CH3Cl极性还是非极性。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
1、基团的给电子性和吸电子性。
(1)给电子基团。
(C和H的电负性都很小)
所有烃基( )都是给电子基团,烃基越大给电子能力越大。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
1、基团的给电子性和吸电子性。
(2)吸电子基团。
(O的电负性很大)
电负性较大的原子或者原子团都会吸电子,这类原子团称为吸电子基团。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
2、共价键的极性对化学性质的影响。
R
X
羧基的极性越大酸性越强。
羧基的极性越小酸性越弱。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
2、共价键的极性对化学性质的影响。
R
羧基上连接了给电子基团,羧基极性减弱,酸性减弱。且给电子基团越大,极性越小酸性越弱。
下列羧酸的酸性谁强谁弱?
【思考探究】
>
>
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
2、共价键的极性对化学性质的影响。
X
羧基上连接了吸电子基团,羧基极性增强,酸性越强。且吸电子基团吸电子能力与越大或者吸电子基团越多极性越大酸性越强。
已知电负性:F > Cl > Br > I
>
>
下列羧酸的酸性谁强谁弱?
【思考探究】
>
>
下列羧酸的酸性谁强谁弱?
【思考探究】
>
>
下列羧酸的酸性谁强谁弱?
【思考探究】
请解释解释下列现象。
【课堂练习】
已知 是给电子基团为什么 溶液呈酸性而
呈中性?
苯环的给电子性小,乙基的给电子性大,所以乙醇中的羟基极性小苯酚中的羟基极性大,更容易电离出H+,所以苯酚溶液呈酸性。
请解释解释下列现象。
【课堂练习】
请推测 、 、 三
种物质中的羟基氢的活性大小。
>
>
请推测三者与钠反应的速率快慢。
第二章:分子结构与性质
第三节:分子结构与物质性质
第一课时:共价键的极性
课标分解
【学习重难点】
重点:1、能理解共价键的极性与分子极性的关系。
2、会判断极性分子和非极性分子。
难点:1、能解释共价键的极性对化学性质的影响。
2、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
课堂导入
如何判断共价键是极性共价键还是非极性共价键?
第二章:分子结构与性质 第二节:分子结构与物质性质
什么是极性、其本质是什么?
一、极性的解释。
HCl
HCl
+
-
电子转移或者共用电子对的偏移,导致电子分布不均,出现正极和负极。
电子云分布不均,正负电荷中心不重合。
第二章:分子结构与性质 第二节:分子结构与物质性质
二、极性与非键极性共价键的判断。
非键极性共价键
分类
键极性共价键
成键原子:
共用电子对:
成键原子:
共用电子对:
同种非金属原子
不发生偏移
不同种非金属原子
发生偏移
第二章:分子结构与性质 第二节:分子结构与物质性质
二、分子极性与共价键键的关系。
非极性分子:
分类
极性分子:
只含非极性共价键的分子。
含极性共价键的分子。
含有极性共价键的分子一定是极性分子吗?
第二章:分子结构与性质 第二节:分子结构与物质性质
二、分子极性与共价键键的关系。
都是等性杂化
化学键空间矢量和为0。
极性分子
非极性分子
不等性杂化
第二章:分子结构与性质 第二节:分子结构与物质性质
化学键空间矢量和不为0
主要看空间结构是否对称。
【课堂练习】
CH4
CO2
SO2
SO3
NH3
BCl3
CCl4
PCl5
H2O
HCl
极性分子
非极性分子
非极性分子
非极性分子
极性分子
极性分子
非极性分子
非极性分子
非极性分子
极性分子
思考
共价键的极性对物质的性质有什么影响呢?
第二章:分子结构与性质 第二节:分子结构与物质性质
主要看空间结构是否对称、矢量和是否为零。
CH3Cl极性还是非极性。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
1、基团的给电子性和吸电子性。
(1)给电子基团。
(C和H的电负性都很小)
所有烃基( )都是给电子基团,烃基越大给电子能力越大。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
1、基团的给电子性和吸电子性。
(2)吸电子基团。
(O的电负性很大)
电负性较大的原子或者原子团都会吸电子,这类原子团称为吸电子基团。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
2、共价键的极性对化学性质的影响。
R
X
羧基的极性越大酸性越强。
羧基的极性越小酸性越弱。
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
2、共价键的极性对化学性质的影响。
R
羧基上连接了给电子基团,羧基极性减弱,酸性减弱。且给电子基团越大,极性越小酸性越弱。
下列羧酸的酸性谁强谁弱?
【思考探究】
>
>
三、共价键的极性对化学性质的影响。
第二章:分子结构与性质 第二节:分子结构与物质性质
2、共价键的极性对化学性质的影响。
X
羧基上连接了吸电子基团,羧基极性增强,酸性越强。且吸电子基团吸电子能力与越大或者吸电子基团越多极性越大酸性越强。
已知电负性:F > Cl > Br > I
>
>
下列羧酸的酸性谁强谁弱?
【思考探究】
>
>
下列羧酸的酸性谁强谁弱?
【思考探究】
>
>
下列羧酸的酸性谁强谁弱?
【思考探究】
请解释解释下列现象。
【课堂练习】
已知 是给电子基团为什么 溶液呈酸性而
呈中性?
苯环的给电子性小,乙基的给电子性大,所以乙醇中的羟基极性小苯酚中的羟基极性大,更容易电离出H+,所以苯酚溶液呈酸性。
请解释解释下列现象。
【课堂练习】
请推测 、 、 三
种物质中的羟基氢的活性大小。
>
>
请推测三者与钠反应的速率快慢。
