8.2 海洋 “晒盐 ” 同步练习(含答案) 2022-2023学年鲁教版九年级下册化学
文档属性
| 名称 | 8.2 海洋 “晒盐 ” 同步练习(含答案) 2022-2023学年鲁教版九年级下册化学 |
|
|
| 格式 | zip | ||
| 文件大小 | 270.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-11 17:46:22 | ||
图片预览

文档简介
8.2 海洋 “晒盐 ” 同步练习 2022-2023学年鲁教版九年级下册化学
一、单选题
1.下列生产、生活中涉及的化学术语不匹配的是( )
A.从海水中制得食盐﹣﹣蒸发
B.用活性炭去除水中的有色物质﹣﹣吸附
C.煤隔绝空气加强热制得煤焦油等物质﹣﹣分馏
D.洗油污前,将纯碱放入水中﹣﹣溶解
2.下列实验操作中,正确的是( )
A. 测定空气中氧气含量
B. 过滤
C. 称量固体
D. 探究分子不断运动
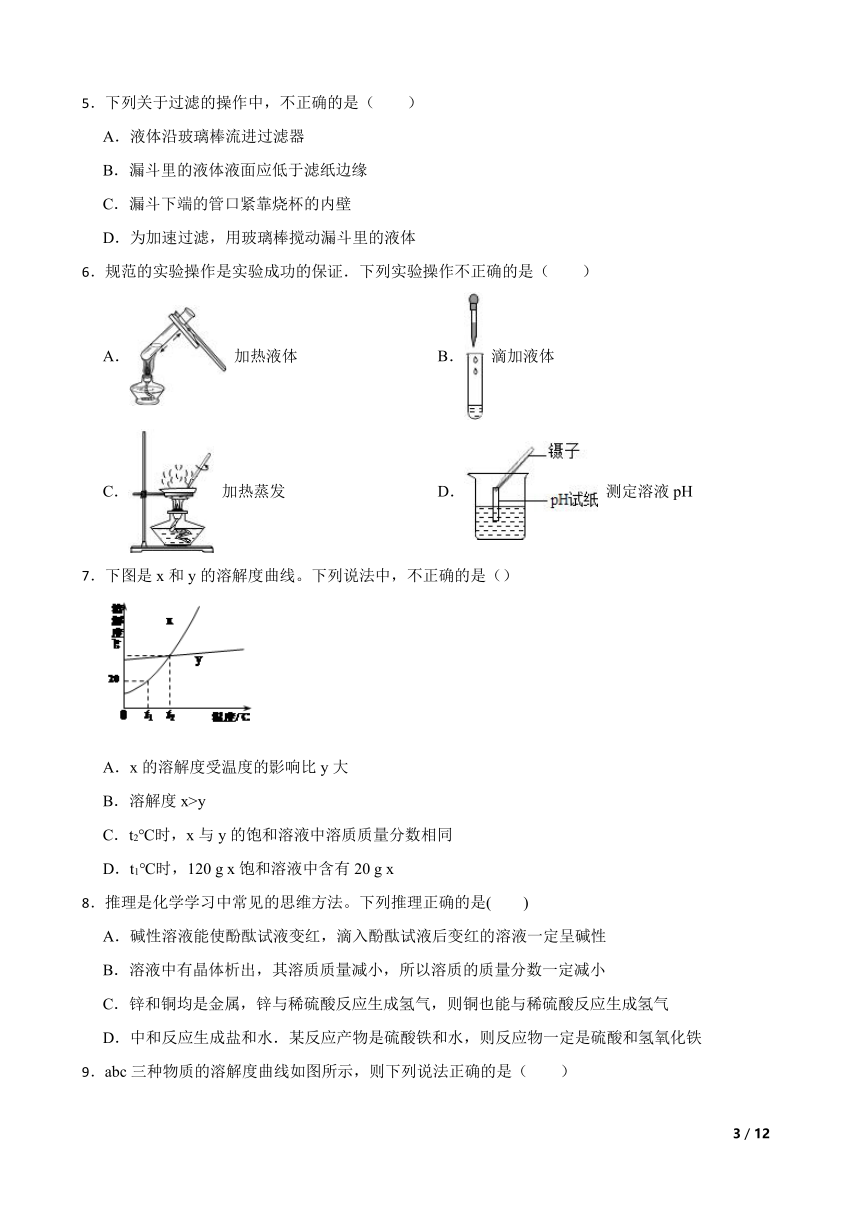
3.下图所示的实验操作错误的是( )
A.检查气密性
B.加入固体粉末
C.滴加液体
D.过滤粗盐水
4.下列图示实验基本操作中正确的是( )
A. 稀释浓硫酸
B. 倾倒液体
C. 称量固体药品
D. 蒸发溶液
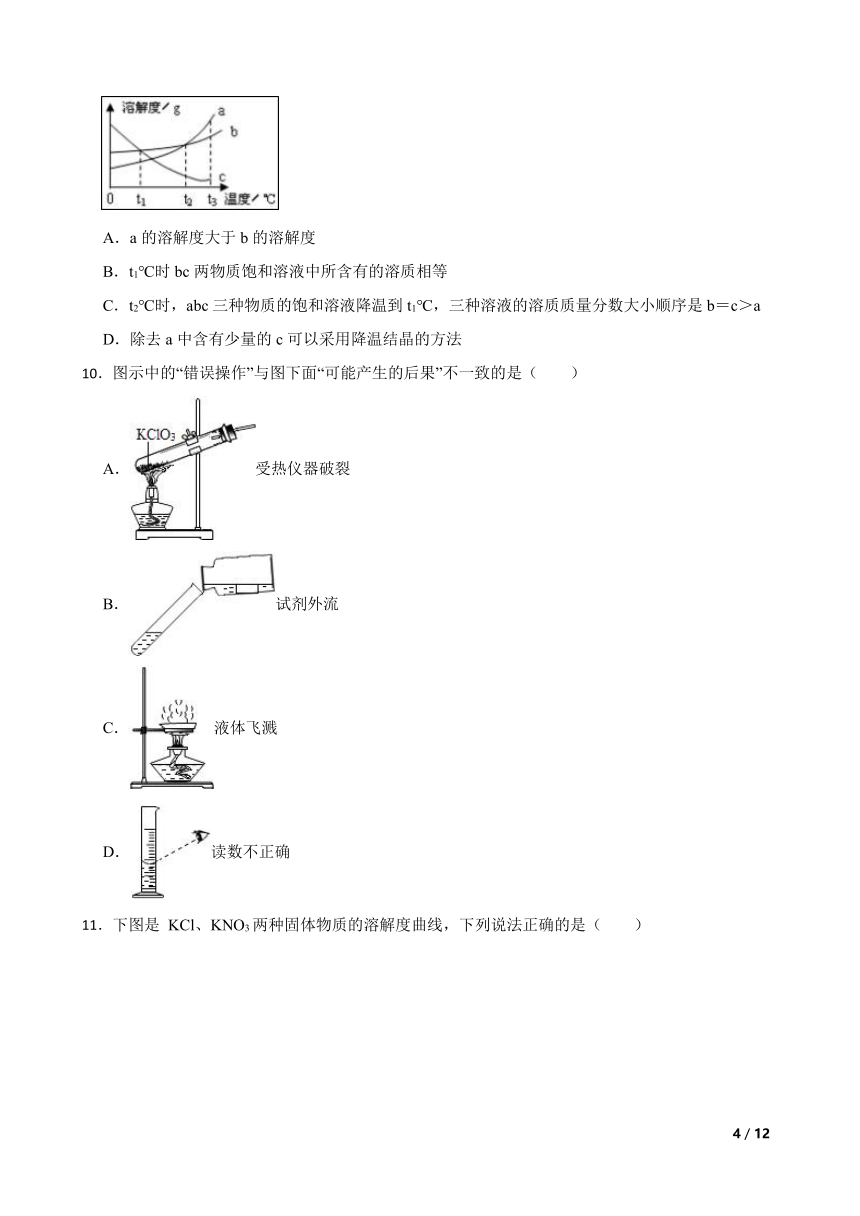
5.下列关于过滤的操作中,不正确的是( )
A.液体沿玻璃棒流进过滤器
B.漏斗里的液体液面应低于滤纸边缘
C.漏斗下端的管口紧靠烧杯的内壁
D.为加速过滤,用玻璃棒搅动漏斗里的液体
6.规范的实验操作是实验成功的保证.下列实验操作不正确的是( )
A. 加热液体 B. 滴加液体
C. 加热蒸发 D. 测定溶液pH
7.下图是x和y的溶解度曲线。下列说法中,不正确的是()
A.x的溶解度受温度的影响比y大
B.溶解度x>y
C.t2℃时,x与y的饱和溶液中溶质质量分数相同
D.t1℃时,120 g x饱和溶液中含有20 g x
8.推理是化学学习中常见的思维方法。下列推理正确的是( )
A.碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性
B.溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小
C.锌和铜均是金属,锌与稀硫酸反应生成氢气,则铜也能与稀硫酸反应生成氢气
D.中和反应生成盐和水.某反应产物是硫酸铁和水,则反应物一定是硫酸和氢氧化铁
9.abc三种物质的溶解度曲线如图所示,则下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.t1℃时bc两物质饱和溶液中所含有的溶质相等
C.t2℃时,abc三种物质的饱和溶液降温到t1℃,三种溶液的溶质质量分数大小顺序是b=c>a
D.除去a中含有少量的c可以采用降温结晶的方法
10.图示中的“错误操作”与图下面“可能产生的后果”不一致的是( )
A.受热仪器破裂
B.试剂外流
C.液体飞溅
D.读数不正确
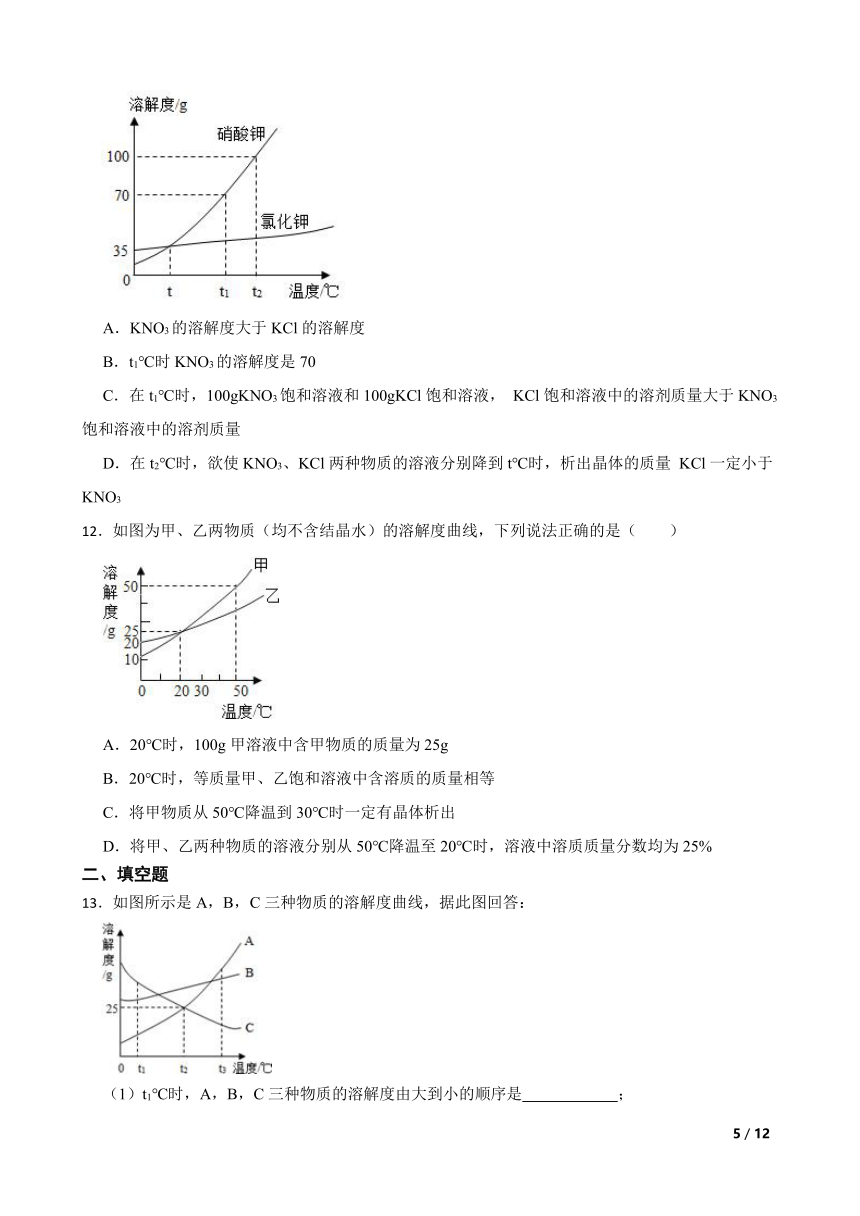
11.下图是 KCl、KNO3两种固体物质的溶解度曲线,下列说法正确的是( )
A.KNO3的溶解度大于KCl的溶解度
B.t1℃时KNO3的溶解度是70
C.在t1℃时,100gKNO3饱和溶液和100gKCl饱和溶液, KCl饱和溶液中的溶剂质量大于KNO3饱和溶液中的溶剂质量
D.在t2℃时,欲使KNO3、KCl两种物质的溶液分别降到t℃时,析出晶体的质量 KCl一定小于KNO3
12.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.20℃时,100g甲溶液中含甲物质的质量为25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.将甲物质从50℃降温到30℃时一定有晶体析出
D.将甲、乙两种物质的溶液分别从50℃降温至20℃时,溶液中溶质质量分数均为25%
二、填空题
13.如图所示是A,B,C三种物质的溶解度曲线,据此图回答:
(1)t1℃时,A,B,C三种物质的溶解度由大到小的顺序是 ;
(2)t2℃时,将30gA放入100g水中,充分搅拌后,所得溶溶液的溶质质量分数是 ;
14. 右图是氯化钠和硝酸钾两种固体物质的溶解度曲线。
(1)硝酸钾溶液中的溶剂是 。
(2) 图中b表示 的溶解度曲线。
(3)某兴趣小组为了研究NaCl和KNO3的溶解和结晶,做了两组实验(室温下),其过程如下:
【第一组】
【第二组】
上述实验过程中所得溶液一定达到饱和的是(填数字序号,下同) ;溶质质量分数一定相等的是 。
15.大多数物质的溶解度随温度的升高 ,例如硝酸钾;有些物质的溶解度随温度的升高而 ,例如氯化钠;氢氧化钙的溶解度随温度的升高 要使氯化钠从溶液中析出可以 ,使硝酸钾从溶液中析出可以 ,如果氯化钠中混有少量硝酸钾,提纯氯化钠 ;硝酸钾中混有少量氯化钠,提纯硝酸钾 .
16.硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是 .
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是 的溶液.
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的 (填“饱和”或“不饱和”)溶液.保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数 (填“变大”、“不变”或“变小”).
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 .
三、综合题
17.二氧化锰因在工业生产中应用广泛而备受关注,制取二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
(1)用高锰酸钾制备
资料一:①3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O
②K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为 ,其反应类型是 ;将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是 。
(2)用硫酸锰制备
电解 MnSO4水溶液可制得MnO2,同时生成氢气和H2SO4,该反应的化学方程式为
(3)用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂回收,流程如下:
请回答下列问题:
a.“滤液”中溶质的主要成分是 (填化学式);
b.在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、玻璃棒和 ;
c.MnO2与碳粉经下列三步反应制得纳米MnO2
①2MnO2+C MnO+CO2↑
②MnO2+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有 (填序号)。
18.
(1)Ⅰ:在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题:
请用图中的序号表示配制溶液的正确操作顺序 。
(2)认真观察②,其中的不正确操作是: 。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数 (填“大于”、“小于”或“等于”)12%。
(3)改正②不正确后,若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是 。(填字母序号)
A.转移已称好的氯化钠固体时,部分洒落在烧杯外
B.用量筒量取水时俯视读数
C.转移已配好的溶液时,有少量溶液溅出
(4)Ⅱ:根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ 10 20 30 40 50 60 70 80
溶解度/g 80.8 87.6 94.9 103 113 124 136 149
20℃时,将90 g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的最简质量比为 。
(5)80℃时,将249 g NaNO3饱和溶液降温至 ℃时,溶液质量变为224g。
(6)50℃时将200g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
19.我省海水资源丰富。工业上利用海水可以获取多种重要的化工原料。
(1)氯化钠是必不可少的生活用品,“烧干海水变银山”是郭沫若对海南莺歌海盐场的赞美诗作,海水“晒盐”是通过 (填“蒸发结晶”或“降温结晶”)的方法获取食盐。
(2)抗日战争期间,我国著名制碱专家侯德榜打破西方国家对制碱技术的垄断,创立“侯氏制碱法”,促进了世界制碱技术的发展。其生产原理示意图如下:
①制碱过程中,可以循环利用的物质是 。产物中可作氮肥的是 。
②产物中NaHCO3比NH4Cl先结晶析出。请结合生产原理及上图解释其原因 。
(3)海水资源丰富,工业以海水为原料提取镁的过程如图(假设每一步均恰好完全反应)
①上述反应I、ⅡⅢ、Ⅳ中涉及的基本反应类型有 种(填“一”“二”“三”或“四”)。
②操作①中所得滤渣的化学式为 。
③请写出反应Ⅲ的化学方程式 。
四、实验探究题
20.气体的实验室制取是学生必备的基本实验技能,请根据下列装置,回答问题:
(1)标号①的仪器名称是 ;
(2)实验室制取CO2,可选用图1中的装置组合是 (填写装置序号),判断CO2已收集满的方法是 ;
(3)实验室用氯酸钾和二氧化锰的混合物制取O2的化学方程式是 ;
(4)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假设已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是 (填写实验序号);
a.烘干b.溶解c.过滤d.洗涤
(5)图2是常用作实验室制取气体的发生装置,请分析该装置的一个优点 ;
(6)甲烷是一种无色无味的气体,密度比空气小且不与空气反应.某兴趣小组同学用加热无水醋酸钠和碱石灰的固体混合物制取甲烷,他们应选择的发生装置是 (填序号).
答案解析部分
1.【答案】C
2.【答案】B
3.【答案】D
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】A
9.【答案】D
10.【答案】B
11.【答案】C
12.【答案】B
13.【答案】(1)C>B>A
(2)20%
14.【答案】水;氯化钠(或NaCl);②⑥⑨;①和⑤;⑥和⑨
15.【答案】而增大;变化不大;而减小;蒸发结晶;降温结晶;蒸发结晶、再过滤;加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤
16.【答案】氯化钾;硝酸钾;饱和;不变;温度不低于t1℃
17.【答案】(1)2KMnO4 K2MnO4+MnO2+O2↑;分解反应;使锰酸钾转化得到二氧化锰,获得更多的二氧化锰
(2)MnSO4+2H2O H2↑+H2SO4+ MnO2↓
(3)NaAlO2;漏斗;①③
18.【答案】(1)④②①⑤③
(2)药品和砝码位置颠倒;小于
(3)A
(4)187.6;9:10
(5)60
(6)13
19.【答案】(1)蒸发结晶
(2)CO2;NH4Cl;相同温度下,NaHCO3的溶解低且反应消耗水
(3)三;Mg(OH)2;Mg(OH)2+2HCl=MgCl2+2H2O
20.【答案】(1)集气瓶
(2)BC;将燃着的小木条放在集气瓶口,若木条熄灭,则已满
(3)2KClO3 2KCl+3O2↑
(4)bcda
(5)可以控制反应的发生和停止
(6)A
1 / 1
一、单选题
1.下列生产、生活中涉及的化学术语不匹配的是( )
A.从海水中制得食盐﹣﹣蒸发
B.用活性炭去除水中的有色物质﹣﹣吸附
C.煤隔绝空气加强热制得煤焦油等物质﹣﹣分馏
D.洗油污前,将纯碱放入水中﹣﹣溶解
2.下列实验操作中,正确的是( )
A. 测定空气中氧气含量
B. 过滤
C. 称量固体
D. 探究分子不断运动
3.下图所示的实验操作错误的是( )
A.检查气密性
B.加入固体粉末
C.滴加液体
D.过滤粗盐水
4.下列图示实验基本操作中正确的是( )
A. 稀释浓硫酸
B. 倾倒液体
C. 称量固体药品
D. 蒸发溶液
5.下列关于过滤的操作中,不正确的是( )
A.液体沿玻璃棒流进过滤器
B.漏斗里的液体液面应低于滤纸边缘
C.漏斗下端的管口紧靠烧杯的内壁
D.为加速过滤,用玻璃棒搅动漏斗里的液体
6.规范的实验操作是实验成功的保证.下列实验操作不正确的是( )
A. 加热液体 B. 滴加液体
C. 加热蒸发 D. 测定溶液pH
7.下图是x和y的溶解度曲线。下列说法中,不正确的是()
A.x的溶解度受温度的影响比y大
B.溶解度x>y
C.t2℃时,x与y的饱和溶液中溶质质量分数相同
D.t1℃时,120 g x饱和溶液中含有20 g x
8.推理是化学学习中常见的思维方法。下列推理正确的是( )
A.碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性
B.溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小
C.锌和铜均是金属,锌与稀硫酸反应生成氢气,则铜也能与稀硫酸反应生成氢气
D.中和反应生成盐和水.某反应产物是硫酸铁和水,则反应物一定是硫酸和氢氧化铁
9.abc三种物质的溶解度曲线如图所示,则下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.t1℃时bc两物质饱和溶液中所含有的溶质相等
C.t2℃时,abc三种物质的饱和溶液降温到t1℃,三种溶液的溶质质量分数大小顺序是b=c>a
D.除去a中含有少量的c可以采用降温结晶的方法
10.图示中的“错误操作”与图下面“可能产生的后果”不一致的是( )
A.受热仪器破裂
B.试剂外流
C.液体飞溅
D.读数不正确
11.下图是 KCl、KNO3两种固体物质的溶解度曲线,下列说法正确的是( )
A.KNO3的溶解度大于KCl的溶解度
B.t1℃时KNO3的溶解度是70
C.在t1℃时,100gKNO3饱和溶液和100gKCl饱和溶液, KCl饱和溶液中的溶剂质量大于KNO3饱和溶液中的溶剂质量
D.在t2℃时,欲使KNO3、KCl两种物质的溶液分别降到t℃时,析出晶体的质量 KCl一定小于KNO3
12.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.20℃时,100g甲溶液中含甲物质的质量为25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.将甲物质从50℃降温到30℃时一定有晶体析出
D.将甲、乙两种物质的溶液分别从50℃降温至20℃时,溶液中溶质质量分数均为25%
二、填空题
13.如图所示是A,B,C三种物质的溶解度曲线,据此图回答:
(1)t1℃时,A,B,C三种物质的溶解度由大到小的顺序是 ;
(2)t2℃时,将30gA放入100g水中,充分搅拌后,所得溶溶液的溶质质量分数是 ;
14. 右图是氯化钠和硝酸钾两种固体物质的溶解度曲线。
(1)硝酸钾溶液中的溶剂是 。
(2) 图中b表示 的溶解度曲线。
(3)某兴趣小组为了研究NaCl和KNO3的溶解和结晶,做了两组实验(室温下),其过程如下:
【第一组】
【第二组】
上述实验过程中所得溶液一定达到饱和的是(填数字序号,下同) ;溶质质量分数一定相等的是 。
15.大多数物质的溶解度随温度的升高 ,例如硝酸钾;有些物质的溶解度随温度的升高而 ,例如氯化钠;氢氧化钙的溶解度随温度的升高 要使氯化钠从溶液中析出可以 ,使硝酸钾从溶液中析出可以 ,如果氯化钠中混有少量硝酸钾,提纯氯化钠 ;硝酸钾中混有少量氯化钠,提纯硝酸钾 .
16.硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是 .
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是 的溶液.
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的 (填“饱和”或“不饱和”)溶液.保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数 (填“变大”、“不变”或“变小”).
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 .
三、综合题
17.二氧化锰因在工业生产中应用广泛而备受关注,制取二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
(1)用高锰酸钾制备
资料一:①3K2MnO4+2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O
②K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为 ,其反应类型是 ;将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是 。
(2)用硫酸锰制备
电解 MnSO4水溶液可制得MnO2,同时生成氢气和H2SO4,该反应的化学方程式为
(3)用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂回收,流程如下:
请回答下列问题:
a.“滤液”中溶质的主要成分是 (填化学式);
b.在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、玻璃棒和 ;
c.MnO2与碳粉经下列三步反应制得纳米MnO2
①2MnO2+C MnO+CO2↑
②MnO2+H2SO4=MnSO4+H2O
③3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有 (填序号)。
18.
(1)Ⅰ:在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题:
请用图中的序号表示配制溶液的正确操作顺序 。
(2)认真观察②,其中的不正确操作是: 。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数 (填“大于”、“小于”或“等于”)12%。
(3)改正②不正确后,若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是 。(填字母序号)
A.转移已称好的氯化钠固体时,部分洒落在烧杯外
B.用量筒量取水时俯视读数
C.转移已配好的溶液时,有少量溶液溅出
(4)Ⅱ:根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ 10 20 30 40 50 60 70 80
溶解度/g 80.8 87.6 94.9 103 113 124 136 149
20℃时,将90 g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的最简质量比为 。
(5)80℃时,将249 g NaNO3饱和溶液降温至 ℃时,溶液质量变为224g。
(6)50℃时将200g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
19.我省海水资源丰富。工业上利用海水可以获取多种重要的化工原料。
(1)氯化钠是必不可少的生活用品,“烧干海水变银山”是郭沫若对海南莺歌海盐场的赞美诗作,海水“晒盐”是通过 (填“蒸发结晶”或“降温结晶”)的方法获取食盐。
(2)抗日战争期间,我国著名制碱专家侯德榜打破西方国家对制碱技术的垄断,创立“侯氏制碱法”,促进了世界制碱技术的发展。其生产原理示意图如下:
①制碱过程中,可以循环利用的物质是 。产物中可作氮肥的是 。
②产物中NaHCO3比NH4Cl先结晶析出。请结合生产原理及上图解释其原因 。
(3)海水资源丰富,工业以海水为原料提取镁的过程如图(假设每一步均恰好完全反应)
①上述反应I、ⅡⅢ、Ⅳ中涉及的基本反应类型有 种(填“一”“二”“三”或“四”)。
②操作①中所得滤渣的化学式为 。
③请写出反应Ⅲ的化学方程式 。
四、实验探究题
20.气体的实验室制取是学生必备的基本实验技能,请根据下列装置,回答问题:
(1)标号①的仪器名称是 ;
(2)实验室制取CO2,可选用图1中的装置组合是 (填写装置序号),判断CO2已收集满的方法是 ;
(3)实验室用氯酸钾和二氧化锰的混合物制取O2的化学方程式是 ;
(4)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假设已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是 (填写实验序号);
a.烘干b.溶解c.过滤d.洗涤
(5)图2是常用作实验室制取气体的发生装置,请分析该装置的一个优点 ;
(6)甲烷是一种无色无味的气体,密度比空气小且不与空气反应.某兴趣小组同学用加热无水醋酸钠和碱石灰的固体混合物制取甲烷,他们应选择的发生装置是 (填序号).
答案解析部分
1.【答案】C
2.【答案】B
3.【答案】D
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】A
9.【答案】D
10.【答案】B
11.【答案】C
12.【答案】B
13.【答案】(1)C>B>A
(2)20%
14.【答案】水;氯化钠(或NaCl);②⑥⑨;①和⑤;⑥和⑨
15.【答案】而增大;变化不大;而减小;蒸发结晶;降温结晶;蒸发结晶、再过滤;加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤
16.【答案】氯化钾;硝酸钾;饱和;不变;温度不低于t1℃
17.【答案】(1)2KMnO4 K2MnO4+MnO2+O2↑;分解反应;使锰酸钾转化得到二氧化锰,获得更多的二氧化锰
(2)MnSO4+2H2O H2↑+H2SO4+ MnO2↓
(3)NaAlO2;漏斗;①③
18.【答案】(1)④②①⑤③
(2)药品和砝码位置颠倒;小于
(3)A
(4)187.6;9:10
(5)60
(6)13
19.【答案】(1)蒸发结晶
(2)CO2;NH4Cl;相同温度下,NaHCO3的溶解低且反应消耗水
(3)三;Mg(OH)2;Mg(OH)2+2HCl=MgCl2+2H2O
20.【答案】(1)集气瓶
(2)BC;将燃着的小木条放在集气瓶口,若木条熄灭,则已满
(3)2KClO3 2KCl+3O2↑
(4)bcda
(5)可以控制反应的发生和停止
(6)A
1 / 1
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
