化学人教版(2019)必修第二册 5.2.3硝酸和酸雨 课件(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册 5.2.3硝酸和酸雨 课件(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 841.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-12 21:09:24 | ||
图片预览





文档简介
(共17张PPT)
《本草纲目拾遗》记载:(硝酸)西洋人所造,性最猛,能蚀五金。王怡堂先生云:其水至强,五金八石皆能穿滴,惟玻璃可盛。
HNO3=H++NO3- (强酸)
硝酸
一、物理性质
色态 挥发性 水溶性 ρ
无色有刺激气味液体
易挥发
(沸点83℃)
与水任意比互溶
ρ>1
2.密度大于水,浓度越大,密度越大,质量分数越大
1.常用浓硝酸69%,98%的浓硝酸为发烟硝酸
【思考】浓硝酸久置后呈黄色,为什么?
1.不稳定性:
①受热/光照:
HNO3(浓)== NO2↑+O2↑
光照/加热
4e--
③如何使久置浓硝酸恢复颜色:
通空气
④工业浓盐酸黄色:
Fe3+溶解在盐酸中
见光易分解物质:
浓HNO3、HClO、银盐(AgNO3、AgCl、AgBr、AgI)
硝酸越浓,越易分解
4
4
+2H2O
②保存:
避光、棕色细口瓶、阴凉处
二、化学性质
纯硝酸 久置硝酸
若将带火星的木条伸入该混合气体内,木条复燃,说明NO2也支持燃烧
√
分解产生NO2溶于浓HNO3使溶液呈黄色
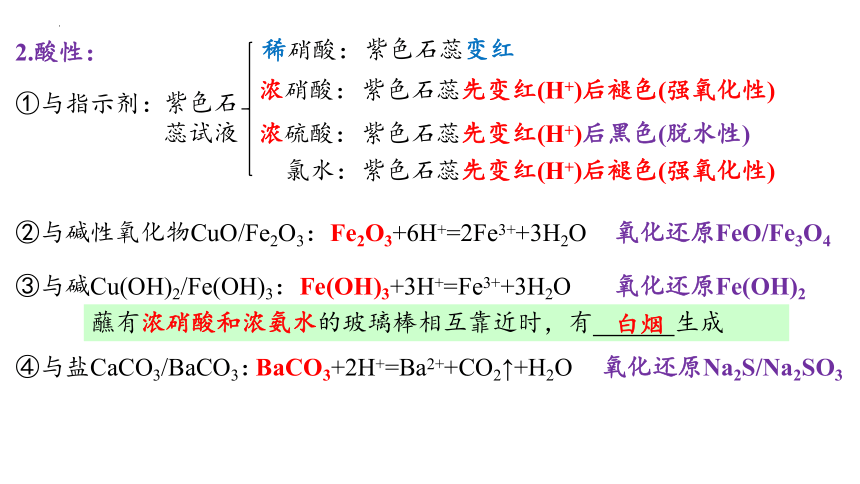
2.酸性:
①与指示剂:
稀硝酸:
浓硝酸:
紫色石蕊试液
②与碱性氧化物CuO/Fe2O3:
Fe2O3+6H+=2Fe3++3H2O
氧化还原FeO/Fe3O4
③与碱Cu(OH)2/Fe(OH)3:
Fe(OH)3+3H+=Fe3++3H2O
氧化还原Fe(OH)2
④与盐CaCO3/BaCO3:
BaCO3+2H+=Ba2++CO2↑+H2O
氧化还原Na2S/Na2SO3
紫色石蕊变红
紫色石蕊先变红(H+)后褪色(强氧化性)
浓硫酸:
紫色石蕊先变红(H+)后黑色(脱水性)
氯水:
紫色石蕊先变红(H+)后褪色(强氧化性)
蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有 生成
白烟
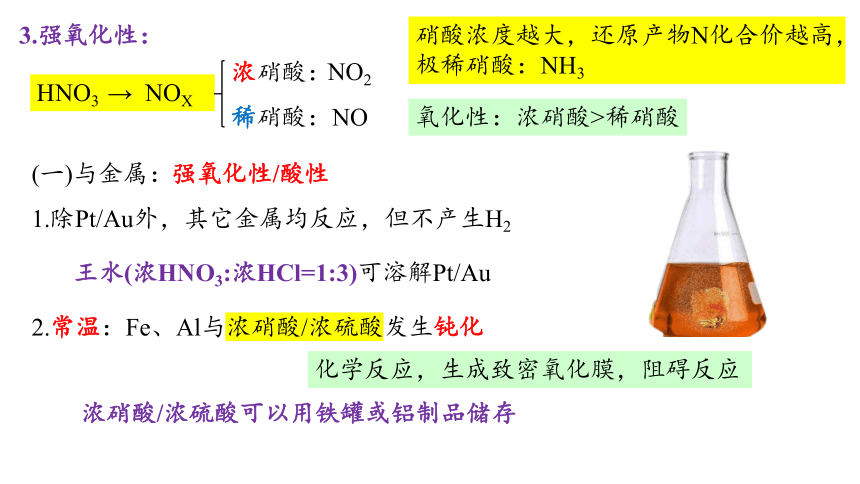
3.强氧化性:
(一)与金属:
HNO3 → NOX
浓硝酸:
稀硝酸:
硝酸浓度越大,还原产物N化合价越高,极稀硝酸:NH3
氧化性:浓硝酸>稀硝酸
1.除Pt/Au外,其它金属均反应,但不产生H2
王水(浓HNO3:浓HCl=1:3)可溶解Pt/Au
2.常温:Fe、Al与浓硝酸/浓硫酸发生钝化
化学反应,生成致密氧化膜,阻碍反应
浓硝酸/浓硫酸可以用铁罐或铝制品储存
NO2
NO
强氧化性/酸性
3.与Cu反应:
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
Cu + NO3--== Cu2++ NO2↑
2e-
还原剂Cu:氧化剂HNO3
氧化性:酸性
=1:2
=2:2
2e-
+4H+
2
2
+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
Cu + NO3--== Cu2++ NO↑
6e-
还原剂Cu:氧化剂HNO3
氧化性:酸性
=3:2
=2:6
6e-
+8H+
2
3
3
2
+4H2O
制备NO2
制备NO
浓HNO3
稀HNO3
足量Cu与浓HNO3反应:
NO2+NO
氧化性:浓硝酸>稀硝酸
1.得失电子守恒:
2.N原子守恒:
n(HNO3)反应=n(NO3--)+n(NO+NO2)
=2n(Cu)+n(NO+NO2)
2n(Cu)=3n(NO)+n(NO2)
32.64 g铜与140 mL的硝酸,铜完全溶解,标况NO和NO2混合气体为11.2 L。
(1)NO的体积为________L,NO2的体积为______L;反应的HNO3 mol
(2)向溶液加V mL a mol/LNaOH溶液。恰好Cu2+全部沉淀,则原硝酸浓度为____ _ mol·L-1;
(3)将11.2L混合气体与一定体积O2混合通入水中,气体完全溶解,需O2 mol;
5.824
5.376
1.52
Cu
HNO3
Cu(NO3)2
NO2
NO
剩HNO3
--失2e--
--得e--
--得3e--
HNO3
O2
NaNO3
NaOH
N守恒
电子守恒
设NO、NO2分别为xmol、ymol
x=0.26 mol y=0.24 mol
n(HNO3)反应
=2n(Cu)+n(NO+NO2)
x+y=0.5
3x+y=0.51×2
n(e-)=2n(Cu)
=n(NO3--)+n(NO+NO2)
n(HNO3)反应
n(HNO3)总
=n(NaOH)+n(NO+NO2)
=n(NO3--)+n(NO+NO2)
n(HNO3)总
(10--3aV+0.5)÷0.14
=4n(O2)
0.255
--得4e--
=3n(NO)+n(NO2)
Cu + NO3--== Cu2++ NO↑
+8H+
2
3
3
2
+4H2O
1. 若铜与硝酸反应后,硝酸不足而铜剩余,向反应体系中加入稀硫酸,铜是否继续溶解?若溶解,发生什么反应?
在2 mol/LH2SO4和4 mol/L HNO3的10 mL混合溶液中,向该溶液中加入足量的铜粉,加热,充分反应后,得到标况下气体体积为 mL
3Cu+8H++2NO3--===3Cu2++4H2O+2NO↑
0.08 mol
0.04 mol
0.02 mol
0.02 mol
448
2.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是 ( )
A. ZnSO4 B. NaHCO3 C. NaHSO4 D. Fe(NO3)3
C
4.与Fe反应:
Fe + NO3--== Fe3++ NO2↑
3e-
+6H+
3
3
+3H2O
Fe+6HNO3(浓)==Fe(NO3)3+3NO2↑+3H2O
3e-
还原剂Fe:氧化剂HNO3
氧化性:酸性
=1:3
=3:3
浓HNO3
Fe(过) + NO3--== Fe2++ NO↑
6e-
+8H+
2
3
3
2
+4H2O
3Fe(过)+8HNO3(稀)==3 Fe(NO3)2+2NO↑+4H2O
Fe(少) +NO3--==Fe3++NO↑
+4H+
+2H2O
Fe(少)+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O
6e-
3e-
3e-
还原剂:氧化剂
氧化性:酸性
=1:3
=1:3
还原剂:氧化剂
氧化性:酸性
=3:2
=2:6
稀
HNO3
n(Fe)/n(HNO3)
1/4
3/8
Fe3+
Fe2+
Fe3++Fe2+
(二)与非金属反应:
C+ HNO3(浓)==CO2↑+ NO2↑
4e--
+2H2O
4
4
强氧化性
(三)与还原性离子:
淀粉KI/Fe2+(FeO/Fe3O4/Fe(OH)2)/HI/HBr/SO2/SO32--/S2--
Fe(OH)2+NO3- = Fe3++NO↑
3
+10H+
3
+8H2O
FeO +NO3- = Fe3++NO↑
Fe3O4 +NO3- = Fe3++NO↑
3
+10H+
3
+5H2O
3
9
+28H+
+14H2O
HNO3酸性:氧化性
9:1
HNO3酸性:氧化性
27:1
3e-
3e-
HNO3酸性:氧化性
=9:1
3e-
强氧化性
三.离子共存
①中性/碱性:NO3--无强氧化性
②H++NO3--+Fe2+(FeO/Fe3O4/Fe(OH)2)/HI/HBr/SO2/SO32--/S2--
氧化还原,离子不共存
1.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
A
0.5molFe与一定量稀HNO3恰好反应生成Fe(NO3)2、Fe(NO3)3和NO,经检测知道Fe(NO3)2与Fe(NO3)3的物质的量之比为3∶2,n(NO)= mol;n(HNO3)= mol.
Fe
HNO3
Fe(NO3)2
Fe(NO3)3
NO
0.3mol
0.2mol
失0.6mole--
失0.6mole--
3n(NO)=1.2
n(NO)=0.4mol
失1.2mole--
0.4
n(HNO3)总
=n(HNO3)酸+n(NO)
=0.3×2+0.2×3+0.4
=1.6mol
1.6
1. 实验室:
四.硝酸的制备
NaNO3+H2SO4(浓) = NaHSO4+HNO3↑
2. 工业:
N2→NH3: ________________________________。
NH3→NO: _______________________________。
NO→NO2: _______________________________。
NO2→HNO3: _____________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+3H2 2NH3
高温高压
催化剂
4NH3+5O2 4NO+6H2O
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
高沸制低沸
五、酸雨
酸雨 硫酸型酸雨 硝酸型酸雨
概念 形成途径
危害 PH<5.6雨水(正常雨水由于溶解了CO2,PH=5.6)
途径1:
2SO2+O2==2SO3
SO3+H2O==H2SO4
飘尘
途径2:
SO2+H2O H2SO3
2H2SO3+O2 ==2H2SO4
2NO+O2=2NO2
3NO2+H2O==2HNO3+NO
SO2
NxOy(NO/NO2)
①破坏农作物、森林、草原
②加速建筑等的腐蚀
放置时间越长,酸性增强,PH减小
SO2/NOx的吸收
SO2
NxOy
①催化还原法
②碱液吸收法
2NO+2CO=N2+2CO2
2NO2+2NaOH=NaNO2+NaNO3+H2O
NO2+NO+2NaOH=2NaNO2H2O
2CaO+2SO2+O2= 2CaSO4
①氨吸收:
②石灰法:
2NH3+H2O + SO2=(NH4)2SO3+H2O
2(NH4)2SO3 + O2=2(NH4)2SO4+H2O
6NO+4NH3===5N2
催化剂
+6H2O
6NO2+8NH3===7N2
催化剂
+12H2O
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰雪融化,释放有毒气体
酸雨 SO2和NOx的排放 土壤酸化,腐蚀建筑物
光化学烟雾 NOx和CxHy的排放 危害人体健康和植物生长
臭氧空洞 NOx和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
赤潮和水华 含磷洗衣粉的大量使用及其废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料大量使用,任意丢弃 破坏土壤结构和生态环境
伦敦毒物:SO2
潮汐自然现象,与环境污染无关
《本草纲目拾遗》记载:(硝酸)西洋人所造,性最猛,能蚀五金。王怡堂先生云:其水至强,五金八石皆能穿滴,惟玻璃可盛。
HNO3=H++NO3- (强酸)
硝酸
一、物理性质
色态 挥发性 水溶性 ρ
无色有刺激气味液体
易挥发
(沸点83℃)
与水任意比互溶
ρ>1
2.密度大于水,浓度越大,密度越大,质量分数越大
1.常用浓硝酸69%,98%的浓硝酸为发烟硝酸
【思考】浓硝酸久置后呈黄色,为什么?
1.不稳定性:
①受热/光照:
HNO3(浓)== NO2↑+O2↑
光照/加热
4e--
③如何使久置浓硝酸恢复颜色:
通空气
④工业浓盐酸黄色:
Fe3+溶解在盐酸中
见光易分解物质:
浓HNO3、HClO、银盐(AgNO3、AgCl、AgBr、AgI)
硝酸越浓,越易分解
4
4
+2H2O
②保存:
避光、棕色细口瓶、阴凉处
二、化学性质
纯硝酸 久置硝酸
若将带火星的木条伸入该混合气体内,木条复燃,说明NO2也支持燃烧
√
分解产生NO2溶于浓HNO3使溶液呈黄色
2.酸性:
①与指示剂:
稀硝酸:
浓硝酸:
紫色石蕊试液
②与碱性氧化物CuO/Fe2O3:
Fe2O3+6H+=2Fe3++3H2O
氧化还原FeO/Fe3O4
③与碱Cu(OH)2/Fe(OH)3:
Fe(OH)3+3H+=Fe3++3H2O
氧化还原Fe(OH)2
④与盐CaCO3/BaCO3:
BaCO3+2H+=Ba2++CO2↑+H2O
氧化还原Na2S/Na2SO3
紫色石蕊变红
紫色石蕊先变红(H+)后褪色(强氧化性)
浓硫酸:
紫色石蕊先变红(H+)后黑色(脱水性)
氯水:
紫色石蕊先变红(H+)后褪色(强氧化性)
蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有 生成
白烟
3.强氧化性:
(一)与金属:
HNO3 → NOX
浓硝酸:
稀硝酸:
硝酸浓度越大,还原产物N化合价越高,极稀硝酸:NH3
氧化性:浓硝酸>稀硝酸
1.除Pt/Au外,其它金属均反应,但不产生H2
王水(浓HNO3:浓HCl=1:3)可溶解Pt/Au
2.常温:Fe、Al与浓硝酸/浓硫酸发生钝化
化学反应,生成致密氧化膜,阻碍反应
浓硝酸/浓硫酸可以用铁罐或铝制品储存
NO2
NO
强氧化性/酸性
3.与Cu反应:
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
Cu + NO3--== Cu2++ NO2↑
2e-
还原剂Cu:氧化剂HNO3
氧化性:酸性
=1:2
=2:2
2e-
+4H+
2
2
+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
Cu + NO3--== Cu2++ NO↑
6e-
还原剂Cu:氧化剂HNO3
氧化性:酸性
=3:2
=2:6
6e-
+8H+
2
3
3
2
+4H2O
制备NO2
制备NO
浓HNO3
稀HNO3
足量Cu与浓HNO3反应:
NO2+NO
氧化性:浓硝酸>稀硝酸
1.得失电子守恒:
2.N原子守恒:
n(HNO3)反应=n(NO3--)+n(NO+NO2)
=2n(Cu)+n(NO+NO2)
2n(Cu)=3n(NO)+n(NO2)
32.64 g铜与140 mL的硝酸,铜完全溶解,标况NO和NO2混合气体为11.2 L。
(1)NO的体积为________L,NO2的体积为______L;反应的HNO3 mol
(2)向溶液加V mL a mol/LNaOH溶液。恰好Cu2+全部沉淀,则原硝酸浓度为____ _ mol·L-1;
(3)将11.2L混合气体与一定体积O2混合通入水中,气体完全溶解,需O2 mol;
5.824
5.376
1.52
Cu
HNO3
Cu(NO3)2
NO2
NO
剩HNO3
--失2e--
--得e--
--得3e--
HNO3
O2
NaNO3
NaOH
N守恒
电子守恒
设NO、NO2分别为xmol、ymol
x=0.26 mol y=0.24 mol
n(HNO3)反应
=2n(Cu)+n(NO+NO2)
x+y=0.5
3x+y=0.51×2
n(e-)=2n(Cu)
=n(NO3--)+n(NO+NO2)
n(HNO3)反应
n(HNO3)总
=n(NaOH)+n(NO+NO2)
=n(NO3--)+n(NO+NO2)
n(HNO3)总
(10--3aV+0.5)÷0.14
=4n(O2)
0.255
--得4e--
=3n(NO)+n(NO2)
Cu + NO3--== Cu2++ NO↑
+8H+
2
3
3
2
+4H2O
1. 若铜与硝酸反应后,硝酸不足而铜剩余,向反应体系中加入稀硫酸,铜是否继续溶解?若溶解,发生什么反应?
在2 mol/LH2SO4和4 mol/L HNO3的10 mL混合溶液中,向该溶液中加入足量的铜粉,加热,充分反应后,得到标况下气体体积为 mL
3Cu+8H++2NO3--===3Cu2++4H2O+2NO↑
0.08 mol
0.04 mol
0.02 mol
0.02 mol
448
2.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是 ( )
A. ZnSO4 B. NaHCO3 C. NaHSO4 D. Fe(NO3)3
C
4.与Fe反应:
Fe + NO3--== Fe3++ NO2↑
3e-
+6H+
3
3
+3H2O
Fe+6HNO3(浓)==Fe(NO3)3+3NO2↑+3H2O
3e-
还原剂Fe:氧化剂HNO3
氧化性:酸性
=1:3
=3:3
浓HNO3
Fe(过) + NO3--== Fe2++ NO↑
6e-
+8H+
2
3
3
2
+4H2O
3Fe(过)+8HNO3(稀)==3 Fe(NO3)2+2NO↑+4H2O
Fe(少) +NO3--==Fe3++NO↑
+4H+
+2H2O
Fe(少)+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O
6e-
3e-
3e-
还原剂:氧化剂
氧化性:酸性
=1:3
=1:3
还原剂:氧化剂
氧化性:酸性
=3:2
=2:6
稀
HNO3
n(Fe)/n(HNO3)
1/4
3/8
Fe3+
Fe2+
Fe3++Fe2+
(二)与非金属反应:
C+ HNO3(浓)==CO2↑+ NO2↑
4e--
+2H2O
4
4
强氧化性
(三)与还原性离子:
淀粉KI/Fe2+(FeO/Fe3O4/Fe(OH)2)/HI/HBr/SO2/SO32--/S2--
Fe(OH)2+NO3- = Fe3++NO↑
3
+10H+
3
+8H2O
FeO +NO3- = Fe3++NO↑
Fe3O4 +NO3- = Fe3++NO↑
3
+10H+
3
+5H2O
3
9
+28H+
+14H2O
HNO3酸性:氧化性
9:1
HNO3酸性:氧化性
27:1
3e-
3e-
HNO3酸性:氧化性
=9:1
3e-
强氧化性
三.离子共存
①中性/碱性:NO3--无强氧化性
②H++NO3--+Fe2+(FeO/Fe3O4/Fe(OH)2)/HI/HBr/SO2/SO32--/S2--
氧化还原,离子不共存
1.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
A
0.5molFe与一定量稀HNO3恰好反应生成Fe(NO3)2、Fe(NO3)3和NO,经检测知道Fe(NO3)2与Fe(NO3)3的物质的量之比为3∶2,n(NO)= mol;n(HNO3)= mol.
Fe
HNO3
Fe(NO3)2
Fe(NO3)3
NO
0.3mol
0.2mol
失0.6mole--
失0.6mole--
3n(NO)=1.2
n(NO)=0.4mol
失1.2mole--
0.4
n(HNO3)总
=n(HNO3)酸+n(NO)
=0.3×2+0.2×3+0.4
=1.6mol
1.6
1. 实验室:
四.硝酸的制备
NaNO3+H2SO4(浓) = NaHSO4+HNO3↑
2. 工业:
N2→NH3: ________________________________。
NH3→NO: _______________________________。
NO→NO2: _______________________________。
NO2→HNO3: _____________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+3H2 2NH3
高温高压
催化剂
4NH3+5O2 4NO+6H2O
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
高沸制低沸
五、酸雨
酸雨 硫酸型酸雨 硝酸型酸雨
概念 形成途径
危害 PH<5.6雨水(正常雨水由于溶解了CO2,PH=5.6)
途径1:
2SO2+O2==2SO3
SO3+H2O==H2SO4
飘尘
途径2:
SO2+H2O H2SO3
2H2SO3+O2 ==2H2SO4
2NO+O2=2NO2
3NO2+H2O==2HNO3+NO
SO2
NxOy(NO/NO2)
①破坏农作物、森林、草原
②加速建筑等的腐蚀
放置时间越长,酸性增强,PH减小
SO2/NOx的吸收
SO2
NxOy
①催化还原法
②碱液吸收法
2NO+2CO=N2+2CO2
2NO2+2NaOH=NaNO2+NaNO3+H2O
NO2+NO+2NaOH=2NaNO2H2O
2CaO+2SO2+O2= 2CaSO4
①氨吸收:
②石灰法:
2NH3+H2O + SO2=(NH4)2SO3+H2O
2(NH4)2SO3 + O2=2(NH4)2SO4+H2O
6NO+4NH3===5N2
催化剂
+6H2O
6NO2+8NH3===7N2
催化剂
+12H2O
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰雪融化,释放有毒气体
酸雨 SO2和NOx的排放 土壤酸化,腐蚀建筑物
光化学烟雾 NOx和CxHy的排放 危害人体健康和植物生长
臭氧空洞 NOx和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
赤潮和水华 含磷洗衣粉的大量使用及其废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料大量使用,任意丢弃 破坏土壤结构和生态环境
伦敦毒物:SO2
潮汐自然现象,与环境污染无关
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
