专题3 第3单元 课时2 共价键键能与化学反应的反应热共价晶体 课件(共41张PPT) 2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3 第3单元 课时2 共价键键能与化学反应的反应热共价晶体 课件(共41张PPT) 2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 853.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 09:54:08 | ||
图片预览










文档简介
(共41张PPT)
专题3
微粒间作用力与物质性质
第三单元 共价键 共价晶体
课时2 共价键键能与化学反应的反应热共价晶体
学 习 目 标
1.知道共价键的键能、键长等的含义,认识影响共价键键能的主要因素,会利用键能比较共价键的强弱及共价型分子的稳定性。
2.了解键能与化学反应热之间的内在联系,会利用键能计算化学反应的反应热。
3.了解金刚石、二氧化硅晶体的结构特点,会比较共价晶体的熔沸点及硬度大小。
活 动 方 案
1.从化学键角度看,化学反应实质上是化学键的断裂与形成,断裂和形成化学键这两个过程,哪个过程吸热,哪个过程放热?
【答案】 断裂化学键吸热,形成化学键放热。
活动一:讨论共价键的键能、键长与共价键的稳定性关系
2.阅读教材,如何描述共价键的强度?了解键能的概念、单位,如断开1 mol H—H 键吸热的能量为436 kJ,H—H 键的键能为多少?
【答案】 共价键的强度一般用键能描述。共价键的键能是在101 kPa、298 K条件下,1 mol 气态 AB 分子生成气态 A 原子和B原子的过程中所吸收的能量,称为AB间共价键的键能,单位为kJ·mol-1。H—H键的键能为436 kJ·mol-1。
3.阅读教材,什么是键长?键长是形成化学键的两个原子的半径之和吗?为什么?结合教材中表格,讨论键长与键能之间有什么关系?如何判断共价键的强弱?比较HF、HCl、HBr、HI中共价键的强弱。
【答案】 两原子形成共价键时,两原子核间的平均间距叫做该共价键的键长。当两个原子形成共价键时,原子轨道发生重叠,所以键长不是原子的半径之和。共价键重叠程度越大,键长越短,键能越大。共价键强弱可以用下面方法判断:一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。HF、HCl、HBr、HI 中,分子的共用电子对数相同(1对),因 F、Cl、Br、I 的原子半径依次增大,共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性:HF>HCl>HBr>HI。
化学反应的实质就是反应物中旧化学键的断裂和生成物中新化学键的形成。旧键断裂会吸收热量,新键形成会放出热量,若旧键断裂吸收的总能量小于新键形成放出的总能量,反应为放热反应,若旧键断裂吸收的总能量大于新键形成放出的总能量,反应为吸热反应。
1.阅读教材,讨论反应热(ΔH)与键能之间有什么关系。
【答案】 ΔH=反应物的键能总和-生成物的键能总和。
2.讨论ΔH的正负,与反应发热吸热之间的关系。
【答案】 ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
活动二:讨论键能与反应热的关系
1.下图是金刚石的晶体结构示意图
活动三:了解共价晶体的概念、物理性质与结构特点
金刚石晶体的结构示意图
金刚石、用金刚石制成的钻头和金刚石晶胞
阅读教材,什么是共价晶体?讨论共价晶体有较高的熔沸点的原因,共价晶体的构成微粒及微粒间作用力是什么?
【答案】 所有原子间以共价键结合而形成的空间网状结构的晶体,叫做共价晶体。共价晶体的构成微粒是原子,微粒间作用力是共价键,由于共价键的键能大,所以共价晶体的熔沸点较高,硬度较大。
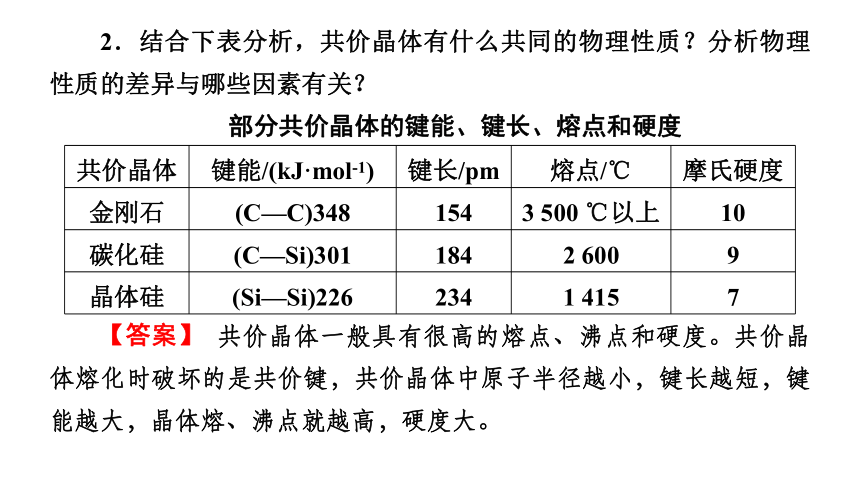
2.结合下表分析,共价晶体有什么共同的物理性质?分析物理性质的差异与哪些因素有关?
部分共价晶体的键能、键长、熔点和硬度
【答案】 共价晶体一般具有很高的熔点、沸点和硬度。共价晶体熔化时破坏的是共价键,共价晶体中原子半径越小,键长越短,键能越大,晶体熔、沸点就越高,硬度大。
共价晶体 键能/(kJ·mol-1) 键长/pm 熔点/℃ 摩氏硬度
金刚石 (C—C)348 154 3 500 ℃以上 10
碳化硅 (C—Si)301 184 2 600 9
晶体硅 (Si—Si)226 234 1 415 7
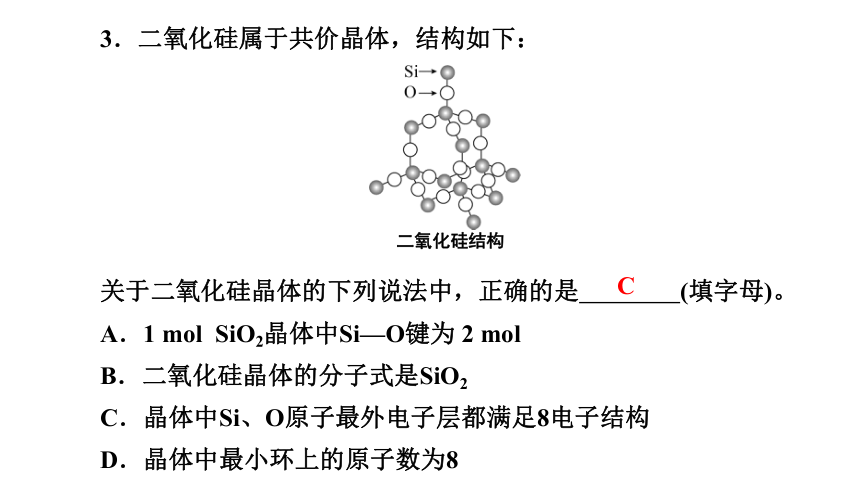
3.二氧化硅属于共价晶体,结构如下:
关于二氧化硅晶体的下列说法中,正确的是 (填字母)。
A.1 mol SiO2晶体中Si—O键为 2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
二氧化硅结构
C
【解析】SiO2晶体中,1个硅原子与周围4个氧原子形成Si—O键,所以1 mol SiO2晶体中Si—O键为4 mol,A错误;晶体中1个硅原子与周围4个氧原子形成共价键,1个氧原子与周围2个硅原子形成共价键,SiO2表示晶体中Si、O原子个数比为1∶2,并不是分子式,B错误;1个硅原子分别与4个氧原子形成4对共用电子对,1个氧原子分别与2个硅原子形成2对共用电子对,所以Si、O原子最外电子层都满足8电子结构,C正确;晶体中最小环上硅与氧交替连接,SiO2晶体中最小环上的原子数为12,其中6个硅原子,6个氧原子,D错误
4.氮化硼是一种新型无机非金属材料,结构有多种,其中有一种硬度仅次于金刚石。
立方氮化硼晶胞
上图中两个都是氮化硼的晶胞,结构是否完全相同?大球和小球分别代表哪种原子?你认为该晶体属什么晶体?构成晶体的微粒是什么?微粒间作用力是什么?画出你理解的氮化硼的结构。
【答案】 两个都是氮化硼的晶胞,结构完全相同。大球为硼原子,小球为氮原子,该晶体属于共价晶体,构成晶体的微粒是硼原子和氮原子,微粒间作用力是共价键。氮化硼的结构如下图:
5.讨论共价晶体共价键之间有什么关系,只含有共价键的晶体都是共价晶体吗?共价晶体一定是共价化合物吗?
【答案】 共价晶体中一般含有共价键,含共价键的不一定是共价晶体,只含共价键的晶体也不一定是共价晶体,如H2O、HCl等由非金属元素组成的分子内只含共价键,但它们不属于共价晶体。共价晶体不一定是共价化合物,也可能是单质,如金刚石。
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
【解析】纯铁硬度低,纯铁的硬度比铁合金小,A错误; 石墨很软,B错误;氯化钠属于离子晶体,金刚石属于共价晶体,离子晶体的硬度小于共价晶体,C错误,D正确。
1. (2020·天津期末)下列物质的晶体硬度最大的是 ( )
A.铁 B.石墨
C.氯化钠 D.金刚石
D
1
2
3
4
5
6
7
8
9
10
11
2.氮化硼是一种新合成的结构材料,它是超硬、耐磨、耐高温的物质,下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间作用力相同的是 ( )
A.C60和金刚石 B.晶体硅和水晶
C.冰和干冰 D.碘和金刚砂
B
【解析】氮化硼是由两种非金属元素形成的化合物,根据该化合物的性质可知其为共价晶体,微粒间作用力为共价键。C60和金刚石熔化时分别克服的是分子间作用力和共价键,A错误;晶体硅和水晶都为共价晶体,物质熔化时所克服的粒子间的作用力均为共价键,B正确; 冰和干冰熔化时均克服的是分子间作用力,C错误;碘和金刚砂熔化时分别克服的是分子间作用力和共价键,D错误。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
3.已知:2H2(g)+O2(g)══2H2O(g) ΔH=-483.6 kJ·mol-1,有关键能数据如下表:
则水分子中O—H键键能为 ( )
A.463.4 kJ·mol-1 B.926.8 kJ·mol-1
C.221.6 kJ·mol-1 D.413 kJ·mol-1
A
化学键 H—H O══O
键能/kJ·mol-1 436 498
【解析】水的结构式为H—O—H,2 mol 水分子中含有4 mol H—O键,2H2(g)+O2(g)══2H2O(g) ΔH=-483.6 kJ·mol-1,反应物总键能-生成物总键能=反应热,则436 kJ·mol-1×2+498 kJ·mol-1-4E(O—H)=-483.6 kJ·mol-1,故E(O—H)=463.4 kJ·mol-1,A正确。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
4.(2020·枣庄三中月考)根据下列性质判断,属于共价晶体的物质是 ( )
A.熔点为2 700 ℃,导电性强,延展性好
B.无色晶体,熔点为3 500 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
B
【解析】共价晶体的熔点高,但不能导电,延展性差,A不符合题意;无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂,符合共价晶体的性质特点,B符合题意;无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电,不属于共价晶体,C不符合题意;熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电,符合分子晶体的性质,属于分子晶体,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
5.(2020·滕州一中月考)美国Lawrence Livermore国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的共价晶体,下列关于CO2的共价晶体的说法正确的是 ( )
A.CO2的共价晶体和分子晶体互为同素异形体
B.在一定条件下,CO2的共价晶体转化为CO2的分子晶体是物理变化
C.CO2的共价晶体和CO2的分子晶体具有相同的物理性质和化学性质
D.在CO2的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合
D
【解析】同素异形体的研究对象是单质,CO2是化合物,A错误;二氧化碳的共价晶体和二氧化碳的分子晶体属于不同物质,所以在一定条件下,CO2的共价晶体转化为CO2的分子晶体是化学变化,B错误;二氧化碳的分子晶体和二氧化碳的共价晶体的构成微粒不同,空间结构不同,所以其物理性质和化学性质不同,C错误;将二氧化硅结构中的硅原子替换成碳原子,在二氧化碳的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合,D正确。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
6.下列有关共价晶体的叙述不正确的是 ( )
A.金刚石和二氧化硅晶体的最小结构单元都是正四面体结构
B.含1 mol C的金刚石中C—C键数目是 2NA,1 mol SiO2晶体中Si—O键数目是4NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.SiO2晶体是共价晶体,所以晶体中不存在分子
C
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
7.(2021·东台创新高级中学检测) 我国科学家合成了富集 11B 的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是
( )
A.11BN 和10BN的性质无差异
B.该晶体具有良好的导电性
C.该晶胞中含有14个B原子,4个N原子
D.N原子周围等距且最近的N原子数为12
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
8.下列事实不能用键能的大小来解释的是 ( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.H2O比H2S沸点高
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
【解析】由于N2分子中存在三键,键能较大,故N2的化学性质很稳定,A不符合题意;H2O比H2S沸点高与键能无关,B符合题意;卤族元素从F到I,原子半径逐渐增大,其氢化物中化学键的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱,C不符合题意;由于H—F键的键能大于H—O键,所以F2更容易与H2反应生成HF,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
9. (2020·泉州一中月考)通常人们把拆开1 mol 某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能,根据键能数据估算下列反应的反应热,CH4(g)+4F2(g)══CF4(g)+4HF(g)的ΔH为
( )
A.-1 940 kJ·mol-1 B.1 940 kJ·mol-1
C.-485 kJ·mol-1 D.485 kJ·mol-1
A
化学键 C—H C—F H—F F—F
键能/(kJ·mol-1) 414 489 565 155
【解析】在反应CH4(g)+4F2(g)══CF4(g)+4HF(g)中,ΔH=反应物的总键能-生成物的总键能=(4×414+4×155)kJ·mol-1-(4×489+4×565)kJ·mol-1=-1 940 kJ·mol-1,A正确。
1
2
3
4
5
6
7
8
9
10
11
【解析】根据表中数据可知,破坏1 mol氢气中的氢氢键所消耗的能量最高,则说明氢气最稳定,具有的能量最低,A正确;
1
2
3
4
5
6
7
8
9
10
11
10. 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
(1) 下列物质本身具有的能量最低的是____(填字母,下同)。
A.H2 B.Cl2
C.Br2 D.I2
物质 Cl2 Br2 I2 HCl HBr HI H2
能量/kJ 243 193 151 431 366 298 436
A
【解析】根据表中数据可知,破坏1 mol氯化氢中的氢氯键所消耗的能量最高,则说明氯化氢最稳定,A正确;
1
2
3
4
5
6
7
8
9
10
11
(2) 下列氢化物中最稳定的是____。
A.HCl B.HBr
C.HI
A
【解析】根据反应:X2+H2══2HX,ΔH=反应物断键吸收的总能量-生成物成键放出的总能量,代入数值进行计算,结果都是ΔH<0,所以卤素单质与氢气的化合反应均为放热反应;
1
2
3
4
5
6
7
8
9
10
11
(3) X2+H2══2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?___________。
放热反应
【解析】生成物越稳定,放出的热量越多,在氯化氢、溴化氢、碘化氢中,氯化氢最稳定,因为同主族元素从上到下元素的氢化物稳定性逐渐减弱,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出热量最多的是氯气。
1
2
3
4
5
6
7
8
9
10
11
(4) 相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是______。
Cl2
1
2
3
4
5
6
7
8
9
10
11
11.金刚石和金刚砂(SiC)具有相似的晶体结构,在金刚砂的三维骨架结构中(如图所示),碳原子、硅原子交替以单键相结合。
1
2
3
4
5
6
7
8
9
10
11
12
试回答:
(1) 金刚砂属于_______晶体。金刚砂熔点比金刚石熔点_____。
(2) 在金刚砂的结构中,一个硅原子周围结合____个碳原子,键角是____________。
(3) 金刚砂的结构中含有由共价键形成的原子环,其中最小的环上有____个硅原子。
共价
低
4
109°28′
3
谢谢观看
Thank you for watching
专题3
微粒间作用力与物质性质
第三单元 共价键 共价晶体
课时2 共价键键能与化学反应的反应热共价晶体
学 习 目 标
1.知道共价键的键能、键长等的含义,认识影响共价键键能的主要因素,会利用键能比较共价键的强弱及共价型分子的稳定性。
2.了解键能与化学反应热之间的内在联系,会利用键能计算化学反应的反应热。
3.了解金刚石、二氧化硅晶体的结构特点,会比较共价晶体的熔沸点及硬度大小。
活 动 方 案
1.从化学键角度看,化学反应实质上是化学键的断裂与形成,断裂和形成化学键这两个过程,哪个过程吸热,哪个过程放热?
【答案】 断裂化学键吸热,形成化学键放热。
活动一:讨论共价键的键能、键长与共价键的稳定性关系
2.阅读教材,如何描述共价键的强度?了解键能的概念、单位,如断开1 mol H—H 键吸热的能量为436 kJ,H—H 键的键能为多少?
【答案】 共价键的强度一般用键能描述。共价键的键能是在101 kPa、298 K条件下,1 mol 气态 AB 分子生成气态 A 原子和B原子的过程中所吸收的能量,称为AB间共价键的键能,单位为kJ·mol-1。H—H键的键能为436 kJ·mol-1。
3.阅读教材,什么是键长?键长是形成化学键的两个原子的半径之和吗?为什么?结合教材中表格,讨论键长与键能之间有什么关系?如何判断共价键的强弱?比较HF、HCl、HBr、HI中共价键的强弱。
【答案】 两原子形成共价键时,两原子核间的平均间距叫做该共价键的键长。当两个原子形成共价键时,原子轨道发生重叠,所以键长不是原子的半径之和。共价键重叠程度越大,键长越短,键能越大。共价键强弱可以用下面方法判断:一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。HF、HCl、HBr、HI 中,分子的共用电子对数相同(1对),因 F、Cl、Br、I 的原子半径依次增大,共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性:HF>HCl>HBr>HI。
化学反应的实质就是反应物中旧化学键的断裂和生成物中新化学键的形成。旧键断裂会吸收热量,新键形成会放出热量,若旧键断裂吸收的总能量小于新键形成放出的总能量,反应为放热反应,若旧键断裂吸收的总能量大于新键形成放出的总能量,反应为吸热反应。
1.阅读教材,讨论反应热(ΔH)与键能之间有什么关系。
【答案】 ΔH=反应物的键能总和-生成物的键能总和。
2.讨论ΔH的正负,与反应发热吸热之间的关系。
【答案】 ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
活动二:讨论键能与反应热的关系
1.下图是金刚石的晶体结构示意图
活动三:了解共价晶体的概念、物理性质与结构特点
金刚石晶体的结构示意图
金刚石、用金刚石制成的钻头和金刚石晶胞
阅读教材,什么是共价晶体?讨论共价晶体有较高的熔沸点的原因,共价晶体的构成微粒及微粒间作用力是什么?
【答案】 所有原子间以共价键结合而形成的空间网状结构的晶体,叫做共价晶体。共价晶体的构成微粒是原子,微粒间作用力是共价键,由于共价键的键能大,所以共价晶体的熔沸点较高,硬度较大。
2.结合下表分析,共价晶体有什么共同的物理性质?分析物理性质的差异与哪些因素有关?
部分共价晶体的键能、键长、熔点和硬度
【答案】 共价晶体一般具有很高的熔点、沸点和硬度。共价晶体熔化时破坏的是共价键,共价晶体中原子半径越小,键长越短,键能越大,晶体熔、沸点就越高,硬度大。
共价晶体 键能/(kJ·mol-1) 键长/pm 熔点/℃ 摩氏硬度
金刚石 (C—C)348 154 3 500 ℃以上 10
碳化硅 (C—Si)301 184 2 600 9
晶体硅 (Si—Si)226 234 1 415 7
3.二氧化硅属于共价晶体,结构如下:
关于二氧化硅晶体的下列说法中,正确的是 (填字母)。
A.1 mol SiO2晶体中Si—O键为 2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
二氧化硅结构
C
【解析】SiO2晶体中,1个硅原子与周围4个氧原子形成Si—O键,所以1 mol SiO2晶体中Si—O键为4 mol,A错误;晶体中1个硅原子与周围4个氧原子形成共价键,1个氧原子与周围2个硅原子形成共价键,SiO2表示晶体中Si、O原子个数比为1∶2,并不是分子式,B错误;1个硅原子分别与4个氧原子形成4对共用电子对,1个氧原子分别与2个硅原子形成2对共用电子对,所以Si、O原子最外电子层都满足8电子结构,C正确;晶体中最小环上硅与氧交替连接,SiO2晶体中最小环上的原子数为12,其中6个硅原子,6个氧原子,D错误
4.氮化硼是一种新型无机非金属材料,结构有多种,其中有一种硬度仅次于金刚石。
立方氮化硼晶胞
上图中两个都是氮化硼的晶胞,结构是否完全相同?大球和小球分别代表哪种原子?你认为该晶体属什么晶体?构成晶体的微粒是什么?微粒间作用力是什么?画出你理解的氮化硼的结构。
【答案】 两个都是氮化硼的晶胞,结构完全相同。大球为硼原子,小球为氮原子,该晶体属于共价晶体,构成晶体的微粒是硼原子和氮原子,微粒间作用力是共价键。氮化硼的结构如下图:
5.讨论共价晶体共价键之间有什么关系,只含有共价键的晶体都是共价晶体吗?共价晶体一定是共价化合物吗?
【答案】 共价晶体中一般含有共价键,含共价键的不一定是共价晶体,只含共价键的晶体也不一定是共价晶体,如H2O、HCl等由非金属元素组成的分子内只含共价键,但它们不属于共价晶体。共价晶体不一定是共价化合物,也可能是单质,如金刚石。
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
【解析】纯铁硬度低,纯铁的硬度比铁合金小,A错误; 石墨很软,B错误;氯化钠属于离子晶体,金刚石属于共价晶体,离子晶体的硬度小于共价晶体,C错误,D正确。
1. (2020·天津期末)下列物质的晶体硬度最大的是 ( )
A.铁 B.石墨
C.氯化钠 D.金刚石
D
1
2
3
4
5
6
7
8
9
10
11
2.氮化硼是一种新合成的结构材料,它是超硬、耐磨、耐高温的物质,下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间作用力相同的是 ( )
A.C60和金刚石 B.晶体硅和水晶
C.冰和干冰 D.碘和金刚砂
B
【解析】氮化硼是由两种非金属元素形成的化合物,根据该化合物的性质可知其为共价晶体,微粒间作用力为共价键。C60和金刚石熔化时分别克服的是分子间作用力和共价键,A错误;晶体硅和水晶都为共价晶体,物质熔化时所克服的粒子间的作用力均为共价键,B正确; 冰和干冰熔化时均克服的是分子间作用力,C错误;碘和金刚砂熔化时分别克服的是分子间作用力和共价键,D错误。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
3.已知:2H2(g)+O2(g)══2H2O(g) ΔH=-483.6 kJ·mol-1,有关键能数据如下表:
则水分子中O—H键键能为 ( )
A.463.4 kJ·mol-1 B.926.8 kJ·mol-1
C.221.6 kJ·mol-1 D.413 kJ·mol-1
A
化学键 H—H O══O
键能/kJ·mol-1 436 498
【解析】水的结构式为H—O—H,2 mol 水分子中含有4 mol H—O键,2H2(g)+O2(g)══2H2O(g) ΔH=-483.6 kJ·mol-1,反应物总键能-生成物总键能=反应热,则436 kJ·mol-1×2+498 kJ·mol-1-4E(O—H)=-483.6 kJ·mol-1,故E(O—H)=463.4 kJ·mol-1,A正确。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
4.(2020·枣庄三中月考)根据下列性质判断,属于共价晶体的物质是 ( )
A.熔点为2 700 ℃,导电性强,延展性好
B.无色晶体,熔点为3 500 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
B
【解析】共价晶体的熔点高,但不能导电,延展性差,A不符合题意;无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂,符合共价晶体的性质特点,B符合题意;无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电,不属于共价晶体,C不符合题意;熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电,符合分子晶体的性质,属于分子晶体,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
5.(2020·滕州一中月考)美国Lawrence Livermore国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的共价晶体,下列关于CO2的共价晶体的说法正确的是 ( )
A.CO2的共价晶体和分子晶体互为同素异形体
B.在一定条件下,CO2的共价晶体转化为CO2的分子晶体是物理变化
C.CO2的共价晶体和CO2的分子晶体具有相同的物理性质和化学性质
D.在CO2的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合
D
【解析】同素异形体的研究对象是单质,CO2是化合物,A错误;二氧化碳的共价晶体和二氧化碳的分子晶体属于不同物质,所以在一定条件下,CO2的共价晶体转化为CO2的分子晶体是化学变化,B错误;二氧化碳的分子晶体和二氧化碳的共价晶体的构成微粒不同,空间结构不同,所以其物理性质和化学性质不同,C错误;将二氧化硅结构中的硅原子替换成碳原子,在二氧化碳的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合,D正确。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
6.下列有关共价晶体的叙述不正确的是 ( )
A.金刚石和二氧化硅晶体的最小结构单元都是正四面体结构
B.含1 mol C的金刚石中C—C键数目是 2NA,1 mol SiO2晶体中Si—O键数目是4NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.SiO2晶体是共价晶体,所以晶体中不存在分子
C
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
7.(2021·东台创新高级中学检测) 我国科学家合成了富集 11B 的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是
( )
A.11BN 和10BN的性质无差异
B.该晶体具有良好的导电性
C.该晶胞中含有14个B原子,4个N原子
D.N原子周围等距且最近的N原子数为12
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
8.下列事实不能用键能的大小来解释的是 ( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.H2O比H2S沸点高
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
【解析】由于N2分子中存在三键,键能较大,故N2的化学性质很稳定,A不符合题意;H2O比H2S沸点高与键能无关,B符合题意;卤族元素从F到I,原子半径逐渐增大,其氢化物中化学键的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱,C不符合题意;由于H—F键的键能大于H—O键,所以F2更容易与H2反应生成HF,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
9. (2020·泉州一中月考)通常人们把拆开1 mol 某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能,根据键能数据估算下列反应的反应热,CH4(g)+4F2(g)══CF4(g)+4HF(g)的ΔH为
( )
A.-1 940 kJ·mol-1 B.1 940 kJ·mol-1
C.-485 kJ·mol-1 D.485 kJ·mol-1
A
化学键 C—H C—F H—F F—F
键能/(kJ·mol-1) 414 489 565 155
【解析】在反应CH4(g)+4F2(g)══CF4(g)+4HF(g)中,ΔH=反应物的总键能-生成物的总键能=(4×414+4×155)kJ·mol-1-(4×489+4×565)kJ·mol-1=-1 940 kJ·mol-1,A正确。
1
2
3
4
5
6
7
8
9
10
11
【解析】根据表中数据可知,破坏1 mol氢气中的氢氢键所消耗的能量最高,则说明氢气最稳定,具有的能量最低,A正确;
1
2
3
4
5
6
7
8
9
10
11
10. 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
(1) 下列物质本身具有的能量最低的是____(填字母,下同)。
A.H2 B.Cl2
C.Br2 D.I2
物质 Cl2 Br2 I2 HCl HBr HI H2
能量/kJ 243 193 151 431 366 298 436
A
【解析】根据表中数据可知,破坏1 mol氯化氢中的氢氯键所消耗的能量最高,则说明氯化氢最稳定,A正确;
1
2
3
4
5
6
7
8
9
10
11
(2) 下列氢化物中最稳定的是____。
A.HCl B.HBr
C.HI
A
【解析】根据反应:X2+H2══2HX,ΔH=反应物断键吸收的总能量-生成物成键放出的总能量,代入数值进行计算,结果都是ΔH<0,所以卤素单质与氢气的化合反应均为放热反应;
1
2
3
4
5
6
7
8
9
10
11
(3) X2+H2══2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?___________。
放热反应
【解析】生成物越稳定,放出的热量越多,在氯化氢、溴化氢、碘化氢中,氯化氢最稳定,因为同主族元素从上到下元素的氢化物稳定性逐渐减弱,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出热量最多的是氯气。
1
2
3
4
5
6
7
8
9
10
11
(4) 相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是______。
Cl2
1
2
3
4
5
6
7
8
9
10
11
11.金刚石和金刚砂(SiC)具有相似的晶体结构,在金刚砂的三维骨架结构中(如图所示),碳原子、硅原子交替以单键相结合。
1
2
3
4
5
6
7
8
9
10
11
12
试回答:
(1) 金刚砂属于_______晶体。金刚砂熔点比金刚石熔点_____。
(2) 在金刚砂的结构中,一个硅原子周围结合____个碳原子,键角是____________。
(3) 金刚砂的结构中含有由共价键形成的原子环,其中最小的环上有____个硅原子。
共价
低
4
109°28′
3
谢谢观看
Thank you for watching
