专题4 第1单元 课时1 分子的空间结构模型(杂化轨道理论) 课件(共44张PPT) 2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 第1单元 课时1 分子的空间结构模型(杂化轨道理论) 课件(共44张PPT) 2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 09:57:09 | ||
图片预览







文档简介
(共44张PPT)
专题4
分子空间结构与物质性质
第一单元 分子的空间结构
课时1 分子的空间结构模型(杂化轨道理论)
学 习 目 标
1.了解杂化轨道理论。
2.学会判断中心原子杂化轨道类型。
3.建立分子空间构型分析的思维模型。
活 动 方 案
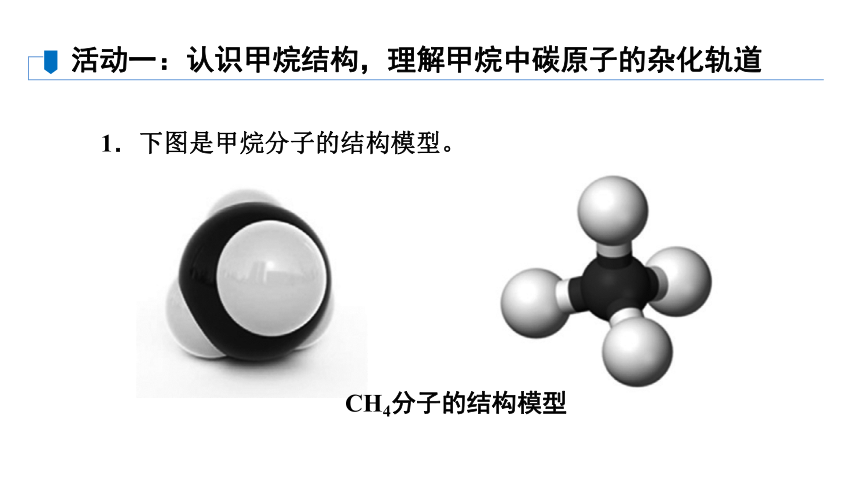
1.下图是甲烷分子的结构模型。
活动一:认识甲烷结构,理解甲烷中碳原子的杂化轨道
CH4分子的结构模型
讨论甲烷的分子式为什么是CH4?下图所示的碳原子外围电子的轨道表示式,你能否解释甲烷分子为什么是正四面体结构?
【答案】 碳原子最外层为4个电子,跟4个氢原子形成4个共价键后,碳原子达到8电子稳定结构,所以甲烷的分子式为CH4。根据前面所学知识,不能解释甲烷分子为什么是正四面体结构。
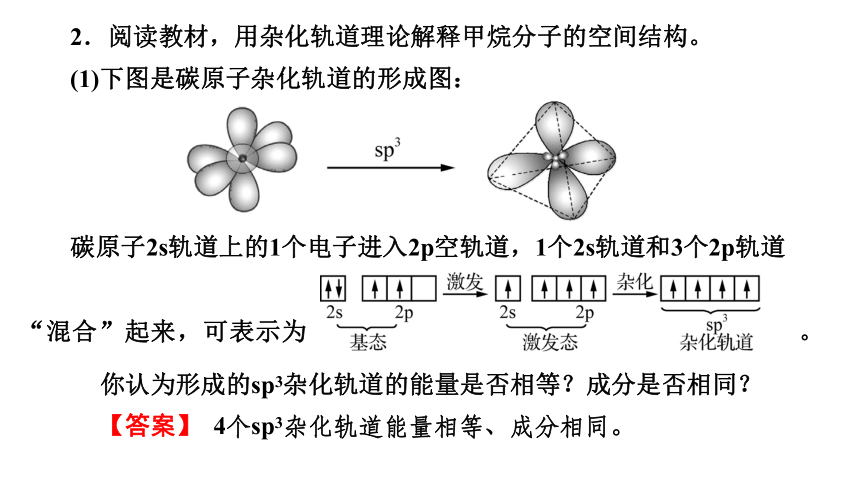
2.阅读教材,用杂化轨道理论解释甲烷分子的空间结构。
(1)下图是碳原子杂化轨道的形成图:
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道
“混合”起来,可表示为 。
你认为形成的sp3杂化轨道的能量是否相等?成分是否相同?
【答案】 4个sp3杂化轨道能量相等、成分相同。
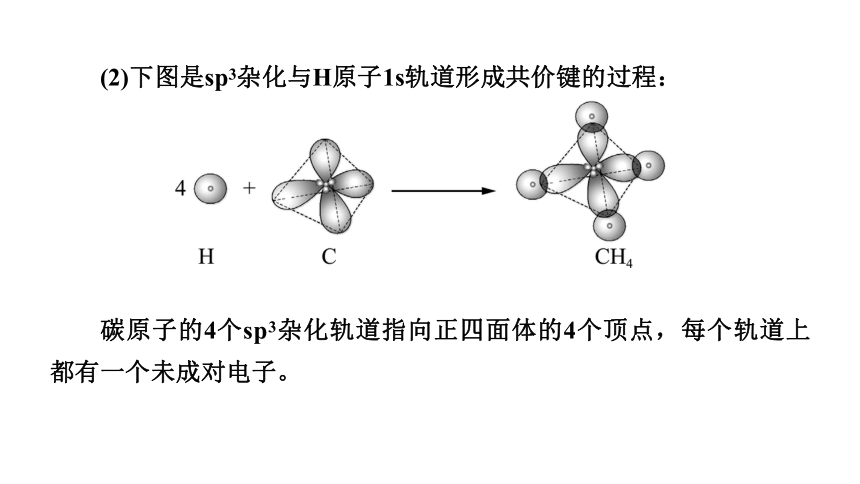
(2)下图是sp3杂化与H原子1s轨道形成共价键的过程:
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。
碳原子的 4 个 sp3 杂化轨道分别与 4 个H原子的 1s 轨道重叠,形成 4 个相同的 σ 键,从而形成甲烷分子。
你认为甲烷分子中的 4 个C—H键是否相同?形成的分子是否是正四面体?
【答案】 甲烷分子中的4个C—H键是相同的,形成的分子是正四面体形。
3.结合教材,讨论哪一类结构的微粒的中心原子一般采取sp3杂化?举例说明。
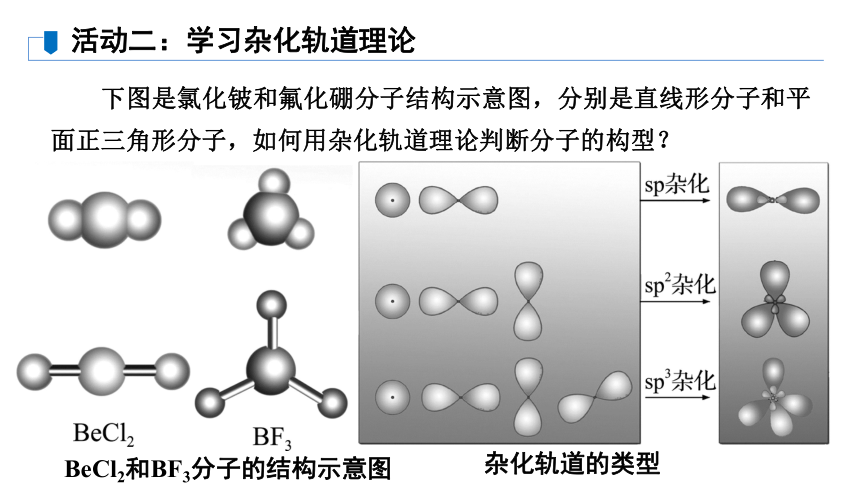
下图是氯化铍和氟化硼分子结构示意图,分别是直线形分子和平面正三角形分子,如何用杂化轨道理论判断分子的构型?
活动二:学习杂化轨道理论
BeCl2和BF3分子的结构示意图
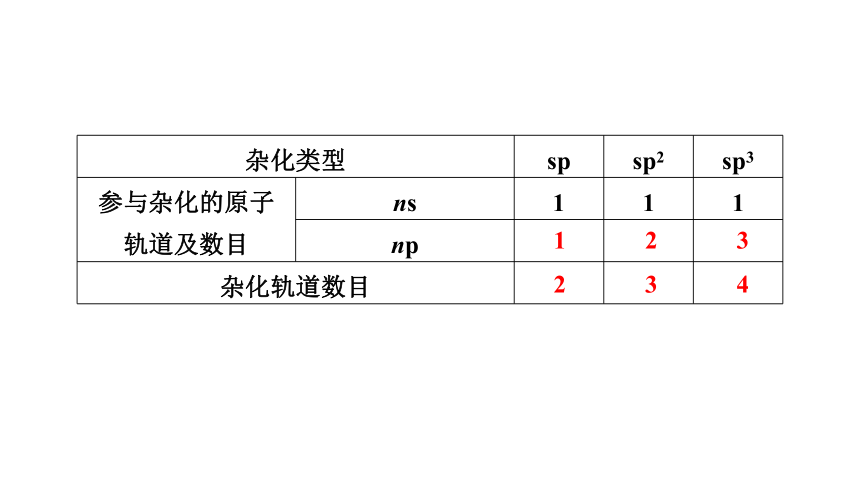
杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原子 轨道及数目 ns 1 1 1
np
杂化轨道数目
1
2
3
2
3
4
1.结合教材,讨论常见的几种杂化方式。上图展示了三种杂化方式,讨论三种杂化轨道由哪些轨道混合而成?形成的杂化轨道形状分别是什么?
【答案】 sp杂化轨道是由一个ns轨道和一个np轨道组合而成的,杂化轨道间的夹角为180°,呈直线形;sp2杂化轨道是由一个ns轨道和两个np轨道组合而成的,杂化轨道间的夹角为120°,呈平面三角形;sp3杂化轨道是由一个ns轨道和三个np轨道组合而成的,杂化轨道间的夹角为109°28′,空间结构为正四面体形。
2.下图是形成气态BeCl2分子过程中Be原子轨道形成杂化情况:
结合图示,描述BeCl2杂化情况,分析该分子呈直线形的原因。
【答案】 杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
3.下图是BF3分子过程中B原子轨道杂化形成情况
结合图示分析,为什么BF3分子具有平面三角形结构?
【答案】 B原子中的 3 个sp2杂化轨道间的夹角为 120°,这 3 个sp2 杂化轨道分别与F原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
活动三:用杂化轨道理论解释乙烷、乙烯、乙炔分子中的成键情况
乙烯和乙炔的结构示意图
结合杂化轨道理论,分析乙烷、乙烯、乙炔分子中的成键情况。
【答案】 在 C2H6 分子中,C 原子均采用 sp3 杂化,每个C原子的 3 个 sp3 轨道分别与 3 个H原子的 1s 轨道重叠形成C—H σ 键;两个C原子各以 1 个sp3轨道发生重叠形成C—C σ键。
在C2H4分子中,C原子均采用sp2杂化,每个C原子的2个sp2轨道分别与2个H原子的1s轨道重叠形成C—H σ键;两个C原子各以1个sp2轨道发生重叠形成C—C σ键,各以1个未杂化的2p轨道发生重叠,形成π键。在与溴发生加成反应时,π键发生断裂。
在C2H2分子中,C原子均采用 sp 杂化,每个C原子的 1 个 sp 轨道分别与 1 个 H 原子的 1s 轨道重叠形成C—H σ 键;两个C原子各以1 个 sp 轨道发生重叠形成C—C σ 键,各以 2 个未杂化的 2p 轨道发生重叠,形成 2 个 π 键。在与足量溴发生加成反应时,2个 π 键发生断裂。
1.讨论不同杂化类型的差异,填写下表。
活动四:归纳小结与应用
杂化类型 sp sp2 sp3
参与杂化的原子轨道
杂化轨道及数目
1个s轨道1个p轨道
1个s轨道2个p轨道
1个s轨道3个p轨道
2个sp杂化轨道
3个sp2杂化轨道
4个sp3杂化轨道
杂化类型 sp sp2 sp3
杂化轨道示意图
分子结构示意图
杂化类型 sp sp2 sp3
杂化轨道间夹角
形成分子空间结构
实例
180°
120°
109°28′
直线形
平面三角形
正四面体形
BeCl2、C2H2
BF3
CH4、CCl4
2.CH4、NH3、H2O分子中,中心原子形成什么类型的杂化?
【答案】 均为sp3杂化。
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
【解析】NH3、CH4、H2O分子中的中心原子的杂化轨道数均为4,都是sp3杂化,A、B、D错误;BF3中的B原子的杂化轨道数为0+3=3,为sp2杂化,C正确。
1.下列分子中的中心原子是sp2杂化的是 ( )
A.NH3 B.CH4
C.BF3 D.H2O
C
1
2
3
4
5
6
7
8
9
10
11
12
2.下列关于杂化轨道的说法中,错误的是 ( )
A.ⅠA族元素成键时不可能有杂化轨道
B.杂化轨道既可能形成 σ 键,也可能形成 π 键
C.s轨道和p轨道杂化不可能有 sp4 杂化轨道出现
D.孤电子对有可能参加杂化
B
【解析】ⅠA族元素如果是碱金属,易失电子,如果是H,一个电子在1s能级上,不可能杂化,A正确;杂化轨道只能形成σ键,不可能形成π键,B错误;p能级只有3个p轨道,不可能有sp4杂化,C正确;水分子中O的杂化方式是sp3,两个孤电子对是完全一样的,参与了杂化,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
3.(2020·瓦房店中学期末)下列分子或离子的中心原子杂化轨道类型不同的是 ( )
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4.下列关于杂化轨道的说法错误的是 ( )
A.所有的原子轨道都参与杂化形成杂化轨道
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定都填充一个电子
A
【解析】参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,即只是能量相近的原子轨道才能参与杂化,A错误,B正确;杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,C正确;并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3、H2O),D正确。
1
2
3
4
5
6
7
8
9
10
11
12
【解析】np轨道有三个:npx、npy、npz,当s轨道和p轨道杂化时只有三种类型:①sp杂化:即一个s轨道和一个p轨道的杂化;②sp2杂化:即一个s轨道和两个p轨道的杂化;③sp3杂化:即一个s轨道和三个p轨道的杂化。
1
2
3
4
5
6
7
8
9
10
11
12
5.S 轨道和 p 轨道杂化的类型不可能有 ( )
A.sp杂化 B.sp2杂化
C.sp3杂化 D.sp4杂化
D
1
2
3
4
5
6
7
8
9
10
11
12
6.下列分子或离子的中心原子采用sp3杂化的是 ( )
A.①②④ B.①⑤
C.②③ D.③⑤
B
1
2
3
4
5
6
7
8
9
10
11
12
7.(2021·南京六校期末联考) 5B、6C、7N、8O是短周期主族元素。下列说法正确的是 ( )
A.元素 C 在周期表中位于第2周期Ⅳ族
B.N2H4中氮原子的轨道杂化类型:sp2
C.第一电离能:N>O>C
D.最高价氧化物对应的水化物的酸性:H3BO3 > H2CO3
C
【解析】元素C在周期表中位于第2周期ⅣA族,A错误;N2H4中氮原子形成3个σ键,还有一对孤电子对,为sp3杂化,B错误;同周期自左至右第一电离能呈增大趋势,但N原子2p能级轨道半满,更稳定,第一电离能大于相邻元素,所以第一电离能:N>O>C,C正确;同周期主族元素自左至右非金属性增强,最高价氧化物对应水化物的酸性增大,所以酸性:H3BO3<H2CO3,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
【解析】中间的碳原子形成了3个σ键,无未成键电子对,需要形成3个杂化轨道,采用的杂化方式是sp2杂化;两边的碳原子各自形成了4个σ键,无未成键电子对,需要形成4个杂化轨道,采用的杂化方式是sp3杂化,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
8.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是 ( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
C
1
2
3
4
5
6
7
8
9
10
11
12
9.(2021·河南长葛一中质检)关于原子轨道的说法正确的是
( )
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
C
【解析】凡是中心原子采取sp3杂化轨道成键的分子其几何构型不一定都是正四面体,如NH3,属于三角锥形,A错误;sp3杂化轨道指一个原子同一电子层内由一个ns轨道和三个np轨道发生杂化形成的轨道,不是不同原子的杂化,B错误;sp3杂化轨道的定义就是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道,C正确;比如SO3属于sp2杂化,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10.如图所示,在乙烯分子中有5个σ键、1个π键,下列表述正确的是 ( )
A.C、H之间是sp2杂化轨道形成的键,C、C之间是未参加杂化的2p轨道形成的π键
B.C、C之间是sp2杂化轨道形成的键,C、H之间是未参加杂化的2p轨道形成的π键
C.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
D.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C
【解析】C、C之间除未参加杂化的2p轨道形成的π键外,还有sp2杂化轨道形成的σ键,A错误;C、H之间是sp2杂化轨道形成的σ键,B错误;sp2杂化轨道形成σ键,未杂化的2p轨道形成π键,C正确,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(1) 分子空间结构为正四面体形的是_______(填序号,下同)。
(2) 中心原子为sp3杂化的是_____________,中心原子为sp2杂化的是_______,中心原子为sp杂化的是_____。
(3) 所有原子共平面(含共直线)的是___________,共直线的是_____。
①⑤
①④⑤⑦⑧
②⑥
③
②③⑥⑦
③
1
2
3
4
5
6
7
8
9
10
11
12
12.“三鹿奶粉事件”在社会上引起了人们对食品
质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工
业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。
三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问
题:
(1) 写出基态碳原子的电子排布式:____________。
(2) 氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是_____、______、______。
(3) 一个三聚氰胺分子中有_____个σ键。
1s22s22p2
sp
sp2
sp3
15
1
2
3
4
5
6
7
8
9
10
11
12
(4) 三聚氰胺与三聚氰酸( )分子相互之间通过氢键结
合,在肾脏内易形成结石。三聚氰酸分子中C原子采取______杂化。该分子的结构简式中,每个碳氧原子之间的共价键是____(填字母)。
A.2个σ键
B.2个π键
C.1个σ键,1个π键
sp2
C
谢谢观看
Thank you for watching
专题4
分子空间结构与物质性质
第一单元 分子的空间结构
课时1 分子的空间结构模型(杂化轨道理论)
学 习 目 标
1.了解杂化轨道理论。
2.学会判断中心原子杂化轨道类型。
3.建立分子空间构型分析的思维模型。
活 动 方 案
1.下图是甲烷分子的结构模型。
活动一:认识甲烷结构,理解甲烷中碳原子的杂化轨道
CH4分子的结构模型
讨论甲烷的分子式为什么是CH4?下图所示的碳原子外围电子的轨道表示式,你能否解释甲烷分子为什么是正四面体结构?
【答案】 碳原子最外层为4个电子,跟4个氢原子形成4个共价键后,碳原子达到8电子稳定结构,所以甲烷的分子式为CH4。根据前面所学知识,不能解释甲烷分子为什么是正四面体结构。
2.阅读教材,用杂化轨道理论解释甲烷分子的空间结构。
(1)下图是碳原子杂化轨道的形成图:
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道
“混合”起来,可表示为 。
你认为形成的sp3杂化轨道的能量是否相等?成分是否相同?
【答案】 4个sp3杂化轨道能量相等、成分相同。
(2)下图是sp3杂化与H原子1s轨道形成共价键的过程:
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。
碳原子的 4 个 sp3 杂化轨道分别与 4 个H原子的 1s 轨道重叠,形成 4 个相同的 σ 键,从而形成甲烷分子。
你认为甲烷分子中的 4 个C—H键是否相同?形成的分子是否是正四面体?
【答案】 甲烷分子中的4个C—H键是相同的,形成的分子是正四面体形。
3.结合教材,讨论哪一类结构的微粒的中心原子一般采取sp3杂化?举例说明。
下图是氯化铍和氟化硼分子结构示意图,分别是直线形分子和平面正三角形分子,如何用杂化轨道理论判断分子的构型?
活动二:学习杂化轨道理论
BeCl2和BF3分子的结构示意图
杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原子 轨道及数目 ns 1 1 1
np
杂化轨道数目
1
2
3
2
3
4
1.结合教材,讨论常见的几种杂化方式。上图展示了三种杂化方式,讨论三种杂化轨道由哪些轨道混合而成?形成的杂化轨道形状分别是什么?
【答案】 sp杂化轨道是由一个ns轨道和一个np轨道组合而成的,杂化轨道间的夹角为180°,呈直线形;sp2杂化轨道是由一个ns轨道和两个np轨道组合而成的,杂化轨道间的夹角为120°,呈平面三角形;sp3杂化轨道是由一个ns轨道和三个np轨道组合而成的,杂化轨道间的夹角为109°28′,空间结构为正四面体形。
2.下图是形成气态BeCl2分子过程中Be原子轨道形成杂化情况:
结合图示,描述BeCl2杂化情况,分析该分子呈直线形的原因。
【答案】 杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
3.下图是BF3分子过程中B原子轨道杂化形成情况
结合图示分析,为什么BF3分子具有平面三角形结构?
【答案】 B原子中的 3 个sp2杂化轨道间的夹角为 120°,这 3 个sp2 杂化轨道分别与F原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
活动三:用杂化轨道理论解释乙烷、乙烯、乙炔分子中的成键情况
乙烯和乙炔的结构示意图
结合杂化轨道理论,分析乙烷、乙烯、乙炔分子中的成键情况。
【答案】 在 C2H6 分子中,C 原子均采用 sp3 杂化,每个C原子的 3 个 sp3 轨道分别与 3 个H原子的 1s 轨道重叠形成C—H σ 键;两个C原子各以 1 个sp3轨道发生重叠形成C—C σ键。
在C2H4分子中,C原子均采用sp2杂化,每个C原子的2个sp2轨道分别与2个H原子的1s轨道重叠形成C—H σ键;两个C原子各以1个sp2轨道发生重叠形成C—C σ键,各以1个未杂化的2p轨道发生重叠,形成π键。在与溴发生加成反应时,π键发生断裂。
在C2H2分子中,C原子均采用 sp 杂化,每个C原子的 1 个 sp 轨道分别与 1 个 H 原子的 1s 轨道重叠形成C—H σ 键;两个C原子各以1 个 sp 轨道发生重叠形成C—C σ 键,各以 2 个未杂化的 2p 轨道发生重叠,形成 2 个 π 键。在与足量溴发生加成反应时,2个 π 键发生断裂。
1.讨论不同杂化类型的差异,填写下表。
活动四:归纳小结与应用
杂化类型 sp sp2 sp3
参与杂化的原子轨道
杂化轨道及数目
1个s轨道1个p轨道
1个s轨道2个p轨道
1个s轨道3个p轨道
2个sp杂化轨道
3个sp2杂化轨道
4个sp3杂化轨道
杂化类型 sp sp2 sp3
杂化轨道示意图
分子结构示意图
杂化类型 sp sp2 sp3
杂化轨道间夹角
形成分子空间结构
实例
180°
120°
109°28′
直线形
平面三角形
正四面体形
BeCl2、C2H2
BF3
CH4、CCl4
2.CH4、NH3、H2O分子中,中心原子形成什么类型的杂化?
【答案】 均为sp3杂化。
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
【解析】NH3、CH4、H2O分子中的中心原子的杂化轨道数均为4,都是sp3杂化,A、B、D错误;BF3中的B原子的杂化轨道数为0+3=3,为sp2杂化,C正确。
1.下列分子中的中心原子是sp2杂化的是 ( )
A.NH3 B.CH4
C.BF3 D.H2O
C
1
2
3
4
5
6
7
8
9
10
11
12
2.下列关于杂化轨道的说法中,错误的是 ( )
A.ⅠA族元素成键时不可能有杂化轨道
B.杂化轨道既可能形成 σ 键,也可能形成 π 键
C.s轨道和p轨道杂化不可能有 sp4 杂化轨道出现
D.孤电子对有可能参加杂化
B
【解析】ⅠA族元素如果是碱金属,易失电子,如果是H,一个电子在1s能级上,不可能杂化,A正确;杂化轨道只能形成σ键,不可能形成π键,B错误;p能级只有3个p轨道,不可能有sp4杂化,C正确;水分子中O的杂化方式是sp3,两个孤电子对是完全一样的,参与了杂化,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
3.(2020·瓦房店中学期末)下列分子或离子的中心原子杂化轨道类型不同的是 ( )
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4.下列关于杂化轨道的说法错误的是 ( )
A.所有的原子轨道都参与杂化形成杂化轨道
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定都填充一个电子
A
【解析】参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,即只是能量相近的原子轨道才能参与杂化,A错误,B正确;杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,C正确;并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3、H2O),D正确。
1
2
3
4
5
6
7
8
9
10
11
12
【解析】np轨道有三个:npx、npy、npz,当s轨道和p轨道杂化时只有三种类型:①sp杂化:即一个s轨道和一个p轨道的杂化;②sp2杂化:即一个s轨道和两个p轨道的杂化;③sp3杂化:即一个s轨道和三个p轨道的杂化。
1
2
3
4
5
6
7
8
9
10
11
12
5.S 轨道和 p 轨道杂化的类型不可能有 ( )
A.sp杂化 B.sp2杂化
C.sp3杂化 D.sp4杂化
D
1
2
3
4
5
6
7
8
9
10
11
12
6.下列分子或离子的中心原子采用sp3杂化的是 ( )
A.①②④ B.①⑤
C.②③ D.③⑤
B
1
2
3
4
5
6
7
8
9
10
11
12
7.(2021·南京六校期末联考) 5B、6C、7N、8O是短周期主族元素。下列说法正确的是 ( )
A.元素 C 在周期表中位于第2周期Ⅳ族
B.N2H4中氮原子的轨道杂化类型:sp2
C.第一电离能:N>O>C
D.最高价氧化物对应的水化物的酸性:H3BO3 > H2CO3
C
【解析】元素C在周期表中位于第2周期ⅣA族,A错误;N2H4中氮原子形成3个σ键,还有一对孤电子对,为sp3杂化,B错误;同周期自左至右第一电离能呈增大趋势,但N原子2p能级轨道半满,更稳定,第一电离能大于相邻元素,所以第一电离能:N>O>C,C正确;同周期主族元素自左至右非金属性增强,最高价氧化物对应水化物的酸性增大,所以酸性:H3BO3<H2CO3,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
【解析】中间的碳原子形成了3个σ键,无未成键电子对,需要形成3个杂化轨道,采用的杂化方式是sp2杂化;两边的碳原子各自形成了4个σ键,无未成键电子对,需要形成4个杂化轨道,采用的杂化方式是sp3杂化,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
8.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是 ( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
C
1
2
3
4
5
6
7
8
9
10
11
12
9.(2021·河南长葛一中质检)关于原子轨道的说法正确的是
( )
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
C
【解析】凡是中心原子采取sp3杂化轨道成键的分子其几何构型不一定都是正四面体,如NH3,属于三角锥形,A错误;sp3杂化轨道指一个原子同一电子层内由一个ns轨道和三个np轨道发生杂化形成的轨道,不是不同原子的杂化,B错误;sp3杂化轨道的定义就是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道,C正确;比如SO3属于sp2杂化,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10.如图所示,在乙烯分子中有5个σ键、1个π键,下列表述正确的是 ( )
A.C、H之间是sp2杂化轨道形成的键,C、C之间是未参加杂化的2p轨道形成的π键
B.C、C之间是sp2杂化轨道形成的键,C、H之间是未参加杂化的2p轨道形成的π键
C.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
D.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C
【解析】C、C之间除未参加杂化的2p轨道形成的π键外,还有sp2杂化轨道形成的σ键,A错误;C、H之间是sp2杂化轨道形成的σ键,B错误;sp2杂化轨道形成σ键,未杂化的2p轨道形成π键,C正确,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(1) 分子空间结构为正四面体形的是_______(填序号,下同)。
(2) 中心原子为sp3杂化的是_____________,中心原子为sp2杂化的是_______,中心原子为sp杂化的是_____。
(3) 所有原子共平面(含共直线)的是___________,共直线的是_____。
①⑤
①④⑤⑦⑧
②⑥
③
②③⑥⑦
③
1
2
3
4
5
6
7
8
9
10
11
12
12.“三鹿奶粉事件”在社会上引起了人们对食品
质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工
业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。
三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问
题:
(1) 写出基态碳原子的电子排布式:____________。
(2) 氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是_____、______、______。
(3) 一个三聚氰胺分子中有_____个σ键。
1s22s22p2
sp
sp2
sp3
15
1
2
3
4
5
6
7
8
9
10
11
12
(4) 三聚氰胺与三聚氰酸( )分子相互之间通过氢键结
合,在肾脏内易形成结石。三聚氰酸分子中C原子采取______杂化。该分子的结构简式中,每个碳氧原子之间的共价键是____(填字母)。
A.2个σ键
B.2个π键
C.1个σ键,1个π键
sp2
C
谢谢观看
Thank you for watching
