专题4 第1单元 课时2 分子的空间结构模型(价层电子对互斥模型)等电子原理 课件(共45张PPT) 2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 第1单元 课时2 分子的空间结构模型(价层电子对互斥模型)等电子原理 课件(共45张PPT) 2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 09:59:08 | ||
图片预览










文档简介
(共45张PPT)
专题4
分子空间结构与物质性质
第一单元 分子的空间结构
课时2 分子的空间结构模型(价层电子对互斥模型) 等电子原理
学 习 目 标
1.了解价层电子对互斥理论,通过对价层电子对互斥模型的探究,建立判断分子空间构型的思维模型。
2.了解等电子体的概念及判断方法,能用等电子原理解释物质的结构和某些性质,结合实例说明“等电子原理”的应用。
活 动 方 案
1.上述分子中的中心原子杂化方式是什么?
【答案】 二氧化碳分子中碳原子sp杂化,其余分子的中心原子均为sp3杂化。
活动一:讨论几种常见分子的空间结构
分子 键长/pm 键角
CO2 116 180°
H2O 96 104°30′
NH3 101 107°18′
CH4 109 109°28′
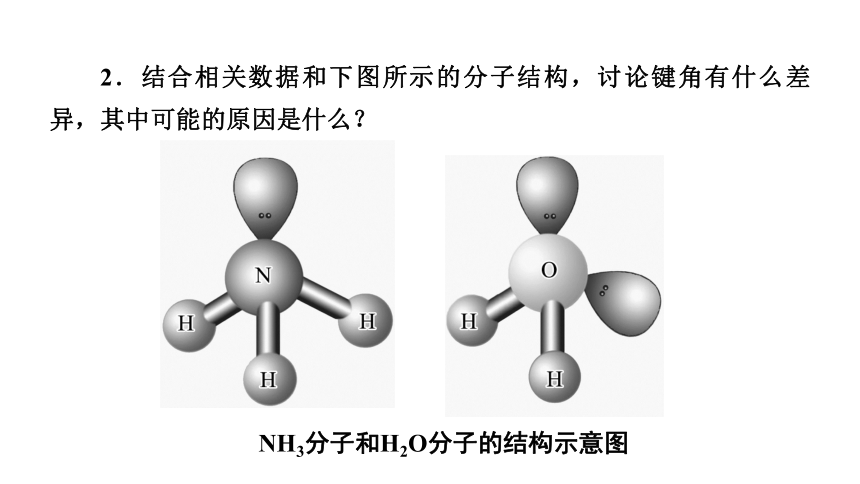
2.结合相关数据和下图所示的分子结构,讨论键角有什么差异,其中可能的原因是什么?
NH3分子和H2O分子的结构示意图
【答案】 甲烷分子中的键角大于氨气,NH3分子中的键角大于水分子。键角的大小除与杂化类型有关,还与分子中的孤电子对数目有关,孤电子对数目越多,键角越小。
3.阅读教材,了解测定分子空间结构的方法有哪些?
【答案】 用实验的方法可以测定分子的空间结构,如红外光谱、晶体的X射线衍射、核磁共振等。
1.分子中的价电子对(包括_____________和___________)由于相互_______作用,而趋向于尽可能彼此_______以减小_______,分子尽可能采取_______的空间结构。
2.讨论价层电子对互斥模型与分子的价电子对的几何构型。
(1)当中心原子的价电子全部参与成键时,为使价电子斥力最小,分子呈_______的空间结构。
活动二:了解价层电子对互斥模型
成键电子对
孤电子对
排斥
远离
斥力
对称
对称
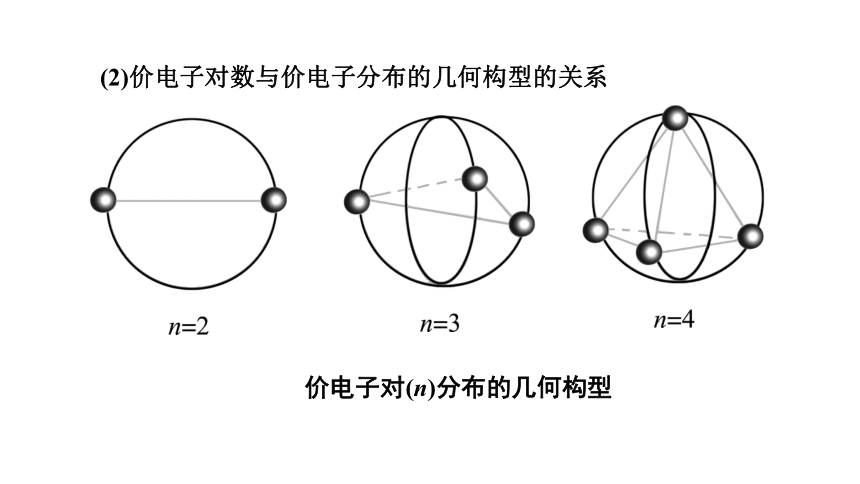
(2)价电子对数与价电子分布的几何构型的关系
价电子对(n)分布的几何构型
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对分布的几何构型也相同。例如,CH4、NH3和H2O分子的价电子对数都是4,中心原子均采取sp3杂化,价电子对分布的几何构型均为正四面体。
该模型的提出主要考虑价电子对之间的斥力,而分子结构的影响因素往往比较复杂。因此应用该模型预测的结果与实验测定有偏差,也不能说明各分子结构中化学键形成的原因和相对稳定性。所以,分子结构的确定最终必须以实验测定为依据。
3.讨论分子的几何构型。
(1)对于价电子对全是成键电子对的分子,价电子对的几何构型与分子的空间结构是一致的。
填写下表:
分子 BeCl2 BF3 CH4
价电子对数 2 3 4
几何构型
球棍模型
直线形
平面三角形
正四面体
(2)中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子的几何构型。
由于中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的几何构型发生变化。如H2O分子氧原子上有两对孤电子对参与互相排斥,所以H2O分子的空间结构为______;NH3分子中氮原子上有一对孤电子对参与互相排斥,NH3的空间结构是___________。
V形
三角锥形
4.讨论电子对之间斥力的大小和分子中键角大小之间的关系。
(1)不同的电子对之间的斥力大小顺序是什么?为什么会出现斥力不同?
【答案】 价电子对之间的斥力大小顺序:孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力。
斥力大小不同的原因是孤电子对比成键电子对更靠近中心原子的原子核,与其他电子对之间的斥力更大。
(2)为什么CH4、NH3和H2O分子中键角依次减小?
【答案】 孤电子对数目的增多,孤电子对对成键电子对的排斥作用增强,使得成键电子对与成键电子对之间的键角也被“压缩”而减小。如CH4分子中C原子的杂化轨道上没有孤电子对,NH3分子中N原子的杂化轨道上有1对孤电子对,H2O分子中O原子的杂化轨道上有2对孤电子对,因此CH4、NH3和H2O分子中键角依次减小。
1.对于ABm型分子(A是中心原子,B是配位原子)的价电子对数可以通过下式确定:
中心原子的价层电子数等于中心原子的_______________,卤素原子按提供____个电子计算,氧族元素的原子按提供____个电子计算;配位原子中卤素原子和H原子提供____个电子,氧族元素的原子提供____个电子。对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数,即:
活动三:学习ABm型分子的价层电子对的计算方法
最外层电子数
7
6
1
0
计算电子对数时,若剩余1个电子,即出现奇数电子,也把这个单电子当作______电子处理。
1对
2.填写常见分子的价层电子对互斥模型和分子的空间结构。
σ键电 子对数 孤电子对数 价电子 对数目 电子对的 排列方式 价层电子对互斥模型 分子或离子的空间结构 实例
2 0 2 BeCl2、CO2
3 0 3 BF3、BCl3
2 1 PbCl2
直线形
直线形
三角形
平面三角形
V形
σ键电 子对数 孤电子对数 价电子 对数目 电子对的 排列方式 价层电子对互斥模型 分子或离子的空间结构 实例
4 0 4 CH4、CCl4
3 1 NH3
2 2 H2O
四面体形
正四面体形
三角锥形
V形
1.具有相同___________和相同_________的分子或离子,具有相同的结构特征,这一原理称为“等电子原理”。原子总数相同、_____________相同的分子或离子互称为等电子体。
2.利用等电子原理可判断简单分子或离子的空间结构,如NH3与H3O+互为___________,二者空间构型相同,均为_________形。
活动四:拓展视野——等电子原理
价电子数
原子数
价电子总数
等电子体
三角锥
3.常见的等电子体。
直线形
直线形
V形
平面三角形
正四面体形
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
【解析】根据等电子体的条件:①原子总数相同,②价电子数之和相等,判断NO+和CN-属于等电子体,C正确。
1.下列各组微粒属于等电子体的是 ( )
A.12CO2和14CO B.H2O和NH3
C.NO+和CN- D.NO和CO
C
1
2
3
4
5
6
7
8
9
10
11
12
2.(2020·吕叔湘中学诊断考试)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
( )
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
A
【解析】水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,A不合理;水分子为V形,H3O+为三角锥形,则微粒的形状发生了改变,B合理;因结构不同,则性质不同,微粒的化学性质发生了改变,C合理;水分子为V形,H3O+为三角锥形,微粒中的键角发生了改变,D合理。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
3.下列分子或离子中,中心原子价层电子对的空间结构为四面体形且分子或离子的空间结构为三角锥形的是 ( )
A.①② B.②③
C.③④ D.①④
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4. (2022·海门中学高三入学考试 )肼(N2H4)是发射航天飞船常用的高能燃料,可通过反应2NH3+NaClO══N2H4+NaCl+H2O制备。下列有关微粒的描述不正确的是 ( )
A.NH3分子空间结构为三角锥形
B.N2H4的结构式为
C.NaClO既含离子键又含共价键
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
( )
A.16O原子中的中子数为16
B.H2O的空间结构是直线形
C.CH3CHO分子中 σ 键和 π 键的数目之比为 5∶2
D.C2H5OH与H2O互溶是因为C2H5OH与H2O形成分子间氢键
D
【解析】16O原子中质子数为8,质量数为16,则中子数=16-8=8,A错误;H2O的空间结构是V形,B错误;单键为σ键,双键含有1个σ键、1个π键,故CH3CHO分子中含有6个σ键、1个π键,σ键和π键的数目之比为6∶1,C错误;C2H5OH与H2O互溶主要是因为C2H5OH与H2O可形成分子间氢键,增大了分子间作用力,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
6.(2021·南京六校期末联考) 二氧化硫虽然是形成酸雨的主要物质,但对食品有漂白和防腐作用,使用二氧化硫能够达到使产品外观光亮、洁白的效果,也是制取硫酸重要的原料气;已知二氧化硫与氧气反应的热化学方程式为 2SO2(g)+O2(g)══2SO3(g) ΔH=-197 kJ·mol-1。下列有关说法正确的是 ( )
A.SO3是共价晶体
B.SO2的水溶液放置在空气中,pH会增大
C.SO3的空间结构为平面三角形
D.SO2制取SO3利用了SO2的氧化性
C
1
2
3
4
5
6
7
8
9
10
11
12
【解析】CO2的空间结构是直线形,A错误;H2O的空间结构为V形,B错误;NH3的空间结构为三角锥形,C错误;CH4是正四面体结构,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
7.下列分子的空间结构模型正确的是 ( )
D
A B C D
CO2 H2O NH3 CH4
1
2
3
4
5
6
7
8
9
10
11
12
8.(2020·山东济宁高二期末)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是 ( )
A.三角锥形、sp3
B.平面三角形、sp3
C.平面三角形、sp2
D.三角锥形、sp2
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10.(2020·云南昭通期末)下列有关SO3的说法正确的是 ( )
A.空间结构与NH3相似
B.空间结构与SO2相似
C.空间结构与BF3相似
D.空间结构与P4相似
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2) 肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间结构是___________;N2H4分子中氮原子轨道的杂化类型是______。
120°
sp2
正四面体形
三角锥形
sp3
1
2
3
4
5
6
7
8
9
10
11
12
(3) H+可与H2O形成H3O+,H3O+中氧原子采用______杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为__________ __________________________________________________________。
sp3
H2O中氧原子有2对孤电子对,H3O+中氧原子只有1对孤电子对,排斥力较小
正四面体形
sp3
1
2
3
4
5
6
7
8
9
10
11
12
12.(1) 写出与OH-互为等电子体的一种分子:____________。
HF、HCl等
N2O4
CH4、SiH4等
C2H6
谢谢观看
Thank you for watching
专题4
分子空间结构与物质性质
第一单元 分子的空间结构
课时2 分子的空间结构模型(价层电子对互斥模型) 等电子原理
学 习 目 标
1.了解价层电子对互斥理论,通过对价层电子对互斥模型的探究,建立判断分子空间构型的思维模型。
2.了解等电子体的概念及判断方法,能用等电子原理解释物质的结构和某些性质,结合实例说明“等电子原理”的应用。
活 动 方 案
1.上述分子中的中心原子杂化方式是什么?
【答案】 二氧化碳分子中碳原子sp杂化,其余分子的中心原子均为sp3杂化。
活动一:讨论几种常见分子的空间结构
分子 键长/pm 键角
CO2 116 180°
H2O 96 104°30′
NH3 101 107°18′
CH4 109 109°28′
2.结合相关数据和下图所示的分子结构,讨论键角有什么差异,其中可能的原因是什么?
NH3分子和H2O分子的结构示意图
【答案】 甲烷分子中的键角大于氨气,NH3分子中的键角大于水分子。键角的大小除与杂化类型有关,还与分子中的孤电子对数目有关,孤电子对数目越多,键角越小。
3.阅读教材,了解测定分子空间结构的方法有哪些?
【答案】 用实验的方法可以测定分子的空间结构,如红外光谱、晶体的X射线衍射、核磁共振等。
1.分子中的价电子对(包括_____________和___________)由于相互_______作用,而趋向于尽可能彼此_______以减小_______,分子尽可能采取_______的空间结构。
2.讨论价层电子对互斥模型与分子的价电子对的几何构型。
(1)当中心原子的价电子全部参与成键时,为使价电子斥力最小,分子呈_______的空间结构。
活动二:了解价层电子对互斥模型
成键电子对
孤电子对
排斥
远离
斥力
对称
对称
(2)价电子对数与价电子分布的几何构型的关系
价电子对(n)分布的几何构型
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对分布的几何构型也相同。例如,CH4、NH3和H2O分子的价电子对数都是4,中心原子均采取sp3杂化,价电子对分布的几何构型均为正四面体。
该模型的提出主要考虑价电子对之间的斥力,而分子结构的影响因素往往比较复杂。因此应用该模型预测的结果与实验测定有偏差,也不能说明各分子结构中化学键形成的原因和相对稳定性。所以,分子结构的确定最终必须以实验测定为依据。
3.讨论分子的几何构型。
(1)对于价电子对全是成键电子对的分子,价电子对的几何构型与分子的空间结构是一致的。
填写下表:
分子 BeCl2 BF3 CH4
价电子对数 2 3 4
几何构型
球棍模型
直线形
平面三角形
正四面体
(2)中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子的几何构型。
由于中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的几何构型发生变化。如H2O分子氧原子上有两对孤电子对参与互相排斥,所以H2O分子的空间结构为______;NH3分子中氮原子上有一对孤电子对参与互相排斥,NH3的空间结构是___________。
V形
三角锥形
4.讨论电子对之间斥力的大小和分子中键角大小之间的关系。
(1)不同的电子对之间的斥力大小顺序是什么?为什么会出现斥力不同?
【答案】 价电子对之间的斥力大小顺序:孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力。
斥力大小不同的原因是孤电子对比成键电子对更靠近中心原子的原子核,与其他电子对之间的斥力更大。
(2)为什么CH4、NH3和H2O分子中键角依次减小?
【答案】 孤电子对数目的增多,孤电子对对成键电子对的排斥作用增强,使得成键电子对与成键电子对之间的键角也被“压缩”而减小。如CH4分子中C原子的杂化轨道上没有孤电子对,NH3分子中N原子的杂化轨道上有1对孤电子对,H2O分子中O原子的杂化轨道上有2对孤电子对,因此CH4、NH3和H2O分子中键角依次减小。
1.对于ABm型分子(A是中心原子,B是配位原子)的价电子对数可以通过下式确定:
中心原子的价层电子数等于中心原子的_______________,卤素原子按提供____个电子计算,氧族元素的原子按提供____个电子计算;配位原子中卤素原子和H原子提供____个电子,氧族元素的原子提供____个电子。对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数,即:
活动三:学习ABm型分子的价层电子对的计算方法
最外层电子数
7
6
1
0
计算电子对数时,若剩余1个电子,即出现奇数电子,也把这个单电子当作______电子处理。
1对
2.填写常见分子的价层电子对互斥模型和分子的空间结构。
σ键电 子对数 孤电子对数 价电子 对数目 电子对的 排列方式 价层电子对互斥模型 分子或离子的空间结构 实例
2 0 2 BeCl2、CO2
3 0 3 BF3、BCl3
2 1 PbCl2
直线形
直线形
三角形
平面三角形
V形
σ键电 子对数 孤电子对数 价电子 对数目 电子对的 排列方式 价层电子对互斥模型 分子或离子的空间结构 实例
4 0 4 CH4、CCl4
3 1 NH3
2 2 H2O
四面体形
正四面体形
三角锥形
V形
1.具有相同___________和相同_________的分子或离子,具有相同的结构特征,这一原理称为“等电子原理”。原子总数相同、_____________相同的分子或离子互称为等电子体。
2.利用等电子原理可判断简单分子或离子的空间结构,如NH3与H3O+互为___________,二者空间构型相同,均为_________形。
活动四:拓展视野——等电子原理
价电子数
原子数
价电子总数
等电子体
三角锥
3.常见的等电子体。
直线形
直线形
V形
平面三角形
正四面体形
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
【解析】根据等电子体的条件:①原子总数相同,②价电子数之和相等,判断NO+和CN-属于等电子体,C正确。
1.下列各组微粒属于等电子体的是 ( )
A.12CO2和14CO B.H2O和NH3
C.NO+和CN- D.NO和CO
C
1
2
3
4
5
6
7
8
9
10
11
12
2.(2020·吕叔湘中学诊断考试)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
( )
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
A
【解析】水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,A不合理;水分子为V形,H3O+为三角锥形,则微粒的形状发生了改变,B合理;因结构不同,则性质不同,微粒的化学性质发生了改变,C合理;水分子为V形,H3O+为三角锥形,微粒中的键角发生了改变,D合理。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
3.下列分子或离子中,中心原子价层电子对的空间结构为四面体形且分子或离子的空间结构为三角锥形的是 ( )
A.①② B.②③
C.③④ D.①④
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4. (2022·海门中学高三入学考试 )肼(N2H4)是发射航天飞船常用的高能燃料,可通过反应2NH3+NaClO══N2H4+NaCl+H2O制备。下列有关微粒的描述不正确的是 ( )
A.NH3分子空间结构为三角锥形
B.N2H4的结构式为
C.NaClO既含离子键又含共价键
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
( )
A.16O原子中的中子数为16
B.H2O的空间结构是直线形
C.CH3CHO分子中 σ 键和 π 键的数目之比为 5∶2
D.C2H5OH与H2O互溶是因为C2H5OH与H2O形成分子间氢键
D
【解析】16O原子中质子数为8,质量数为16,则中子数=16-8=8,A错误;H2O的空间结构是V形,B错误;单键为σ键,双键含有1个σ键、1个π键,故CH3CHO分子中含有6个σ键、1个π键,σ键和π键的数目之比为6∶1,C错误;C2H5OH与H2O互溶主要是因为C2H5OH与H2O可形成分子间氢键,增大了分子间作用力,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
6.(2021·南京六校期末联考) 二氧化硫虽然是形成酸雨的主要物质,但对食品有漂白和防腐作用,使用二氧化硫能够达到使产品外观光亮、洁白的效果,也是制取硫酸重要的原料气;已知二氧化硫与氧气反应的热化学方程式为 2SO2(g)+O2(g)══2SO3(g) ΔH=-197 kJ·mol-1。下列有关说法正确的是 ( )
A.SO3是共价晶体
B.SO2的水溶液放置在空气中,pH会增大
C.SO3的空间结构为平面三角形
D.SO2制取SO3利用了SO2的氧化性
C
1
2
3
4
5
6
7
8
9
10
11
12
【解析】CO2的空间结构是直线形,A错误;H2O的空间结构为V形,B错误;NH3的空间结构为三角锥形,C错误;CH4是正四面体结构,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
7.下列分子的空间结构模型正确的是 ( )
D
A B C D
CO2 H2O NH3 CH4
1
2
3
4
5
6
7
8
9
10
11
12
8.(2020·山东济宁高二期末)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是 ( )
A.三角锥形、sp3
B.平面三角形、sp3
C.平面三角形、sp2
D.三角锥形、sp2
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10.(2020·云南昭通期末)下列有关SO3的说法正确的是 ( )
A.空间结构与NH3相似
B.空间结构与SO2相似
C.空间结构与BF3相似
D.空间结构与P4相似
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2) 肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间结构是___________;N2H4分子中氮原子轨道的杂化类型是______。
120°
sp2
正四面体形
三角锥形
sp3
1
2
3
4
5
6
7
8
9
10
11
12
(3) H+可与H2O形成H3O+,H3O+中氧原子采用______杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为__________ __________________________________________________________。
sp3
H2O中氧原子有2对孤电子对,H3O+中氧原子只有1对孤电子对,排斥力较小
正四面体形
sp3
1
2
3
4
5
6
7
8
9
10
11
12
12.(1) 写出与OH-互为等电子体的一种分子:____________。
HF、HCl等
N2O4
CH4、SiH4等
C2H6
谢谢观看
Thank you for watching
