专题4 第2单元 配合物的形成和应用课件(共43张PPT)2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 第2单元 配合物的形成和应用课件(共43张PPT)2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 10:53:49 | ||
图片预览











文档简介
(共43张PPT)
专题4
分子空间结构与物质性质
第二单元 配合物的形成和应用
学 习 目 标
1.认识配合物的成键特征,了解简单配合物的基本组成。
2.学会简单配合物的制备。
3.能联系配合物的组成和结构解释相关实验现象。
4.认识配合物在生产生活和科学研究方面的广泛应用。
活 动 方 案
1.学习配合物的制备,观察实验现象
【实验1】向试管中加入 2 mL 5%硫酸铜溶液,再逐滴加入浓氨水,振荡,观察并记录实验现象。
实验现象:_________________________________________
【实验2】取5%的氯化铜溶液、5%的硝酸铜溶液各 2 mL,分别逐滴加入浓氨水,观察并记录实验现象。
实验现象:_________________________________________
【答案】 两个实验均会看到类似的现象,先生成蓝色沉淀,最终沉淀溶解,形成深蓝色的溶液。
活动一:了解配合物的形成、配合物的概念
2.讨论溶液呈深蓝色的原因,写出生成物的电离方程式。
【答案】 NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
4.什么是配合物?形成配合物的条件有哪些?
【答案】 由提供孤电子对的配体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物简称配合物。形成配合物的条件有:①一个原子有孤电子对,②另一原子有接受孤电子对的空轨道。
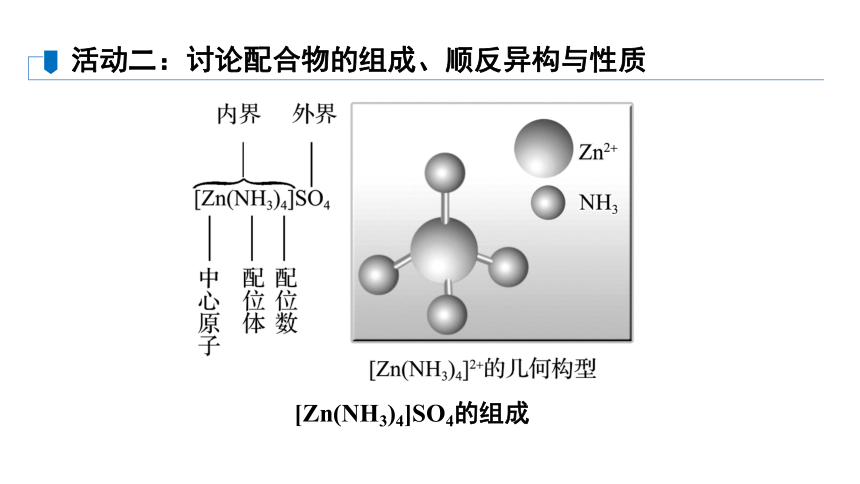
活动二:讨论配合物的组成、顺反异构与性质
[Zn(NH3)4]SO4的组成
1.结合上图[Zn(NH3)4]SO4的组成,讨论什么是配合物的内界、外界、中心原子、配位原子、配位体、配位数等?
【答案】 配离子属于内界,配离子以外的其他离子属于外界。中心原子是提供空轨道的原子,通常是过渡金属元素(离子和原子),少数是非金属元素等,如[Zn(NH3)4]2+的中心原子是Zn2+;配位体是含孤电子对的分子和离子,如: F-、Cl-、Br-、I-、OH-、 CN-、H2O、NH3、CO等,[Zn(NH3)4]2+中配位体是NH3;配位原子是配位体中具有孤电子对的原子,如:C、N、O、F、Cl、S等,[Zn(NH3)4]2+中配位原子为N原子;配位数是向中心原子提供孤电子对的原子数目,如[Zn(NH3)4]2+中配位数为4。
2.内、外界之间的作用力是什么?配合物带电吗?
【答案】 内界和外界之间以离子键结合,外界离子所带电荷总数等于配离子的电荷数,所以配合物不带电。
【答案】 不是同一种物质,它们的结构不同,内界、配离子不同,溶液的颜色也不相同。
4.阅读教材批判性思维,了解配合物的顺反异构。
Pt(NH3)2Cl2的顺式和反式异构体
结合上图,理解配合物的顺式、反式异构,结合教材给出的表格:
讨论A、B配合物哪个是顺式异构体、哪个是反式异构体。
【答案】 根据A有极性,在水中的溶解性相对较大,可得出A为顺式异构,B为非极性,在水中的溶解性小,所以B为反式异构体。
配合物 颜色 极性 在水中的溶解性(100 g水中) 抗癌活性
A 棕黄色 极性 0.257 7 g 有活性
B 淡黄色 非极性 0.036 6 g 无活性
5.阅读拓展视野,了解配合物离子的空间结构。
讨论后填写下表
直线形
四面体
平面四边形
八面体
1.在实验研究中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
(1)向AgNO3溶液中逐滴加入氨水的现象为____________________ _________,产生的配合物是_________________。形成的溶液为银氨溶液,可用于检验_________。
(2)向FeCl3溶液中滴入KSCN溶液的现象为_______________,产生的配合物是_____________________,该反应可用于___________。
活动三:了解配合物的应用
先生成沉淀,然后沉淀再溶解
[Ag(NH3)2]OH
葡萄糖
溶液变血红色
[Fe(SCN)n](3-n)+
检验Fe3+
(3)在两支试管中分别加入2 mL 0.01 mol·L-1硫酸铜和0.01 mol·L-1硫酸铁的混合溶液,向一支试管中滴加10%的氢氧化钠溶液,向另一支试管中滴加浓氨水。
其中加入氢氧化钠的试管中生成两种颜色的沉淀,溶液变为_______;而滴加浓氨水的试管中最终只有红褐色沉淀,溶液变为_________,产生的配合物是_________________,可用于离子_______。
无色
深蓝色
[Cu(NH3)4]2+
分离
2.在生产中,配合物被广泛用于染色、电镀、硬水软化、金属冶炼领域。
配位化合物在羊毛染色过程中的作用
为了使羊毛呈现不同的色彩,同时在洗涤和光照的条件下不易褪色,我们可以在染色过程中,使用金属盐(如铬、铝、铁、铜盐等)对其进行处理。因羊毛和染料中都含有可与金属离子配位的基团(—NH2、—COOH),染色时,金属离子和染料及羊毛之间发生反应,生成体积较大、溶解度小的配合物,使染料坚固地附着在纤维上,从而改变羊毛的颜色。
3.生命体中的许多金属元素都以配合物形式存在。
叶绿素的结构示意图
4.配合物在医疗方面应用也很广泛。
5.模拟生物固氮也与配合物有关。
血红素的结构示意图
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
12
【解析】配合物[Cu(NH3)4](OH)2中,Cu2+为中心离子,NH3为配体,配位数为4,A正确。
1.配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物[Cu(NH3)4](OH)2的中心离子、配体和配位数分别为 ( )
A.Cu2+、NH3、4 B.Cu+、NH3、4
C.Cu2+、OH-、2 D.Cu2+、NH3、2
A
【解析】配位化合物中除含有配位键外,还可能含有离子键等,B错误。
1
2
3
4
5
6
7
8
9
10
11
12
2.(2020·凌源二中网测)下列关于配位化合物的叙述中,不正确的是 ( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医药科学、催化反应和材料化学等领域都有广泛的应用
B
【解析】向FeCl2溶液中滴入氯水,发生反应:2FeCl2+Cl2══2FeCl3,与配合物无关,故选C。
1
2
3
4
5
6
7
8
9
10
11
12
3.下列过程与配合物无关的是 ( )
A.向FeCl3溶液中滴加KSCN溶液出现血红色
B.用Na2S2O3溶液溶解照相底片上没有感光的 AgBr
C.向FeCl2溶液中滴加氯水,溶液颜色加深
D.向AlCl3溶液中逐滴加入 NaOH 溶液,先出现白色沉淀,继而沉淀消失
C
1
2
3
4
5
6
7
8
9
10
11
12
4. (2021·南京二十九中阶段测试)下列说法正确的是 ( )
A.将过量的氨水加入CuSO4溶液中,最终得到蓝色沉淀
B.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则
C.由于氢键的作用,H2O的稳定性强于H2S
D.H—Cl 的键能为 431.8 kJ·mol-1,H—I 的键能为298.7 kJ·mol-1,这可以说明 HCl 分子比 HI 分子稳定
D
【解析】将过量的氨水加入CuSO4溶液中,先得到蓝色沉淀,氨水过量,观察到沉淀溶解,溶液变为深蓝色,生成[Cu(NH3)4]2+,A错误;p轨道有3个,每个轨道最多容纳2个自旋方向相反的电子,故违反了泡利不相容原理,B错误; 由于分子内共价键牢固,H2O的稳定性强于H2S,C错误; H—Cl的键能大于H—I的键能,这可以说明HCl分子比HI分子稳定,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
5.下列关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的说法中,正确的是 ( )
A.配位体是Cl-和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目之比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
C
【解析】配合物[TiCl(H2O)5]Cl2·H2O中,配位体是Cl-和H2O,配位数是6,A错误;中心离子是Ti3+,配离子是Cl-,B错误;配合物[TiCl(H2O)5]Cl2·H2O,配离子是Cl-为1,外界离子是Cl-为2,内界和外界中的Cl-的数目之比是1∶2,C正确;加入足量AgNO3溶液,外界离子Cl-与Ag+反应,配位离子Cl-不与Ag+反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
6.(2022·高邮高三学情调研)反应:NH4Cl+NaNO2══NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列说法正确的是 ( )
A.Na+和Cl-的核外电子层结构相同
B.NH4Cl中含有配位键
C.NaCl的电子式为
D.H2O是非极性分子
B
1
2
3
4
5
6
7
8
9
10
11
12
【解析】Ag+有空轨道,NH3中的氮原子上有孤电子对,可以形成配位键,A错误;BF3中B原子有空轨道,NH3中的氮原子上有孤电子对,可以形成配位键,B错误;Co3+有空轨道,CO中的氧原子上有孤电子对,可以形成配位键,C错误;Ag+、H+两种离子都没有孤电子对,所以不能形成配位键,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
7.下列不能形成配位键的组合是 ( )
A.Ag+、NH3 B.BF3、NH3
C.Co3+、CO D.Ag+、H+
D
1
2
3
4
5
6
7
8
9
10
11
12
8.如图所示是卟啉配合物叶绿素的部分结构示意图,下列有关叙述正确的是 ( )
A.该叶绿素只含有H、Mg、C元素
B.该叶绿素是配合物,中心离子是镁离子
C.该叶绿素是配合物,其配位体是N元素
D.该叶绿素不是配合物,而是高分子化合物
B
【解析】该化合物还含有O元素和N元素,A错误;Mg的最高化合价为+2价,而化合物中Mg与4个N原子作用,由此可以判断该化合物中Mg与N原子间形成配位键,该物质为配合物,B正确,D错误;该化合物中配位原子为N原子,不能称N原子为配位体,同样也不能称N元素为配位体,因为配位体一般为离子或分子,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
【解析】K2[Co(SCN)4]中Co2+的配位数是4,A不符合题意;Fe(SCN)3中Fe3+的配位数是3,B不符合题意;Na3[AlF6]中Al3+的配位数是6,C符合题意;[Cu(NH3)4]Cl2中Cu2+的配位数是4,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
9.下列配合物的配位数是6的是 ( )
A.K2[Co(SCN)4] B.Fe(SCN)3
C.Na3[AlF6] D.[Cu(NH3)4]Cl2
C
10. (2022·姜堰中学、如东中学、前黄中学三校高三联考)[Cu(OH)(NH3)]+是汽车尾气脱硝的催化剂,其催化机理如图所示,下列说法错误的是 ( )
A.[Cu(OH)(NH3)]+中O和
N原子是配位原子
B.该催化循环中Cu的成键
数目发生了变化
C.反应过程中存在非极性
键的断裂和形成
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1) [Ni(NH3)6]SO4中阴离子的立体构型是___________。
正四面体
【解析】NH3中氮原子存在一对孤电子对,作为电子对供给者,Ni2+存在空轨道,因而[Ni(NH3)6]2+中Ni2+与NH3之间形成配位键,提供孤电子对的成键原子是N。
1
2
3
4
5
6
7
8
9
10
11
12
(2) 在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是____。
配位键
N
1
2
3
4
5
6
7
8
9
10
11
12
(3) 氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是____________________。氨是_______(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为______。
高于
NH3分子间存在氢键
极性
sp3
1
2
3
4
5
6
7
8
9
10
11
12
12.(2020·四川新津中学月考改编)铜单质及其化合物在很多领域有重要的用途。
Ⅰ.金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
(1) 超细铜粉的某制备方法如下:
[Cu(NH3)4]SO4中的配体是______。
NH3
1
2
3
4
5
6
7
8
9
10
11
12
(2) 氯化亚铜(CuCl)的制备过程:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀,反应的离子方程式为_______________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
Ⅱ.波尔多液是一种杀菌剂,广泛应用于树木和花卉上,蓝色的胆矾是配制波尔多液的主要原料。
(1) 与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有________(填元素符号)。
K、Cr
1
2
3
4
5
6
7
8
9
10
11
12
(2) 往CuSO4浓溶液中加入过量较浓的NH3·H2O,直到生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层。经过一段时间后可观察到在两层“交界处”下部析出深蓝色晶体,该晶体为[Cu(NH3)4]SO4·H2O。实验中所加C2H5OH的作用是_____________________________________。
(3) [Cu(NH3)4]SO4·H2O晶体中呈正四面体的粒子是_______,杂化轨道类型是sp3的原子是__________。
减小“溶剂”的极性,降低溶质溶解度
N、S、O
谢谢观看
Thank you for watching
专题4
分子空间结构与物质性质
第二单元 配合物的形成和应用
学 习 目 标
1.认识配合物的成键特征,了解简单配合物的基本组成。
2.学会简单配合物的制备。
3.能联系配合物的组成和结构解释相关实验现象。
4.认识配合物在生产生活和科学研究方面的广泛应用。
活 动 方 案
1.学习配合物的制备,观察实验现象
【实验1】向试管中加入 2 mL 5%硫酸铜溶液,再逐滴加入浓氨水,振荡,观察并记录实验现象。
实验现象:_________________________________________
【实验2】取5%的氯化铜溶液、5%的硝酸铜溶液各 2 mL,分别逐滴加入浓氨水,观察并记录实验现象。
实验现象:_________________________________________
【答案】 两个实验均会看到类似的现象,先生成蓝色沉淀,最终沉淀溶解,形成深蓝色的溶液。
活动一:了解配合物的形成、配合物的概念
2.讨论溶液呈深蓝色的原因,写出生成物的电离方程式。
【答案】 NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
4.什么是配合物?形成配合物的条件有哪些?
【答案】 由提供孤电子对的配体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物简称配合物。形成配合物的条件有:①一个原子有孤电子对,②另一原子有接受孤电子对的空轨道。
活动二:讨论配合物的组成、顺反异构与性质
[Zn(NH3)4]SO4的组成
1.结合上图[Zn(NH3)4]SO4的组成,讨论什么是配合物的内界、外界、中心原子、配位原子、配位体、配位数等?
【答案】 配离子属于内界,配离子以外的其他离子属于外界。中心原子是提供空轨道的原子,通常是过渡金属元素(离子和原子),少数是非金属元素等,如[Zn(NH3)4]2+的中心原子是Zn2+;配位体是含孤电子对的分子和离子,如: F-、Cl-、Br-、I-、OH-、 CN-、H2O、NH3、CO等,[Zn(NH3)4]2+中配位体是NH3;配位原子是配位体中具有孤电子对的原子,如:C、N、O、F、Cl、S等,[Zn(NH3)4]2+中配位原子为N原子;配位数是向中心原子提供孤电子对的原子数目,如[Zn(NH3)4]2+中配位数为4。
2.内、外界之间的作用力是什么?配合物带电吗?
【答案】 内界和外界之间以离子键结合,外界离子所带电荷总数等于配离子的电荷数,所以配合物不带电。
【答案】 不是同一种物质,它们的结构不同,内界、配离子不同,溶液的颜色也不相同。
4.阅读教材批判性思维,了解配合物的顺反异构。
Pt(NH3)2Cl2的顺式和反式异构体
结合上图,理解配合物的顺式、反式异构,结合教材给出的表格:
讨论A、B配合物哪个是顺式异构体、哪个是反式异构体。
【答案】 根据A有极性,在水中的溶解性相对较大,可得出A为顺式异构,B为非极性,在水中的溶解性小,所以B为反式异构体。
配合物 颜色 极性 在水中的溶解性(100 g水中) 抗癌活性
A 棕黄色 极性 0.257 7 g 有活性
B 淡黄色 非极性 0.036 6 g 无活性
5.阅读拓展视野,了解配合物离子的空间结构。
讨论后填写下表
直线形
四面体
平面四边形
八面体
1.在实验研究中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
(1)向AgNO3溶液中逐滴加入氨水的现象为____________________ _________,产生的配合物是_________________。形成的溶液为银氨溶液,可用于检验_________。
(2)向FeCl3溶液中滴入KSCN溶液的现象为_______________,产生的配合物是_____________________,该反应可用于___________。
活动三:了解配合物的应用
先生成沉淀,然后沉淀再溶解
[Ag(NH3)2]OH
葡萄糖
溶液变血红色
[Fe(SCN)n](3-n)+
检验Fe3+
(3)在两支试管中分别加入2 mL 0.01 mol·L-1硫酸铜和0.01 mol·L-1硫酸铁的混合溶液,向一支试管中滴加10%的氢氧化钠溶液,向另一支试管中滴加浓氨水。
其中加入氢氧化钠的试管中生成两种颜色的沉淀,溶液变为_______;而滴加浓氨水的试管中最终只有红褐色沉淀,溶液变为_________,产生的配合物是_________________,可用于离子_______。
无色
深蓝色
[Cu(NH3)4]2+
分离
2.在生产中,配合物被广泛用于染色、电镀、硬水软化、金属冶炼领域。
配位化合物在羊毛染色过程中的作用
为了使羊毛呈现不同的色彩,同时在洗涤和光照的条件下不易褪色,我们可以在染色过程中,使用金属盐(如铬、铝、铁、铜盐等)对其进行处理。因羊毛和染料中都含有可与金属离子配位的基团(—NH2、—COOH),染色时,金属离子和染料及羊毛之间发生反应,生成体积较大、溶解度小的配合物,使染料坚固地附着在纤维上,从而改变羊毛的颜色。
3.生命体中的许多金属元素都以配合物形式存在。
叶绿素的结构示意图
4.配合物在医疗方面应用也很广泛。
5.模拟生物固氮也与配合物有关。
血红素的结构示意图
课 堂 反 馈
1
2
3
4
5
6
7
8
9
10
11
12
【解析】配合物[Cu(NH3)4](OH)2中,Cu2+为中心离子,NH3为配体,配位数为4,A正确。
1.配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物[Cu(NH3)4](OH)2的中心离子、配体和配位数分别为 ( )
A.Cu2+、NH3、4 B.Cu+、NH3、4
C.Cu2+、OH-、2 D.Cu2+、NH3、2
A
【解析】配位化合物中除含有配位键外,还可能含有离子键等,B错误。
1
2
3
4
5
6
7
8
9
10
11
12
2.(2020·凌源二中网测)下列关于配位化合物的叙述中,不正确的是 ( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医药科学、催化反应和材料化学等领域都有广泛的应用
B
【解析】向FeCl2溶液中滴入氯水,发生反应:2FeCl2+Cl2══2FeCl3,与配合物无关,故选C。
1
2
3
4
5
6
7
8
9
10
11
12
3.下列过程与配合物无关的是 ( )
A.向FeCl3溶液中滴加KSCN溶液出现血红色
B.用Na2S2O3溶液溶解照相底片上没有感光的 AgBr
C.向FeCl2溶液中滴加氯水,溶液颜色加深
D.向AlCl3溶液中逐滴加入 NaOH 溶液,先出现白色沉淀,继而沉淀消失
C
1
2
3
4
5
6
7
8
9
10
11
12
4. (2021·南京二十九中阶段测试)下列说法正确的是 ( )
A.将过量的氨水加入CuSO4溶液中,最终得到蓝色沉淀
B.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则
C.由于氢键的作用,H2O的稳定性强于H2S
D.H—Cl 的键能为 431.8 kJ·mol-1,H—I 的键能为298.7 kJ·mol-1,这可以说明 HCl 分子比 HI 分子稳定
D
【解析】将过量的氨水加入CuSO4溶液中,先得到蓝色沉淀,氨水过量,观察到沉淀溶解,溶液变为深蓝色,生成[Cu(NH3)4]2+,A错误;p轨道有3个,每个轨道最多容纳2个自旋方向相反的电子,故违反了泡利不相容原理,B错误; 由于分子内共价键牢固,H2O的稳定性强于H2S,C错误; H—Cl的键能大于H—I的键能,这可以说明HCl分子比HI分子稳定,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
5.下列关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的说法中,正确的是 ( )
A.配位体是Cl-和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目之比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
C
【解析】配合物[TiCl(H2O)5]Cl2·H2O中,配位体是Cl-和H2O,配位数是6,A错误;中心离子是Ti3+,配离子是Cl-,B错误;配合物[TiCl(H2O)5]Cl2·H2O,配离子是Cl-为1,外界离子是Cl-为2,内界和外界中的Cl-的数目之比是1∶2,C正确;加入足量AgNO3溶液,外界离子Cl-与Ag+反应,配位离子Cl-不与Ag+反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
6.(2022·高邮高三学情调研)反应:NH4Cl+NaNO2══NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列说法正确的是 ( )
A.Na+和Cl-的核外电子层结构相同
B.NH4Cl中含有配位键
C.NaCl的电子式为
D.H2O是非极性分子
B
1
2
3
4
5
6
7
8
9
10
11
12
【解析】Ag+有空轨道,NH3中的氮原子上有孤电子对,可以形成配位键,A错误;BF3中B原子有空轨道,NH3中的氮原子上有孤电子对,可以形成配位键,B错误;Co3+有空轨道,CO中的氧原子上有孤电子对,可以形成配位键,C错误;Ag+、H+两种离子都没有孤电子对,所以不能形成配位键,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
7.下列不能形成配位键的组合是 ( )
A.Ag+、NH3 B.BF3、NH3
C.Co3+、CO D.Ag+、H+
D
1
2
3
4
5
6
7
8
9
10
11
12
8.如图所示是卟啉配合物叶绿素的部分结构示意图,下列有关叙述正确的是 ( )
A.该叶绿素只含有H、Mg、C元素
B.该叶绿素是配合物,中心离子是镁离子
C.该叶绿素是配合物,其配位体是N元素
D.该叶绿素不是配合物,而是高分子化合物
B
【解析】该化合物还含有O元素和N元素,A错误;Mg的最高化合价为+2价,而化合物中Mg与4个N原子作用,由此可以判断该化合物中Mg与N原子间形成配位键,该物质为配合物,B正确,D错误;该化合物中配位原子为N原子,不能称N原子为配位体,同样也不能称N元素为配位体,因为配位体一般为离子或分子,C错误。
1
2
3
4
5
6
7
8
9
10
11
12
【解析】K2[Co(SCN)4]中Co2+的配位数是4,A不符合题意;Fe(SCN)3中Fe3+的配位数是3,B不符合题意;Na3[AlF6]中Al3+的配位数是6,C符合题意;[Cu(NH3)4]Cl2中Cu2+的配位数是4,D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
9.下列配合物的配位数是6的是 ( )
A.K2[Co(SCN)4] B.Fe(SCN)3
C.Na3[AlF6] D.[Cu(NH3)4]Cl2
C
10. (2022·姜堰中学、如东中学、前黄中学三校高三联考)[Cu(OH)(NH3)]+是汽车尾气脱硝的催化剂,其催化机理如图所示,下列说法错误的是 ( )
A.[Cu(OH)(NH3)]+中O和
N原子是配位原子
B.该催化循环中Cu的成键
数目发生了变化
C.反应过程中存在非极性
键的断裂和形成
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
(1) [Ni(NH3)6]SO4中阴离子的立体构型是___________。
正四面体
【解析】NH3中氮原子存在一对孤电子对,作为电子对供给者,Ni2+存在空轨道,因而[Ni(NH3)6]2+中Ni2+与NH3之间形成配位键,提供孤电子对的成键原子是N。
1
2
3
4
5
6
7
8
9
10
11
12
(2) 在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是____。
配位键
N
1
2
3
4
5
6
7
8
9
10
11
12
(3) 氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是____________________。氨是_______(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为______。
高于
NH3分子间存在氢键
极性
sp3
1
2
3
4
5
6
7
8
9
10
11
12
12.(2020·四川新津中学月考改编)铜单质及其化合物在很多领域有重要的用途。
Ⅰ.金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
(1) 超细铜粉的某制备方法如下:
[Cu(NH3)4]SO4中的配体是______。
NH3
1
2
3
4
5
6
7
8
9
10
11
12
(2) 氯化亚铜(CuCl)的制备过程:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀,反应的离子方程式为_______________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
Ⅱ.波尔多液是一种杀菌剂,广泛应用于树木和花卉上,蓝色的胆矾是配制波尔多液的主要原料。
(1) 与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有________(填元素符号)。
K、Cr
1
2
3
4
5
6
7
8
9
10
11
12
(2) 往CuSO4浓溶液中加入过量较浓的NH3·H2O,直到生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层。经过一段时间后可观察到在两层“交界处”下部析出深蓝色晶体,该晶体为[Cu(NH3)4]SO4·H2O。实验中所加C2H5OH的作用是_____________________________________。
(3) [Cu(NH3)4]SO4·H2O晶体中呈正四面体的粒子是_______,杂化轨道类型是sp3的原子是__________。
减小“溶剂”的极性,降低溶质溶解度
N、S、O
谢谢观看
Thank you for watching
同课章节目录
