3.1.3氯气性质及应用 课件(共41张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1.3氯气性质及应用 课件(共41张PPT) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 09:34:32 | ||
图片预览









文档简介
(共41张PPT)
EN
众
3.1.3氯气的性质及应用
【新课程目标)
掌握氯气及其重要化合物以及氯水的主要性质和应用
氯的存在与氯气的发现
课本P58
0
1.发现:海水中含有大量氯元素,它主要以氯化钠、
氯化镁等
氯化物的形式存在,其单质氯气的化学性质非常活泼,在自然界
20
中不存在游离态的氯,只存在化合态的氯。
15
10
2.存在:1774年,瑞典化学家舍勒把浓盐酸与软锰矿(主要成分
0221出
KCI
是MnO,)混合在一起加热。意外地发现了氯气。
化学方程式为:MnO,+4HCI(浓)MnCL,+Cl,个+2H,O
图3-1
每千克海水中几
种氯化物的含量
命名:1810年,英国化学家戴维将其命名为氯气。
2.原子结构示意图:
+9
CI
+17
8
结构
决定性质定用途
氯气是一种化学性质活泼的非金属单质,具有强氧化性,能与钠、铁、铜等
金属发生反应,生成相应的氯化物,还能与氢气、磷、硫等非金属发生反应。
知识点二氯气的物理性质
颜色
密度
气味
毒性
状态
溶解性
特性
黄绿色
比空
刺激性
有毒
气体
1体积水约能溶
易液化
气大
气味
解2体积氯气
加压的条件下,氯气转化为液态(称为液氯),可储存于钢瓶中,便于运输和使用。
思考:如何闻C,的气味?氯气泄漏时,人们应该如何转移?
用手在瓶口轻轻扇动,使少量气体飘入鼻孔。
因为C,密度大于空气,所以C,在低洼处浓度较大,人们应往高处转移。
闻气体时的正确操作
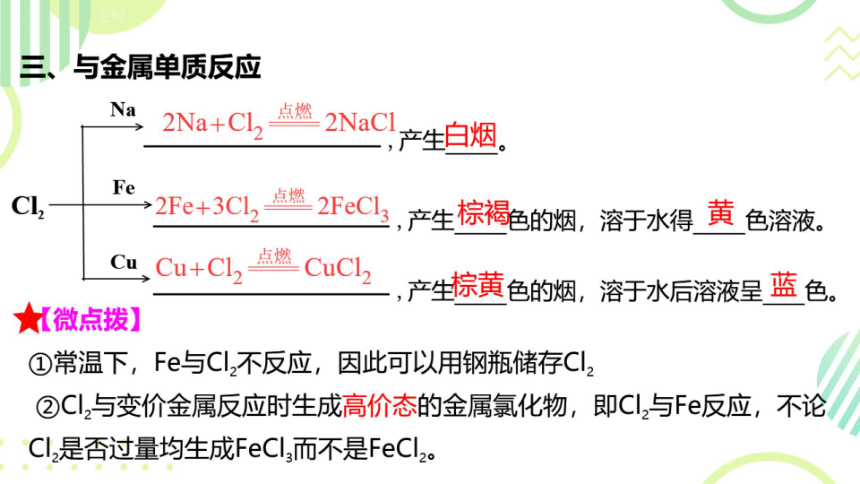
三、与金属单质反应
Na
2Na+Cl,
点燃
2NaCl产生白烟。
Fe
C
→2Fe+3Cl
点燃
2FeCl
,产生棕褐色的烟,溶于水得黄色溶液。
Cu
Cu+Cl2-
点燃
CuCL,,产生棕黄色的烟,溶于水后溶液呈蓝色。
☆《微点拨】
①常温下,Fe与Cl2不反应,因此可以用钢瓶储存Cl2
②Cl,与变价金属反应时生成高价态的金属氯化物,即Cl,与Fe反应,不论
Cl,是否过量均生成FeCl3而不是FeCl2。
四、与非金属反应
1.与氢气反应
操作
H,在C,中燃烧
H,和Cl,的混合气体光照
现象
H2在盛有C2的集气瓶中安静地燃
发生爆炸
烧,发出苍白色火焰,集气瓶口
有白雾产生
反应方程式
H+C1)
点燃或光照
2HCI
应用
工业上制盐酸
【微点拨】燃烧是指发热发光的剧烈的化学反应。它强调的是①发光时也要发
热;②反应剧烈;③实质是剧烈的氧化还原反应;④不一定要有氧气参加。
EN
众
3.1.3氯气的性质及应用
【新课程目标)
掌握氯气及其重要化合物以及氯水的主要性质和应用
氯的存在与氯气的发现
课本P58
0
1.发现:海水中含有大量氯元素,它主要以氯化钠、
氯化镁等
氯化物的形式存在,其单质氯气的化学性质非常活泼,在自然界
20
中不存在游离态的氯,只存在化合态的氯。
15
10
2.存在:1774年,瑞典化学家舍勒把浓盐酸与软锰矿(主要成分
0221出
KCI
是MnO,)混合在一起加热。意外地发现了氯气。
化学方程式为:MnO,+4HCI(浓)MnCL,+Cl,个+2H,O
图3-1
每千克海水中几
种氯化物的含量
命名:1810年,英国化学家戴维将其命名为氯气。
2.原子结构示意图:
+9
CI
+17
8
结构
决定性质定用途
氯气是一种化学性质活泼的非金属单质,具有强氧化性,能与钠、铁、铜等
金属发生反应,生成相应的氯化物,还能与氢气、磷、硫等非金属发生反应。
知识点二氯气的物理性质
颜色
密度
气味
毒性
状态
溶解性
特性
黄绿色
比空
刺激性
有毒
气体
1体积水约能溶
易液化
气大
气味
解2体积氯气
加压的条件下,氯气转化为液态(称为液氯),可储存于钢瓶中,便于运输和使用。
思考:如何闻C,的气味?氯气泄漏时,人们应该如何转移?
用手在瓶口轻轻扇动,使少量气体飘入鼻孔。
因为C,密度大于空气,所以C,在低洼处浓度较大,人们应往高处转移。
闻气体时的正确操作
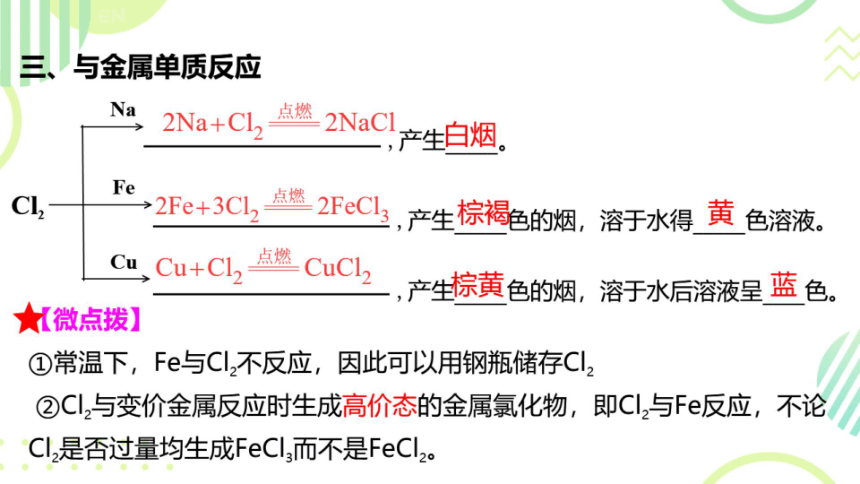
三、与金属单质反应
Na
2Na+Cl,
点燃
2NaCl产生白烟。
Fe
C
→2Fe+3Cl
点燃
2FeCl
,产生棕褐色的烟,溶于水得黄色溶液。
Cu
Cu+Cl2-
点燃
CuCL,,产生棕黄色的烟,溶于水后溶液呈蓝色。
☆《微点拨】
①常温下,Fe与Cl2不反应,因此可以用钢瓶储存Cl2
②Cl,与变价金属反应时生成高价态的金属氯化物,即Cl,与Fe反应,不论
Cl,是否过量均生成FeCl3而不是FeCl2。
四、与非金属反应
1.与氢气反应
操作
H,在C,中燃烧
H,和Cl,的混合气体光照
现象
H2在盛有C2的集气瓶中安静地燃
发生爆炸
烧,发出苍白色火焰,集气瓶口
有白雾产生
反应方程式
H+C1)
点燃或光照
2HCI
应用
工业上制盐酸
【微点拨】燃烧是指发热发光的剧烈的化学反应。它强调的是①发光时也要发
热;②反应剧烈;③实质是剧烈的氧化还原反应;④不一定要有氧气参加。
