(2017-2021)五年高考化学真题分层汇编-01认识化学科学基础题(天津专用)(含答案)
文档属性
| 名称 | (2017-2021)五年高考化学真题分层汇编-01认识化学科学基础题(天津专用)(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 325.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 00:00:00 | ||
图片预览



文档简介
(2017-2021)五年高考化学真题分层汇编-01认识化学科学基础题(天津专用)
一、单选题(共10题)
1.(2021·天津·统考高考真题)近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是
A.北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素
B.奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料
C.长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应
D.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料
2.(2021·天津·统考高考真题)关于反应所涉及的物质,下列说法错误的是
A.H2SO4在该反应中为氧化剂 B.Na2SO3容易被空气中的O2氧化变质
C.Na2SO4是含有共价键的离子化合物 D.SO2是导致酸雨的主要有害污染物
3.(2021·天津·统考高考真题)下列化学用语表达正确的是
A.F-的离子结构示意图:
B.基态碳原子的轨道表示式:
C.丙炔的键线式:
D.H2O分子的球棍模型:
4.(2021·天津·统考高考真题)设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol/LHCl溶液中,HCl分子的数目为NA
B.22.4L氢气中,H2分子的数目为NA
C.180g葡萄糖中,C原子的数目为6NA
D.1molN2中,σ键的数目为3NA
5.(2021·天津·统考高考真题)常温下,下列各组离子在给定溶液中能大量共存的是
A.pH=1的溶液:Fe2+、Mg2+、、
B.pH=12的溶液:K+、Na+、、
C.pH=7的溶液:Na+、Cu2+、S2-、Cl-
D.pH=7的溶液:Al3+、K+、Cl-、
6.(2020·天津·高考真题)下列离子方程式书写正确的是
A.CaCO3与稀硝酸反应:
B.FeSO4溶液与溴水反应:
C.NaOH溶液与过量H2C2O4溶液反应:
D.C6H5ONa溶液中通入少量CO2:
7.(2020·天津·高考真题)熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(x=5~3,难溶于熔融硫),下列说法错误的是
A.Na2S4的电子式为
B.放电时正极反应为
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以为隔膜的二次电池
8.(2019·天津·高考真题)化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
9.(2019·天津·高考真题)下列离子方程式能用来解释相应实验现象的是
实验现象 离子方程式
A 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B 向沸水中滴加饱和氯化铁溶液得到红褐色液体
C 二氧化硫使酸性高锰酸钾溶液褪色
D 氧化亚铁溶于稀硝酸
A.A B.B C.C D.D
10.(2017·天津·高考真题)下列能量转化过程与氧化还原反应无关的是
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
二、实验题(共1题)
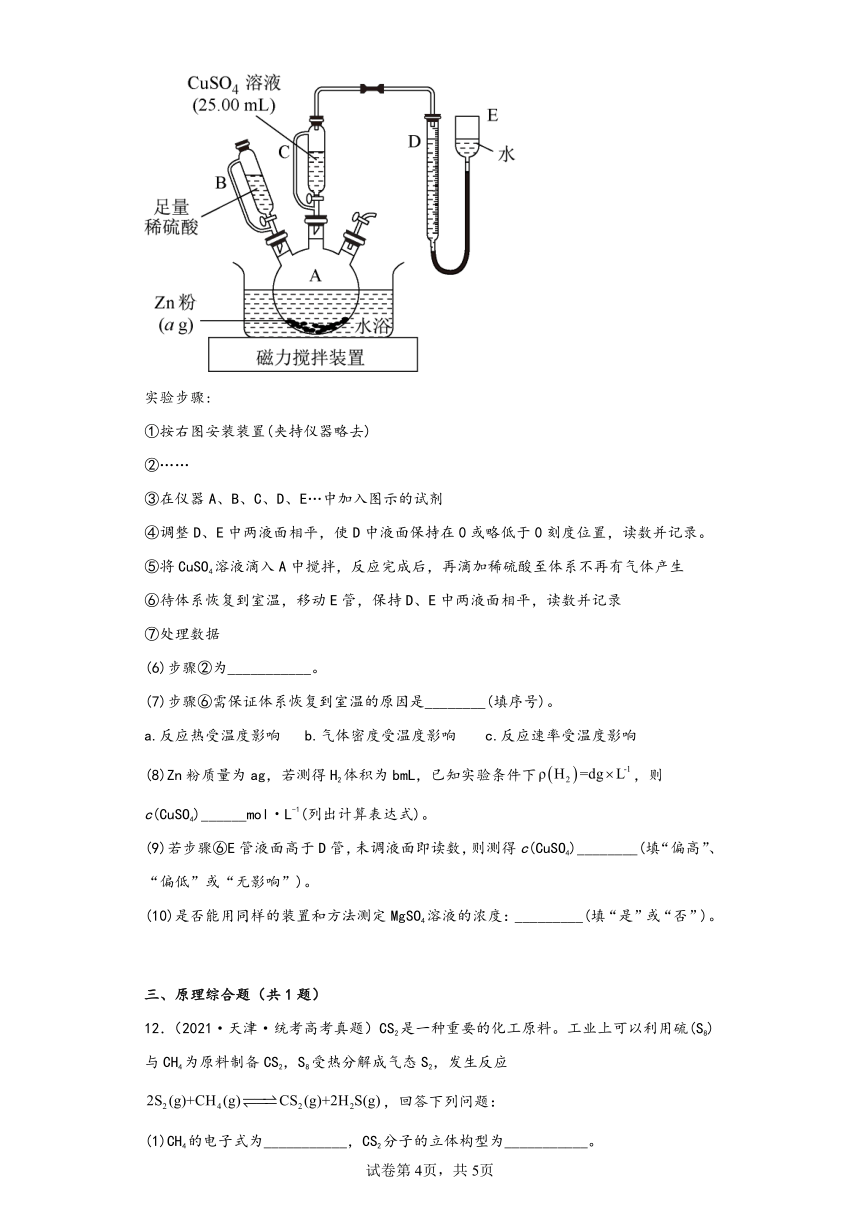
11.(2020·天津·高考真题)为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:
实验步骤:
(1)判断沉淀完全的操作为____________。
(2)步骤②判断沉淀是否洗净所选用的试剂为_____________。
(3)步骤③灼烧时盛装样品的仪器名称为__________。
(4)固体质量为wg,则c(CuSO4)=________mol L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_________(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:,
实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为___________。
(7)步骤⑥需保证体系恢复到室温的原因是________(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下,则c(CuSO4)______mol L-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)________(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________(填“是”或“否”)。
三、原理综合题(共1题)
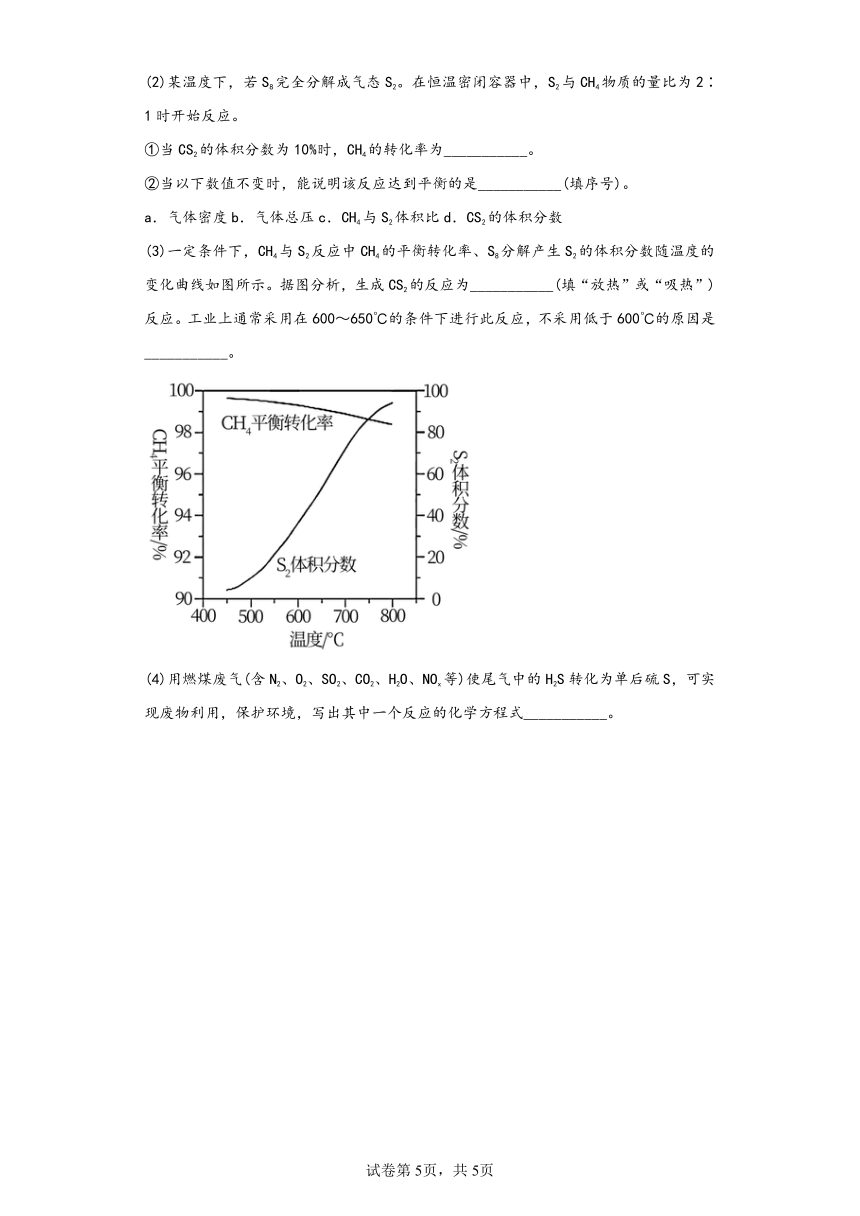
12.(2021·天津·统考高考真题)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应,回答下列问题:
(1)CH4的电子式为___________,CS2分子的立体构型为___________。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________。
②当以下数值不变时,能说明该反应达到平衡的是___________(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________。
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.铷位于周期表第六周期第ⅠA族,属于碱金属,属于铷(Rb)是金属元素,故A正确;
B.钛合金为合金,属于金属材料,故B错误;
C.火箭动力源于火箭燃料的燃烧,属于氧化还原反应,故C正确;
D.芳纶属于合成纤维,是高分子材料,故D正确;
故选B。
2.A
【详解】A.中无化合价的变化,不属于氧化还原反应,所以该反应中无氧化剂,故A错误;
B.Na2SO3不稳定,容易被空气中的O2氧化成硫酸钠变质,故B正确;
C.Na2SO4含有阴阳离子,存在离子键,硫酸根中含有共价键,故C正确;
D.SO2在空去中会转化成硫酸,形成酸雨,所以二氧化硫是导致酸雨的主要有害污染物,故D正确;
故选A。
3.D
【详解】A.F-最外层有8个电子,离子结构示意图:,故A错误;
B.基态碳原子的轨道表示式:,故B错误;
C.丙炔的三个碳原子在一条线上,故C错误;
D.H2O分子的空间构型为V型,所以球棍模型为:,故D正确;
故选D。
4.C
【详解】A.体积未知,HCl分子的数目不能计算,故A错误;
B.没有标准状态,不能计算H2分子的数目,故B错误;
C.葡萄糖的分子式为C6H12O6,故180g葡萄糖的分子的物质的量为1mol,C原子的数目为6NA,故C正确;
D.1molN2中有1molσ键,故σ键的数目为NA,故D错误;
故选C。
5.B
【详解】A.pH=1的溶液中,在酸性条件下与Fe2+会发生氧化还原反应,不能大量共存,故A错误;
B.pH=12的溶液中,K+、Na+、、均不能发生反应,能大量共存,故B正确;
C.pH=7的溶液中,Cu2+、S2-会发生反应生成沉淀,不能大量共存,故C错误;
D.pH=7的溶液中,Al3+、会发生双水解,不能大量共存,故D错误;
故选B。
6.B
【详解】A.CaCO3与稀硝酸反应生成硝酸钙和水和二氧化碳,碳酸钙是固体难溶物,写离子方程式时不能拆成离子形式,正确的离子方程式为:,故A错误;
B.FeSO4溶液与溴水反应时,溴单质氧化了亚铁离子,将亚铁离子氧化成铁离子,正确的离子方程式为:,故B正确;
C.氢氧化钠与过量的草酸反应,说明氢氧化钠的量不足,生成草酸氢钠,正确的离子方程式为,故C错误;
D.苯酚钠中通入少量或过量二氧化碳都生成苯酚和碳酸氢钠,苯酚的酸性弱于碳酸强于碳酸氢根,故正确的离子方程式为:,故D错误;
答案选B。
7.C
【分析】根据电池反应:可知,放电时,钠作负极,发生氧化反应,电极反应为:Na-e-= Na+,硫作正极,发生还原反应,电极反应为,据此分析。
【详解】A.Na2S4属于离子化合物,4个硫原子间形成三对共用电子对,电子式为,故A正确;
B.放电时发生的是原电池反应,正极发生还原反应,电极反应为:,故B正确;
C.放电时,Na为电池的负极,正极为硫单质,故C错误;
D.放电时,该电池是以钠作负极,硫作正极的原电池,充电时,是电解池,为隔膜,起到电解质溶液的作用,该电池为二次电池,故D正确;
答案选C。
8.D
【解析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断.
【详解】A、秸杆主要成分为纤维素,利用废弃的秸秆生产生物质燃料乙醇,有新物质生成,属于化学变化,故A涉及化学反应;
B、利用石油生产塑料、化纤等高分子材料,产生新物质,属于化学变化,故B涉及化学反应;
C、利用基本化学原料生产化学合成药,产生新物质,属于化学变化,故C涉及化学反应;
D、海水中的水淡化成淡水,没有产生新物质,属于物理变化,故D不涉及化学反应;
故选D。
【点睛】本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.
9.A
【解析】A、氢氧化镁碱性强于氨水;
B、制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀;
C、电荷不守恒;
D、硝酸具有强氧化性,将亚铁氧化成铁离子;
【详解】A、氢氧化镁碱性强于氨水,故A能用来解释相应实验现象;
B、制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,故B不能用来解释相应实验现象;
C、电荷不守恒,正确的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,故C不能用来解释相应实验现象;
D、硝酸具有强氧化性,其可将亚铁氧化成铁离子,正确的离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故D不能用来解释相应实验现象;
故选A。
【点睛】本题考查离子反应方程式书写,解题关键:结合原理正确书写离子方程式,难点C:氧化还原反应的离子方程式的书写,配平前不能将H+写在反应物中,应先配电子转移守恒,再通过电荷守恒将H+补在生成物中。
10.A
【详解】A、硅太阳能电池工作时,光能转化成电能,不是氧化还原反应,A正确;
B、锂离子电池放电时,化学能转化成电能,锂失去电子,发生氧化反应,B错误;
C、电解质溶液导电时,电能转化成化学能,发生的是电解,属于氧化还原反应,C错误;
D、葡萄糖为人类生命活动提供能量时,化学能转化成热能,反应中葡萄糖被氧化,属于氧化还原反应,D错误;
答案选A。
11. 向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全 AgNO3溶液 坩埚 偏低 检查装置气密性 b 偏高 否
【分析】甲方案是利用溶液中的硫酸铜与氯化钡反应生成硫酸钡沉淀,经灼烧、洗涤、称重后得到的固体是硫酸钡,利用硫酸根守恒,计算出硫酸铜的物质的量,从而计算出浓度;乙方案是利用锌与稀硫酸反应释放出氢气的体积,换算成质量,计算出与稀硫酸反应的锌的物质的量,再利用锌的总的物质的量减去与酸反应的锌的物质的量,得到与硫酸铜反应的锌的物质的量,根据锌和硫酸铜的物质的量关系,计算出硫酸铜的物质的量,根据得到硫酸铜的浓度,据此分析。
【详解】Ⅰ.(1)硫酸根离子的检验是滴加氯化钡溶液,若产生白色沉淀,证明溶液中含有硫酸根离子,故判断沉淀完全的操作向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全;
(2)步骤②判断沉淀是否洗净所选用的试剂为AgNO3溶液,硫酸钡沉淀中可能附着有氯化钡,为了证明还有没氯离子,需要加入硝酸银溶液,若产生白色沉淀,证明没有洗净;
(3)步骤③灼烧时盛装样品的仪器为坩埚;
(4)固体质量为wg,为硫酸钡的质量,硫酸钡的物质的量为n=,根据硫酸根守恒可知,CuSO4~BaSO4,则c(CuSO4)===mol L-1;
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,会使固体的质量偏小,物质的量偏小,根据可知,则测得c(CuSO4)偏低;
Ⅱ.(6)加入药品之前需检查装置的气密性;步骤②为检查装置气密性;
(7)气体的体积受温度和压强的影响较大,气体的质量不随温度和压强的变化而改变,密度也受温度和压强的影响,步骤⑥需保证体系恢复到室温的原因是气体密度受温度影响;反应热不受温度的影响,只与反应物和生成物自身的能量有关,不随温度压强而改变;反应速率受温度影响,温度越高,反应速率越快,步骤⑥需保证体系恢复到室温与反应速率无关;
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下,氢气的质量=,利用氢气的质量得到氢气的物质的量n=,根据,与酸反应的锌的物质的量为,锌的总物质的量为,与硫酸铜反应的锌的物质的量为,根据,则c(CuSO4)=;
(9)若步骤⑥E管液面高于D管,未调液面即读数,得到氢气的体积偏小,与硫酸反应的锌的质量偏小,与硫酸铜反应的锌的质量偏大,则测得c(CuSO4)偏高;
(10) 不能用同样的装置和方法测定MgSO4溶液的浓度,硫酸镁不和锌发生置换反应。
【点睛】本题甲方案计算时,需要根据硫酸根守恒,是易错点。
12.(1) 直线形
(2) 30% d
(3) 放热 600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢
(4)、、写出任意一个
【分析】(1)
CH4的电子式为:;CS2和二氧化碳是等电子体故其立体构型为:直线型;
(2)
①在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应,
CS2的体积分数为10%,即,解得x=0.3a,则CH4的转化率为30%。
②a.恒容容器,质量不变,故密度一直不变,故密度不变不一定平衡,不选;b.反应前后气体的物质的量不变,故压强也一直不变,故压强不变一定平衡,不选;c.CH4与S2体积比一直为1:2,故不一定平衡,不选;d.CS2的体积分数说明反应已经达到了平衡,选;故选d。
(3)
由图可知,随温度升高,甲烷的转化率降低,故反应为放热反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢。
(4)
用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S)发生的化学反应方程式为、、写出任意一个。
答案第1页,共2页
答案第1页,共2页
一、单选题(共10题)
1.(2021·天津·统考高考真题)近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是
A.北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素
B.奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料
C.长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应
D.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料
2.(2021·天津·统考高考真题)关于反应所涉及的物质,下列说法错误的是
A.H2SO4在该反应中为氧化剂 B.Na2SO3容易被空气中的O2氧化变质
C.Na2SO4是含有共价键的离子化合物 D.SO2是导致酸雨的主要有害污染物
3.(2021·天津·统考高考真题)下列化学用语表达正确的是
A.F-的离子结构示意图:
B.基态碳原子的轨道表示式:
C.丙炔的键线式:
D.H2O分子的球棍模型:
4.(2021·天津·统考高考真题)设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol/LHCl溶液中,HCl分子的数目为NA
B.22.4L氢气中,H2分子的数目为NA
C.180g葡萄糖中,C原子的数目为6NA
D.1molN2中,σ键的数目为3NA
5.(2021·天津·统考高考真题)常温下,下列各组离子在给定溶液中能大量共存的是
A.pH=1的溶液:Fe2+、Mg2+、、
B.pH=12的溶液:K+、Na+、、
C.pH=7的溶液:Na+、Cu2+、S2-、Cl-
D.pH=7的溶液:Al3+、K+、Cl-、
6.(2020·天津·高考真题)下列离子方程式书写正确的是
A.CaCO3与稀硝酸反应:
B.FeSO4溶液与溴水反应:
C.NaOH溶液与过量H2C2O4溶液反应:
D.C6H5ONa溶液中通入少量CO2:
7.(2020·天津·高考真题)熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(x=5~3,难溶于熔融硫),下列说法错误的是
A.Na2S4的电子式为
B.放电时正极反应为
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以为隔膜的二次电池
8.(2019·天津·高考真题)化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
9.(2019·天津·高考真题)下列离子方程式能用来解释相应实验现象的是
实验现象 离子方程式
A 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B 向沸水中滴加饱和氯化铁溶液得到红褐色液体
C 二氧化硫使酸性高锰酸钾溶液褪色
D 氧化亚铁溶于稀硝酸
A.A B.B C.C D.D
10.(2017·天津·高考真题)下列能量转化过程与氧化还原反应无关的是
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
二、实验题(共1题)
11.(2020·天津·高考真题)为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:
实验步骤:
(1)判断沉淀完全的操作为____________。
(2)步骤②判断沉淀是否洗净所选用的试剂为_____________。
(3)步骤③灼烧时盛装样品的仪器名称为__________。
(4)固体质量为wg,则c(CuSO4)=________mol L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_________(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:,
实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为___________。
(7)步骤⑥需保证体系恢复到室温的原因是________(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下,则c(CuSO4)______mol L-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)________(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________(填“是”或“否”)。
三、原理综合题(共1题)
12.(2021·天津·统考高考真题)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应,回答下列问题:
(1)CH4的电子式为___________,CS2分子的立体构型为___________。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________。
②当以下数值不变时,能说明该反应达到平衡的是___________(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________。
(4)用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.铷位于周期表第六周期第ⅠA族,属于碱金属,属于铷(Rb)是金属元素,故A正确;
B.钛合金为合金,属于金属材料,故B错误;
C.火箭动力源于火箭燃料的燃烧,属于氧化还原反应,故C正确;
D.芳纶属于合成纤维,是高分子材料,故D正确;
故选B。
2.A
【详解】A.中无化合价的变化,不属于氧化还原反应,所以该反应中无氧化剂,故A错误;
B.Na2SO3不稳定,容易被空气中的O2氧化成硫酸钠变质,故B正确;
C.Na2SO4含有阴阳离子,存在离子键,硫酸根中含有共价键,故C正确;
D.SO2在空去中会转化成硫酸,形成酸雨,所以二氧化硫是导致酸雨的主要有害污染物,故D正确;
故选A。
3.D
【详解】A.F-最外层有8个电子,离子结构示意图:,故A错误;
B.基态碳原子的轨道表示式:,故B错误;
C.丙炔的三个碳原子在一条线上,故C错误;
D.H2O分子的空间构型为V型,所以球棍模型为:,故D正确;
故选D。
4.C
【详解】A.体积未知,HCl分子的数目不能计算,故A错误;
B.没有标准状态,不能计算H2分子的数目,故B错误;
C.葡萄糖的分子式为C6H12O6,故180g葡萄糖的分子的物质的量为1mol,C原子的数目为6NA,故C正确;
D.1molN2中有1molσ键,故σ键的数目为NA,故D错误;
故选C。
5.B
【详解】A.pH=1的溶液中,在酸性条件下与Fe2+会发生氧化还原反应,不能大量共存,故A错误;
B.pH=12的溶液中,K+、Na+、、均不能发生反应,能大量共存,故B正确;
C.pH=7的溶液中,Cu2+、S2-会发生反应生成沉淀,不能大量共存,故C错误;
D.pH=7的溶液中,Al3+、会发生双水解,不能大量共存,故D错误;
故选B。
6.B
【详解】A.CaCO3与稀硝酸反应生成硝酸钙和水和二氧化碳,碳酸钙是固体难溶物,写离子方程式时不能拆成离子形式,正确的离子方程式为:,故A错误;
B.FeSO4溶液与溴水反应时,溴单质氧化了亚铁离子,将亚铁离子氧化成铁离子,正确的离子方程式为:,故B正确;
C.氢氧化钠与过量的草酸反应,说明氢氧化钠的量不足,生成草酸氢钠,正确的离子方程式为,故C错误;
D.苯酚钠中通入少量或过量二氧化碳都生成苯酚和碳酸氢钠,苯酚的酸性弱于碳酸强于碳酸氢根,故正确的离子方程式为:,故D错误;
答案选B。
7.C
【分析】根据电池反应:可知,放电时,钠作负极,发生氧化反应,电极反应为:Na-e-= Na+,硫作正极,发生还原反应,电极反应为,据此分析。
【详解】A.Na2S4属于离子化合物,4个硫原子间形成三对共用电子对,电子式为,故A正确;
B.放电时发生的是原电池反应,正极发生还原反应,电极反应为:,故B正确;
C.放电时,Na为电池的负极,正极为硫单质,故C错误;
D.放电时,该电池是以钠作负极,硫作正极的原电池,充电时,是电解池,为隔膜,起到电解质溶液的作用,该电池为二次电池,故D正确;
答案选C。
8.D
【解析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断.
【详解】A、秸杆主要成分为纤维素,利用废弃的秸秆生产生物质燃料乙醇,有新物质生成,属于化学变化,故A涉及化学反应;
B、利用石油生产塑料、化纤等高分子材料,产生新物质,属于化学变化,故B涉及化学反应;
C、利用基本化学原料生产化学合成药,产生新物质,属于化学变化,故C涉及化学反应;
D、海水中的水淡化成淡水,没有产生新物质,属于物理变化,故D不涉及化学反应;
故选D。
【点睛】本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.
9.A
【解析】A、氢氧化镁碱性强于氨水;
B、制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀;
C、电荷不守恒;
D、硝酸具有强氧化性,将亚铁氧化成铁离子;
【详解】A、氢氧化镁碱性强于氨水,故A能用来解释相应实验现象;
B、制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,故B不能用来解释相应实验现象;
C、电荷不守恒,正确的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,故C不能用来解释相应实验现象;
D、硝酸具有强氧化性,其可将亚铁氧化成铁离子,正确的离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故D不能用来解释相应实验现象;
故选A。
【点睛】本题考查离子反应方程式书写,解题关键:结合原理正确书写离子方程式,难点C:氧化还原反应的离子方程式的书写,配平前不能将H+写在反应物中,应先配电子转移守恒,再通过电荷守恒将H+补在生成物中。
10.A
【详解】A、硅太阳能电池工作时,光能转化成电能,不是氧化还原反应,A正确;
B、锂离子电池放电时,化学能转化成电能,锂失去电子,发生氧化反应,B错误;
C、电解质溶液导电时,电能转化成化学能,发生的是电解,属于氧化还原反应,C错误;
D、葡萄糖为人类生命活动提供能量时,化学能转化成热能,反应中葡萄糖被氧化,属于氧化还原反应,D错误;
答案选A。
11. 向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全 AgNO3溶液 坩埚 偏低 检查装置气密性 b 偏高 否
【分析】甲方案是利用溶液中的硫酸铜与氯化钡反应生成硫酸钡沉淀,经灼烧、洗涤、称重后得到的固体是硫酸钡,利用硫酸根守恒,计算出硫酸铜的物质的量,从而计算出浓度;乙方案是利用锌与稀硫酸反应释放出氢气的体积,换算成质量,计算出与稀硫酸反应的锌的物质的量,再利用锌的总的物质的量减去与酸反应的锌的物质的量,得到与硫酸铜反应的锌的物质的量,根据锌和硫酸铜的物质的量关系,计算出硫酸铜的物质的量,根据得到硫酸铜的浓度,据此分析。
【详解】Ⅰ.(1)硫酸根离子的检验是滴加氯化钡溶液,若产生白色沉淀,证明溶液中含有硫酸根离子,故判断沉淀完全的操作向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全;
(2)步骤②判断沉淀是否洗净所选用的试剂为AgNO3溶液,硫酸钡沉淀中可能附着有氯化钡,为了证明还有没氯离子,需要加入硝酸银溶液,若产生白色沉淀,证明没有洗净;
(3)步骤③灼烧时盛装样品的仪器为坩埚;
(4)固体质量为wg,为硫酸钡的质量,硫酸钡的物质的量为n=,根据硫酸根守恒可知,CuSO4~BaSO4,则c(CuSO4)===mol L-1;
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,会使固体的质量偏小,物质的量偏小,根据可知,则测得c(CuSO4)偏低;
Ⅱ.(6)加入药品之前需检查装置的气密性;步骤②为检查装置气密性;
(7)气体的体积受温度和压强的影响较大,气体的质量不随温度和压强的变化而改变,密度也受温度和压强的影响,步骤⑥需保证体系恢复到室温的原因是气体密度受温度影响;反应热不受温度的影响,只与反应物和生成物自身的能量有关,不随温度压强而改变;反应速率受温度影响,温度越高,反应速率越快,步骤⑥需保证体系恢复到室温与反应速率无关;
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下,氢气的质量=,利用氢气的质量得到氢气的物质的量n=,根据,与酸反应的锌的物质的量为,锌的总物质的量为,与硫酸铜反应的锌的物质的量为,根据,则c(CuSO4)=;
(9)若步骤⑥E管液面高于D管,未调液面即读数,得到氢气的体积偏小,与硫酸反应的锌的质量偏小,与硫酸铜反应的锌的质量偏大,则测得c(CuSO4)偏高;
(10) 不能用同样的装置和方法测定MgSO4溶液的浓度,硫酸镁不和锌发生置换反应。
【点睛】本题甲方案计算时,需要根据硫酸根守恒,是易错点。
12.(1) 直线形
(2) 30% d
(3) 放热 600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢
(4)、、写出任意一个
【分析】(1)
CH4的电子式为:;CS2和二氧化碳是等电子体故其立体构型为:直线型;
(2)
①在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应,
CS2的体积分数为10%,即,解得x=0.3a,则CH4的转化率为30%。
②a.恒容容器,质量不变,故密度一直不变,故密度不变不一定平衡,不选;b.反应前后气体的物质的量不变,故压强也一直不变,故压强不变一定平衡,不选;c.CH4与S2体积比一直为1:2,故不一定平衡,不选;d.CS2的体积分数说明反应已经达到了平衡,选;故选d。
(3)
由图可知,随温度升高,甲烷的转化率降低,故反应为放热反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是600℃时甲烷平衡转化率高达99%,低于600℃时,S2浓度明显偏小,且反应速率慢。
(4)
用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S)发生的化学反应方程式为、、写出任意一个。
答案第1页,共2页
答案第1页,共2页
同课章节目录
