(2018-2022)五年高考化学真题分层汇编-02物质结构与性质(北京专用) 基础题(含解析)
文档属性
| 名称 | (2018-2022)五年高考化学真题分层汇编-02物质结构与性质(北京专用) 基础题(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 801.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-13 00:00:00 | ||
图片预览




文档简介
(2018-2022)五年高考化学真题分层汇编-02物质结构与性质基础题(北京专用)
单选题(共16题)
1.(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
2.(2022·北京·高考真题)下列化学用语或图示表达不正确的是
A.乙炔的结构简式:
B.顺丁烯的分子结构模型:
C.基态原子的价层电子的轨道表示式:
D.的电子式:
3.(2022·北京·高考真题)(锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法不正确的是
A.位于元素周期表中第六周期、第ⅡA族
B.可用质谱法区分和
C.和含有的中子数分别为49和48
D.同一地域产出的同种土壤生物中值相同
4.(2022·北京·高考真题)已知:。下列说法不正确的是
A.分子的共价键是键,分子的共价键是键
B.燃烧生成的气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将与反应的化学能转化为电能
5.(2022·北京·高考真题)我国科学家提出的聚集诱导发光机制已成为研究热点之一、一种具有聚集诱导发光性能的物质,其分子结构如图所示。下列说法不正确的是
A.分子中N原子有、两种杂化方式
B.分子中含有手性碳原子
C.该物质既有酸性又有碱性
D.该物质可发生取代反应、加成反应
6.(2022·北京·高考真题)由键能数据大小,不能解释下列事实的是
化学键
键能/ 411 318 799 358 452 346 222
A.稳定性: B.键长:
C.熔点: D.硬度:金刚石>晶体硅
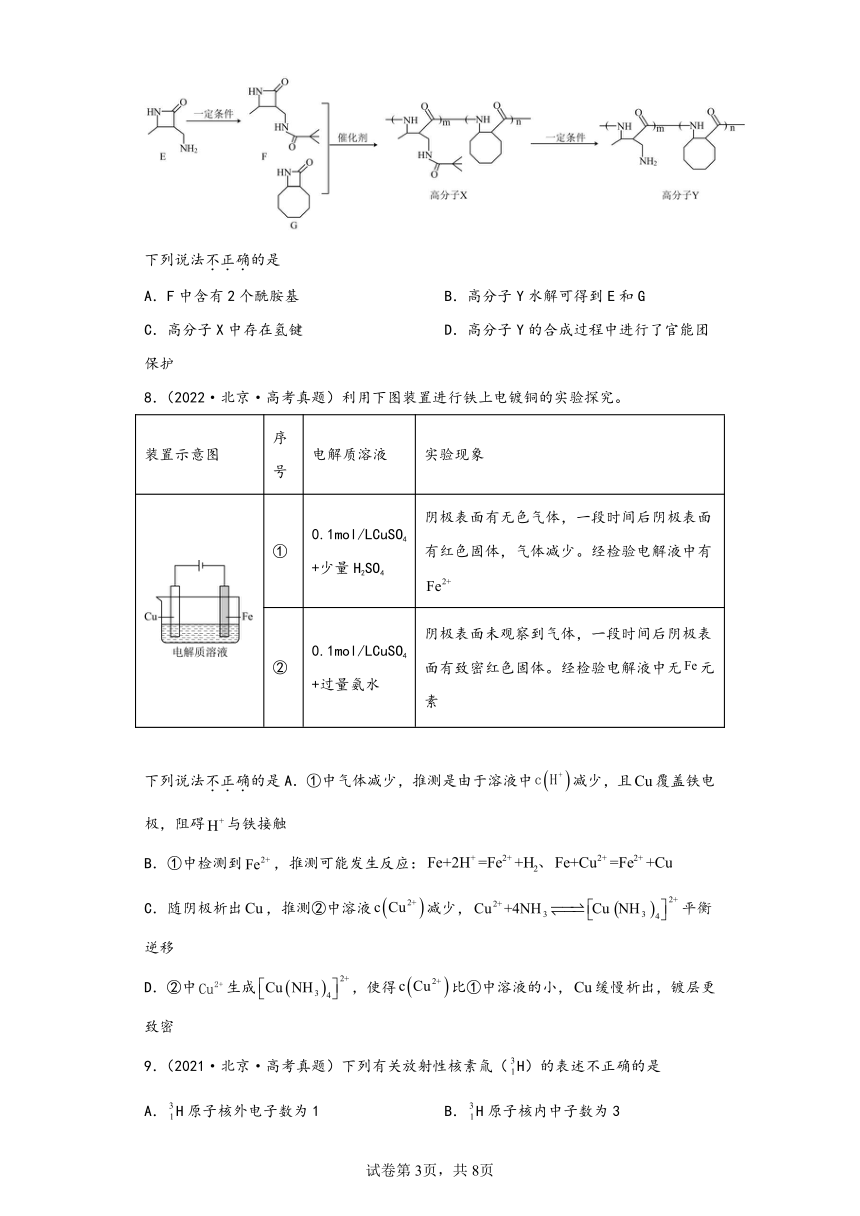
7.(2022·北京·高考真题)高分子Y是一种人工合成的多肽,其合成路线如下。
下列说法不正确的是
A.F中含有2个酰胺基 B.高分子Y水解可得到E和G
C.高分子X中存在氢键 D.高分子Y的合成过程中进行了官能团保护
8.(2022·北京·高考真题)利用下图装置进行铁上电镀铜的实验探究。
装置示意图 序号 电解质溶液 实验现象
① 0.1mol/LCuSO4 +少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
② 0.1mol/LCuSO4 +过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
下列说法不正确的是A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:
C.随阴极析出,推测②中溶液减少,平衡逆移
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
9.(2021·北京·高考真题)下列有关放射性核素氚(H)的表述不正确的是
A.H原子核外电子数为1 B.H原子核内中子数为3
C.与H2化学性质基本相同 D.具有放射性
10.(2021·北京·高考真题)下列性质的比较,不能用元素周期律解释的是
A.酸性:HClO4>H2SO3>H2SiO3 B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3 D.非金属性:F>O>N
11.(2020·北京·高考真题)已知:33As(砷)与P为同族元素。下列说法不正确的是
A.As原子核外最外层有5个电子
B.AsH3的电子式是
C.热稳定性:AsH3D.非金属性:As12.(2019·北京·高考真题)下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
A.4.03米大口径碳化硅反射镜 B.2022年冬奥会聚氨酯速滑服 C.能屏蔽电磁波的碳包覆银纳米线 D.“玉兔二号”钛合金筛网轮
A.A B.B C.C D.D
13.(2019·北京·高考真题)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B.11549In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
14.(2018·北京·高考真题)下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
A.甲醇低温所制氢气用于新能源汽车 B.氘、氚用作“人造太阳”核聚变燃料 C.偏二甲肼用作发射“天宫二号”的火箭燃料 D.开采可燃冰,将其作为能源使用
A.A B.B C.C D.D
15.(2018·北京·高考真题)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
16.(2018·北京·高考真题)下列化学用语对事实的表述不正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OHC17H35COOC2H5+H218O
B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2ONH4++OH
C.由Na和C1形成离子键的过程:
D.电解精炼铜的阴极反应:Cu2+ +2e =Cu
二、结构与性质(共1题)
17.(2022·北京·高考真题)工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。
(1)结构示意图如图1。
①的价层电子排布式为___________。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因___________。
③中与与的作用力类型分别是___________。
(2)晶体的晶胞形状为立方体,边长为,结构如图2。
①距离最近的阴离子有___________个。
②的摩尔质量为,阿伏加德罗常数为。
该晶体的密度为___________。
(3)加热脱水后生成,再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点___________。
三、工业流程题(共1题)
18.(2018·北京·高考真题)磷精矿湿法制备磷酸的一种工艺流程如下:
已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO410CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42 残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L 1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol 1)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.醋酸钠在水溶液中能完全电离,醋酸钠是强电解质,故A正确;
B.醋酸钠晶体是离子晶体,冰是分子晶体,故B错误;
C.醋酸钠是强碱弱酸盐,常温下,醋酸钠溶液的,故C正确;
D.过饱和醋酸钠溶液处于亚稳态,加入少量醋酸钠固体可以促进醋酸钠晶体析出,形成饱和溶液,故D正确;
选B。
2.C
【详解】A.乙炔中含有碳碳三键,其结构简式为,A项正确;
B.顺丁烯中两个甲基位于双键同侧,其结构模型为,B项正确;
C.基态原子的价层电子排布式为3s23p2,其轨道表示式为,C项错误;
D.是离子化合物,其电子式为,D项正确;
答案选C。
3.A
【详解】A.位于元素周期表中第五周期、第ⅡA族,故A错误;
B.质谱法可以测定原子的相对原子质量,和的相对原子质量不同,可以用质谱法区分,故B正确;
C.的中子数为87-38=49,的中子数为86-38=48,故C正确;
D.由题意可知,(锶)的、稳定同位素在同一地域土壤中值不变,故D正确;
故选A。
4.A
【详解】A.H2分子里的共价键H-H键是由两个s电子重叠形成的,称为s-s σ键,Cl2分子里的共价键Cl-Cl键是由两个p电子重叠形成的,称为p-p σ键,故A错误;
B.HCl气体极易溶于水,遇到空气中的水蒸气后立即形成盐酸小液滴,即白雾,故B正确;
C.浓氨水易挥发,挥发的氨气和HCl气体互相反应,化学方程式NH3+HCl=NH4Cl,生成NH4Cl氯化铵固体小颗粒,固体粉末就是烟,故C正确;
D.与的反应是能够自发进行的氧化还原反应,可通过原电池将与反应的化学能转化为电能,故D正确;
故选A。
5.B
【详解】A.该有机物中从左往右第一个N原子有一个孤对电子和两个σ键,为杂化;第二个N原子有一个孤对电子和三个σ键,为杂化,A正确;
B.手性碳原子是指与四个各不相同原子或基团相连的碳原子,该有机物中没有手性碳原子,B错误;
C.该物质中存在羧基,具有酸性;该物质中还含有 ,具有碱性,C正确;
D.该物质中存在苯环可以发生加成反应,含有甲基可以发生取代反应,D正确;
故选B。
6.C
【详解】A.键能越大越稳定,键能大于,所以稳定性:,故不选A;
B.键能越大,键长越短,键能大于,所以键长:,故不选B;
C.CO2是分子晶体,熔点由分子间作用力决定,SiO2是共价晶体,所以熔点,不能用键能解释熔点,故选C;
D.金刚石、晶体硅都是共价晶体,共价晶体中键能越大,晶体的硬度越大,的键能大于,所以硬度:金刚石>晶体硅,故不选D;
选C。
7.B
【详解】A.由结构简式可知,F中含有2个酰胺基,故A正确,
B.由结构简式可知,高分子Y一定条件下发生水解反应生成 和,故B错误;
C.由结构简式可知,高分子X中含有的酰胺基能形成氢键,故C正确;
D.由结构简式可知,E分子和高分子Y中都含有氨基,则高分子Y的合成过程中进行了官能团氨基的保护,故D正确;
故选B。
8.C
【分析】由实验现象可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,一段时间后,铜离子在阴极得到电子发生还原反应生成铜;实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层。
【详解】A.由分析可知,实验①时,铁会先与溶液中的氢离子、铜离子反应,当溶液中氢离子浓度减小,反应和放电生成的铜覆盖铁电极,阻碍氢离子与铁接触,导致产生的气体减少,故A正确;
B.由分析可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,可能发生的反应为,故B正确;
C.由分析可知,铜离子在阴极得到电子发生还原反应,在阴极析出铜,但阳极发生Cu-2e-=Cu2+的反应,铜离子浓度不变,平衡不移动,故C错误;
D.由分析可知,实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层,故D正确;
故选C。
9.B
【详解】A.放射性核素H,质量数是3,质子数是1,质子数等于核外电子数,所以核外电子数等于1,故A正确;
B.放射性核素H,质量数是3,质子数是1,所以中子数等于3-1=2,故B错误;
C.与H2的相对分子质量不同,二者的沸点不同,但二者同属于氢气,化学性质基本相同,故C正确;
D.H是放射性核素,所以3H2O也具有放射性,故D正确;
故选B。
10.A
【详解】A.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,由于S元素最高价含氧酸是H2SO4,不是H2SO3,因此不能根据元素周期律判断酸性:HClO4>H2SO3>H2SiO3,A错误;
B.同一主族元素的金属性随原子序数的增大而增强。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强。元素的金属性:K>Na>Li,所以碱性:KOH>NaOH>LiOH,B正确;
C.同一周期元素的非金属性随原子序数的增大而增强;同一主族元素的非金属性随原子序数的增大而减弱。元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:O>S>P,所以氢化物的热稳定性:H2O>H2S>PH3,C正确;
D.同一周期元素的非金属性随原子序数的增大而增强,所以元素的非金属性:F>O>N,D正确;
故合理选项是A。
11.B
【详解】A.As与P为同族元素,为VA族元素,则其原子核外最外层有5个电子,A说法正确;
B.AsH3属于共价化合物,电子式与氨气相似,为,B说法不正确;
C.非金属的非金属性越强,其气体氢化物越稳定,非金属性As<P,热稳定性:AsH3<PH3,C说法正确;
D.同周期元素,原子序数越小,非金属性越强,非金属性:As<Cl,D说法正确;
答案为B。
12.A
【分析】本题主要考查有机物与无机物的区分(B选项为有机物,其他均为无机物),金属材料与非金属材料的区分。同时穿插考查了元素周期表中同主族的概念。
【详解】A.碳化硅(SiC)是由碳元素和硅元素组成的无机非金属材料,且碳元素与硅元素均位于元素周期表第IVA族,故A符合题意;
B.聚氨酯为有机高分子化合物,不属于无机非金属材料,故B不符合题意;
C.碳包覆银纳米材料属于复合材料,不属于无机非金属材料,且银不是主族元素,故C不符合题意;
D.钛合金为含有金属钛元素的合金,其属于金属材料,不属于无机非金属材料,故D不符合题意;
综上所述,本题应选A。
【点睛】本题依托有机物和无机物的概念考查了化学知识与生活中物质的联系,创新点在于除了要判断是否为无机非金属材料,还给其加了限制条件“同主族”,应注意有机物中一定含碳元素,但含碳元素的却不一定是有机物。
13.D
【分析】A.根据原子核外电子排布规则,该原子结构示意图为,据此判断该元素在周期表中的位置;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,原子的质子数=电子数;
C.同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大;
D.同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱;
【详解】A.根据原子核外电子排布规则,该原子结构示意图为,因此In位于元素周期表第五周期第IIIA族,故A不符合题意;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,因此该原子的质子数=电子数=49,中子数为115-49=66,所以中子数与电子数之差为66-49=17,故B不符合题意;
C.Al位于元素周期表的三周期IIIA族,In位于元素周期表第五周期IIIA族,同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大,因此原子半径In>Al,故C不符合题意;
D.In位于元素周期表第五周期,铷(Rb)位于元素周期表第五周期第IA族,同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱,因此碱性:In(OH)3<RbOH,故D符合题意;
综上所述,本题应选D。
【点睛】本题考查原子结构与元素性质,题目难度不大,明确原子结构与元素周期律的关系为解答关键,注意掌握原子构成及表示方法,试题培养了学生的分析能力及灵活应用能力。
14.B
【详解】分析:A项,甲醇低温制氢气有新物质生成,属于化学变化;B项,氘、氚用作核聚变燃料,是核反应,不属于化学变化;C项,偏二甲肼与N2O4反应生成CO2、N2和H2O,放出大量热,属于化学变化;D项,可燃冰是甲烷的结晶水合物,CH4燃烧生成CO2和H2O,放出大量热,属于化学变化。
详解:A项,甲醇低温制氢气有新物质生成,属于化学变化;B项,氘、氚用作核聚变燃料,是核反应,不属于化学变化;C项,偏二甲肼与N2O4反应生成CO2、N2和H2O,放出大量热,反应的化学方程式为C2H8N2+2N2O43N2↑+2CO2↑+4H2O,属于化学变化;D项,可燃冰是甲烷的结晶水合物,CH4燃烧生成CO2和H2O,放出大量热,反应的化学方程式为CH4+2O2CO2+2H2O,属于化学变化;答案选B。
点睛:本题考查化学变化、核反应的区别,化学变化的特征是有新物质生成。注意化学变化与核反应的区别,化学变化过程中原子核不变,核反应不属于化学反应。
15.D
【详解】分析:A项,生成CH3COOH的总反应为CH4+CO2CH3COOH,原子利用率为100%;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂;C项,根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率。
详解:A项,根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A项正确;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂,B项正确;C项,根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C项正确;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D项错误;答案选D。
点睛:本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
16.A
【详解】分析:A项,酯化反应的机理是“酸脱羟基醇脱氢”;B项,氨水为弱碱水溶液,存在电离平衡;C项,Na易失电子形成Na+,Cl易得电子形成Cl-;D项,电解精炼铜时,精铜为阴极,粗铜为阳极。
详解:A项,酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OHC17H35CO18OC2H5+H2O,A项错误;B项,常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-10.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2ONH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;答案选A。
点睛:本题考查酯化反应的机理、电离方程式的书写、用电子式表示物质的形成过程、电解精炼铜的原理。注意强电解质和弱电解质电离方程式的区别、用电子式表示离子化合物和共价化合物形成过程的区别。
17.(1) 孤电子对有较大斥力,使键角小于键角 配位键、氢键
(2) 6
(3)燃烧放热为分解提供能量;反应产物是制备铁精粉和硫酸的原料
【详解】(1)①Fe的价层电子排布为3d64s2,形成Fe2+时失去4s上的2个电子,于是Fe2+的价层电子排布为3d6。
②H2O中O 和中S都是sp3杂化,H2O中O杂化形成的4个杂化轨道中2个被孤电子对占据,2个被键合电子对占据,而中S杂化形成的4个杂化轨道均被键合电子对占据。孤电子对与键合电子对间的斥力大于键合电子对与键合电子对间的斥力,使得键角与键角相比被压缩减小。
③H2O中O有孤电子对,Fe2+有空轨道,二者可以形成配位键。中有电负性较大的O元素可以与H2O中H元素形成氢键。
答案为:3d6;孤电子对有较大斥力,使键角小于键角;配位键、氢键。
(2)①以位于面心Fe2+为例,与其距离最近的阴离子所处位置如图所示(圆中):
。
4个阴离子位于楞上,2个位于体心位置上,共6个。
②依据分摊法可知晶胞中Fe2+离子个数为,个数为。一个晶胞中相当于含有4个FeS2,因此一个晶胞的质量。所以晶体密度。
答案为:6;
(3)燃烧为放热反应,分解为吸热反应,燃烧放出的热量恰好为分解提供能量。另外,燃烧和分解的产物如Fe2O3、SO2、SO3可以作为制备铁精粉或硫酸的原料。
答案为:燃烧放热为分解提供能量;反应产物是制备铁精粉和硫酸的原料。
18. 研磨、加热 < 核电荷数P<S,原子半径P>S,得电子能力P<S,非金属性P<S 2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑ 80 ℃后,H2O2分解速率大,浓度显著降低 CaSO4微溶 BaCO3++2H3PO4BaSO4+CO2↑+H2O+2
【详解】分析:磷精矿粉酸浸后生成粗磷酸和磷石膏,粗磷酸经过脱有机碳、脱硫等步骤获得精制磷酸。
(1)根据外界条件对化学反应速率的影响分析,流程中能加快反应速率的措施有:研磨、加热。
(2)①根据“强酸制弱酸”的复分解反应规律,酸性:H3PO4H2SO4。
②用元素周期律解释,P和S电子层数相同,核电荷数PS,原子半径PS,得电子能力PS,非金属性PS。
(3)根据“强酸制弱酸”的复分解反应规律,Ca5(PO4)3F与H2SO4反应生成HF、磷石膏和磷酸。
(4)图示是相同投料比、相同反应时间,不同温度下的有机碳脱除率,80℃前温度升高反应速率加快,相同时间内有机碳脱除率增大;80℃后温度升高,H2O2分解速率大,H2O2浓度显著降低,反应速率减慢,相同条件下有机碳脱除率减小。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,原因是:CaSO4微溶于水。加入BaCO3可进一步提高硫的脱除率,因为BaSO4难溶于水,反应的离子方程式为BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-+H2O。
(6)根据题意关系式为H3PO4~2NaOH,由消耗的NaOH计算H3PO4。
详解:(1)研磨能增大反应物的接触面积,加快反应速率,加热,升高温度加快反应速率;流程中能加快反应速率的措施有:研磨、加热。
(2)①根据“强酸制弱酸”的复分解反应规律,酸性:H3PO4H2SO4。
②用元素周期律解释酸性:H3PO4H2SO4,P和S电子层数相同,核电荷数PS,原子半径PS,得电子能力PS,非金属性PS。
(3)根据“强酸制弱酸”的复分解反应规律,Ca5(PO4)3F与H2SO4反应生成HF、磷石膏和磷酸,生成HF的化学方程式为2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑。
(4)图示是相同投料比、相同反应时间,不同温度下的有机碳脱除率,80℃前温度升高反应速率加快,相同时间内有机碳脱除率增大;80℃后温度升高,H2O2分解速率大,H2O2浓度显著降低,反应速率减慢,相同条件下有机碳脱除率减小。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,原因是:CaSO4微溶于水。加入BaCO3可进一步提高硫的脱除率,因为BaSO4难溶于水,其中SO42-与BaCO3生成更难溶的BaSO4和CO32-,H3PO4的酸性强于H2CO3,在粗磷酸中CO32-转化成H2O和CO2,反应的离子方程式为BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-+H2O。
(6)滴定终点生成Na2HPO4,则消耗的H3PO4与NaOH物质的量之比为1:2,n(H3PO4)=n(NaOH)=bmol/Lc10-3L=mol,m(H3PO4)=mol98g/mol=g=0.049bcg,精制磷酸中H3PO4的质量分数为。
点睛:本题以磷精矿湿法制备磷酸的工艺流程为载体,考查影响化学反应速率的因素、“强酸制弱酸”的复分解反应规律、元素周期律、指定情境下方程式的书写、物质含量的计算等。解题时必须利用所学知识结合流程分析,如第(5)问注意脱硫的反应是在粗磷酸中进行的,BaCO3或CaCO3中碳元素最终变为CO2;第(6)问中H3PO4与NaOH物质的量之比的确定等。
答案第1页,共2页
答案第1页,共2页
单选题(共16题)
1.(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
2.(2022·北京·高考真题)下列化学用语或图示表达不正确的是
A.乙炔的结构简式:
B.顺丁烯的分子结构模型:
C.基态原子的价层电子的轨道表示式:
D.的电子式:
3.(2022·北京·高考真题)(锶)的、稳定同位素在同一地域土壤中值不变。土壤生物中值与土壤中值有效相关。测定土壤生物中值可进行产地溯源。下列说法不正确的是
A.位于元素周期表中第六周期、第ⅡA族
B.可用质谱法区分和
C.和含有的中子数分别为49和48
D.同一地域产出的同种土壤生物中值相同
4.(2022·北京·高考真题)已知:。下列说法不正确的是
A.分子的共价键是键,分子的共价键是键
B.燃烧生成的气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将与反应的化学能转化为电能
5.(2022·北京·高考真题)我国科学家提出的聚集诱导发光机制已成为研究热点之一、一种具有聚集诱导发光性能的物质,其分子结构如图所示。下列说法不正确的是
A.分子中N原子有、两种杂化方式
B.分子中含有手性碳原子
C.该物质既有酸性又有碱性
D.该物质可发生取代反应、加成反应
6.(2022·北京·高考真题)由键能数据大小,不能解释下列事实的是
化学键
键能/ 411 318 799 358 452 346 222
A.稳定性: B.键长:
C.熔点: D.硬度:金刚石>晶体硅
7.(2022·北京·高考真题)高分子Y是一种人工合成的多肽,其合成路线如下。
下列说法不正确的是
A.F中含有2个酰胺基 B.高分子Y水解可得到E和G
C.高分子X中存在氢键 D.高分子Y的合成过程中进行了官能团保护
8.(2022·北京·高考真题)利用下图装置进行铁上电镀铜的实验探究。
装置示意图 序号 电解质溶液 实验现象
① 0.1mol/LCuSO4 +少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有
② 0.1mol/LCuSO4 +过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无元素
下列说法不正确的是A.①中气体减少,推测是由于溶液中减少,且覆盖铁电极,阻碍与铁接触
B.①中检测到,推测可能发生反应:
C.随阴极析出,推测②中溶液减少,平衡逆移
D.②中生成,使得比①中溶液的小,缓慢析出,镀层更致密
9.(2021·北京·高考真题)下列有关放射性核素氚(H)的表述不正确的是
A.H原子核外电子数为1 B.H原子核内中子数为3
C.与H2化学性质基本相同 D.具有放射性
10.(2021·北京·高考真题)下列性质的比较,不能用元素周期律解释的是
A.酸性:HClO4>H2SO3>H2SiO3 B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3 D.非金属性:F>O>N
11.(2020·北京·高考真题)已知:33As(砷)与P为同族元素。下列说法不正确的是
A.As原子核外最外层有5个电子
B.AsH3的电子式是
C.热稳定性:AsH3
A.4.03米大口径碳化硅反射镜 B.2022年冬奥会聚氨酯速滑服 C.能屏蔽电磁波的碳包覆银纳米线 D.“玉兔二号”钛合金筛网轮
A.A B.B C.C D.D
13.(2019·北京·高考真题)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B.11549In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
14.(2018·北京·高考真题)下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
A.甲醇低温所制氢气用于新能源汽车 B.氘、氚用作“人造太阳”核聚变燃料 C.偏二甲肼用作发射“天宫二号”的火箭燃料 D.开采可燃冰,将其作为能源使用
A.A B.B C.C D.D
15.(2018·北京·高考真题)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
16.(2018·北京·高考真题)下列化学用语对事实的表述不正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OHC17H35COOC2H5+H218O
B.常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2ONH4++OH
C.由Na和C1形成离子键的过程:
D.电解精炼铜的阴极反应:Cu2+ +2e =Cu
二、结构与性质(共1题)
17.(2022·北京·高考真题)工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。
(1)结构示意图如图1。
①的价层电子排布式为___________。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因___________。
③中与与的作用力类型分别是___________。
(2)晶体的晶胞形状为立方体,边长为,结构如图2。
①距离最近的阴离子有___________个。
②的摩尔质量为,阿伏加德罗常数为。
该晶体的密度为___________。
(3)加热脱水后生成,再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点___________。
三、工业流程题(共1题)
18.(2018·北京·高考真题)磷精矿湿法制备磷酸的一种工艺流程如下:
已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO410CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42 残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L 1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol 1)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.醋酸钠在水溶液中能完全电离,醋酸钠是强电解质,故A正确;
B.醋酸钠晶体是离子晶体,冰是分子晶体,故B错误;
C.醋酸钠是强碱弱酸盐,常温下,醋酸钠溶液的,故C正确;
D.过饱和醋酸钠溶液处于亚稳态,加入少量醋酸钠固体可以促进醋酸钠晶体析出,形成饱和溶液,故D正确;
选B。
2.C
【详解】A.乙炔中含有碳碳三键,其结构简式为,A项正确;
B.顺丁烯中两个甲基位于双键同侧,其结构模型为,B项正确;
C.基态原子的价层电子排布式为3s23p2,其轨道表示式为,C项错误;
D.是离子化合物,其电子式为,D项正确;
答案选C。
3.A
【详解】A.位于元素周期表中第五周期、第ⅡA族,故A错误;
B.质谱法可以测定原子的相对原子质量,和的相对原子质量不同,可以用质谱法区分,故B正确;
C.的中子数为87-38=49,的中子数为86-38=48,故C正确;
D.由题意可知,(锶)的、稳定同位素在同一地域土壤中值不变,故D正确;
故选A。
4.A
【详解】A.H2分子里的共价键H-H键是由两个s电子重叠形成的,称为s-s σ键,Cl2分子里的共价键Cl-Cl键是由两个p电子重叠形成的,称为p-p σ键,故A错误;
B.HCl气体极易溶于水,遇到空气中的水蒸气后立即形成盐酸小液滴,即白雾,故B正确;
C.浓氨水易挥发,挥发的氨气和HCl气体互相反应,化学方程式NH3+HCl=NH4Cl,生成NH4Cl氯化铵固体小颗粒,固体粉末就是烟,故C正确;
D.与的反应是能够自发进行的氧化还原反应,可通过原电池将与反应的化学能转化为电能,故D正确;
故选A。
5.B
【详解】A.该有机物中从左往右第一个N原子有一个孤对电子和两个σ键,为杂化;第二个N原子有一个孤对电子和三个σ键,为杂化,A正确;
B.手性碳原子是指与四个各不相同原子或基团相连的碳原子,该有机物中没有手性碳原子,B错误;
C.该物质中存在羧基,具有酸性;该物质中还含有 ,具有碱性,C正确;
D.该物质中存在苯环可以发生加成反应,含有甲基可以发生取代反应,D正确;
故选B。
6.C
【详解】A.键能越大越稳定,键能大于,所以稳定性:,故不选A;
B.键能越大,键长越短,键能大于,所以键长:,故不选B;
C.CO2是分子晶体,熔点由分子间作用力决定,SiO2是共价晶体,所以熔点,不能用键能解释熔点,故选C;
D.金刚石、晶体硅都是共价晶体,共价晶体中键能越大,晶体的硬度越大,的键能大于,所以硬度:金刚石>晶体硅,故不选D;
选C。
7.B
【详解】A.由结构简式可知,F中含有2个酰胺基,故A正确,
B.由结构简式可知,高分子Y一定条件下发生水解反应生成 和,故B错误;
C.由结构简式可知,高分子X中含有的酰胺基能形成氢键,故C正确;
D.由结构简式可知,E分子和高分子Y中都含有氨基,则高分子Y的合成过程中进行了官能团氨基的保护,故D正确;
故选B。
8.C
【分析】由实验现象可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,一段时间后,铜离子在阴极得到电子发生还原反应生成铜;实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层。
【详解】A.由分析可知,实验①时,铁会先与溶液中的氢离子、铜离子反应,当溶液中氢离子浓度减小,反应和放电生成的铜覆盖铁电极,阻碍氢离子与铁接触,导致产生的气体减少,故A正确;
B.由分析可知,实验①时,铁做电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,可能发生的反应为,故B正确;
C.由分析可知,铜离子在阴极得到电子发生还原反应,在阴极析出铜,但阳极发生Cu-2e-=Cu2+的反应,铜离子浓度不变,平衡不移动,故C错误;
D.由分析可知,实验②中铜离子与过量氨水反应生成四氨合铜离子,使得溶液中铜离子浓度比①中要小,电解速率减慢,铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层,故D正确;
故选C。
9.B
【详解】A.放射性核素H,质量数是3,质子数是1,质子数等于核外电子数,所以核外电子数等于1,故A正确;
B.放射性核素H,质量数是3,质子数是1,所以中子数等于3-1=2,故B错误;
C.与H2的相对分子质量不同,二者的沸点不同,但二者同属于氢气,化学性质基本相同,故C正确;
D.H是放射性核素,所以3H2O也具有放射性,故D正确;
故选B。
10.A
【详解】A.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,由于S元素最高价含氧酸是H2SO4,不是H2SO3,因此不能根据元素周期律判断酸性:HClO4>H2SO3>H2SiO3,A错误;
B.同一主族元素的金属性随原子序数的增大而增强。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强。元素的金属性:K>Na>Li,所以碱性:KOH>NaOH>LiOH,B正确;
C.同一周期元素的非金属性随原子序数的增大而增强;同一主族元素的非金属性随原子序数的增大而减弱。元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:O>S>P,所以氢化物的热稳定性:H2O>H2S>PH3,C正确;
D.同一周期元素的非金属性随原子序数的增大而增强,所以元素的非金属性:F>O>N,D正确;
故合理选项是A。
11.B
【详解】A.As与P为同族元素,为VA族元素,则其原子核外最外层有5个电子,A说法正确;
B.AsH3属于共价化合物,电子式与氨气相似,为,B说法不正确;
C.非金属的非金属性越强,其气体氢化物越稳定,非金属性As<P,热稳定性:AsH3<PH3,C说法正确;
D.同周期元素,原子序数越小,非金属性越强,非金属性:As<Cl,D说法正确;
答案为B。
12.A
【分析】本题主要考查有机物与无机物的区分(B选项为有机物,其他均为无机物),金属材料与非金属材料的区分。同时穿插考查了元素周期表中同主族的概念。
【详解】A.碳化硅(SiC)是由碳元素和硅元素组成的无机非金属材料,且碳元素与硅元素均位于元素周期表第IVA族,故A符合题意;
B.聚氨酯为有机高分子化合物,不属于无机非金属材料,故B不符合题意;
C.碳包覆银纳米材料属于复合材料,不属于无机非金属材料,且银不是主族元素,故C不符合题意;
D.钛合金为含有金属钛元素的合金,其属于金属材料,不属于无机非金属材料,故D不符合题意;
综上所述,本题应选A。
【点睛】本题依托有机物和无机物的概念考查了化学知识与生活中物质的联系,创新点在于除了要判断是否为无机非金属材料,还给其加了限制条件“同主族”,应注意有机物中一定含碳元素,但含碳元素的却不一定是有机物。
13.D
【分析】A.根据原子核外电子排布规则,该原子结构示意图为,据此判断该元素在周期表中的位置;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,原子的质子数=电子数;
C.同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大;
D.同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱;
【详解】A.根据原子核外电子排布规则,该原子结构示意图为,因此In位于元素周期表第五周期第IIIA族,故A不符合题意;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,因此该原子的质子数=电子数=49,中子数为115-49=66,所以中子数与电子数之差为66-49=17,故B不符合题意;
C.Al位于元素周期表的三周期IIIA族,In位于元素周期表第五周期IIIA族,同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大,因此原子半径In>Al,故C不符合题意;
D.In位于元素周期表第五周期,铷(Rb)位于元素周期表第五周期第IA族,同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱,因此碱性:In(OH)3<RbOH,故D符合题意;
综上所述,本题应选D。
【点睛】本题考查原子结构与元素性质,题目难度不大,明确原子结构与元素周期律的关系为解答关键,注意掌握原子构成及表示方法,试题培养了学生的分析能力及灵活应用能力。
14.B
【详解】分析:A项,甲醇低温制氢气有新物质生成,属于化学变化;B项,氘、氚用作核聚变燃料,是核反应,不属于化学变化;C项,偏二甲肼与N2O4反应生成CO2、N2和H2O,放出大量热,属于化学变化;D项,可燃冰是甲烷的结晶水合物,CH4燃烧生成CO2和H2O,放出大量热,属于化学变化。
详解:A项,甲醇低温制氢气有新物质生成,属于化学变化;B项,氘、氚用作核聚变燃料,是核反应,不属于化学变化;C项,偏二甲肼与N2O4反应生成CO2、N2和H2O,放出大量热,反应的化学方程式为C2H8N2+2N2O43N2↑+2CO2↑+4H2O,属于化学变化;D项,可燃冰是甲烷的结晶水合物,CH4燃烧生成CO2和H2O,放出大量热,反应的化学方程式为CH4+2O2CO2+2H2O,属于化学变化;答案选B。
点睛:本题考查化学变化、核反应的区别,化学变化的特征是有新物质生成。注意化学变化与核反应的区别,化学变化过程中原子核不变,核反应不属于化学反应。
15.D
【详解】分析:A项,生成CH3COOH的总反应为CH4+CO2CH3COOH,原子利用率为100%;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂;C项,根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率。
详解:A项,根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A项正确;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂,B项正确;C项,根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C项正确;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D项错误;答案选D。
点睛:本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
16.A
【详解】分析:A项,酯化反应的机理是“酸脱羟基醇脱氢”;B项,氨水为弱碱水溶液,存在电离平衡;C项,Na易失电子形成Na+,Cl易得电子形成Cl-;D项,电解精炼铜时,精铜为阴极,粗铜为阳极。
详解:A项,酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OHC17H35CO18OC2H5+H2O,A项错误;B项,常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-10.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH3·H2ONH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;答案选A。
点睛:本题考查酯化反应的机理、电离方程式的书写、用电子式表示物质的形成过程、电解精炼铜的原理。注意强电解质和弱电解质电离方程式的区别、用电子式表示离子化合物和共价化合物形成过程的区别。
17.(1) 孤电子对有较大斥力,使键角小于键角 配位键、氢键
(2) 6
(3)燃烧放热为分解提供能量;反应产物是制备铁精粉和硫酸的原料
【详解】(1)①Fe的价层电子排布为3d64s2,形成Fe2+时失去4s上的2个电子,于是Fe2+的价层电子排布为3d6。
②H2O中O 和中S都是sp3杂化,H2O中O杂化形成的4个杂化轨道中2个被孤电子对占据,2个被键合电子对占据,而中S杂化形成的4个杂化轨道均被键合电子对占据。孤电子对与键合电子对间的斥力大于键合电子对与键合电子对间的斥力,使得键角与键角相比被压缩减小。
③H2O中O有孤电子对,Fe2+有空轨道,二者可以形成配位键。中有电负性较大的O元素可以与H2O中H元素形成氢键。
答案为:3d6;孤电子对有较大斥力,使键角小于键角;配位键、氢键。
(2)①以位于面心Fe2+为例,与其距离最近的阴离子所处位置如图所示(圆中):
。
4个阴离子位于楞上,2个位于体心位置上,共6个。
②依据分摊法可知晶胞中Fe2+离子个数为,个数为。一个晶胞中相当于含有4个FeS2,因此一个晶胞的质量。所以晶体密度。
答案为:6;
(3)燃烧为放热反应,分解为吸热反应,燃烧放出的热量恰好为分解提供能量。另外,燃烧和分解的产物如Fe2O3、SO2、SO3可以作为制备铁精粉或硫酸的原料。
答案为:燃烧放热为分解提供能量;反应产物是制备铁精粉和硫酸的原料。
18. 研磨、加热 < 核电荷数P<S,原子半径P>S,得电子能力P<S,非金属性P<S 2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑ 80 ℃后,H2O2分解速率大,浓度显著降低 CaSO4微溶 BaCO3++2H3PO4BaSO4+CO2↑+H2O+2
【详解】分析:磷精矿粉酸浸后生成粗磷酸和磷石膏,粗磷酸经过脱有机碳、脱硫等步骤获得精制磷酸。
(1)根据外界条件对化学反应速率的影响分析,流程中能加快反应速率的措施有:研磨、加热。
(2)①根据“强酸制弱酸”的复分解反应规律,酸性:H3PO4H2SO4。
②用元素周期律解释,P和S电子层数相同,核电荷数PS,原子半径PS,得电子能力PS,非金属性PS。
(3)根据“强酸制弱酸”的复分解反应规律,Ca5(PO4)3F与H2SO4反应生成HF、磷石膏和磷酸。
(4)图示是相同投料比、相同反应时间,不同温度下的有机碳脱除率,80℃前温度升高反应速率加快,相同时间内有机碳脱除率增大;80℃后温度升高,H2O2分解速率大,H2O2浓度显著降低,反应速率减慢,相同条件下有机碳脱除率减小。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,原因是:CaSO4微溶于水。加入BaCO3可进一步提高硫的脱除率,因为BaSO4难溶于水,反应的离子方程式为BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-+H2O。
(6)根据题意关系式为H3PO4~2NaOH,由消耗的NaOH计算H3PO4。
详解:(1)研磨能增大反应物的接触面积,加快反应速率,加热,升高温度加快反应速率;流程中能加快反应速率的措施有:研磨、加热。
(2)①根据“强酸制弱酸”的复分解反应规律,酸性:H3PO4H2SO4。
②用元素周期律解释酸性:H3PO4H2SO4,P和S电子层数相同,核电荷数PS,原子半径PS,得电子能力PS,非金属性PS。
(3)根据“强酸制弱酸”的复分解反应规律,Ca5(PO4)3F与H2SO4反应生成HF、磷石膏和磷酸,生成HF的化学方程式为2Ca5(PO4)3F+10H2SO4+5H2O10CaSO4·0.5H2O+6H3PO4+2HF↑。
(4)图示是相同投料比、相同反应时间,不同温度下的有机碳脱除率,80℃前温度升高反应速率加快,相同时间内有机碳脱除率增大;80℃后温度升高,H2O2分解速率大,H2O2浓度显著降低,反应速率减慢,相同条件下有机碳脱除率减小。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,原因是:CaSO4微溶于水。加入BaCO3可进一步提高硫的脱除率,因为BaSO4难溶于水,其中SO42-与BaCO3生成更难溶的BaSO4和CO32-,H3PO4的酸性强于H2CO3,在粗磷酸中CO32-转化成H2O和CO2,反应的离子方程式为BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-+H2O。
(6)滴定终点生成Na2HPO4,则消耗的H3PO4与NaOH物质的量之比为1:2,n(H3PO4)=n(NaOH)=bmol/Lc10-3L=mol,m(H3PO4)=mol98g/mol=g=0.049bcg,精制磷酸中H3PO4的质量分数为。
点睛:本题以磷精矿湿法制备磷酸的工艺流程为载体,考查影响化学反应速率的因素、“强酸制弱酸”的复分解反应规律、元素周期律、指定情境下方程式的书写、物质含量的计算等。解题时必须利用所学知识结合流程分析,如第(5)问注意脱硫的反应是在粗磷酸中进行的,BaCO3或CaCO3中碳元素最终变为CO2;第(6)问中H3PO4与NaOH物质的量之比的确定等。
答案第1页,共2页
答案第1页,共2页
同课章节目录
