浙教版科学中考复习专题训练:金属制备的流程分析【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:金属制备的流程分析【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 74.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-13 19:52:36 | ||
图片预览


文档简介
金属制备的流程分析
1.利用生锈废铁屑和钛白废酸(含硫酸、硫酸亚铁)制备硫酸亚铁的主要转化过程如下:
(1)Ⅰ中除铁锈的化学方程式为__________________________。
(2)Ⅱ中反应属于基本反应类型中的________。
2.回答下列问题:工业上以赤铁矿为原料炼铁的主要流程如图所示:
(1)写出图中有铁生成的反应的化学方程式__________________________。
(2)石灰石的作用是将矿石中的二氧化硅转化为炉渣(CaSiO3),二氧化硅中硅元素的化合价为______。
(3)固体原料进入高炉之前需粉碎,其目的是__________________________。
3.黄铜是铜和锌的合金,某化学兴趣小组为研究合金中铜的含量,取样品15 g进行如下操作。
(1)操作①的名称是________。该操作用到的玻璃仪器有玻璃棒、烧杯、________。
(2)加入稀硫酸发生的反应的化学方程式为______________________。
(3)最后称得黄色固体为13 g,得到含铜量为86.7%,高于实际含铜量,其原因可能____________________________________。
4. 某合金由铝、铁、铜三种金属组成。现要测定一定质量该合金中铝的质量,设计以下流程并实验。
通过以上实验可验证三种金属的活动性顺序,其判断依据是_______________
________________________________________________________________________。
(2)步骤①中加入适量稀硫酸的目的是_________________________
________________________________________________________________________。
5. 为了从硝酸亚铁和硝酸银的混合溶液中提取并回收银,某同学设计了如下的实验方案:
(1)溶液乙中含有的溶质有__________。
(2)步骤②中发生反应的化学方程式______________________。(任写一个)
6.我国古代以炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉为原料制得了黄铜(锌和铜的合金,外观似黄金)。其生产流程如下:
回答下列问题:
(1)赤铜中铜元素的化合价是________。
(2)黄铜的硬度比铜和锌都 ____(填“大”或“小”)。
(3)操作X的名称是________。
(4)加热时,发生的主要反应方程式为①ZnCO3 ZnO+CO2↑、②2ZnO+C 2Zn+CO2↑、③______________________(赤铜和木炭粉反应)。其中不属于置换反应的是________(填反应序号)。
(5)气体A中,除二氧化碳外还有另一种生成气体,它的化学式是________,该气体的用途有________(写一条)。
(6)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是____________。
7.为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。
(1)X的成分为 ;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和 。
(2)加入B时反应的化学方程式为 。
(3)操作Ⅱ中玻璃棒的作用是______________________________________________。
8.回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下:
已知:Fe+Fe2(SO4)3=== 3FeSO4
(1)写出C的化学式 。
(2)过程Ⅱ和过程Ⅲ都需要进行的实验操作是 。
(3)过程Ⅰ中氧化铁参与反应的化学方程式是 。
9. 废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
已知:Sn+SnCl4=== 2SnCl2
(1)铜的金属活动性比锡的 (填“强”或“弱”),固体A中一定含有的金属元素是 。
(2)写出步骤②发生反应的化学方程式。
(3)相比于直接焚烧废旧电路板回收金属,该工艺主要优点有哪些?(回答一点即可)。
10.钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。下图是利用钼矿石(主要成分为MoS2)制备金属钼的流程图:
请回答下列问题:
(1)MoO3中钼元素的化合价为 。
(2)反应①常将钼矿石粉碎,其目的是什么?
(3)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,写出其反应的化学方程式。
11.2020年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如下:
已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作①的名称是 ;
(2)提炼出的贵重金属可制作奖牌,其成分是 ;
(3)调节pH的主要目的是除去滤液中 (填金属离子符号);
(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式。
12.废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属铜,实验流程如图所示(部分生成物已略去)。
已知:2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑
(1)操作Ⅱ用到的玻璃仪器有烧杯、漏斗和 (填仪器名称)。
(2)若取适量FeSO4溶液,滴入BaCl2溶液,发生反应的化学方程式为 ,该反应属于基本反应类型中的 反应。
(3)写出步骤B的化学方程式。
(4)铝制品在空气中耐腐蚀的原因。
13.金属钛广泛用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
请回答下列问题:
(1)反应②需持续通入氩气,写出氩气的作用。
(2)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,写出该反应的化学方程式。
(3)反应①②③中属于分解反应的是 (填序号)。
14.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 。
(3)调节pH可用NaOH,但不能过量,简述其原因。
(4)写出焙烧Zn(OH)2发生分解反应的化学方程式。
参考答案
1. (1)Fe2O3 + 6HCl=== 2FeCl3 + 3H2O (2)置换反应
2. (1)3CO+ Fe2O3 2Fe + 3CO2 (2)+4 (3)增大接触面积,加快反应速率
3. (1)过滤 漏斗 (2)Zn+H2SO4=== ZnSO4+H2↑(3)由于铜覆盖在锌的表面,使锌不能完全反应(合理即可)
4. (1)铝和铁都能和稀硫酸反应,铜不能和稀硫酸反应,说明铝和铁的金属活动性都位于氢前,铜位于氢后;铝能够和硫酸亚铁反应,说明铝比铁活泼,因此说明三种金属的活动性顺序为:铝>铁>铜 (2)加入适量的稀硫酸可将合金中的铝、铁恰好溶解,既能测量出铜的质量,还能保证步骤②中所加的铝只能与硫酸亚铁反应,继而确定铁的质量
5. (1)硝酸锌[或Zn(NO3)2] (2)Fe+H2SO4=== FeSO4+H2↑(或Zn+H2SO4=== ZnSO4+H2↑)
6. (1)+1 (2)大 (3)研磨 (4) 2Cu2O+C 4Cu+CO2↑ ① (5)CO 作燃料(合理即可) (6)表面变黑的是黄铜,不变色的是黄金
7. (1)Zn、Cu(或锌、铜) 漏斗
(2)Zn+H2SO4=== ZnSO4+H2↑
(3)搅拌,防止局部温度过高造成液滴飞溅
8. (1)Fe (2)过滤
(3)Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
9. (1)弱 Cu(或铜)
(2)2SnCl2 Sn+SnCl4
(3)避免焚烧塑料产生污染,更加环保。(合理即可)
10. (1)+6
(2)增大反应物的接触面积,使反应更充分。
(3)过滤 SO2+2NaOH=== Na2SO3+H2O
11. (1)过滤
(2)金、铂(或Au、Pt)
(3)Al3+、Fe3+
(4)Cu+H2SO4+H2O2=== CuSO4+2H2O
12. (1)玻璃棒
(2)FeSO4+BaCl2=== BaSO4↓+FeCl2 复分解
(3)Fe+H2SO4=== FeSO4+H2↑
(4)在常温下,铝能与空气中的氧气反应,生成一层致密的氧化铝薄膜,阻止内部的铝进一步被氧化。
13. (1)隔绝空气(或防止生成物被氧化或作保护气等合理即可)。
(2)2FeSO4 Fe2O3+SO2↑+SO3↑ (3)①③
14. (1)Cu(或铜) (2)溶解过程会产生氢气,氢气不纯遇明火会爆炸 Zn+CuSO4=== Cu+ZnSO4
(3)过量的NaOH会使生成的Zn(OH)2沉淀溶解。
(4)Zn(OH)2 ZnO+H2O↑
(
5
)
1.利用生锈废铁屑和钛白废酸(含硫酸、硫酸亚铁)制备硫酸亚铁的主要转化过程如下:
(1)Ⅰ中除铁锈的化学方程式为__________________________。
(2)Ⅱ中反应属于基本反应类型中的________。
2.回答下列问题:工业上以赤铁矿为原料炼铁的主要流程如图所示:
(1)写出图中有铁生成的反应的化学方程式__________________________。
(2)石灰石的作用是将矿石中的二氧化硅转化为炉渣(CaSiO3),二氧化硅中硅元素的化合价为______。
(3)固体原料进入高炉之前需粉碎,其目的是__________________________。
3.黄铜是铜和锌的合金,某化学兴趣小组为研究合金中铜的含量,取样品15 g进行如下操作。
(1)操作①的名称是________。该操作用到的玻璃仪器有玻璃棒、烧杯、________。
(2)加入稀硫酸发生的反应的化学方程式为______________________。
(3)最后称得黄色固体为13 g,得到含铜量为86.7%,高于实际含铜量,其原因可能____________________________________。
4. 某合金由铝、铁、铜三种金属组成。现要测定一定质量该合金中铝的质量,设计以下流程并实验。
通过以上实验可验证三种金属的活动性顺序,其判断依据是_______________
________________________________________________________________________。
(2)步骤①中加入适量稀硫酸的目的是_________________________
________________________________________________________________________。
5. 为了从硝酸亚铁和硝酸银的混合溶液中提取并回收银,某同学设计了如下的实验方案:
(1)溶液乙中含有的溶质有__________。
(2)步骤②中发生反应的化学方程式______________________。(任写一个)
6.我国古代以炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉为原料制得了黄铜(锌和铜的合金,外观似黄金)。其生产流程如下:
回答下列问题:
(1)赤铜中铜元素的化合价是________。
(2)黄铜的硬度比铜和锌都 ____(填“大”或“小”)。
(3)操作X的名称是________。
(4)加热时,发生的主要反应方程式为①ZnCO3 ZnO+CO2↑、②2ZnO+C 2Zn+CO2↑、③______________________(赤铜和木炭粉反应)。其中不属于置换反应的是________(填反应序号)。
(5)气体A中,除二氧化碳外还有另一种生成气体,它的化学式是________,该气体的用途有________(写一条)。
(6)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是____________。
7.为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。
(1)X的成分为 ;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和 。
(2)加入B时反应的化学方程式为 。
(3)操作Ⅱ中玻璃棒的作用是______________________________________________。
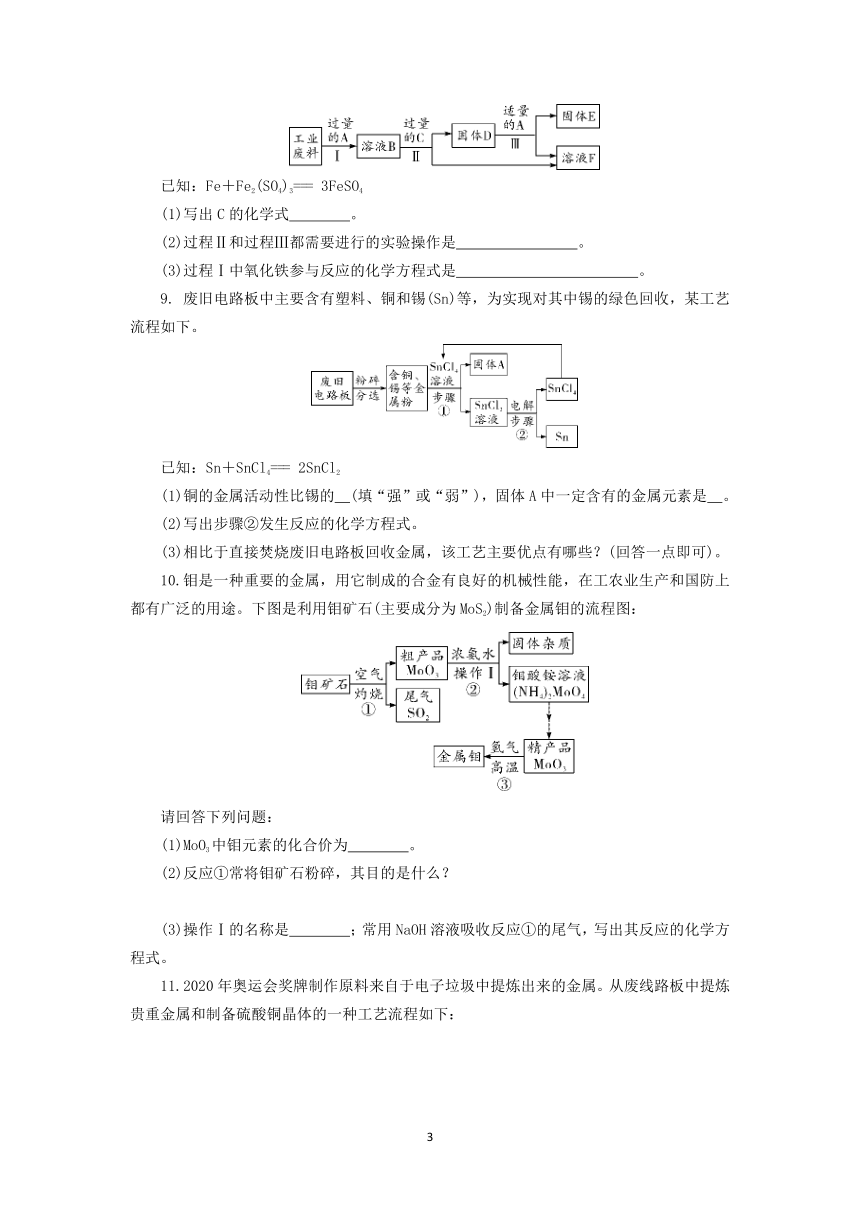
8.回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下:
已知:Fe+Fe2(SO4)3=== 3FeSO4
(1)写出C的化学式 。
(2)过程Ⅱ和过程Ⅲ都需要进行的实验操作是 。
(3)过程Ⅰ中氧化铁参与反应的化学方程式是 。
9. 废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
已知:Sn+SnCl4=== 2SnCl2
(1)铜的金属活动性比锡的 (填“强”或“弱”),固体A中一定含有的金属元素是 。
(2)写出步骤②发生反应的化学方程式。
(3)相比于直接焚烧废旧电路板回收金属,该工艺主要优点有哪些?(回答一点即可)。
10.钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。下图是利用钼矿石(主要成分为MoS2)制备金属钼的流程图:
请回答下列问题:
(1)MoO3中钼元素的化合价为 。
(2)反应①常将钼矿石粉碎,其目的是什么?
(3)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,写出其反应的化学方程式。
11.2020年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如下:
已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作①的名称是 ;
(2)提炼出的贵重金属可制作奖牌,其成分是 ;
(3)调节pH的主要目的是除去滤液中 (填金属离子符号);
(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式。
12.废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属铜,实验流程如图所示(部分生成物已略去)。
已知:2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑
(1)操作Ⅱ用到的玻璃仪器有烧杯、漏斗和 (填仪器名称)。
(2)若取适量FeSO4溶液,滴入BaCl2溶液,发生反应的化学方程式为 ,该反应属于基本反应类型中的 反应。
(3)写出步骤B的化学方程式。
(4)铝制品在空气中耐腐蚀的原因。
13.金属钛广泛用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
请回答下列问题:
(1)反应②需持续通入氩气,写出氩气的作用。
(2)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,写出该反应的化学方程式。
(3)反应①②③中属于分解反应的是 (填序号)。
14.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 。
(3)调节pH可用NaOH,但不能过量,简述其原因。
(4)写出焙烧Zn(OH)2发生分解反应的化学方程式。
参考答案
1. (1)Fe2O3 + 6HCl=== 2FeCl3 + 3H2O (2)置换反应
2. (1)3CO+ Fe2O3 2Fe + 3CO2 (2)+4 (3)增大接触面积,加快反应速率
3. (1)过滤 漏斗 (2)Zn+H2SO4=== ZnSO4+H2↑(3)由于铜覆盖在锌的表面,使锌不能完全反应(合理即可)
4. (1)铝和铁都能和稀硫酸反应,铜不能和稀硫酸反应,说明铝和铁的金属活动性都位于氢前,铜位于氢后;铝能够和硫酸亚铁反应,说明铝比铁活泼,因此说明三种金属的活动性顺序为:铝>铁>铜 (2)加入适量的稀硫酸可将合金中的铝、铁恰好溶解,既能测量出铜的质量,还能保证步骤②中所加的铝只能与硫酸亚铁反应,继而确定铁的质量
5. (1)硝酸锌[或Zn(NO3)2] (2)Fe+H2SO4=== FeSO4+H2↑(或Zn+H2SO4=== ZnSO4+H2↑)
6. (1)+1 (2)大 (3)研磨 (4) 2Cu2O+C 4Cu+CO2↑ ① (5)CO 作燃料(合理即可) (6)表面变黑的是黄铜,不变色的是黄金
7. (1)Zn、Cu(或锌、铜) 漏斗
(2)Zn+H2SO4=== ZnSO4+H2↑
(3)搅拌,防止局部温度过高造成液滴飞溅
8. (1)Fe (2)过滤
(3)Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
9. (1)弱 Cu(或铜)
(2)2SnCl2 Sn+SnCl4
(3)避免焚烧塑料产生污染,更加环保。(合理即可)
10. (1)+6
(2)增大反应物的接触面积,使反应更充分。
(3)过滤 SO2+2NaOH=== Na2SO3+H2O
11. (1)过滤
(2)金、铂(或Au、Pt)
(3)Al3+、Fe3+
(4)Cu+H2SO4+H2O2=== CuSO4+2H2O
12. (1)玻璃棒
(2)FeSO4+BaCl2=== BaSO4↓+FeCl2 复分解
(3)Fe+H2SO4=== FeSO4+H2↑
(4)在常温下,铝能与空气中的氧气反应,生成一层致密的氧化铝薄膜,阻止内部的铝进一步被氧化。
13. (1)隔绝空气(或防止生成物被氧化或作保护气等合理即可)。
(2)2FeSO4 Fe2O3+SO2↑+SO3↑ (3)①③
14. (1)Cu(或铜) (2)溶解过程会产生氢气,氢气不纯遇明火会爆炸 Zn+CuSO4=== Cu+ZnSO4
(3)过量的NaOH会使生成的Zn(OH)2沉淀溶解。
(4)Zn(OH)2 ZnO+H2O↑
(
5
)
