浙教版科学中考复习专题训练:酸碱盐制备的流程分析【word,含答案】
文档属性
| 名称 | 浙教版科学中考复习专题训练:酸碱盐制备的流程分析【word,含答案】 |  | |
| 格式 | docx | ||
| 文件大小 | 69.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-03-13 19:53:31 | ||
图片预览


文档简介
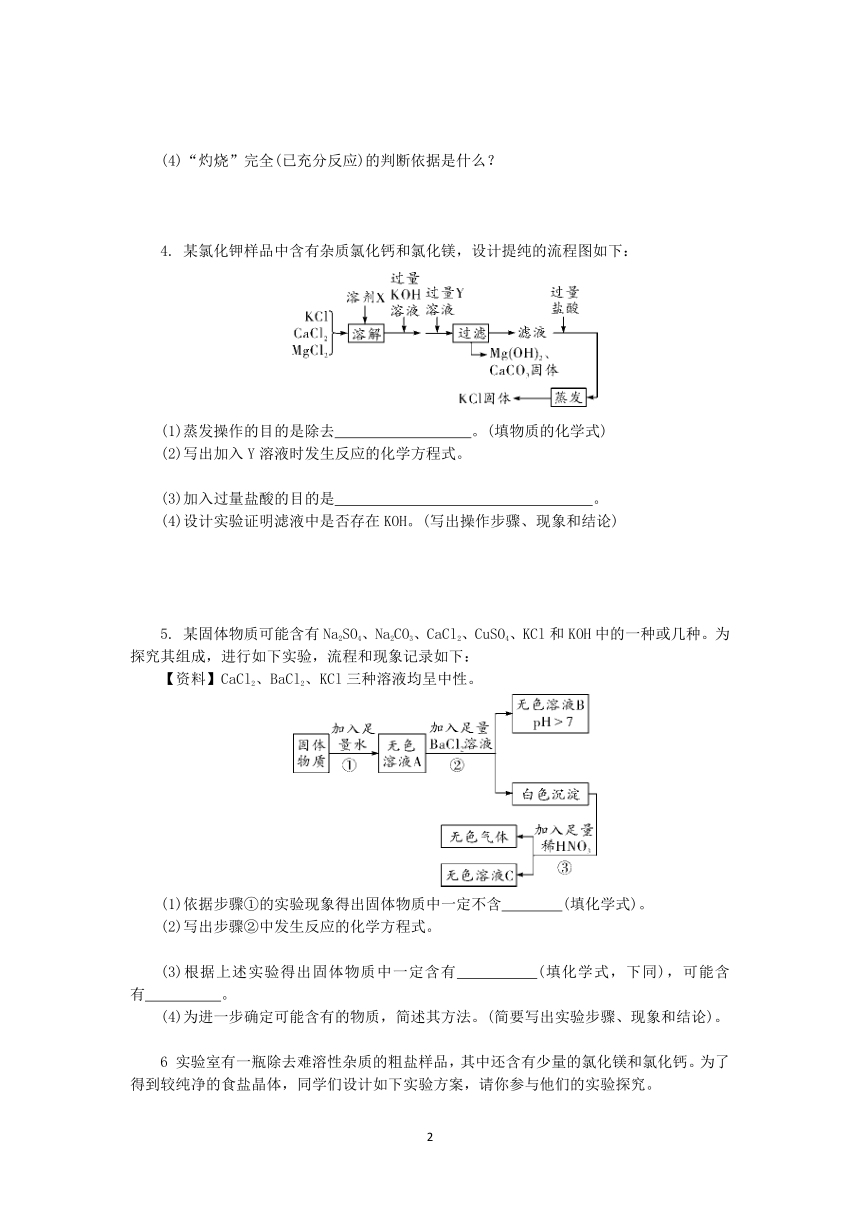
酸碱盐制备的流程分析
1.Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如下:
(1)BaCO3与稀HNO3反应的反应类型是 ;写出Fe2O3与稀HNO3反应的化学方程式 。
(2)试剂Y为 (填序号)。
①BaCl2溶液
②Ba(OH)2溶液
③NaOH溶液
(3)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是__________________________。
2.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)写出白色沉淀A与稀盐酸反应的化学方程式。
(2)白色沉淀C的化学式为 。
(3)写出这包白色固体的组成(写化学式)。
3.胆矾(CuSO4·5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如图所示:
查阅资料:氧化锌能溶于氢氧化钠溶液。
(1)废旧电池铜帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起 作用。
(2)“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、 等。
(3)“酸溶”时,写出发生反应的化学方程式。
(4)“灼烧”完全(已充分反应)的判断依据是什么?
4. 某氯化钾样品中含有杂质氯化钙和氯化镁,设计提纯的流程图如下:
(1)蒸发操作的目的是除去 。(填物质的化学式)
(2)写出加入Y溶液时发生反应的化学方程式。
(3)加入过量盐酸的目的是 。
(4)设计实验证明滤液中是否存在KOH。(写出操作步骤、现象和结论)
5. 某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、KCl和KOH中的一种或几种。为探究其组成,进行如下实验,流程和现象记录如下:
【资料】CaCl2、BaCl2、KCl三种溶液均呈中性。
(1)依据步骤①的实验现象得出固体物质中一定不含 (填化学式)。
(2)写出步骤②中发生反应的化学方程式。
(3)根据上述实验得出固体物质中一定含有 (填化学式,下同),可能含有 。
(4)为进一步确定可能含有的物质,简述其方法。(简要写出实验步骤、现象和结论)。
6 实验室有一瓶除去难溶性杂质的粗盐样品,其中还含有少量的氯化镁和氯化钙。为了得到较纯净的食盐晶体,同学们设计如下实验方案,请你参与他们的实验探究。
(1)实验过程中,向粗盐水中先加入过量的氢氧化钙溶液,再加入过量的碳酸钠溶液,依次加入的目的是____________________________________,写出两种盐之间发生反应的化学方程式________________________________。
(2)实验过程中,用到的操作有________________,得到食盐晶体时,应在________中进行。
7利用电石渣[主要成分为Ca(OH)2、MgO]制备硫酸钙的主要工艺流程如下:
已知:MgO难溶于水;MgSO4易溶于水;CaSO4微溶于水。
(1)反应器中搅拌的目的是________________________________________。
(2)反应器中发生的反应主要有MgO+H2SO4=== MgSO4+H2O和________________________________________________________________________。
(3)上述流程中,用于分离提纯的设备有______________________。
8.Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如下:
(1)Ba(NO3)2中钡元素的化合价为________;流程中所涉及的氧化物是________(填1种即可)。
(2)BaCO3与稀HNO3反应的反应类型是______________;写出Fe2O3与稀HNO3反应的化学方程式:
________________________________________________________________________。
(3)试剂Y为________(填序号)。
①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是________。
9.有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如图实验:
(1)取少量固体按图甲实验
图甲
图乙
根据步骤①可知固体中一定不含有________。
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随添加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有________________。
(3)取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,无色溶液C中一定含有的离子是________________(填离子符号)。
(4)为进一步确定原固体中可能含有的物质是否存在,应采用的操作步骤是________________________________________,通过观察现象即可确定。
10.水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下(气体产物已略去):
回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的________反应;反应Ⅱ除产生水垢外,还有一种气体产物为________;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是_______________________________。
(2)向200 g水垢中加入400 g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如表所示:
时间/s(秒) 0 30 60 90 120 180
混合物的质量/g 600 574 554 547.2 547.2 547.2
①观察到的现象是________________________。
11.如图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳酸钙的实验流程。请回答下列问题:
已知:①SiO2不溶于水也不溶于酸
②氨水呈碱性,与盐酸反应的化学方程式为:
NH3·H2O+HCl === NH4Cl+H2O
(1)稀盐酸不能用稀硫酸代替,原因是____________________________________________。
(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和________________。
(3)写出滤液A中加氨水生成Fe(OH)3的化学方程式_________________________。
(4)滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为________________。
12.某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,分离A、B的实验操作名称是______,试剂a是________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是________(双选,填序号)。
A. NaOH溶液 B. CaCl2溶液
C. NaCl溶液 D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_________________________________________。
(4)要达到预期的目的,还需要改进的方法为______________________________________。
参考答案
1. (1)复分解反应 Fe2O3+6HNO3=== 2Fe(NO3)3+3H2O (2)② (3)蒸发溶剂(或蒸发结晶,合理即可)
2. (1)BaCO3+2HCl=== BaCl2+H2O+CO2↑
(2)CaCO3 (3)BaCl2、Na2CO3
3. (1)乳化 (2)加热(合理即可)
(3)CuO+H2SO4=== CuSO4+H2O
(4)固体质量不再发生变化。
4. (1)H2O、HCl
(2)K2CO3+CaCl2=== CaCO3↓+2KCl
(3)除去过量的氢氧化钾和碳酸钾
(4)取少量滤液于试管中,加入足量的氯化钙(或氯化钡)溶液,产生白色沉淀,静置,取上层清液向其中加入几滴酚酞溶液,若溶液变红,则滤液中有氢氧化钾,反之则不存在。
5. (1)CuSO4
(2)BaCl2+Na2CO3=== BaCO3↓+2NaCl
(3)Na2CO3、KOH KCl
(4)取少量无色溶液A于试管中,加入过量的稀硝酸,然后滴加硝酸银溶液,若产生白色沉淀,则固体中一定含有KCl,否则不含KCl。
6. (1)除去氯化镁和氯化钙且保证加入的过量的氢氧化钙溶液被碳酸钠溶液除去 CaCl2+Na2CO3=== CaCO3↓+2NaCl (2)溶解、过滤、蒸发结晶 蒸发皿
7. (1)增大反应物接触、碰撞的几率,使反应更充分,加快反应速率 (2)H2SO4 + Ca(OH)2=== CaSO4 + 2H2O(3)过滤器和洗涤槽
8. (1)+2 氧化铁(合理即可) (2)复分解反应 Fe2O3+6HNO3=== 2Fe(NO3)3+3H2O (3)②(4)蒸发溶剂(合理即可)
9. (1)FeCl3(或氯化铁)(2)Na2SO4、Na2CO3(或硫酸钠、碳酸钠)(3)Na+、Ba2+、OH-、NO(4)取C溶液少许于试管中,先滴加足量的稀硝酸,然后再滴加硝酸银溶液(答案合理即可)
10. (1)分解 CO2 CaSO4微溶于水,且升温会使其溶解度降低 (2)①固体逐渐溶解,产生无色气体
11. (1)稀硫酸和大理石中的碳酸钙反应生成了微溶于水的硫酸钙覆盖在大理石表面,会阻碍大理石和酸的进一步反应 (2)漏斗 (3)FeCl3+3NH3·H2O=== Fe(OH)3↓+3NH4Cl (4)(NH4)2CO3
12. (1)过滤 K2CO3溶液 (2)BD (3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)向滤液A中加入适量的稀盐酸(合理即可)
(
1
)
1.Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如下:
(1)BaCO3与稀HNO3反应的反应类型是 ;写出Fe2O3与稀HNO3反应的化学方程式 。
(2)试剂Y为 (填序号)。
①BaCl2溶液
②Ba(OH)2溶液
③NaOH溶液
(3)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是__________________________。
2.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)写出白色沉淀A与稀盐酸反应的化学方程式。
(2)白色沉淀C的化学式为 。
(3)写出这包白色固体的组成(写化学式)。
3.胆矾(CuSO4·5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如图所示:
查阅资料:氧化锌能溶于氢氧化钠溶液。
(1)废旧电池铜帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起 作用。
(2)“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、 等。
(3)“酸溶”时,写出发生反应的化学方程式。
(4)“灼烧”完全(已充分反应)的判断依据是什么?
4. 某氯化钾样品中含有杂质氯化钙和氯化镁,设计提纯的流程图如下:
(1)蒸发操作的目的是除去 。(填物质的化学式)
(2)写出加入Y溶液时发生反应的化学方程式。
(3)加入过量盐酸的目的是 。
(4)设计实验证明滤液中是否存在KOH。(写出操作步骤、现象和结论)
5. 某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、KCl和KOH中的一种或几种。为探究其组成,进行如下实验,流程和现象记录如下:
【资料】CaCl2、BaCl2、KCl三种溶液均呈中性。
(1)依据步骤①的实验现象得出固体物质中一定不含 (填化学式)。
(2)写出步骤②中发生反应的化学方程式。
(3)根据上述实验得出固体物质中一定含有 (填化学式,下同),可能含有 。
(4)为进一步确定可能含有的物质,简述其方法。(简要写出实验步骤、现象和结论)。
6 实验室有一瓶除去难溶性杂质的粗盐样品,其中还含有少量的氯化镁和氯化钙。为了得到较纯净的食盐晶体,同学们设计如下实验方案,请你参与他们的实验探究。
(1)实验过程中,向粗盐水中先加入过量的氢氧化钙溶液,再加入过量的碳酸钠溶液,依次加入的目的是____________________________________,写出两种盐之间发生反应的化学方程式________________________________。
(2)实验过程中,用到的操作有________________,得到食盐晶体时,应在________中进行。
7利用电石渣[主要成分为Ca(OH)2、MgO]制备硫酸钙的主要工艺流程如下:
已知:MgO难溶于水;MgSO4易溶于水;CaSO4微溶于水。
(1)反应器中搅拌的目的是________________________________________。
(2)反应器中发生的反应主要有MgO+H2SO4=== MgSO4+H2O和________________________________________________________________________。
(3)上述流程中,用于分离提纯的设备有______________________。
8.Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如下:
(1)Ba(NO3)2中钡元素的化合价为________;流程中所涉及的氧化物是________(填1种即可)。
(2)BaCO3与稀HNO3反应的反应类型是______________;写出Fe2O3与稀HNO3反应的化学方程式:
________________________________________________________________________。
(3)试剂Y为________(填序号)。
①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是________。
9.有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如图实验:
(1)取少量固体按图甲实验
图甲
图乙
根据步骤①可知固体中一定不含有________。
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随添加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有________________。
(3)取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,无色溶液C中一定含有的离子是________________(填离子符号)。
(4)为进一步确定原固体中可能含有的物质是否存在,应采用的操作步骤是________________________________________,通过观察现象即可确定。
10.水与自然界中矿石长期接触,常含Ca(HCO3)2、Mg(HCO3)2等物质,导致钙离子、镁离子含量较多,称之为硬水。生活中,水的硬度过高会造成一定危害。长期使用硬水烧水的热水壶,内部会形成一层水垢,其主要成分为碳酸钙和氢氧化镁,说明加热煮沸可使这类硬水成为软水。其原理的流程如下(气体产物已略去):
回答下列问题:
(1)反应Ⅰ属于四大基本反应类型中的________反应;反应Ⅱ除产生水垢外,还有一种气体产物为________;如果当地硬水中CaSO4含量较多,则水垢中还常含有少量CaSO4,CaSO4析出的原因是_______________________________。
(2)向200 g水垢中加入400 g过量的稀盐酸,充分反应,测得3分钟内混合物质量的变化(不考虑水与HCl的挥发)如表所示:
时间/s(秒) 0 30 60 90 120 180
混合物的质量/g 600 574 554 547.2 547.2 547.2
①观察到的现象是________________________。
11.如图是实验室模拟工业上用大理石(含少量Fe2O3和SiO2)为原料提纯碳酸钙的实验流程。请回答下列问题:
已知:①SiO2不溶于水也不溶于酸
②氨水呈碱性,与盐酸反应的化学方程式为:
NH3·H2O+HCl === NH4Cl+H2O
(1)稀盐酸不能用稀硫酸代替,原因是____________________________________________。
(2)操作a中需要用到的玻璃仪器有烧杯、玻璃棒和________________。
(3)写出滤液A中加氨水生成Fe(OH)3的化学方程式_________________________。
(4)滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为________________。
12.某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计了如图所示的实验流程:
供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,分离A、B的实验操作名称是______,试剂a是________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是________(双选,填序号)。
A. NaOH溶液 B. CaCl2溶液
C. NaCl溶液 D. AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为_________________________________________。
(4)要达到预期的目的,还需要改进的方法为______________________________________。
参考答案
1. (1)复分解反应 Fe2O3+6HNO3=== 2Fe(NO3)3+3H2O (2)② (3)蒸发溶剂(或蒸发结晶,合理即可)
2. (1)BaCO3+2HCl=== BaCl2+H2O+CO2↑
(2)CaCO3 (3)BaCl2、Na2CO3
3. (1)乳化 (2)加热(合理即可)
(3)CuO+H2SO4=== CuSO4+H2O
(4)固体质量不再发生变化。
4. (1)H2O、HCl
(2)K2CO3+CaCl2=== CaCO3↓+2KCl
(3)除去过量的氢氧化钾和碳酸钾
(4)取少量滤液于试管中,加入足量的氯化钙(或氯化钡)溶液,产生白色沉淀,静置,取上层清液向其中加入几滴酚酞溶液,若溶液变红,则滤液中有氢氧化钾,反之则不存在。
5. (1)CuSO4
(2)BaCl2+Na2CO3=== BaCO3↓+2NaCl
(3)Na2CO3、KOH KCl
(4)取少量无色溶液A于试管中,加入过量的稀硝酸,然后滴加硝酸银溶液,若产生白色沉淀,则固体中一定含有KCl,否则不含KCl。
6. (1)除去氯化镁和氯化钙且保证加入的过量的氢氧化钙溶液被碳酸钠溶液除去 CaCl2+Na2CO3=== CaCO3↓+2NaCl (2)溶解、过滤、蒸发结晶 蒸发皿
7. (1)增大反应物接触、碰撞的几率,使反应更充分,加快反应速率 (2)H2SO4 + Ca(OH)2=== CaSO4 + 2H2O(3)过滤器和洗涤槽
8. (1)+2 氧化铁(合理即可) (2)复分解反应 Fe2O3+6HNO3=== 2Fe(NO3)3+3H2O (3)②(4)蒸发溶剂(合理即可)
9. (1)FeCl3(或氯化铁)(2)Na2SO4、Na2CO3(或硫酸钠、碳酸钠)(3)Na+、Ba2+、OH-、NO(4)取C溶液少许于试管中,先滴加足量的稀硝酸,然后再滴加硝酸银溶液(答案合理即可)
10. (1)分解 CO2 CaSO4微溶于水,且升温会使其溶解度降低 (2)①固体逐渐溶解,产生无色气体
11. (1)稀硫酸和大理石中的碳酸钙反应生成了微溶于水的硫酸钙覆盖在大理石表面,会阻碍大理石和酸的进一步反应 (2)漏斗 (3)FeCl3+3NH3·H2O=== Fe(OH)3↓+3NH4Cl (4)(NH4)2CO3
12. (1)过滤 K2CO3溶液 (2)BD (3)BaCO3+2HCl=== BaCl2+CO2↑+H2O (4)向滤液A中加入适量的稀盐酸(合理即可)
(
1
)
