第六章第二节第一课时 化学反应速率 课件 (共20张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章第二节第一课时 化学反应速率 课件 (共20张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 08:40:04 | ||
图片预览







文档简介
(共20张PPT)
化学反应速率
思考与交流
你了解以下反应进行的快慢吗?
爆炸
溶洞形成
很快
很慢
钢铁生锈
较慢
牛奶腐坏
较快
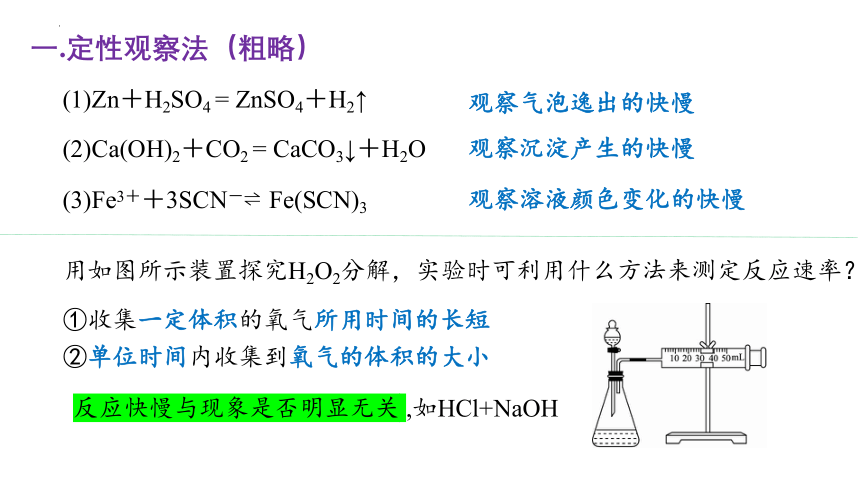
一.定性观察法(粗略)
(1)Zn+H2SO4 = ZnSO4+H2↑
(2)Ca(OH)2+CO2 = CaCO3↓+H2O
(3)Fe3++3SCN- Fe(SCN)3
观察气泡逸出的快慢
观察沉淀产生的快慢
观察溶液颜色变化的快慢
用如图所示装置探究H2O2分解,实验时可利用什么方法来测定反应速率?
②单位时间内收集到氧气的体积的大小
①收集一定体积的氧气所用时间的长短
反应快慢与现象是否明显无关 ,如HCl+NaOH
2.表达式:
1.定义:单位时间内反应物浓度的________或生成物浓度的________。
二.定量表示法(准确)
—化学反应速率:衡量化学反应速率快慢的物理量
减少量
增加量
3.常用单位:
mol·L-1·min-1或mol·L-1·s-1
mol/(L·min) 或mol/(L·s)
1mol/(L min)= mol/(L s)
单位换算:
①化学反应速率指平均速率,不是瞬时速率(2min内 2min时/末 )
②化学反应速率是标量,均取正值
③一般不用固体、纯液体表示化学反应速率
④对于同一化学反应,不同物质表示的速率在数值上可能不同,但意义相同因此表示化学反应速率,必须指明物质,如V(N2),V(NH3)
一定温度下,向2L的密闭容器中加入2mol N2,6mol H2进行反应,2min后测得容器中NH3的物质的量为0.8mol。
(1)N2的转化率是多少?2min后容器压强时起始时压强的 倍;
(2)分别求出2min内N2、H2和NH3的化学反应速率是多少?
(2)N2、H2和NH3的反应速率的数值是否相等?其数值大小有何关系?
v(H2)=1.2 mol/(2L·2min)
v(N2) )=0.4 mol/(2L·2min)
v(NH3) )=0.8 mol/(2L·2min)
v(N2):v(H2):v(NH3)=
1:3:2
=0. 3mol/(L·min)
=0.1mol/(L·min)
=0.2mol/(L·min)
N2 + 3H2 2NH3
no
Δn
n (2min)
2 6 0
三段式法
0.8
0.8
1.2
0.4
1.6 4.8
注意n和c
速率之比=计量数之比
mol
α(N2)=0.4mol÷2mol×100%=20%
P之比=n之比
0.9
※ v之比
= Δc之比
= Δn之比
= 化学计量数之比
v(A):v(B):v(C):v(D=a︰b︰c︰d
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(s),正确的是( )
A. v(W)=3v(Z) B.3v(X)=2v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
2v(W)=3v(X)
C
同段时间同一化学反应: aA(g)+bB(g) = cC(g)+dD(g)
※乘以对方的系数
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:该反应进行快慢的顺序为 .
①v(A)=0.45 mol·L-1·min-1,②v(B)=0.6 mol·L-1·s-1,
③v(C)=0.4 mol·L-1·s-1,④v(D)=0.45 mol·L-1·s-1。
0.45÷60 mol·L-1·s-1
v(A)=0.2 mol·L-1·s-1
v(A)=0.2 mol·L-1·s-1
v(A)=0.25 mol·L-1·s-1
④>③=②>①
[化学反应速率大小比较]
方法1:归一法
①同一单位
②同一物质
方法2:比值法,速率与化学计量数之比
如aA+bB=cC+dD,若 > ,则A表示的速率>B表示的速率。
1mol/(L min)= mol/(L s)
不用s、l表示
化为系数为1的物质
夏天食物变质比冬天快
结合已学知识和生活经验,请同学们讨论影响化学反应速率的因素有哪些呢?
三.影响速率的因素
(一)内因--物质自身性质
相同温度下,相同形状、大小的镁条和铝条与等浓度的盐酸反应, 反应进行得快,原因是 。
镁
镁的活动性比铝强
不同的化学反应,具有不同的反应速率。
本质/决定性因素
二.外因
【实验探究1】温度对H2O2分解反应速率的影响
实验操作
实验现象
实验结论
试管中均有2--3ml同浓度的滴有FeCl3溶液的H2O2溶液
溶液中产生气泡速率的相对大小为
其它条件不变,温度越高,化学反应速率越快,反之,速率越慢
③>②>①
对于可逆反应,升高温度,正、逆速率均增大
升高温度,无论是吸热反应还是放热反应,速率均增大
升高温度,一定会加快反应速率
控制变量
【实验探究2】催化剂对H2O2分解反应速率的影响
实验操作
实验现象
实验结论
溶液中产生气泡速率的相对大小为
②>①
③>①
其它条件不变时,FeCl3、MnO2能加快H2O2的分解速率
有的催化剂能加快化学反应的速率,叫正催化剂;
有的催化剂能减慢化学反应的速率,叫负催化剂。
默认指正催化剂
催化剂只影响速率,不影响反应的能量变化;不影响转化率
影响速率大小与催化剂的表面积有关,催化剂参与反应,但质量和性质不变
2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1,在V2O5存在时,该反应的机理为
V2O5+SO2==2VO2+SO3(快)
4VO2+O2==2V2O5(慢)
下列说法正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的吸收198 kJ能量
D.增大SO2的浓度可显著提高反应速率
V2O5
催化剂
VO2
中间产物
催化剂的表面积
C
反应速率由慢反应决定
【实验探究3】浓度对化学反应速率的影响
实验操作 取2支试管,分别加入表面积相同的铝片,向其中一支试管滴入2ml 3mol/L的盐酸,向另外一支试管滴入2ml 0.5mol/L的盐酸,对比观察实验现象。
实验现象
实验结论
产生气泡速率:
其它条件不变时,反应物浓度越大,化学反应速率越快
3mol/L的盐酸>0.5mol/L的盐酸
FeCl3+3KSCN Fe(SCN)3+3KCl
Q:增加氯化钾的浓度
速率不变
Fe3++3SCN-- Fe(SCN)3
②对于离子反应,只有改变参与反应的离子浓度,速率才改变
①固体、纯液体(如H2O)不适用
Na与水反应时增大水的用量
C(s)+CO2(g)=2CO(g)增加C的用量
v不变
v不变
在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2mol L-1降到0.8mol L-1需要20s,那么反应物浓度再由
0.8mol L-1降到0.2mol L-1所需要的时间为( )
A.10s B.大于10s C.小于10s D.无法判断
B
变化1.2mol/L
变化0.6mol/L
随着反应的进行,反应物浓度越来越小,反应速率越来越小
过量锌片与100ml 2mol/LH2SO4反应,反应速率?生成氢气的总量?
A.加入K2SO4溶液
B.改用200ml 1mol/LH2SO4
C.加入CuSO4溶液
D.加入CH3COONa溶液
E.加入Na2CO3溶液
F.加入NaNO3粉末
G.改用锌粉
H.升高体系的温度
Zn+2H+=Zn2++H2↑
H2量由H2SO4物质的量决定
速率由H+浓度决定
速率减小
,量不变
速率减小
,量不变
速率加快
,量不变
H2SO4→HAc
H2SO4→H2CO3
速率减小
,量不变
速率加快
,量不变
速率加快
,量不变
速率减小
,量减小
形成原电池
加入水
H2SO4→HNO3
速率减小
,量减小
→H2↑
→CO2↑
→NO↑
【实验探究4】压强对化学反应速率的影响
①P↑→c↑→v↑
增大压强,减小体积,增大浓度
②只适用于有气体参加或生成的化学反应,P↑→c↑→v↑。
必须引起参加物质的浓度的变化
在K2SO4溶液与BaCl2溶液反应时,增大压强
(双选)对于反应N2+O2 2NO在密闭容器中进行,下列条件中哪些能加快该反应的化学反应速率( )
A.缩小体积使压强增大
B.体积不变充入N 2 / O2 / NO使压强增大
C.体积不变充入He/Ne/Ar/H2使压强增大
D.使体积增大到原来的2倍
E.保持压强不变,通入He
A
B
c增大,v增大
c不变,v不变
P减小,c减小,v减小
V增大,c减小,v减小
c增大,v增大
对于有气体物质参加的反应:①恒温恒容时,充入气体反应物→总压强增大→浓度增大→速率增大。②恒温恒容时,充入“惰性气体”→总压强增大,但浓度不发生变化,速率不变。③恒温恒压时,充入“惰性气体”→容器容积增大→浓度减小→化学反应速率减小。
说明:“惰性气体”是指不参与反应的气体。
物质本身的性质(主要因素)
外因
内因
温度
浓度
催化剂
其他因素
影响化学反应速率的因素
其他条件不变,c↑ ,v ↑ ;c↓ ,v ↓
固体、水浓度改变不影响化学反应速率
其他条件不变,T↑, v ↑;T↓, v ↓
正催化剂: 使v↑;负催化剂: 使v↓
只影响速率,不改变能量和转化率
压强
有气体参与,引起浓度变化,p↑→c↑→v↑;p↓→c↑→v↓
固体表面积、原电池、光、波等
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示。在下列因素中,能影响此反应速率的是( )
①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.仅①④ B.仅②③
C.仅①②③ D.仅③④
②S↑,v↑
c↓,v↓
C
①T↑,v↑
放热反应
把下列4种Na2S2O3溶液和相应体积的水,分别加入4个盛有20mL2mol/L硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,最早出现明显浑浊的是( )
A.25℃ ,20mL 3mol/L的Na2S2O3溶液,25mL蒸馏水
B.0℃ ,30mL 2mol/L的Na2S2O3溶液,15mL蒸馏水
C.25℃ ,10mL 4mol/L的Na2S2O3溶液,35mL蒸馏水
D.0℃ ,10mL 2mol/L的Na2S2O3溶液,35mL蒸馏水
20×3÷45=12/9 mol/LNa2S2O3
10×4÷45=8/9 mol/LNa2S2O3
A
c=n(溶质)÷V(溶液总)
化学反应速率
思考与交流
你了解以下反应进行的快慢吗?
爆炸
溶洞形成
很快
很慢
钢铁生锈
较慢
牛奶腐坏
较快
一.定性观察法(粗略)
(1)Zn+H2SO4 = ZnSO4+H2↑
(2)Ca(OH)2+CO2 = CaCO3↓+H2O
(3)Fe3++3SCN- Fe(SCN)3
观察气泡逸出的快慢
观察沉淀产生的快慢
观察溶液颜色变化的快慢
用如图所示装置探究H2O2分解,实验时可利用什么方法来测定反应速率?
②单位时间内收集到氧气的体积的大小
①收集一定体积的氧气所用时间的长短
反应快慢与现象是否明显无关 ,如HCl+NaOH
2.表达式:
1.定义:单位时间内反应物浓度的________或生成物浓度的________。
二.定量表示法(准确)
—化学反应速率:衡量化学反应速率快慢的物理量
减少量
增加量
3.常用单位:
mol·L-1·min-1或mol·L-1·s-1
mol/(L·min) 或mol/(L·s)
1mol/(L min)= mol/(L s)
单位换算:
①化学反应速率指平均速率,不是瞬时速率(2min内 2min时/末 )
②化学反应速率是标量,均取正值
③一般不用固体、纯液体表示化学反应速率
④对于同一化学反应,不同物质表示的速率在数值上可能不同,但意义相同因此表示化学反应速率,必须指明物质,如V(N2),V(NH3)
一定温度下,向2L的密闭容器中加入2mol N2,6mol H2进行反应,2min后测得容器中NH3的物质的量为0.8mol。
(1)N2的转化率是多少?2min后容器压强时起始时压强的 倍;
(2)分别求出2min内N2、H2和NH3的化学反应速率是多少?
(2)N2、H2和NH3的反应速率的数值是否相等?其数值大小有何关系?
v(H2)=1.2 mol/(2L·2min)
v(N2) )=0.4 mol/(2L·2min)
v(NH3) )=0.8 mol/(2L·2min)
v(N2):v(H2):v(NH3)=
1:3:2
=0. 3mol/(L·min)
=0.1mol/(L·min)
=0.2mol/(L·min)
N2 + 3H2 2NH3
no
Δn
n (2min)
2 6 0
三段式法
0.8
0.8
1.2
0.4
1.6 4.8
注意n和c
速率之比=计量数之比
mol
α(N2)=0.4mol÷2mol×100%=20%
P之比=n之比
0.9
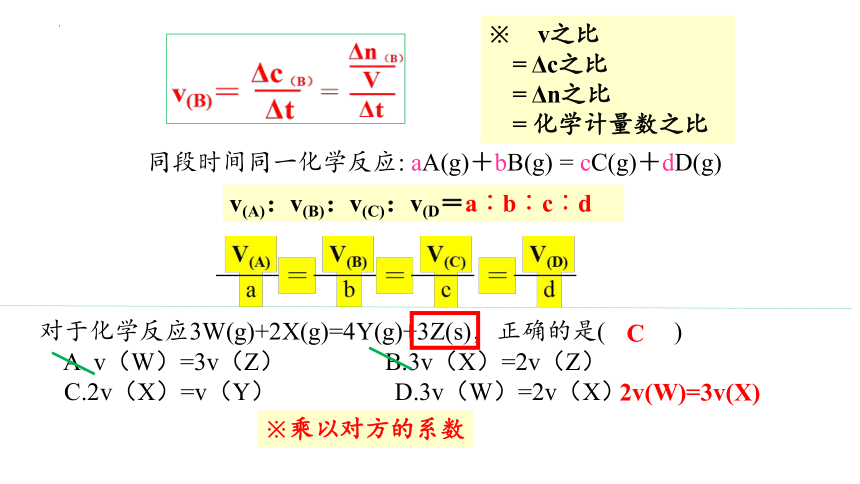
※ v之比
= Δc之比
= Δn之比
= 化学计量数之比
v(A):v(B):v(C):v(D=a︰b︰c︰d
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(s),正确的是( )
A. v(W)=3v(Z) B.3v(X)=2v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
2v(W)=3v(X)
C
同段时间同一化学反应: aA(g)+bB(g) = cC(g)+dD(g)
※乘以对方的系数
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:该反应进行快慢的顺序为 .
①v(A)=0.45 mol·L-1·min-1,②v(B)=0.6 mol·L-1·s-1,
③v(C)=0.4 mol·L-1·s-1,④v(D)=0.45 mol·L-1·s-1。
0.45÷60 mol·L-1·s-1
v(A)=0.2 mol·L-1·s-1
v(A)=0.2 mol·L-1·s-1
v(A)=0.25 mol·L-1·s-1
④>③=②>①
[化学反应速率大小比较]
方法1:归一法
①同一单位
②同一物质
方法2:比值法,速率与化学计量数之比
如aA+bB=cC+dD,若 > ,则A表示的速率>B表示的速率。
1mol/(L min)= mol/(L s)
不用s、l表示
化为系数为1的物质
夏天食物变质比冬天快
结合已学知识和生活经验,请同学们讨论影响化学反应速率的因素有哪些呢?
三.影响速率的因素
(一)内因--物质自身性质
相同温度下,相同形状、大小的镁条和铝条与等浓度的盐酸反应, 反应进行得快,原因是 。
镁
镁的活动性比铝强
不同的化学反应,具有不同的反应速率。
本质/决定性因素
二.外因
【实验探究1】温度对H2O2分解反应速率的影响
实验操作
实验现象
实验结论
试管中均有2--3ml同浓度的滴有FeCl3溶液的H2O2溶液
溶液中产生气泡速率的相对大小为
其它条件不变,温度越高,化学反应速率越快,反之,速率越慢
③>②>①
对于可逆反应,升高温度,正、逆速率均增大
升高温度,无论是吸热反应还是放热反应,速率均增大
升高温度,一定会加快反应速率
控制变量
【实验探究2】催化剂对H2O2分解反应速率的影响
实验操作
实验现象
实验结论
溶液中产生气泡速率的相对大小为
②>①
③>①
其它条件不变时,FeCl3、MnO2能加快H2O2的分解速率
有的催化剂能加快化学反应的速率,叫正催化剂;
有的催化剂能减慢化学反应的速率,叫负催化剂。
默认指正催化剂
催化剂只影响速率,不影响反应的能量变化;不影响转化率
影响速率大小与催化剂的表面积有关,催化剂参与反应,但质量和性质不变
2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1,在V2O5存在时,该反应的机理为
V2O5+SO2==2VO2+SO3(快)
4VO2+O2==2V2O5(慢)
下列说法正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的吸收198 kJ能量
D.增大SO2的浓度可显著提高反应速率
V2O5
催化剂
VO2
中间产物
催化剂的表面积
C
反应速率由慢反应决定
【实验探究3】浓度对化学反应速率的影响
实验操作 取2支试管,分别加入表面积相同的铝片,向其中一支试管滴入2ml 3mol/L的盐酸,向另外一支试管滴入2ml 0.5mol/L的盐酸,对比观察实验现象。
实验现象
实验结论
产生气泡速率:
其它条件不变时,反应物浓度越大,化学反应速率越快
3mol/L的盐酸>0.5mol/L的盐酸
FeCl3+3KSCN Fe(SCN)3+3KCl
Q:增加氯化钾的浓度
速率不变
Fe3++3SCN-- Fe(SCN)3
②对于离子反应,只有改变参与反应的离子浓度,速率才改变
①固体、纯液体(如H2O)不适用
Na与水反应时增大水的用量
C(s)+CO2(g)=2CO(g)增加C的用量
v不变
v不变
在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2mol L-1降到0.8mol L-1需要20s,那么反应物浓度再由
0.8mol L-1降到0.2mol L-1所需要的时间为( )
A.10s B.大于10s C.小于10s D.无法判断
B
变化1.2mol/L
变化0.6mol/L
随着反应的进行,反应物浓度越来越小,反应速率越来越小
过量锌片与100ml 2mol/LH2SO4反应,反应速率?生成氢气的总量?
A.加入K2SO4溶液
B.改用200ml 1mol/LH2SO4
C.加入CuSO4溶液
D.加入CH3COONa溶液
E.加入Na2CO3溶液
F.加入NaNO3粉末
G.改用锌粉
H.升高体系的温度
Zn+2H+=Zn2++H2↑
H2量由H2SO4物质的量决定
速率由H+浓度决定
速率减小
,量不变
速率减小
,量不变
速率加快
,量不变
H2SO4→HAc
H2SO4→H2CO3
速率减小
,量不变
速率加快
,量不变
速率加快
,量不变
速率减小
,量减小
形成原电池
加入水
H2SO4→HNO3
速率减小
,量减小
→H2↑
→CO2↑
→NO↑
【实验探究4】压强对化学反应速率的影响
①P↑→c↑→v↑
增大压强,减小体积,增大浓度
②只适用于有气体参加或生成的化学反应,P↑→c↑→v↑。
必须引起参加物质的浓度的变化
在K2SO4溶液与BaCl2溶液反应时,增大压强
(双选)对于反应N2+O2 2NO在密闭容器中进行,下列条件中哪些能加快该反应的化学反应速率( )
A.缩小体积使压强增大
B.体积不变充入N 2 / O2 / NO使压强增大
C.体积不变充入He/Ne/Ar/H2使压强增大
D.使体积增大到原来的2倍
E.保持压强不变,通入He
A
B
c增大,v增大
c不变,v不变
P减小,c减小,v减小
V增大,c减小,v减小
c增大,v增大
对于有气体物质参加的反应:①恒温恒容时,充入气体反应物→总压强增大→浓度增大→速率增大。②恒温恒容时,充入“惰性气体”→总压强增大,但浓度不发生变化,速率不变。③恒温恒压时,充入“惰性气体”→容器容积增大→浓度减小→化学反应速率减小。
说明:“惰性气体”是指不参与反应的气体。
物质本身的性质(主要因素)
外因
内因
温度
浓度
催化剂
其他因素
影响化学反应速率的因素
其他条件不变,c↑ ,v ↑ ;c↓ ,v ↓
固体、水浓度改变不影响化学反应速率
其他条件不变,T↑, v ↑;T↓, v ↓
正催化剂: 使v↑;负催化剂: 使v↓
只影响速率,不改变能量和转化率
压强
有气体参与,引起浓度变化,p↑→c↑→v↑;p↓→c↑→v↓
固体表面积、原电池、光、波等
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示。在下列因素中,能影响此反应速率的是( )
①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.仅①④ B.仅②③
C.仅①②③ D.仅③④
②S↑,v↑
c↓,v↓
C
①T↑,v↑
放热反应
把下列4种Na2S2O3溶液和相应体积的水,分别加入4个盛有20mL2mol/L硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,最早出现明显浑浊的是( )
A.25℃ ,20mL 3mol/L的Na2S2O3溶液,25mL蒸馏水
B.0℃ ,30mL 2mol/L的Na2S2O3溶液,15mL蒸馏水
C.25℃ ,10mL 4mol/L的Na2S2O3溶液,35mL蒸馏水
D.0℃ ,10mL 2mol/L的Na2S2O3溶液,35mL蒸馏水
20×3÷45=12/9 mol/LNa2S2O3
10×4÷45=8/9 mol/LNa2S2O3
A
c=n(溶质)÷V(溶液总)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
