黑龙江省大庆市肇州县第二高级中学2022-2023学年高二下学期第一次考试化学试题(含答案)
文档属性
| 名称 | 黑龙江省大庆市肇州县第二高级中学2022-2023学年高二下学期第一次考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 973.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-03-14 08:55:45 | ||
图片预览



文档简介
肇州县第二高级中学2022-2023学年高二下学期第一次考试
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 S 32
第I卷(选择题 共44分)
一 选择题:本题共18小题,1--10每小题2分11--18题每小题3分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列符号不符合事实的是( )
A.4s2 B.2p3 C.3d8 D.3f14
2.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
3 2018 年 10 月 24 日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属所技术能保障大桥 120 年耐久性。下列保护钢管桩的措施不合理的是
A. 钢管桩附着铜以增强抗腐蚀性 B. 在钢筋表面附上新一代高性能环氧涂层
C. 使用抗腐蚀性强的合金钢 D. 将钢管桩连通电源负极
4. 常温下,等物质的量浓度的下列溶液中最小的是
A. B. C. D.
5.. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. PH=7溶液中:Fe3+,
B. 的溶液中:
C. 使甲基橙呈红色的溶液中:
D. 水电离的的溶液中:
6. 某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中不正确的是
A. 夏天,打开啤酒瓶时会在瓶口逸出气体,可以用勒夏特列原理解释
B. 使用催化剂既不会改变反应的限度也不会改变反应的焓变
C. 强电解质溶液的导电能力比弱电解质溶液的导电能力都强
D. 实验室盛放、等碱性溶液的试剂瓶应用橡胶塞,而不能用玻璃塞
7. 下列化学用语对事实表述正确的是
A. 溶液水解方程式:
B. 用铜作阳极电解稀硫酸:
C. 向悬浊液中滴入溶液:
D. 明矾常作净水剂:
8. 某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应: 。下列有关说法不正确的是
A. 该反应在高温条件下能自发进行
B. 若容器内混合气体的密度不变,则说明反应达到平衡状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 反应达到平衡后,保持容器体积和温度不变,再往容器中充入一定量,则平衡逆向移动
9. 下列叙述正确的是
A. 向氨水中加入醋酸使溶液呈酸性,则
B. 向溶液中加入少量固体,则的水解程度增大
C. 向相同,体积相等的盐酸和醋酸溶液中,分别加入等浓度的溶液,则消耗溶液的体积前者小于后者
D. 向磷酸中加水稀释至原体积的两倍,则
10. 已知A转化为C和D分步进行:①;②,其反应过程能量如图所示,下列说法正确的是
A. 1mol A(g)的能量低于2mol D(g)的能量
B. 反应过程中,由于,反应②速率大于反应①,气体B很难大量积累
C.
D. 断裂1mol A(g)化学键吸收的热量小于形成1mol B(g)和2mol D(g)化学键所放出的热量
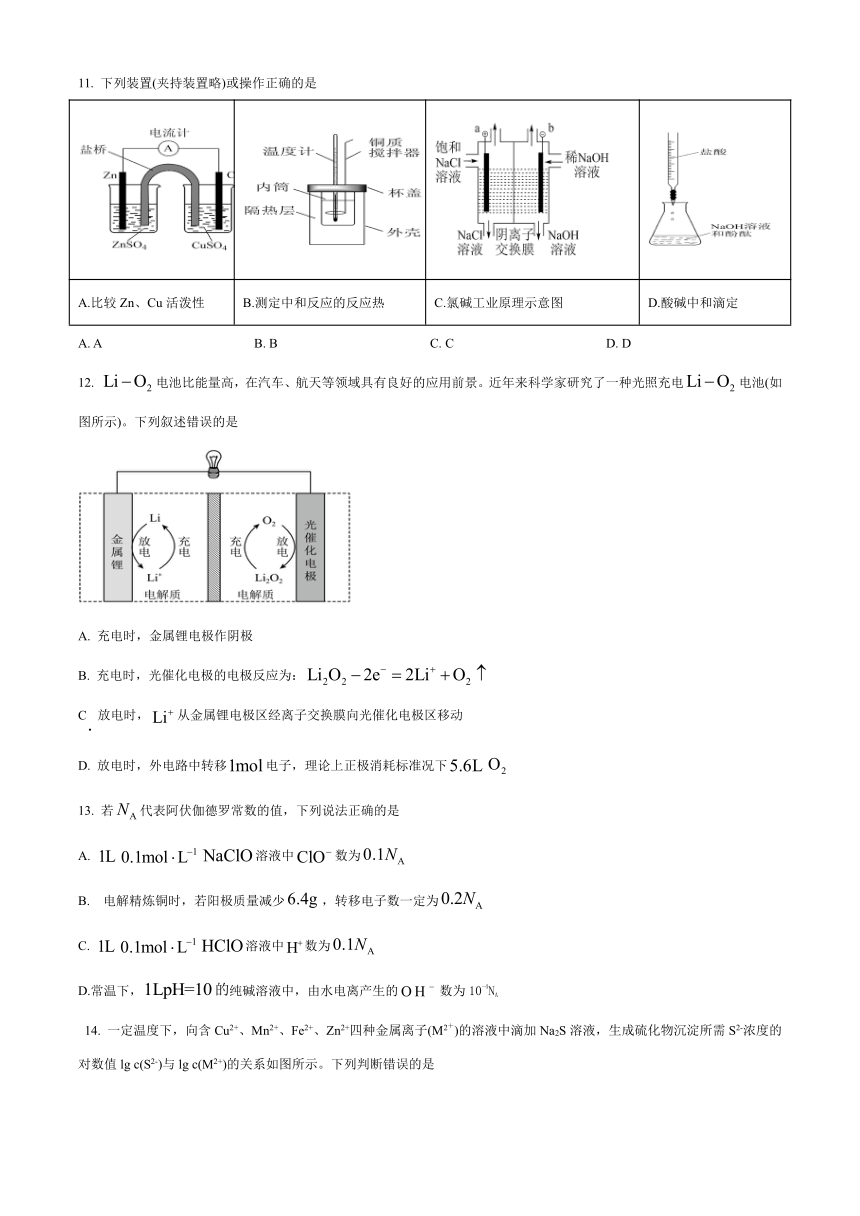
11. 下列装置(夹持装置略)或操作正确的是
A.比较Zn、Cu活泼性 B.测定中和反应的反应热 C.氯碱工业原理示意图 D.酸碱中和滴定
A. A B. B C. C D. D
12. 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电电池(如图所示)。下列叙述错误的是
A. 充电时,金属锂电极作阴极
B. 充电时,光催化电极的电极反应为:
C 放电时,从金属锂电极区经离子交换膜向光催化电极区移动
D. 放电时,外电路中转移电子,理论上正极消耗标准况下
13. 若代表阿伏伽德罗常数的值,下列说法正确的是
A. 溶液中数为
B. 电解精炼铜时,若阳极质量减少,转移电子数一定为
C. 溶液中数为
D.常温下,纯碱溶液中,由水电离产生的数为10-4NA
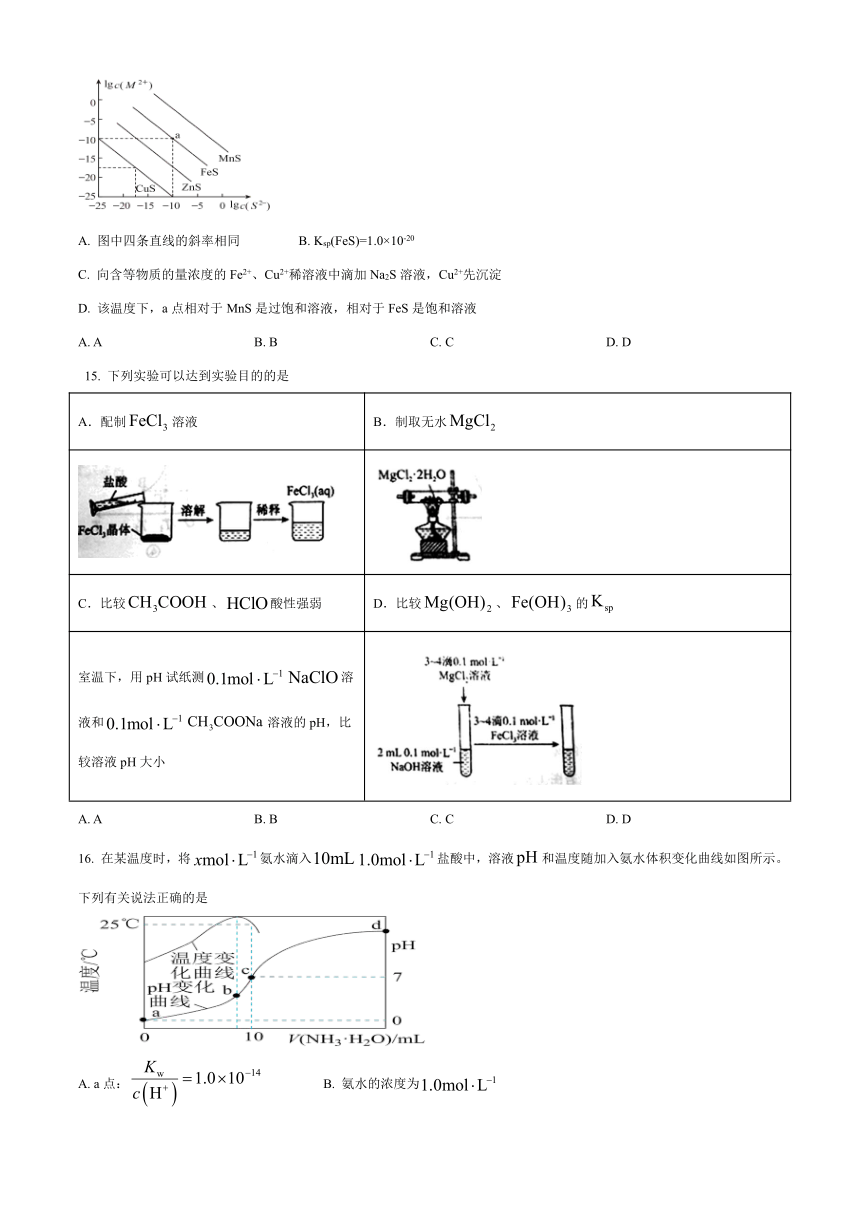
14. 一定温度下,向含Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+)的溶液中滴加Na2S溶液,生成硫化物沉淀所需S2-浓度的对数值lg c(S2-)与lg c(M2+)的关系如图所示。下列判断错误的是
A. 图中四条直线的斜率相同 B. Ksp(FeS)=1.0×10-20
C. 向含等物质的量浓度的Fe2+、Cu2+稀溶液中滴加Na2S溶液,Cu2+先沉淀
D. 该温度下,a点相对于MnS是过饱和溶液,相对于FeS是饱和溶液
A. A B. B C. C D. D
15. 下列实验可以达到实验目的的是
A.配制溶液 B.制取无水
C.比较、酸性强弱 D.比较、的
室温下,用pH试纸测溶液和溶液的pH,比较溶液pH大小
A. A B. B C. C D. D
16. 在某温度时,将氨水滴入盐酸中,溶液和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
A. a点: B. 氨水的浓度为
C. c点溶液中离子浓度大小关系:
D. b、c、d三点水的电离程度大小关系:
17.常温下,向某浓度的H2A溶液中逐滴加入NaOH溶液,溶液中-lg c(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。下列说法正确的是( )
A.c点溶液中c(Na+)>3c(A2-)
B.整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变
C.将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH=0.8
D.b点对应溶液的pH为3.05
18 常温下,向溶液中滴加同浓度的NaOH溶液,水电离的与NaOH溶液体积的关系如图所示。下列说法错误的是
A. d点溶液显中性 B. c点溶液中
C. c点溶液中c(CH3CH2COOH)+c(CH3CH2COO-)=c(Na+)
D. 常温下,的水解常数约为
第II卷(非选择题 共56分)
二、填空题:本题共4小题,共56分。
19(15分) 氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用肼作为火箭发射的助燃剂。
①已知各共价键键能如下表:
键能 946 497 193 391 463
的结构如图
;_______。
②与氨气相似,是一种碱性气体,易溶于水,生成弱碱。用电离方程式表示显碱性原因_______。
(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
弱电解质
电离平衡常数
①的电离平衡常数的表达式_______; ②常温下,等浓度的下列溶液a.;b.;c.,其由大到小的顺序是_______(用字母表示)。
(3)某同学设计一个肼燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中为阳离子交换膜。
①通入肼的电极为_______(填“正极”或“负极”),正极的电极反应式为_______。
②若甲中有氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为____,丙中硫酸铜溶液的浓度_______(填“变大”、“变小”或“不变”)。
20.(13分) 某研究小组为了检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入香菇样品和水;锥形瓶中加入水、淀粉溶液。
②以流速通入氮气,再加入过量硫酸,加热并保持微沸,同时用的碘标准溶液滴定锥形瓶中吸收的。③用适量替代香菇样品,重复上述步骤,测得的平均回收率为95%。
回答下列问题:(1)装置图中仪器的名称为_______。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用标准碘液的体积为_______。
(3)解释第②步骤中加硫酸之前先通入氮气的原因_______。
(4)滴定反应的离子方程式为_______。(5)判断滴定达到终点的依据是_______。
(6)该香菇中亚硫酸盐含量为_______(以计,结果保留三位有效数字)。
(7)以下操作会造成测得香菇中亚硫酸盐含量偏高的是_______(填字母)
A. 量取标准碘液的滴定管未润洗 B. 滴定终点读数时,俯视滴定管的刻度
C. 锥形瓶水洗后未干燥 D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
21.(14分) 将转化为、等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。 (1)时,还原的热化学方程式如下:
I:
II:
已知反应I、II的平衡常数分别为、。由盖斯定律可知,与反应生成的热化学方程式为_______,_______(用、表示)。
(2)若反应I的正反应活化能表示为,则_______41(填“”“”或“”)。
(3),向密闭容器中充入和,发生反应I,达到平衡时,测得的物质的量为。 ①平衡时的体积分数_______
②下列措施既能加快反应速率又能提高的平衡转化率的是_______。
A.升高反应温度 B.增大的浓度 C.分离出 D.缩小容器容积
③,向密闭容器中充入和一定量的,发生反应I,两种气体的平衡转化率(a),与起始反应物的物质的量之比的关系如图所示:
能表示平衡转化率曲线的是_______(填或),M点的纵坐标:_______。
在,压强为时,_______。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
22. (14分)我国重晶石(含90%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一、某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡的工艺流程如下:
①常温下:,。
②在常温下是无色液体,遇水容易发生水解:。
③草酸氧钛钡的化学式为。请回答下列问题:
(1)中元素的化合价为_______。
(2)工业上用饱和溶液处理重晶石(假设杂质不与溶液作用),待达到平衡后,移走上层清液,重复多次操作,将转化为易溶于酸的,该反应的平衡常数_______(填写计算结果)。当溶液的浓度大于_______时就能实现转化为。(不考虑的水解)
(3)配制溶液时通常将固体溶于浓盐酸再加水稀释,其目的是_______。
(4)写出混合液加入和溶液反应的化学方程式_______。
(5)检验草酸氧钛钡晶体是否洗净的方法_______。
(6)煅烧草酸氧钛钡晶体得到的同时,高温下生成的气体产物有、_______和_______(填化学式)
化学答案
一、单选题(1-10题每小题2分,11-18每小题3分,共44分。)
1 2 3 4 5 6 7 8 9 10
D A A A B C B D C B
11 12 13 14 15 16 17 18
A D D D A D D A
二、19【答案】(1) ①. ②.
(2) ①. ②. c>b>a
(3) ①. 负极 ②. 略 ③. ④. 变小
20 (1)酸式滴定管
(2)13.10 (3)通入氮气,将装置内空气排尽,防止亚硫酸钠和被空气氧化
(4)
(5)当滴入最后半滴标准溶液时,溶液由无色变为蓝色且半分钟内颜色无变化
(6)88.3 (7)AD
21【答案】(1) ①. ②.
(2)> (3) ①. 或14.3% ②. AB ③. ④. 或33.3%
(4)0.25
22【答案】(1)+4 (2) ①. ②.
(3)防止水解
(4)
(5)取最后一次洗涤液,向其中加入硝酸酸化的硝酸银溶液,若没有白色沉淀产生,则晶体已洗净
(6) ①. ②.
)
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 S 32
第I卷(选择题 共44分)
一 选择题:本题共18小题,1--10每小题2分11--18题每小题3分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列符号不符合事实的是( )
A.4s2 B.2p3 C.3d8 D.3f14
2.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
3 2018 年 10 月 24 日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属所技术能保障大桥 120 年耐久性。下列保护钢管桩的措施不合理的是
A. 钢管桩附着铜以增强抗腐蚀性 B. 在钢筋表面附上新一代高性能环氧涂层
C. 使用抗腐蚀性强的合金钢 D. 将钢管桩连通电源负极
4. 常温下,等物质的量浓度的下列溶液中最小的是
A. B. C. D.
5.. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. PH=7溶液中:Fe3+,
B. 的溶液中:
C. 使甲基橙呈红色的溶液中:
D. 水电离的的溶液中:
6. 某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中不正确的是
A. 夏天,打开啤酒瓶时会在瓶口逸出气体,可以用勒夏特列原理解释
B. 使用催化剂既不会改变反应的限度也不会改变反应的焓变
C. 强电解质溶液的导电能力比弱电解质溶液的导电能力都强
D. 实验室盛放、等碱性溶液的试剂瓶应用橡胶塞,而不能用玻璃塞
7. 下列化学用语对事实表述正确的是
A. 溶液水解方程式:
B. 用铜作阳极电解稀硫酸:
C. 向悬浊液中滴入溶液:
D. 明矾常作净水剂:
8. 某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应: 。下列有关说法不正确的是
A. 该反应在高温条件下能自发进行
B. 若容器内混合气体的密度不变,则说明反应达到平衡状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 反应达到平衡后,保持容器体积和温度不变,再往容器中充入一定量,则平衡逆向移动
9. 下列叙述正确的是
A. 向氨水中加入醋酸使溶液呈酸性,则
B. 向溶液中加入少量固体,则的水解程度增大
C. 向相同,体积相等的盐酸和醋酸溶液中,分别加入等浓度的溶液,则消耗溶液的体积前者小于后者
D. 向磷酸中加水稀释至原体积的两倍,则
10. 已知A转化为C和D分步进行:①;②,其反应过程能量如图所示,下列说法正确的是
A. 1mol A(g)的能量低于2mol D(g)的能量
B. 反应过程中,由于,反应②速率大于反应①,气体B很难大量积累
C.
D. 断裂1mol A(g)化学键吸收的热量小于形成1mol B(g)和2mol D(g)化学键所放出的热量
11. 下列装置(夹持装置略)或操作正确的是
A.比较Zn、Cu活泼性 B.测定中和反应的反应热 C.氯碱工业原理示意图 D.酸碱中和滴定
A. A B. B C. C D. D
12. 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电电池(如图所示)。下列叙述错误的是
A. 充电时,金属锂电极作阴极
B. 充电时,光催化电极的电极反应为:
C 放电时,从金属锂电极区经离子交换膜向光催化电极区移动
D. 放电时,外电路中转移电子,理论上正极消耗标准况下
13. 若代表阿伏伽德罗常数的值,下列说法正确的是
A. 溶液中数为
B. 电解精炼铜时,若阳极质量减少,转移电子数一定为
C. 溶液中数为
D.常温下,纯碱溶液中,由水电离产生的数为10-4NA
14. 一定温度下,向含Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+)的溶液中滴加Na2S溶液,生成硫化物沉淀所需S2-浓度的对数值lg c(S2-)与lg c(M2+)的关系如图所示。下列判断错误的是
A. 图中四条直线的斜率相同 B. Ksp(FeS)=1.0×10-20
C. 向含等物质的量浓度的Fe2+、Cu2+稀溶液中滴加Na2S溶液,Cu2+先沉淀
D. 该温度下,a点相对于MnS是过饱和溶液,相对于FeS是饱和溶液
A. A B. B C. C D. D
15. 下列实验可以达到实验目的的是
A.配制溶液 B.制取无水
C.比较、酸性强弱 D.比较、的
室温下,用pH试纸测溶液和溶液的pH,比较溶液pH大小
A. A B. B C. C D. D
16. 在某温度时,将氨水滴入盐酸中,溶液和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
A. a点: B. 氨水的浓度为
C. c点溶液中离子浓度大小关系:
D. b、c、d三点水的电离程度大小关系:
17.常温下,向某浓度的H2A溶液中逐滴加入NaOH溶液,溶液中-lg c(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。下列说法正确的是( )
A.c点溶液中c(Na+)>3c(A2-)
B.整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变
C.将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH=0.8
D.b点对应溶液的pH为3.05
18 常温下,向溶液中滴加同浓度的NaOH溶液,水电离的与NaOH溶液体积的关系如图所示。下列说法错误的是
A. d点溶液显中性 B. c点溶液中
C. c点溶液中c(CH3CH2COOH)+c(CH3CH2COO-)=c(Na+)
D. 常温下,的水解常数约为
第II卷(非选择题 共56分)
二、填空题:本题共4小题,共56分。
19(15分) 氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用肼作为火箭发射的助燃剂。
①已知各共价键键能如下表:
键能 946 497 193 391 463
的结构如图
;_______。
②与氨气相似,是一种碱性气体,易溶于水,生成弱碱。用电离方程式表示显碱性原因_______。
(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
弱电解质
电离平衡常数
①的电离平衡常数的表达式_______; ②常温下,等浓度的下列溶液a.;b.;c.,其由大到小的顺序是_______(用字母表示)。
(3)某同学设计一个肼燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中为阳离子交换膜。
①通入肼的电极为_______(填“正极”或“负极”),正极的电极反应式为_______。
②若甲中有氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为____,丙中硫酸铜溶液的浓度_______(填“变大”、“变小”或“不变”)。
20.(13分) 某研究小组为了检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入香菇样品和水;锥形瓶中加入水、淀粉溶液。
②以流速通入氮气,再加入过量硫酸,加热并保持微沸,同时用的碘标准溶液滴定锥形瓶中吸收的。③用适量替代香菇样品,重复上述步骤,测得的平均回收率为95%。
回答下列问题:(1)装置图中仪器的名称为_______。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用标准碘液的体积为_______。
(3)解释第②步骤中加硫酸之前先通入氮气的原因_______。
(4)滴定反应的离子方程式为_______。(5)判断滴定达到终点的依据是_______。
(6)该香菇中亚硫酸盐含量为_______(以计,结果保留三位有效数字)。
(7)以下操作会造成测得香菇中亚硫酸盐含量偏高的是_______(填字母)
A. 量取标准碘液的滴定管未润洗 B. 滴定终点读数时,俯视滴定管的刻度
C. 锥形瓶水洗后未干燥 D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
21.(14分) 将转化为、等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。 (1)时,还原的热化学方程式如下:
I:
II:
已知反应I、II的平衡常数分别为、。由盖斯定律可知,与反应生成的热化学方程式为_______,_______(用、表示)。
(2)若反应I的正反应活化能表示为,则_______41(填“”“”或“”)。
(3),向密闭容器中充入和,发生反应I,达到平衡时,测得的物质的量为。 ①平衡时的体积分数_______
②下列措施既能加快反应速率又能提高的平衡转化率的是_______。
A.升高反应温度 B.增大的浓度 C.分离出 D.缩小容器容积
③,向密闭容器中充入和一定量的,发生反应I,两种气体的平衡转化率(a),与起始反应物的物质的量之比的关系如图所示:
能表示平衡转化率曲线的是_______(填或),M点的纵坐标:_______。
在,压强为时,_______。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
22. (14分)我国重晶石(含90%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一、某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡的工艺流程如下:
①常温下:,。
②在常温下是无色液体,遇水容易发生水解:。
③草酸氧钛钡的化学式为。请回答下列问题:
(1)中元素的化合价为_______。
(2)工业上用饱和溶液处理重晶石(假设杂质不与溶液作用),待达到平衡后,移走上层清液,重复多次操作,将转化为易溶于酸的,该反应的平衡常数_______(填写计算结果)。当溶液的浓度大于_______时就能实现转化为。(不考虑的水解)
(3)配制溶液时通常将固体溶于浓盐酸再加水稀释,其目的是_______。
(4)写出混合液加入和溶液反应的化学方程式_______。
(5)检验草酸氧钛钡晶体是否洗净的方法_______。
(6)煅烧草酸氧钛钡晶体得到的同时,高温下生成的气体产物有、_______和_______(填化学式)
化学答案
一、单选题(1-10题每小题2分,11-18每小题3分,共44分。)
1 2 3 4 5 6 7 8 9 10
D A A A B C B D C B
11 12 13 14 15 16 17 18
A D D D A D D A
二、19【答案】(1) ①. ②.
(2) ①. ②. c>b>a
(3) ①. 负极 ②. 略 ③. ④. 变小
20 (1)酸式滴定管
(2)13.10 (3)通入氮气,将装置内空气排尽,防止亚硫酸钠和被空气氧化
(4)
(5)当滴入最后半滴标准溶液时,溶液由无色变为蓝色且半分钟内颜色无变化
(6)88.3 (7)AD
21【答案】(1) ①. ②.
(2)> (3) ①. 或14.3% ②. AB ③. ④. 或33.3%
(4)0.25
22【答案】(1)+4 (2) ①. ②.
(3)防止水解
(4)
(5)取最后一次洗涤液,向其中加入硝酸酸化的硝酸银溶液,若没有白色沉淀产生,则晶体已洗净
(6) ①. ②.
)
同课章节目录
